Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Orale Intubation Erwachsenen Zebrafisch: ein Modell für die Bewertung der intestinalen Aufnahme von bioaktiven Substanzen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt sondenschaft Erwachsenen Zebrafisch mit einem biologischen; dann zerlegen und zytometrie, konfokale Mikroskopie und qPCR Darm vorbereiten. Diese Methode ermöglicht die Verwaltung von bioaktiven Substanzen, intestinale Aufnahme und der lokalen immun Reiz hervorgerufen zu überwachen. Es ist relevant für die Prüfung der intestinalen Dynamik von oralen Prophylaxe.
Zusammenfassung
Die meisten Krankheitserreger dringen in Organismen durch ihre Schleimhaut. Dies gilt insbesondere bei Fischen wie sie kontinuierlich zu einer mikrobiellen angereicherte Wasser Umwelt ausgesetzt sind. Entwicklung effektiver Methoden zur mündlichen Lieferung von immunstimulantien oder Impfstoffe, die das Immunsystem gegen Infektionskrankheiten zu aktivieren, ist höchst wünschenswert. Bei der Ausarbeitung prophylaktische Werkzeuge, werden gute experimentelle Modelle benötigt, um ihre Leistung zu testen. Hier zeigen wir eine Methode für die orale Intubation Erwachsenen Zebrafisch und eine Reihe von Verfahren zu sezieren und zytometrie, konfokale Mikroskopie und quantitative Polymerase-Kettenreaktion (qPCR) Analyse des Darms vorbereiten. Mit diesem Protokoll können wir präzise Volumen bis zu 50 µL für Fische mit einem Gewicht von ca. 1 g einfach und schnell, ohne Schädigung der Tiere verwalten. Diese Methode ermöglicht es uns, die Aufnahme direkt in Vivo eindringmittel gekennzeichneten Verbindungen durch die Darmschleimhaut und die immunmodulatorische Fähigkeit von solchen Biologics am lokalen Standort nach Intubation zu erkunden. Durch die Kombination von nachgelagerten Verfahren wie Durchflusszytometrie, Histologie, qPCR und konfokalen Mikroskopie des intestinalen Gewebes, können wir verstehen, wie immunstimulantien oder Impfstoffe in der Lage sind, die intestinale Schleimhaut-Hindernisse überqueren, durchlaufen die Lamina Propria und den Muskel, übt eine Wirkung auf die intestinalen mukosalen Immunsystems zu erreichen. Das Modell könnte verwendet werden, um Kandidaten orale Prophylaxe und Delivery-Systeme oder die lokale Wirkung von eine oral verabreichte bioaktive Verbindung testen.
Einleitung
Das Ziel dieses Artikels soll in der Tiefe eine einfache Methode für die orale Intubation Zebrafisch, zusammen mit nützlichen verbunden nachgelagerten Verfahren beschreiben. Orale Intubation mit Zebrafisch ist ein praktisches Modell bei der Untersuchung von Infektionskrankheiten Dynamik, oralen Impfstoff/immunstimulierende Medikament/Nanoparticle Aufnahme und Wirksamkeit und Darm-Schleimhaut Immunität geworden. Zebrafisch orale Intubation wird zum Beispiel in der Studie von Mycobacterium Marinum und Mycobacterium Peregrinum Infektion1eingesetzt wurden. Lovmo Et al. auch zur erfolgreich dieses Modell Nanopartikel und M. Marinum mit dem Magen-Darm-Trakt von Erwachsenen Zebrafisch2liefern. Darüber hinaus verwendet Chen Et Al. Zebrafisch orale Intubation um zu zeigen, dass Drogen durch Nanopartikel verkapselt wann verabreicht über den Magen-Darm-Trakt, über die Blut-Gehirn-Schranke3transportiert wurden. Diese Autoren durchgeführt Intubation basierend auf der Gauvage-Methode von Collymore Et Al. beschrieben 4 mit einigen Änderungen. Allerdings hat sie kein sehr detailliertes Protokoll beschreibt die orale Intubation Verfahren bereitgestellt. Hier präsentieren wir Ihnen eine Methode für die orale Intubation Erwachsenen Zebrafisch aufbauend auf Collymore Et al. 4 wir sind weiter die Vorbereitung des Darms für nachgelagerte Analyse zytometrie, konfokale Mikroskopie und qPCR.
Der Darm und vor allem seine Schleimhaut ist die erste Linie der Verteidigung gegen Infektion und die primären Ort der Nährstoffaufnahme5. Wenn die Epithelzellen und Antigen-präsentierenden Zellen in der Schleimhaut Barrieren Gefahrensignale wahrnehmen, ist eine sofortige angeborene Immunantwort ausgelöst. Als nächstes ist die hochspezifische adaptiven Immunantwort von T- und B-Lymphozyten6,7gegründet. Entwicklung von oralen Impfstoffen ist ein aktueller Schwerpunkt im Vaccinology. Solchen Impfstoffen wäre ein effektives Werkzeug, um den Organismus an exponierten Standorten aufgrund der spezifischen Reaktion der Immunzellen in der Mukosa-assoziierten lymphatischen Gewebe (MALT)8,9zu schützen. In der Aquakultur haben Schleimhaut-Impfstoffe offensichtliche Vorteile im Vergleich zu injizierbaren Impfstoffen. Sie sind praktisch für Massenimpfungen, weniger arbeitsintensiv, sind für die Fische weniger belastend und Jungfische verabreicht werden können. Dennoch müssen Schleimhaut Impfstoffkandidaten das zweite Segment der Darm erreichen, ohne in die Mundhöhle denaturiert wird. Sie müssen auch Schleimhaut Hindernisse überqueren, um Zugriff auf antigenpräsentierende Zellen (APCs), lokale und/oder systemische Reaktionen10zu induzieren. Daher unbedingt testen der Schleimhaut-Aufnahme durch die Kandidaten mündliche Antigene und ihrer Trägersysteme erreicht, sowie die Immunantwort hervorgerufen, bei der Entwicklung von oralen Impfstoffen.
In einem biomedizinischen Kontext entwickelt ein Modell, um die biologische Wirkungen von Verbindungen zu testen, nachdem orale Intubation von Interesse ist. Viele von den anatomischen und physiologischen Merkmale des Darms sind zwischen Bilaterian Linien mit Säugetieren und Knochenfische11konserviert. Diese orale Intubation Modell an nachgelagerte Analyse angeschlossen kann ein Werkzeug, um Einblicke in die menschliche Biologie sowie ein Testfeld für Biologics zur Verfügung zu stellen oder andere Substanzen in Vivo.
Die orale Intubation Protokoll kann von einem Bediener, z.B.erfolgreich administrieren bis zu 50 µL der Protein Nanopartikel Suspension mit einem Gewicht von 1 g, mit eine hohe Überlebensrate Fischen durchgeführt werden. Das Verfahren ist einfach einzurichten und schnell; 30 Fische können in 1 h intubiert werden. Das Protokoll für Darm Vorbereitung ist Schlüssel zur Bereitstellung von QUALITÄTSPROBEN Zell- und für die spätere Analyse. Der nachgeschaltete Ergebnisse Beispiele die zeigen das Protokoll nutzen bei der Beschaffung von Daten in Bezug auf intestinale Aufnahme und Qualität RNA für qPCR zu isolieren. Das Protokoll wäre von großem Nutzen für diejenigen, die ein geeignetes Modell, um die Dynamik von oralen Prophylaxe oder andere Verbindungen im Darm zu testen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle experimentellen Verfahren Zebrafisch (Danio Rerio) wurden von der Ethikkommission der Universitat Autònoma de Barcelona (CEEH Nummer 1582) im Einvernehmen mit der internationalen Leitprinzipien für Forschung an denen Tiere (autorisiert. EU 2010/63). Alle Experimente mit live Zebrafisch wurden bei 26 – 28 ° c durchgeführt.
1. Vorbereitung der Ausrüstung für orale Intubation
- Legen Sie ca. 1 cm von einem feinen Silikonschlauch auf einer 31 G Luer Lock Nadel an der Spitze der Nadel zu decken.
- Schnitt einer 10 µL Sterilfilter Pipette Tipp (ca. 2 cm), nehmen Sie das feinere Ende und legen Sie es über den Silikonschlauch als eine Hülle. Sicherstellen Sie, dass die Spitze der Nadel, um nicht zu verletzen, das Tier die Pipette hinausragt.
- Legen Sie die Nadel auf einer 100 µL Luer Lock Spritze.
Hinweis: Spülen Sie mit Ethanol und dann Phosphat gepufferte Kochsalzlösung (PBS, finden Sie unter Materialien) gründlich zwischen den Behandlungen.
(2) die erforderlichen Lösungen
- Bereiten Sie 150 mg/L (für Anästhesie) oder 300 mg/L (für Euthanasie) Ethyl 3-Aminobenzoate Methanesulfonate (MS-222) Lösung mit Wasser aus dem Aquarium, wo der Zebrafisch sind gepflegt. Füllen Sie einen kleinen Behälter mit 1 L des Anästhetikums Lösung und halten Sie es belüftet.
- Füllen Sie einen anderen kleinen Behälter mit 1 L Aquarienwasser ohne MS-222 für Fische Erholung und halten Sie es belüftet.
- 50 mL 1 X PBS aus 10 x sterile Vorratslösung zu machen.
- Zytometrie Analyse/Darm Zelle isoliert Vorbereitung genügend frische 0,15 % Kollagenase Typ IV-Lösung für 1 mL pro Fisch aus einer Stammlösung oder Pulver in Dulbeccos modifizierten Eagle Medium (DMEM) mit 1 % V/V Penicillin und Streptomycin (siehe Material). Machen Sie Aliquote (1 pro Fisch) von 1 mL in 2 mL Zentrifuge Röhren. Bei 4 ° C bis 30 min vor der Dissektion Schritt halten.
- Zur Fixierung der konfokalen Mikroskopie/Probe bereiten Sie 50 mL frische 4 % Paraformaldehyd (PFA) Lösung mit PBS-Puffer oder tauen Sie eine Stammlösung von-20 ° C-Gefrierschrank in einer Dampfhaube auf.
Achtung: PFA ist giftig. Bitte lesen Sie das Sicherheitsdatenblatt vor der Arbeit mit ihm. Handschuhe und Schutzbrille getragen werden sollte, und immer Lösungen in einer Dampfhaube lassen.
3. Herstellung der fluoreszierende Nanopartikel Suspension
- Beschriften Sie die Protein-Nanopartikel mit Atto 488-NHS Ester (siehe Tabelle der Materialien) oder einem geeigneten Fluoreszenzfarbstoff gemäß den Anweisungen des Herstellers.
- Aufschwemmen der Nanopartikel in 0,1 M-Sodium Bicarbonat-Puffer bei der Konzentration von 2 mg/mL.
- Atto 488-NHS Ester in Amin-freie Dimethyl Sulfoxid (DMSO) 2 mg/ml auflösen. Halten Sie eine Aliquote von 10 µL Kennzeichnung Effizienz (Schritt 3.7-3.8) zu überprüfen.
- Mischen Sie die Nanopartikel und Atto 488-NHS Ester in einem Molverhältnis von 1:2 (Protein: Farbstoff) durch rühren in der Dunkelheit.
- Spin-down der beschrifteten Nanopartikel durch Zentrifugation bei 8.000 X g für 10 min bei Raumtemperatur, den überstand zu entfernen und halten sie zur Kennzeichnung (Schritt 3.7-3.8) zu überprüfen.
- Waschen Sie die markierte Nanopartikel durch resuspending in 1 mL 0,1 M Sodium Bicarbonat Puffer durch aufschütteln und pipettieren rauf und runter. Dann verwerfen des Überstands durch Zentrifugation bei 8.000 X g für 10 min bei Raumtemperatur. Wiederholen Sie Schritt 3.6 für 5mal.
- Das Pellet in 5 mL 0,1 M-Sodium Bicarbonat-Puffer in einem 15 mL Zentrifugenröhrchen aufschwemmen und Aliquote fluoreszierende Nanopartikel in 1,5 mL Zentrifuge Röhren (30 Aliquote) zu machen. Spin-down bei 8.000 X g für 10 min bei Raumtemperatur, den überstand verwerfen und bei-80 ° C lichtgeschützt aufbewahren.
-
Messen Sie die Kennzeichnung Effizienz mit einem Microvolume Spektralphotometer.
- Nehmen Sie 1 µL der Originallösung Atto 488 Schritt 3.3 gehindert und verdünnen Sie es weiter in DMSO (z. B.01:20 nach dem Volumenverhältnis). Dies ist das Volumen, das molare Verhältnis von Protein-Nanopartikel und Atto 488 Mischung in Schritt 3.4 gewöhnen.
- 1 µL der gespeicherten überstand aus der Kennzeichnung Reaktion in Schritt 3.5 statt. Messen Sie die Absorption (abs) bei = 501 nm. Der Anteil der Kennzeichnung ist:
(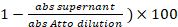
- Bereiten Sie vor dem Experiment die Nanopartikel Suspension auf die gewünschte Konzentration mit 1 X PBS-Lösung.
4. Zebrafisch Anesthetization und orale Intubation
- Schnell die Fische (> 0,5 g) mindestens 48 h vor dem Experiment, den Darm zu entleeren.
- Bewegen Sie die Fische (12 Fische) bis zu den experimentellen Tanks (6 L) eine Nacht vor dem Experiment zur Akklimatisierung12ermöglichen.
- Wirbel die Nanopartikel-Lösung gut (z. B. 2500 u/min und 30 s) und zeichnen Sie die gewünschte Lautstärke der Nanopartikel Suspension (z. B. 20 – 50 µL) in die Spritze an der geschützten Nadel befestigt.
- Legen Sie den Fisch in den belüfteten 150 mg/L MS-222-Lösung (siehe Abschnitt 2) bis sie auf den Boden des Tanks sinken und nicht auf eine Schwanzflosse Prise reagieren; Dieser Vorgang dauert weniger als 5 Minuten.
- Schnell die betäubten Fische mit einem Netz auf einem nassen Plastikbehälter übertragen, das Tier horizontal, um die Nadel zu stellen und sofort beginnen die orale Intubation zu orientieren.
- Vorsichtig unterstützen Sie die Fische mit einer Hand zu und öffnen Sie den Mund mit der anderen Hand unter Verwendung der geschützten Nadel. Sanft stechen Sie die Nadel nach unten die Speiseröhre um ca. 1 cm von der Mundöffnung.
Hinweis: Der Betreiber kann einen leichten Widerstand fühlen, wenn das Ende des der Pipettenspitze Gill übergeben hat. Achten Sie darauf, nicht die Nadel Eintrag Winkel auch vieles, was die Kieme Perforieren kann. - Injizieren Sie langsam die Nanopartikel Suspension zu den Fischen. Stellen Sie sicher, dass die Federung nicht nach außen durch die Kiemen oder den Mund fließt.
- Vorsichtig entfernen Sie die Nadel und legen Sie den Fisch in den Schmutzwassertank (siehe Abschnitt 2). Genesung dauert in der Regel innerhalb von 1 min.
- Überprüfen Sie den Fisch sorgfältig für jede Abweichung (z. B.Blutungen an den Kiemen ist ein Zeichen der Perforation).
- Sobald der Fisch erholt haben, kehren sie an die experimentelle Panzer.
5. Zebrafisch Darm Dissektion
- Nach einem bestimmten Zeitraum buchen Intubation (z. B. 5 h bzw. 24 h), legen Sie den Fisch mit einem Netz in 300 mg/L MS-222 Lösung für Euthanasie (siehe Abschnitt 2). Stellen Sie sicher die Kiemendeckel nicht mehr bewegt und es gibt keine Rute Prise Reflex. Fünf Minuten sind normalerweise ausreichend.
- Abholen der euthanasierten Tieres mit einem Netz und legen Sie es auf einem Filterpapier.
Hinweis: Das Filterpapier ist sehr nützlich für die selbstklebende Gewebe entlang der Darm entfernt. - Mit scharfe Dissektion Schere, machen Sie einen halbrunden Schnitt aus dem Anus, der Kiemendeckel und offenen Schnitt mit einer feinen Pinzette. Schneiden Sie beide Enden des Darms, nehmen Sie die inneren Organe, und legen Sie sie auf dem Filterpapier.
Achtung: Arbeiten schnell, Zellstoffwechsel und Tod zu reduzieren.
Hinweis: Alternativ, entfernen Sie das selbstklebende Gewebe mit PBS-Puffer und auf Eis. - Trennen Sie den Darm aus inneren Organen und achten Sie auf seine Orientierung (Anterior posterior Darm Segment) und ziehen Sie es heraus. Das vordere Segment des Darmes ist in der Regel breiter als posterioren Segment. Achten Sie darauf, um alle des Darms zu erhalten, wenn sezieren.
Hinweis: Das hintere Ende ist ganz fein und zerbrechlich in kleine Fische und brechen kann, besonders bei Tieren < 0, 7 g. - Rollen Sie den Darm auf dem Filterpapier mit einer Pinzette um das selbstklebende Gewebe aus dem Darm zu lösen.
- Fahren Sie mit den Darm auf verschiedenen nachgeschalteten Analysen (Abschnitte 6, 7 und 8) vorzubereiten.
6. Vorbereitung der Darmzellen für Zytometrie
- Bereiten Sie im Voraus Aliquote von 0,15 % Kollagenase Lösung (siehe Abschnitt 2.4).
Hinweis: Aliquote sollte bei Raumtemperatur bevor Sie fortfahren. - Optional: Fortsetzung von Schritt 5.5, Schlitz offen den Darm längs und mit 1 X PBS waschen.
- Mit einer Pinzette, legen Sie den Darm in die 2 mL Zentrifugenröhrchen mit 0,15 % Kollagenase Lösung gefüllt.
- Legen Sie die Röhren auf eine vertikale Labor Rotator für 1 h bei Raumtemperatur im Dunkeln.
- Legen Sie den Darm auf ein 100 µm Zelle Sieb über eine 50 mL Zentrifugenröhrchen unterstützt. Unterteilen Sie den Darm mit einer 5 mL Spritzenkolben, 3 Mal mit 1 X PBS, sammeln die Durchströmung der Probe in der 50 mL Zentrifugenröhrchen waschen.
- Zentrifugieren Sie die 50 mL Zentrifugenröhrchen 400 X g für 10 min bei 4 ° C.
- Sorgfältig die Pipette aus den meisten des Überstands nicht verlieren die Zellen, von die einige zu den Schleim verbunden sein kann.
- Aufschwemmen Sie die Darmzellen am unteren Rand die Zentrifugenröhrchen mit 500 µL 1 X PBS und auf Eis bis zytometrie Analyse
- Filter-Proben durch einen 30 µm Zelle Filter in 5 mL Rundrohr unten für zytometrie.
- Legen Sie die Parameter (z. B. die Anzahl der Zellen für die Analyse, die Region von Interesse, Spannung und Entschädigung, Auswahl von Detektoren) auf eine Cytometer Ausrüstung (siehe Material).
- Sofort analysieren Sie die Zellen auf einem Cytometer, nach den Anweisungen der Einsatz13.
7. Vorbereitung Darm Cryosections für die konfokale Mikroskopie
- Füllen Sie den Kunststoff-Formenbau (siehe Tabelle der Materialien), halbe Lautstärke mit optimale Arbeitstemperatur (O.C.T.) Verbindung.
- Fortsetzung von Schritt 5.5 und unmittelbar nach der Dissektion, legen Sie vorsichtig den Darm in der Kunststoff-Formenbau. Stellen Sie sicher, dass der Darm vollständig eingebettet in die O.C.T.-Verbindung ist. Falls erforderlich, fügen Sie mehr O.C.T. Verbindung zu den Kunststoff-Formenbau.
Hinweis: Es wird empfohlen, den Darm mit einem "Z" Form in O.C.T. Verbindung einfach die natürliche Ausrichtung verfolgen zu platzieren. - Legen Sie den Kunststoff-Formenbau auf Trockeneis bis es undurchsichtig geht (weniger als eine Minute).
- Speichern Sie den Kunststoff-Formenbau bei-80 ° C für langfristige Nutzung oder Prozess sofort mithilfe des folgenden Verfahrens.
Hinweis: Das Protokoll kann hier angehalten werden. - Schneiden Sie den gefrorenen Darm in 10 µm Abschnitte oder entsprechenden Dicke mit einem Kryostaten bei-20 ° c
- Den Darm Abschnitt mit einem feinen Pinsel auf einer Folie zu sammeln.
- Tauchen Sie die Folie in 4 % PFA für 15 min bei Raumtemperatur, die Probe zu beheben.
Achtung: PFA ist giftig. Bitte lesen Sie das Sicherheitsdatenblatt vor der Arbeit mit ihm. Handschuhe und Schutzbrille getragen werden sollte, und immer Lösungen in einer Dampfhaube lassen. - Waschen Sie die Folie 3 Mal mit 1 X PBS, 10 min.
- Geben Sie einen Tropfen Eindeckmittel und legen Sie ein Deckglas über die Probe.
Hinweis: Das Protokoll kann hier angehalten werden. - Beobachten Sie die Probe unter einem confocal Mikroskop bei entsprechenden Vergrößerung.
8. Vorbereitung der Darm für Real-Time qPCR (RT-qPCR)
- Fortsetzung von Schritt 5.5, bringen Sie den Darm in einem kryogenen Fläschchen und frieren Sie schnell den Darm in flüssigem Stickstoff und Store bei-80 ° C bis zum Gebrauch ein.
Hinweis: Das Protokoll kann hier angehalten werden. - Für die Homogenisierung, 200 µL von 2 % (V/V) gekühlt 1-Thioglycerol/Homogenisierung Lösung hinzufügen (siehe Tabelle der Materialien) oder alternative Homogenisierung Lösung für den Darm Probe.
- Arbeiten schnell, Homogenisieren die Darm Probe auf Eis mit einem Labor-Homogenisator mit hoher Geschwindigkeit (eingestellt auf 25 – 30.000 u/min) bis keine sichtbare Gewebe Fragmente erhalten. 3 Mal für 5 s ist in der Regel ausreichend.
- Isolieren der RNA mit einem kommerziellen kit (siehe Tabelle der Materialien) entsprechend des Herstellers Anweisungen14 oder eine geeignete alternative Methode. Bei Bedarf speichern Sie die RNA bei-80 ° C für den Langzeiteinsatz.
Hinweis: Das Protokoll kann hier angehalten werden. - Quantifizieren Sie die RNA-Konzentration mit einem Spektrophotometer15 und bewerten Sie die Qualität mit einer RNA-Analysator-16.
- Bereiten Sie 1 µg oder einer entsprechenden Menge an cDNA mit einer cDNA Synthese Kit gemäß den Anweisungen des Herstellers.
Hinweis: Das Protokoll kann hier angehalten werden. Folgen Sie für qPCR Analyse bitte der MIQE Leitlinien17. - Entwerfen Sie geeignete Grundierung Paare für das Gen/s von Interesse.
- Wählen Sie eine geeignete Referenz-gen und analysieren den Ausdruck jedes Gen durch eine RT-qPCR-Erkennung mit einem kommerziellen System kit (siehe Material).
Hinweis: zum Beispiel 5 µL SYBR green Supermix, 0,5 µM Primer, 2,5 µL verdünnter cDNA und 1,5 µL Wasser in einem Endvolumen von 10 µL für jede Vertiefung der qPCR Platte hinzufügen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Zebrafisch (durchschnittliches Gewicht: 1,03 ± 0,16 g) des gemischten Geschlechts wurden erfolgreich intubiert mit verschiedenen rekombinanten Proteins Nanopartikel (bakterielle Einschlusskörperchen) mit unseren hausgemachten orale Intubation Gerät (Abbildung 1). Wir haben erfolgreich die orale Intubation durchgeführt und erreicht eine niedrige durchschnittliche prozentuale Mortalität (6,8 %) (Tabelle 1). Zebrafisch waren entweder mit 30...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Dieses Protokoll ist eine Verbesserung der zuvor beschriebenen Technik für orale Intubation von Collymore Et al. 4 unser Protokoll beschreibt im Detail die orale Intubation Methode und umfasst die Vorbereitung des Darms für nachgelagerte Analysen. Unsere Methode verbessert Fisch Manipulation Geschwindigkeit, so dass eine Person das gesamte Protokoll schnell und ohne viel Variation zwischen den Betreibern durchführen. Ein Hauptunterschied von unserem Protokoll mit dem vorherigen ist, da...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass es keinen Interessenkonflikt gibt.
Danksagungen
Diese Arbeit wurde durch Zuschüsse vom spanischen Ministerium für Wissenschaft, Europäische Kommission und AGAUR Mittel zur NR (AGL2015-65129-R MINECO/FEDER und 2014SGR-345 AGAUR) unterstützt. RT hält ein Pre-Promotionsstipendium aus AGAUR (Spanien), JJ wurde unterstützt durch ein Promotionsstipendium von der China Scholarship Council (China) und NR stützt sich auf das Ramón y Cajal-Programm (RYC-2010-06210, 2010, MINECO). Wir danken Dr. Torrealba für kompetente Beratung in Protein-Produktion, N. Barba aus "Servei de Microscopia" und Dr. M. Costa von der "Servei de Citometria" von der Universitat Autònoma de Barcelona für hilfreiche technische Unterstützung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
Referenzen
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85(2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542(2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054(2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190(2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten