È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Intubazione orale di Zebrafish adulto: un modello per valutare l'assorbimento intestinale di sostanze bioattive
In questo articolo
Riepilogo
Il protocollo descrive intubating zebrafish adulto con un biologico; quindi di dissezione e preparando l'intestino per citometria, microscopia confocale e qPCR. Questo metodo consente la somministrazione di composti bioattivi per monitorare l'assorbimento intestinale e lo stimolo immune locale evocato. È rilevante per il test la dinamica intestinale di profilassi orale.
Abstract
Maggior parte dei patogeni invadono gli organismi attraverso loro mucosa. Questo è particolarmente vero nei pesci come sono continuamente esposti a un ambiente microbico-ricco di acqua. Lo sviluppo di metodi efficaci per la consegna orale di immunostimolanti o vaccini, che attivano il sistema immunitario contro le malattie infettive, è altamente auspicabile. Nell'elaborazione di strumenti profilattici, buoni modelli sperimentali sono necessari per testare le loro prestazioni. Qui, vi mostriamo un metodo per intubazione orale di zebrafish adulto e una serie di procedure per sezionare e preparare l'intestino cytometry, microscopia confocale e l'analisi quantitativa della polimerasi reazione a catena (qPCR). Con questo protocollo, precisamente possiamo erogare volumi fino a 50 µ l a pescare circa 1 g di peso semplicemente e rapidamente, senza danneggiare gli animali. Questo metodo ci permette di esplorare l'assorbimento diretto in vivo di composti fluorescente etichettati da mucosa intestinale e la capacità immunomodulatoria di tali farmaci biologici nel sito locale dopo intubazione. Combinando metodi a valle come flusso cytometry, istologia, qPCR e microscopia confocale del tessuto intestinale, possiamo capire come immunostimolanti o vaccini sono in grado di attraversare le barriere della mucosa intestinale, passano attraverso la lamina propria, e raggiungere il muscolo, esercitando un effetto sul sistema immunitario della mucosa intestinale. Il modello potrebbe essere utilizzato per testare i sistemi di consegna e profilassi orale candidato o l'effetto locale di qualsiasi composto bioactive oralmente amministrato.
Introduzione
L'obiettivo di questo articolo è di descrivere in profondità un metodo semplice per intubazione orale di zebrafish, insieme a utili procedure associate a valle. Intubazione orale utilizzando zebrafish è diventato un modello pratico nello studio delle dinamiche di malattia infettiva, orale vaccino/immunostimolante, droga/nanoparticella assorbimento e l'efficacia e l'immunità mucosa intestinale. Ad esempio, intubazione orale zebrafish è stato utilizzato nello studio di infezione da Mycobacterium marinum e Mycobacterium peregrinum 1. Lovmo et al. anche usato con successo questo modello per fornire le nanoparticelle e M. marinum a tratto gastro-intestinale di zebrafish adulto2. Inoltre, Chen et al. usato intubazione orale zebrafish per mostrare che farmaci incapsulati da nanoparticelle, quando somministrata tramite il tratto gastro-intestinale, sono stati trasportati attraverso il sangue del cervello barriera3. Questi autori hanno effettuato intubazione sulla base del metodo di gauvage descritto da Collymore et al. 4 con alcune modifiche. Tuttavia, non forniscono un protocollo altamente dettagliato che descrive la procedura di intubazione orale. Qui, presentiamo un metodo per intubazione orale di zebrafish adulto sulla base di Collymore et al. 4 includiamo ulteriormente la preparazione dell'intestino per rilevanti dell'analisi a valle da cytometry, microscopia confocale e qPCR.
L'intestino e particolarmente relativo mucosa è la prima linea di difesa contro le infezioni e il sito primario di assorbimento dei nutrienti5. Quando le cellule epiteliali e cellule presentanti l'antigene all'interno della mucosa barriere percepiscono segnali di pericolo, viene attivata un'immediata risposta immunitaria innata. Successivamente, la risposta immunitaria adattativa altamente specifica è stabilita da T e B linfociti6,7. Sviluppo di vaccini orali è una area di interesse attuale in vaccinologia. Tali vaccini sarebbe uno strumento efficace per proteggere l'organismo in luoghi esposti a causa della risposta specifica delle cellule immunitarie nei tessuti linfoidi mucosa-collegato (malto)8,9. In acquacoltura, vaccini mucosali hanno evidenti vantaggi rispetto ai vaccini iniettabili. Sono pratici per la vaccinazione di massa, meno laborioso, sono meno stressanti per i pesci e può essere somministrati ai pesci giovani. Tuttavia, mucosa vaccini candidati devono raggiungere il secondo segmento di intestino senza essere denaturato nell'ambiente orale. Anche devono passare le barriere della mucosa per avere accesso alle cellule (APC) per indurre risposte locali e/o sistemica10presentanti l'antigene. Quindi, test di assorbimento della mucosa raggiunto dagli antigeni orali candidati e loro sistemi di consegna, così come la risposta immunitaria evocata, è essenziale nello sviluppo di vaccini orali.
In un contesto biomedico, sviluppando un modello per testare gli effetti biologici dei composti dopo intubazione orale è di crescente interesse. Molte delle caratteristiche anatomiche e fisiologiche dell'intestino sono conservate tra Spriggina lignaggi, con mammiferi e pesci ossei11. Questo modello di intubazione orale collegato alla analisi a valle può essere uno strumento per fornire intuizioni in biologia umana, così come un terreno di sperimentazione per biologics o altri composti in vivo.
Il protocollo di intubazione orale può essere eseguito da un operatore, ad esempio, amministrare con successo fino a 50 µ l della sospensione di nanoparticelle proteina a pesare 1 g, con un alto tasso di sopravvivenza di pesce. La procedura è semplice da impostare e veloce; 30 pesci possono essere intubati in 1h. Il protocollo per la preparazione dell'intestino è fondamentale per fornire campioni di cellule e tessuti di qualità per la successiva analisi. Esempi di risultati a valle sono dati che mostrano la utilità del protocollo nell'ottenere i dati relazionati all'assorbimento intestinale e nell'isolamento del RNA di qualità per qPCR. Il protocollo sarebbe di grande utilità per coloro che necessitano di un modello adatto per testare le dinamiche della profilassi orale o altri composti nell'intestino.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i procedimenti sperimentali zebrafish (Danio rerio) sono stati autorizzati dal comitato etico della Universitat Autònoma de Barcelona (numero di chetta 1582) in accordo con gli International Guiding Principles for Research Involving Animals ( EU 2010/63). Tutti gli esperimenti con il danio zebrato dal vivo sono stati eseguiti 26 – 28 ° c.
1. preparare l'attrezzatura per intubazione orale
- Posto circa 1 cm di tubo in silicone bene sui ferri 31 G Luer lock per coprire la punta dell'ago.
- Taglio una pipetta di filtro sterile 10 µ l punta (circa 2 cm), prendere l'estremità più sottile e posto sopra il tubo di silicone come una guaina. Assicurarsi che la pipetta si estende oltre la punta dell'ago per evitare di ferire l'animale.
- Inserire l'ago di una siringa di 100 µ l Luer lock.
Nota: Sciacquare sempre con etanolo e quindi tampone fosfato salino (PBS, Vedi materiali) accuratamente fra i trattamenti.
2. soluzioni richieste
- Preparare 150 mg/L (per l'anestesia) o 300 mg/L (per eutanasia) di soluzione di methanesulfonate (MS-222) 3-aminobenzoate etilico con acqua dall'acquario dove sono mantenuti zebrafish. Riempire un serbatoio piccolo con 1 L di soluzione anestetica e mantenerlo aerato.
- Riempire un altro piccolo serbatoio con 1 L di acqua dell'acquario senza MS-222 per il recupero del pesce e mantenerlo aerato.
- Portare a 50 mL di 1X PBS da un 10 x soluzione sterile.
- Per isolamento delle cellule intestinali/analisi cytometry, preparare abbastanza fresco collagenasi di 0,15% soluzione di tipo IV per 1 mL / pesce da una soluzione di riserva o da polvere in mezzo di eagle modificate di Dulbecco (DMEM) con 1% v/v penicillina e streptomicina (Vedi materiali). Rendere le aliquote (1 per ogni pesce) da 1 mL in provette da centrifuga 2 mL. Conservare a 4 ° C fino a 30 min prima del passaggio di dissezione.
- Per la fissazione di microscopia confocale/campione, preparare 50 mL di soluzione fresca di paraformaldeide (PFA) 4% in PBS o scongelare una soluzione stock dal congelatore a-20 ° C in una cappa aspirante.
Attenzione: PFA è tossico. Si prega di leggere il foglio di dati materiale di sicurezza prima di lavorare con esso. Guanti e occhiali di sicurezza devono essere indossati e lasciare sempre soluzioni all'interno di una cappa aspirante.
3. preparare la sospensione delle nanoparticelle fluorescenti
- Etichettare la proteina di nanoparticelle con estere NHS Atto-488 (Vedi Tabella materiali) o un colorante fluorescente appropriato secondo le istruzioni del produttore.
- Risospendere le nanoparticelle in 0.1 M tampone del bicarbonato di sodio alla concentrazione di 2 mg/mL.
- Sciogliere l'estere di Atto 488 NHS in privo di ammina dimetilsolfossido (DMSO) a 2 mg/mL. Mantenere un'aliquota di 10 µ l di verificare l'efficienza d'etichettatura (passo 3,7-3,8).
- Mescolare le nanoparticelle e l'estere NHS 488 Atto ad un rapporto molare di 1:2 (proteina: tintura) mediante agitazione al buio.
- Rotazione verso il basso le nanoparticelle con etichettate mediante centrifugazione a 8.000 x g per 10 min a temperatura ambiente, rimuovere il supernatante e tenerlo per verificare l'efficienza d'etichettatura (passo 3,7-3,8).
- Lavare le nanoparticelle con etichettate di risospensione in 1 mL di soluzione tampone del bicarbonato di sodio 0,1 M di Vortex e pipettaggio su e giù. Quindi eliminare il supernatante mediante centrifugazione a 8.000 x g per 10 min a temperatura ambiente. Ripetere il passaggio 3.6 per 5 volte.
- Risospendere il pellet in 5 mL di soluzione tampone del bicarbonato di sodio 0,1 M in una provetta da centrifuga da 15 mL e rendere le aliquote della nanoparticella fluorescente in provette da 1,5 mL (30 aliquote). Rotazione verso il basso a 8.000 x g per 10 min a temperatura ambiente, scartare il surnatante e conservare a-80 ° C al riparo dalla luce.
-
Misurare l'efficienza d'etichettatura utilizzando uno spettrofotometro di microvolume.
- Prendere 1 µ l della soluzione originale Atto 488 mantenuta dal punto 3.3 e diluire ulteriormente in DMSO (ad es., 01:20 in base al rapporto di volume). Questo è il volume utilizzato per ottenere il rapporto molare della proteina di nanoparticelle e Atto 488 mix al punto 3.4.
- Prendere 1 µ l del surnatante salvato dalla reazione di etichettatura al punto 3.5. Misurare l'assorbimento (abs) a = 501 nm. La percentuale di etichettatura è:
(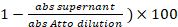
- Prima dell'esperimento, preparare la sospensione di nanoparticelle alla concentrazione desiderata utilizzando la soluzione PBS 1X.
4. Zebrafish amputate e intubazione orale
- Veloce il pesce (> 0,5 g) almeno 48 h prima dell'esperimento per svuotare l'intestino.
- Spostare il pesce (12 pesce) per i carri armati sperimentali (6 L) una notte prima dell'esperimento per consentire acclimatazione12.
- Vortex la soluzione di nanoparticelle bene (ad esempio, 2.500 giri/min e 30 s) e aspirare il volume desiderato della sospensione delle nanoparticelle (ad es., 20 – 50 µ l) nella siringa all'ago protetto.
- Mettere il pesce in aerato 150mg/L MS-222 soluzione (vedere la sezione 2) finché non si depositano sul fondo del serbatoio e non rispondono ad un pizzico di pinna caudale; Questo processo richiede meno di 5 minuti.
- Rapidamente il pesce anestetizzato con una rete di trasferimento per un vassoio di plastica bagnato, orientano l'animale orizzontalmente per affrontare l'ago e avviare immediatamente l'intubazione orale.
- Accuratamente il pesce con una mano di sostegno e aprire la bocca con l'altra mano utilizzando l'ago protetto. Inserire delicatamente l'ago giù l'esofago a circa 1 cm dall'apertura della bocca.
Nota: L'operatore può sentire una leggera resistenza quando alla fine della punta della pipetta ha superato la branchia. Fare attenzione a non la voce di ago troppo che può perforare la branchia di angolo. - Iniettare lentamente la sospensione di nanoparticelle per il pesce. Assicurarsi che la sospensione non scorre verso l'esterno attraverso le branchie o la bocca.
- Rimuovere l'ago delicatamente e mettere il pesce nel serbatoio di recupero (Vedi sezione 2). Recupero richiede solitamente entro 1 min.
- Controllare il pesce con attenzione per qualsiasi anomalia (ad es., sanguinamento alle branchie è un segno di perforazione).
- Una volta il pesce hanno recuperato, restituirli ai serbatoi sperimentali.
5. Zebrafish intestino dissezione
- Dopo un periodo di tempo specificato post intubazione (ad es., 5h e/o 24 h), mettere il pesce usando una rete in 300 mg/L MS-222 soluzione per eutanasia (Vedi sezione 2). Assicurarsi che l'opercolo smette di muoversi e non c'è nessun riflesso di pizzico di coda. Cinque minuti è normalmente sufficiente.
- Pick up l'animale eutanasizzato con un netto e posizionarlo su una carta da filtro.
Nota: La carta da filtro è molto utile per rimuovere il tessuto adesivo lungo l'intestino. - Utilizzando le forbici dissezione tagliente, fare un'incisione semicircolare dall'ano per opercolo ed aperta con pinzette bene. Tagli entramba l'estremità dell'intestino, prendere fuori tutti gli organi interni e metterli su carta da filtro.
Attenzione: Intervenire rapidamente per ridurre la morte e il metabolismo cellulare.
Nota: In alternativa, rimuovere il tessuto adesivo in PBS e su ghiaccio. - Separare l'intestino dagli organi interni facendo attenzione a mantenere il suo orientamento (anteriore al segmento intestinale posteriore) e allungarla. Di solito, il segmento anteriore dell'intestino è maggiore di segmento posteriore. Prendere cura di ottenere tutti dell'intestino quando di dissezione.
Nota: L'estremità posteriore è abbastanza fine e fragile a piccoli pesci e può rompersi, particolarmente in animali < 0,7 g. - Rotolare l'intestino su carta da filtro con le pinzette per staccare l'adesivo tessuto dall'intestino.
- Procedere per preparare l'intestino per varie analisi a valle (sezioni 6, 7 e 8).
6. preparazione di cellule intestinali per citometria a
- Preparare in anticipo le aliquote di soluzione della collagenosi 0,15% (vedere paragrafo 2.4).
Nota: Le aliquote devono essere a temperatura ambiente prima di procedere. - Opzionale: Proseguendo dal passaggio 5.5, fessura aperta l'intestino longitudinalmente e lavare con PBS 1X.
- Utilizzando pinzette, posizionare l'intestino la provetta da centrifuga 2 mL riempita con soluzione di collagenasi di 0,15%.
- Disporre le provette in un rotatore di laboratorio verticale per 1 h a temperatura ambiente al buio.
- Posizionare l'intestino su un colino di cella di 100 µm sostenuto sopra un tubo di centrifuga da 50 mL. Spezzare l'intestino con un pistone della siringa 5ml, lavare 3 volte con PBS 1X, raccogliendo il flusso attraverso il campione nella provetta centrifugo 50ml.
- Centrifugare la provetta da centrifuga 50 mL a 400 x g per 10 min a 4 ° C.
- Pipettare attentamente la maggior parte del surnatante pur non perdendo le cellule, alcune delle quali possono essere associati al muco.
- Risospendere le cellule intestinali in fondo della provetta da centrifuga con 500 µ l di PBS 1X e tenere il ghiaccio fino all'analisi di citometria a
- Filtro campioni attraverso un filtro a celle 30 µm in 5 mL rotondo fondo tubi per cytometry.
- Impostare i parametri (ad esempio, il numero di cellule per l'analisi, la regione di interesse, la tensione e la compensazione, selezione di rivelatori) su un citometro apparecchiature (Vedi materiali).
- Analizzare immediatamente le cellule su un citometro, seguendo le istruzioni di uso13.
7. preparazione dell'intestino Cryosections per microscopia confocale
- Riempire lo stampo di plastica (Vedi Tabella materiali) a metà del volume con temperatura di taglio ottimale (t.o.c.) composto.
- Proseguendo dal passaggio 5.5 e immediatamente dopo la dissezione, posizionare delicatamente l'intestino nella muffa di plastica. Assicurarsi che l'intestino è completamente incorporato nel o.c.t. compound. Se necessario, aggiungere altro o.c.t. compound per la muffa di plastica.
Nota: È consigliabile posizionare l'intestino con una forma di "Z" in o.c.t. compound per seguire facilmente il suo orientamento naturale. - Posizionare la muffa di plastica su ghiaccio secco finché non va opaco (meno di un minuto).
- Memorizzare la muffa di plastica a-80 ° C per uso a lungo termine o processo immediatamente utilizzando la procedura seguente.
Nota: Il protocollo può essere messo in pausa qui. - Affettare l'intestino congelato in 10 µm sezioni o spessore appropriato utilizzando un criostato a-20 ° C.
- Raccogliere la sezione dell'intestino con un pennello sottile su un vetrino.
- Immergere il vetrino in 4% PFA per 15 min a temperatura ambiente per correggere l'esempio.
Attenzione: PFA è tossico. Si prega di leggere il foglio di dati materiale di sicurezza prima di lavorare con esso. Guanti e occhiali di sicurezza devono essere indossati e lasciare sempre soluzioni all'interno di una cappa aspirante. - Lavare il vetrino 3 volte con 1x PBS, 10 min ciascuno.
- Aggiungere una goccia di mezzo di montaggio e porre un coprivetrino sopra il preparato.
Nota: Il protocollo può essere messo in pausa qui. - Osservare il campione al microscopio confocale a ingrandimento idoneo.
8. preparazione dell'intestino per qPCR tempo reale (RT-qPCR)
- Proseguendo dal passaggio 5.5, mettere l'intestino in un vial criogeniche e congelare rapidamente l'intestino in azoto liquido e conservare a-80 ° C fino all'utilizzo.
Nota: Il protocollo può essere messo in pausa qui. - Per l'omogeneizzazione, aggiungere 200 µ l del 2% (v/v) refrigerati 1-Thioglycerol/omogeneizzazione soluzione (Vedi Tabella materiali) o soluzione alternativa omogeneizzazione al campione dell'intestino.
- Lavorare velocemente, omogeneizzare il campione dell'intestino sul ghiaccio con un omogeneizzatore laboratorio ad alta velocità (impostato a 25-30.000 giri/min) fino a nessun tessuto visibile rimangono frammenti. 3 volte per 5 s è solitamente sufficiente.
- Isolare il RNA usando uno spot kit (Vedi Tabella materiali) secondo istruzioni14 del produttore o un metodo alternativo adatto. Se necessario, conservare il RNA a-80 ° C per uso a lungo termine.
Nota: Il protocollo può essere messo in pausa qui. - Quantificare la concentrazione di RNA usando un spettrofotometro15 e valutare la qualità utilizzando un analizzatore di RNA16.
- Preparare 1 µ g o una quantità appropriata di cDNA usando un kit di sintesi di cDNA secondo le istruzioni del produttore.
Nota: Il protocollo può essere messo in pausa qui. Per analisi qPCR, si prega di seguire le linee guida MIQE17. - Progettazione di coppie di primer appropriato per il gene/s di interesse.
- Selezionare un gene di riferimento adeguati e analizzare l'espressione di ogni gene tramite una rilevazione di RT-qPCR kit impianto utilizzando delle imprese (Vedi materiali).
Nota: ad esempio, aggiungere 5 µ l di supermix SYBR green, 0,5 µ m di primer, 2,5 µ l di cDNA diluito e 1,5 µ l di acqua in un volume finale di 10 µ l per ciascun pozzetto della piastra di qPCR.
Access restricted. Please log in or start a trial to view this content.
Risultati
Zebrafish (peso medio: 1,03 ± 0,16 g) di sesso misto con successo sono stati intubati con nanoparticelle di differenti della proteina ricombinante (corpi di inclusione batterici) utilizzando il nostro dispositivo di intubazione orale fatto in casa (Figura 1). Abbiamo correttamente eseguita l'intubazione orale e raggiunto un tasso di mortalità basso percentuale media (6,8%) (Tabella 1). Zebrafish erano sia intubati con 30 µ l o 50 µ l di s...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo protocollo è un miglioramento della tecnica precedentemente descritta per intubazione orale di Collymore et al. 4 il nostro protocollo viene descritto in dettaglio il metodo di intubazione orale e prevede la preparazione dell'intestino per analisi successive. Il nostro metodo migliora la velocità di manipolazione di pesce permettendo una persona di svolgere l'intero protocollo rapidamente, senza molta variazione tra gli operatori. Una differenza principale del nostro protocollo c...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano che non interessi concorrenti presenti.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dal Ministero spagnolo della scienza, AGAUR fondi al NR (AGL2015-65129-R MINECO/FEDER e 2014SGR-345 AGAUR) e Commissione europea. RT ha conseguito una borsa di studio pre-dottorato AGAUR (Spagna), JJ è stata sostenuta da una borsa di dottorato del Consiglio di borsa di studio della Cina (Cina) e NR è supportato dal programma Ramón y Cajal (RYC-2010-06210, 2010, MINECO). Ringraziamo il dottor Torrealba per consulenza di esperti nella produzione di proteine, N. Barba dal "Servei de Microscopia" e Dr. M. Costa da "Servei de Citometria" della Universitat Autònoma de Barcelona per assistenza tecnica disponibile.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Silicone tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 mL homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
Riferimenti
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85(2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. ø An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542(2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054(2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190(2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon