JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
성인 Zebrafish의 구강 삽 관 법: 생리 활성 화합물의 장의 이해를 평가 하기 위한 모델
요약
생물 학적;와 intubating 성인 zebrafish를 프로토콜에 설명 합니다. 그리고 해 부 cytometry, confocal 현미경 검사 법 및 정량에 대 한 소장을 준비 합니다. 이 메서드는 관리를 장의 글귀와 로컬 면역 자극을 갖는 생리 활성 화합물의 수 있습니다. 그것은 구두 prophylactics의 장 역학 테스트 관련이 있습니다.
초록
대부분 병원 체 유기 체 그들의 점 막을 통해 침입 한다. 이것은 생선에 특히 사실 그들은 지속적으로 미생물이 풍부한 물 환경에 노출 되는. Immunostimulants 또는 백신, 전염 성 질병에 대 한 면역 시스템을 활성화 하는 구두 납품을 위한 효과적인 방법을 개발 하는 것이 매우 바람직하다입니다. 예방 도구를 고안, 좋은 실험 모델의 성능을 테스트 필요 합니다. 여기, 우리는 성인 zebrafish의 구강 삽 관 법에 대 한 방법 및 해 부 cytometry, confocal 현미경 검사 법 및 정량적 중 합 효소 연쇄 반응 (정량) 분석에 대 한 소장을 준비 하는 절차의 집합을 보여줍니다. 이 프로토콜, 우리가 정확 하 게 동물을 해치지 않고 약 1 g을 간단 하 고 신속 하 게, 무게 물고기 50 µ L까지 볼륨을 관리할 수 있습니다. 이 방법은 삽 관 법 후 장 점 막 및 로컬 사이트에 같은 생물 의약품의 immunomodulatory 용량 붙일 이라는 화합물의 직접 vivo에서 이해를 탐험 수 있습니다. 장 조직의 confocal 현미경 검사 법, 정량, 조직학, cytometry 등 다운스트림 메서드를 결합해 서, 우리는 immunostimulants 또는 예방 접종 수 있는 방법을 장 점 막 방 벽을 교차, 통과 lamina propria 이해할 수 있다 고 장내 점 막 면역 시스템에 효과 발휘 하는 근육에 도달 합니다. 모델 후보 구두 prophylactics 및 전달 시스템 또는 로컬 효과 있는 구두 관리 생리 활성 화합물의 테스트 사용 될 수 있습니다.
서문
이 문서의 목표는 깊이에 유용한 연결 된 다운스트림 절차 함께 zebrafish의 구강 삽 관 법에 대 한 간단한 방법 설명. 제 브라를 사용 하 여 구강 삽 관 법의 전염병 역학, 구강 백신/immunostimulant, 마약/나노 통풍 관 및 효능, 장내 점 막 면역 연구에 실용적인 모델 되고있다. 예를 들어 zebrafish 구강 삽 관 법 진 균 marinum 고 진 균 peregrinum 감염1의 연구에 사용 되었습니다. Lovmo 외. 또한 나노 입자 및 M. marinum 는 위장 지역 성인 zebrafish2를 제공을 성공적으로이 모델을 사용. 첸 외. 마약, 나노 입자에 의해 캡슐화 보여 zebrafish 구강 삽 관 법을 사용 하는 또한 때 관리를 통해 위장 관의 혈액 두뇌 방 벽3에서 수송 되었다. 이 저자 수행 Collymore 그 외 여러분 에 의해 설명 하는 gauvage 방법에 따라 삽 관 법 몇 가지 수정 4 . 그러나, 그들은 구두 삽 관 법 절차를 설명 하는 매우 상세한 프로토콜을 제공 하지 않았다. 여기, 우리 Collymore 외 에 성인 zebrafish의 구강 삽 관 법에 대 한 방법 제시 4 우리는 더 cytometry, confocal 현미경 검사 법 및 정량 소장 관련 다운스트림 분석에 대 한 준비 포함.
소장 및 특히 그것의 점 막 감염에 대 한 방어의 첫 번째 라인 및 양분 통풍 관5의 주 사이트입니다. 상피 세포와 점 막 장벽 내에서 항 원 제시 세포 위험 신호 인식 때 즉시 타고 난 면역 반응은 트리거됩니다. 다음으로, 매우 구체적인 적합 한 면역 반응 T와 B 림프 톨6,7으로 설정 됩니다. 구강 백신의 개발 백신에 현재 초점 지역 이다. 이러한 백신 노출된 사이트 점 막 관련 림프 조직 (맥 아)8,9에 면역 세포의 특정 응답 때문에 유기 체를 보호 하기 위해 효과적인 도구 것입니다. 양식, 점 막 백신 주사 백신에 비해 분명 장점이 있다. 그들은 보다 적게 노동 집약 대량 예방 접종에 대 한 실용적, 물고기, 보다 적게 스트레스가 많은 있으며 젊은 물고기를 관리할 수 있습니다. 그럼에도 불구 하 고, 점 막 백신 후보자 없이 구강 환경에서 변성 되 고 두 번째 직감 세그먼트를 도달 해야 한다. 그들은 또한 항 원 제시 세포 (Apc) 로컬 및/또는 조직의 응답10유도 하에 액세스 점 막 방 벽을 교차 해야 합니다. 따라서, 후보 구두 항 원 및 그들의 배달 시스템을 함으로써 점 막 통풍 관의 테스트, 갖는, 면역 반응 뿐만 아니라에 필수적입니다 구강 백신의 개발.
생물 의학 맥락에서 후 구강 삽 관 법은 성장 관심사의 이다 화합물의 생물 학적 효과 테스트 하는 모델을 개발. 내장의 해 부 및 생리 기능의 많은 포유류와 나폴레옹 물고기11bilaterian 계보 사이 보존 됩니다. 다운스트림 분석에 연결 하는이 구두 삽 관 법 모델 생물 의약품에 대 한 테스트 땅 뿐 아니라 인간의 생물학으로 통찰력을 제공 하는 도구 일 수 있다 또는 다른 비보에화합물.
구강 삽 관 법 프로토콜 성공적으로 물고기는 높은 생존 율과 무게 1 g, 단백질 나노 입자 현 탁 액의 최대 50 µ L를 관리 예를 들어, 하나의 연산자에 의해 수행할 수 있습니다. 절차는 간단 설정 하 고 빠른; 1 시간에 30 물고기를 intubated 수 있습니다. 내장 준비를 위한 프로토콜은 후속 분석을 위한 질 세포 및 조직 샘플을 제공 하는 열쇠입니다. 다운스트림 결과의 예는 장 통풍 관에 관련 된 데이터를 취득 및 정량에 대 한 품질 RNA 격리 프로토콜의 유용성을 표시 하는 주어진 다. 프로토콜 내장에서 구두 prophylactics의 역학 또는 다른 화합물을 테스트 하는 적합 한 모델을 필요 들을 잘 사용 될 것 이다.
프로토콜
Zebrafish (Danio rerio)를 포함 하는 모든 실험 절차 연구와 관련 된 동물 (국제 원칙와 Universitat Autònoma de 바르셀로나 (CEEH 수 1582)의 윤리 위원회에 의해 승인 되었다 EU 2010/63). 라이브 zebrafish 모든 실험 26-28 ° c.에 수행 되었다
1. 구강 삽 관 법에 대 한 장비 준비
- 31 G Luer 잠금 바늘 바늘 팁을 커버 하기에 좋은 실리콘 튜브의 대략 1 cm를 놓습니다.
- 컷 10 µ L 살 균 필터 피 펫 팁 (약 2cm), 미세한 끝과 칼 집으로 실리콘 튜브 위에 그것을 배치. 피펫으로 확장 부상 동물을 피하기 위해 바늘의 끝 다는 것을 확인 하십시오.
- 100 µ L Luer 잠금 주사기 바늘을 연결 합니다.
참고: 항상 에탄올으로 씻어 고 다음 인산 염 버퍼 (PBS, 자료를 참조) 치료 사이의 철저 하 게.
2입니다. 솔루션 필요
- 150 mg/L (마 취) 또는 300 mg/L (안락사)는 zebrafish 유지는 수족관에서 물과 에틸 3-aminobenzoate methanesulfonate (MS-222) 솔루션의 준비. 마 취 솔루션의 1 리터와 작은 탱크를 화난 그것을 유지.
- 물고기 복구에 대 한 MS-222 없이 수족관 물 1 리터와 함께 또 다른 작은 탱크를 화난 그것을 유지.
- 살 균 재고 솔루션 x 10에서 1 x PBS의 50 mL를 확인 합니다.
- Cytometry 분석/장내 세포 격리에 대 한 1 %v / v 페니실린과 스 (자료 참조)와 함께 물고기 재고 솔루션 또는 Dulbecco의 수정된이 글 매체 (DMEM) 분말 당 1 ml 충분 한 신선한 0.15% 콜라 유형 IV 솔루션을 준비 합니다. 2 mL 원심 분리기 튜브에 aliquots (물고기 당 1) 1 ml를 확인 합니다. 해 부 단계 전에 30 분까지 4 ° C에서 유지.
- Confocal 현미경 검사 법/샘플 고정, 50 mL PBS에 신선한 4 %paraformaldehyde (PFA) 솔루션의 준비 또는 재고 솔루션 증기 두건에서-20 ° C 냉장고에서 해 동.
주의: PFA 독성이 있다. 그것으로 작업 하기 전에 물질 안전 데이터 시트를 읽어 보시기 바랍니다. 장갑, 안전 안경 착용 해야 하 고 항상 증기 두건 내부 솔루션을 떠나.
3. 준비 형광 나노 서 스 펜 션
- Atto 488 NHS 에스테 르 단백질 나노 레이블 ( 테이블의 자료를 참조) 또는 제조업체의 지침에 따라 적절 한 형광 성 염료.
- 2 mg/mL의 농도에서 0.1 M 탄산 버퍼에는 나노 입자를 resuspend.
- 2 mg/mL에 디 메 틸 아민 무료 sulfoxide (DMSO)에 거 488 NHS 에스테 르 분해. 라벨 효율 (3.7-3.8 단계)을 확인 하는 10 µ L의 약 수를 유지 합니다.
- 어둠 속에서 감동으로는 나노 입자와 1:2 (단백질: 염료)의 어 금 니 비율에서 Atto 488 NHS 에스테 르를 혼합.
- 실 온에서 10 분 동안 8000 x g 에서 원심 분리 하 여 레이블이 지정 된 나노 입자를 회전 시키십시오, 제거는 상쾌한 고 라벨 효율 (3.7-3.8 단계)을 확인 하.
- Vortexing 및 아래로 pipetting으로 1 mL의 0.1 M 탄산 버퍼에 resuspending에 의해 레이블이 지정 된 나노 입자를 씻어. 다음 실 온에서 10 분 동안 8000 x g 에서 원심 분리 하 여는 상쾌한을 삭제 합니다. 5 회 3.6 단계를 반복 합니다.
- 15 mL 원심 분리기 튜브에 0.1 M 탄산 버퍼의 5 mL에 펠 릿을 resuspend 하 고 aliquots 형광 나노 입자의 1.5 mL 원심 분리기 튜브 (30 aliquots). 실 온에서 10 분 동안 8000 x g 에 아래로 회전, 삭제는 상쾌한 고 빛 으로부터 보호-80 ° C에 저장 합니다.
-
Microvolume 분 광 광도 계를 사용 하 여 라벨 효율성을 측정 합니다.
- 원래 거 488 솔루션 단계 3.3에서에서 유지의 1 µ L을 추가 (예를 들어, 볼륨 비율에 따라 1시 20분) DMSO에 희석. 이것은 단계 3.4에서 단백질 나노 입자와 거 488 믹스의 어 금 니 비율을 얻을 하는 데 사용 하는 볼륨입니다.
- 3.5 단계에서 라벨 반응에서 저장 된 상쾌한의 1 µ L를 가져가 라. 흡수 (abs) 측정 = 501 nm. 라벨의 백분율은:
(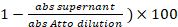
- 실험 전에 나노 서 스 펜 션 1 x PBS 솔루션을 사용 하 여 원하는 농도에서 준비 합니다.
4. 제 브라 Anesthetization 및 구강 삽 관 법
- 빠른 물고기 (> 0.5 g) 이상 48 h 소장을 실험 하기 전에.
- 하룻밤 순응12수 있도록 실험 전에 실험 탱크 (6 패) 물고기 (12 생선)을 이동 합니다.
- 회오리 잘 나노 솔루션 (예: 2500 rpm 및 30 s) 보호 바늘에 연결 된 주사기에 원하는 양의 나노 서 스 펜 션 (예를 들어, 20-50 µ L)를 그립니다.
- 화난된 150 mg/L MS에서에서 장소 물고기-222 솔루션 (섹션 2 참조) 그들은 탱크의 바닥에 가라앉을 때까지 꼬리 핀치;에 응답 하지 않는 이 과정에는 5 분 미만 걸립니다.
- 신속 하 게 젖은 플라스틱 쟁반에 그물과 마 취 물고기를 전송, 바늘 얼굴과 구강 삽 관 법을 즉시 시작 하 가로 동물을 찾으시는.
- 조심 스럽게 한 손으로 물고기를 지원 하 고 보호 된 바늘을 사용 하 여 다른 손으로 입을 열어. 부드럽게 열고 입에서 약 1 cm 식도 아래로 바늘을 삽입 합니다.
참고: 연산자는 피 펫 팁의 끝은 길 통과 하는 때 약간의 저항을 느낄 수 있습니다. 알아서 하지 각도 아가미 구멍 수 있습니다 너무 많은 바늘 항목. - 천천히 물고기를 나노 입자 현 탁 액을 주입. 정지 아가미 또는 입을 통해 밖으로 흐름 하지 않습니다 다는 것을 확인 하십시오.
- 부드럽게 바늘을 제거 하 고 복구 탱크 (섹션 2 참조)에 물고기를 놓습니다. 복구는 일반적으로 1 분 이내 소요 됩니다.
- 신중 하 게 어떤 이상에 대 한 물고기를 확인 하십시오 (예를 들어, 아가미에 출혈 구멍 뚫 기의 표시 이다).
- 일단 물고기, 회복 실험 탱크에 그들을 반환 합니다.
5. 제 브라 내장 해 부
- 지정 된 기간 후 게시 삽 관 법 (예를 들어, 5 h / 24 h), 장소 300 mg/L MS에 그물을 사용 하 여 물고기-안락사 (섹션 2 참조)에 대 한 222 솔루션. operculum 이동 중지 하 고 아무 꼬리 핀치 반사는 다는 것을 확인 하십시오. 5 분은 일반적으로 충분 합니다.
- 그물을 가진 안락사 동물을 선택 하 고 필터 종이에 그것을 배치.
참고: 필터 종이 소장을 따라 접착제 조직을 제거에 대 한 매우 유용 합니다. - 날카로운 해 부가 위를 사용 하는 operculum에 항문에서 세미 원형 절 개 및 오픈 절 개 괜 찮 핀셋을 사용 하 여 확인 합니다. 내장의 양쪽 끝을 잘라, 모든 내부 장기를 꺼내와 필터 종이에 그들을 배치.
주의: 세포 대사와 죽음을 줄이기 위해 신속 하 게 작동 합니다.
참고: 또는, PBS에 얼음에 접착제 조직을 제거 합니다. - (앞쪽 후부 장 세그먼트) 방향을 유지 하 고 그것을 밖으로 기지개 하는 내부 장기에서 내장을 분리 합니다. 일반적으로, 내장의 앞쪽 세그먼트는 후부 세그먼트 보다 넓은. 내장의 모든 해 부 할 때를 돌 봐.
참고: 후부 끝은 아주 작은 물고기에 연약한 고 끊다 수 있습니다, 특히 동물에서에서 < 0.7 g. - 소장에서 접착제 조직 분리 하기 위해 핀셋으로 필터 종이에 소장 롤.
- 다양 한 다운스트림 분석 (섹션 6, 7, 8)에 대 한 소장을 준비를 진행 합니다.
6. Cytometry 장 세포 준비
- 0.15% 콜라 솔루션 (섹션 2.4 참조)의 aliquots 사전에 준비 합니다.
참고: 계속 하기 전에 실내 온도에 Aliquots 이어야 한다. - 옵션: 단계 5.5에서에서 계속, 슬릿 오픈 소장 경도 하 고 1x PBS로 세척.
- 핀셋을 사용 하 여, 0.15% 콜라 솔루션으로 가득 2 mL 원심 분리기 튜브에 내장을 놓습니다.
- 어둠 속에서 실 온에서 1 h에 대 한 수직 실험실 회전자에 튜브를 놓습니다.
- 100 µ m 셀 거르는 50 mL 원심 분리기 튜브 지원에 소장을 놓습니다. 50 mL 원심 분리기 튜브에 샘플을 통해 흐름을 수집 1 x PBS로 3 번 세척 5 mL 주사기 플런저와 소장을 휴식.
- 4 ° c.에서 10 분, 400 x g 에서 50 mL 원심 분리기 튜브 원심
- 신중 하 게 일부는 점액에 연결 될 수 있습니다, 셀을 잃지 않는 하는 동안 상쾌한의 대부분에서 피 펫.
- Resuspend 1 x PBS의 500 µ L 원심 분리기 튜브의 하단에 장 세포와 cytometry 분석까지 얼음에 계속
- 5 mL로 30 µ m 셀 필터를 통해 필터 샘플 하단 튜브 cytometry에 대 한 라운드.
- 매개 변수 (예를 들어, 분석에 대 한 셀의 수, 관심 지역, 전압 보상, 검출기의 선택) cytometer 장비에 설정 (자료 참조).
- 즉시 분석에 사용13의 지침에 따라는 cytometer 세포.
7. Confocal 현미경 검사 법에 대 한 내장 Cryosections 준비
- 플라스틱 몰드 채우기 ( 재료의 표참조) 절반 볼륨 최적의 절삭 온도 (O.C.T.) 화합물.
- 신중 하 게 장소 단계 5.5에서에서 해 부 후에 즉시 계속, 플라스틱 형 소장. 내장은 완전히 O.C.T. 화합물에서 포함 된 다는 것을 확인 하십시오. 필요한 경우, 플라스틱 형에 더 O.C.T. 화합물을 추가 합니다.
참고: 그것은 쉽게 자연 방향을 따라 복합 O.C.T.에 "Z" 모양으로 소장을 배치 하 고 좋습니다. - (1 분 미만) 불투명가 될 때까지 드라이 아이스에 플라스틱 금형을 놓습니다.
- 장기간 사용 하거나 즉시 다음 절차를 사용 하 여 프로세스에 대 한-80 ° C에서 플라스틱 금형을 저장 합니다.
참고: 프로토콜 수 수 일시 중지 여기. - 10 µ m 섹션 또는-20 ° c.에 있는 cryostat를 사용 하 여 적절 한 간격으로 냉동된 내장 슬라이스
- 슬라이드에 좋은 브러쉬 내장 섹션을 수집 합니다.
- 4%에서 슬라이드를 담가 PFA 실 온에서 15 분에 대 한 예제를 해결 하기 위해.
주의: PFA 독성이 있다. 그것으로 작업 하기 전에 물질 안전 데이터 시트를 읽어 보시기 바랍니다. 장갑, 안전 안경 착용 해야 하 고 항상 증기 두건 내부 솔루션을 떠나. - 슬라이드 1 x PBS, 10 분으로 3 회 씻는 다.
- 설치 매체의 한 방울을 추가 하 고 장소는 coverslip 표본.
참고: 프로토콜 수 수 일시 중지 여기. - 적절 한 배율에 confocal 현미경 샘플을 관찰 합니다.
8. 실시간 정량 pcr (RT-정량) 소장 준비
- 단계 5.5에서에서 계속, 극저온 유리병에 내장을 넣어 하 고 빠르게 사용까지 액체 질소와-80 ° C에 게 소장을 동결.
참고: 프로토콜 수 수 일시 중지 여기. - 균질, 추가 200 µ L 2% (v/v)의 냉장 1-Thioglycerol/균질 솔루션 ( 재료의 표참조) 또는 대체 균질 솔루션 내장 샘플을.
- 신속 하 게 작업, 얼음에 내장 샘플 균질 아니 보이는 조직까지 (25-30000 rpm 설정) 빠른 속도로 실험실 균질 화기 파편 남아 있다. 5를 3 번 s 일반적으로 충분 하다.
- 상업을 사용 하 여 RNA를 분리 ( 재료의 표참조) 키트 제조 업체의 지침14 또는 적당 한 다른 방법. 필요에 따라 장기간 사용-80 ° C에서 RNA를 저장 합니다.
참고: 프로토콜 수 수 일시 중지 여기. - 15 분 광 광도 계 사용 하 여 RNA 농도 계량 하 고 RNA 분석기16를 사용 하 여 품질을 평가 합니다.
- 1 µ g 또는 제조업체의 지침에 따라 cDNA 합성 키트를 사용 하 여 cDNA의 적절 한 금액을 준비 합니다.
참고: 프로토콜 수 수 일시 중지 여기. 정량 분석을 위한 MIQE 지침17을 따르시기 바랍니다. - 관심사의 유전자/s에 대 한 적절 한 뇌관 쌍을 디자인 합니다.
- 적합 한 참조 유전자를 선택 하 고 실시간 정량 검출에 의해 각 유전자의 표현 분석 상업을 사용 하 여 시스템 키트 (자료 참조).
참고: 예를 들어 정량 플레이트의 각 잘 10 µ L의 최종 볼륨에서 SYBR 녹색 supermix의 5 µ L, 0.5 µ M 뇌관, 희석된 cDNA의 2.5 µ L 및 1.5 µ L의 물 추가 합니다.
결과
제 브라 (중량 평균: 1.03 ± 0.16 g) 혼합 섹스 했다 성공적으로 intubated 다른 재조합 단백질 나노 입자 (세균 포함 시체)가 우리 집에서 만든 구강 삽 관 법 장치 (그림 1)를 사용 하 여 함께. 우리는 성공 구강 삽 관 법을 수행 하 고 낮은 평균 비율 사망률 (6.8%) (표 1)입니다. Zebrafish 되었고 중 intubated 30 µ L 또는 나노 입자 현 탁 액의 50 µ L 사망...
토론
이 프로토콜은 Collymore 그 외 여러분 에 의해 구강 삽 관 법에 대 한 앞에서 설명한 방법의 개선 4 우리의 프로토콜 구강 삽 관 법 방법 자세히 설명 하 고 다운스트림 분석에 대 한 내장의 준비를 포함 한다. 우리의 방법은 사업자 사이 많은 변화 없이 빠르게, 전체 프로토콜을 수행 하는 한 사람을 허용 하는 물고기 조작 속도를 향상 시킵니다. 우리의 이전 프로토콜의 주요 ...
공개
저자는 아무 경쟁 관심사 존재 선언 합니다.
감사의 말
이 작품은 유럽 위원회와 AGAUR 자금 (AGL2015-65129-R MINECO/페더 및 2014SGR-345 AGAUR) NR 과학, 스페인 정부에서 교부 금에 의해 지원 되었다. RT는 AGAUR (스페인), JJ에서에서 전 박사 장학금 중국 장학금 위원회 (중국)에서 박사 학위 장학금에 의해 지원 되었다와 NR 라몬 y Cajal 프로그램 (RYC-2010-06210, 2010, MINECO)에 의해 지원 됩니다 보유 하고있다. 우리는 단백질 생산, "룸 드 Microscopia"에서 명 Barba 전문가 조언에 감사 박사 Torrealba와 Universitat Autònoma 드 바르셀로나 유용한 기술 지원의 "룸 드 Citometria"에서 닥터 엠 코스타.
자료
| Name | Company | Catalog Number | Comments |
| Silicon tube | Dow Corning | 508-001 | 0.30 mm inner diameter and 0.64 mm outer diameter |
| Luer lock needle | Hamilton | 7750-22 | 31 G, Kel-F Hub |
| Luer lock syringe | Hamilton | 81020/01 | 100 μL, Kel-F Hub |
| Filtered pipette tip | Nerbe Plus | 07-613-8300 | 10 μL |
| MS-222 | Sigma Aldrich | E10521 | powder |
| 10x PBS | Sigma Aldrich | P5493 | |
| Filter paper | Filter-Lab | RM14034252 | |
| Collagenase | Gibco | 17104019 | |
| DMEM | Gibco | 31966 | Dulbecco's modified eagle medium |
| Penicillin and streptomycin | Gibco | 15240 | |
| Cell strainer | Falcon | 352360 | |
| CellTrics filters | Sysmex Partec | 04-004-2326 (Wolflabs) | 30 µm mesh size filters with 2 mL reservoir |
| Tissue-Tek O.C.T. compound | SAKURA | 4583 | |
| Plastic molds for cryosections | SAKURA | 4557 | Disposable Vinyl molds. 25 mm x 20 mm x 5 mm |
| Slide | Thermo Scientific | 10149870 | SuperFrost Plus slide |
| Cover glasses | Labbox | COVN-024-200 | 24´24 mm |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Atto-488 NHS ester | Sigma-Aldrich | 41698 | |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | |
| DMSO | Sigma-Aldrich | D8418 | |
| Maxwell RSC simplyRNA Tissue Kit | Promega | AS1340 | |
| 1-Thioglycerol/Homogenization solution | Promega | Inside of Maxwell RSC simplyRNA Tissue Kit | adding 20 μl 1-Thioglycerol to 1 ml homogenization solution (2%) |
| vertical laboratory rotator | Suministros Grupo Esper | 10000-01062 | |
| Cryostat | Leica | CM3050S | |
| Homogenizer | KINEMATICA | Polytron PT1600E | |
| Flow cytometer | Becton Dickinson | FACS Canto | |
| 5 mL round bottom tube | Falcon | 352058 | |
| Confocal microscope | Leica | SP5 | |
| Fume Hood | Kottermann | 2-447 BST | |
| Nanodrop 1000 | Thermo Fisher Scientific | ND-1000 | Spectrophotometer |
| Agilent 2100 Bioanalyzer System | Agilent | G2939A | RNA bioanalyzer |
| Maxwell Instrument | Promega | AS4500 | |
| iScript cDNA synthesis kit | Bio-rad | 1708891 | |
| CFX384 Real-Time PCR Detection System | Bio-Rad | 1855485 | |
| iTaq universal SYBR Green Supermix kit | Bio-rad | 172-5120 | |
| Water | Sigma-Aldrich | W4502 | |
| Cryogenic vial | Thermo Fisher Scientific | 375418 | CryoTube vial |
| Mounting medium | Sigma-Aldrich | F6057 | Fluoroshield with DAPI |
참고문헌
- Harriff, M. J., Bermudez, L. E., Kent, M. L. Experimental exposure of zebrafish, Danio rerio (Hamilton), to Mycobacterium marinum and Mycobacterium peregrinum reveals the gastrointestinal tract as the primary route of infection: A potential model for environmental mycobacterial infection. Journal of Fish Diseases. 30 (10), 587-600 (2007).
- Lovmo, S. D., et al. Translocation of nanoparticles and Mycobacterium marinum across the intestinal epithelium in zebrafish and the role of the mucosal immune system. Developmental and Comparative Immunology. 67, 508-518 (2017).
- Chen, T., et al. Small-Sized mPEG-PLGA Nanoparticles of Schisantherin A with Sustained Release for Enhanced Brain Uptake and Anti-Parkinsonian Activity. ACS Applied Materials and Interfaces. 9 (11), 9516-9527 (2017).
- Collymore, C., Rasmussen, S., Tolwani, R. J. Gavaging Adult Zebrafish. Journal of Visualized Experiments. (78), e50691-e50691 (2013).
- Kim, S. H., Jang, Y. S. Antigen targeting to M cells for enhancing the efficacy of mucosal vaccines. Experimental and Molecular Medicine. 46 (3), 85 (2014).
- Iwasaki, A., Medzhitov, R. Regulation of adaptive immunity by the innate immune system. Science. 327 (5963), 291-295 (2010).
- Kunisawa, J., Kiyono, H. A marvel of mucosal T cells and secretory antibodies for the creation of first lines of defense. Cellular and Molecular Life Sciences. 62 (12), 1308-1321 (2005).
- Rombout, J. H., Yang, G., Kiron, V. Adaptive immune responses at mucosal surfaces of teleost fish. Fish Shellfish Immunology. 40 (2), 634-643 (2014).
- Salinas, I. The Mucosal Immune System of Teleost Fish. Biology. 4, 525-539 (2015).
- Munang'andu, H. M., Mutoloki, S., Evensen, O. &. #. 2. 4. 8. ;. An overview of challenges limiting the design of protective mucosal vaccines for finfish. Frontiers in Immunology. 6, 542 (2015).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), 2002054 (2017).
- Brand, M., Granato, M., Nüsslein-Volhard, C. Keeping and raising zebrafish. Zebrafish. 261, 7-37 (2002).
- Rességuier, J., et al. Specific and efficient uptake of surfactant-free poly(lactic acid) nanovaccine vehicles by mucosal dendritic cells in adult zebrafish after bath immersion. Frontiers in Immunology. 8, 190 (2017).
- Kephart, D., Terry, G., Krueger, S., Hoffmann, K., Shenoi, H. High-Performance RNA Isolation Using the Maxwell 16 Total RNA Purification Kit. Promega Notes. , (2006).
- . Thermo Fisher Scientific NanoDrop 1000 spectrophotometer V3.8 user's manual. Thermo Fisher Scientific Incorporation. , (2010).
- Lightfoot, S. Quantitation comparison of total RNA using the Agilent 2100 bioanalyzer, ribogreen analysis, and UV spectrometry. Agilent Application Note. , (2002).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum information for publication of quantitative digital PCR experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR Journal. 53 (2), 192-204 (2012).
- Renshaw, S., Loynes, C. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유