Method Article
組み立て済みプラスチックマイクロ流体チップ内のヒト幹細胞由来ニューロンの区分化
要約
このプロトコルは、コンパートメント化されたマイクロ流体チップの使用を示し、環状オレフィン共重合体で成形された注射をヒト幹細胞から分化した培養ニューロンに対して行う。これらのチップは、従来のコンパートメント化ポリ(ジメチルシロキサン)デバイスよりも組み立て済みで使いやすいです。ウイルス標識、流体単離、軸除染、免疫染色など、複数の一般的な実験パラダイムがここに記載されています。
要約
培養ニューロンを区分するマイクロ流体デバイスの使用は、神経科学の標準的な方法となっています。このプロトコルは、環状オレフィン共重合体(COC)で作られた組み立て済みマルチコンパートメントチップを使用して、ヒト幹細胞から分化したニューロンを区画化する方法を示す。これらのCOCチップのフットプリントは、標準的な顕微鏡スライドと同じであり、高解像度顕微鏡検査と同等に互換性があります。ニューロンはヒト神経幹細胞(NSC)からチップ内のグルタマチング性ニューロンに分化し、5週間維持され、これらのニューロンがシナプスと樹状脊椎を開発するのに十分な時間を与えます。さらに、ウイルス標識、微小環境の確立、軸切出、免疫細胞化学など、これらのマルチコンパートメントチップを用いた複数の一般的な実験手順を示す。
概要
ヒト幹細胞分化ニューロン(hSC-ニューロン)は、生物学的研究にますます使用されています。これらのニューロンは、ヒトの物質から得られるもので、外傷性脳損傷やアルツハイマー病などの神経変性疾患の研究を含む翻訳研究に大きな関心を持っています。したがって、hSCニューロンの研究を改善し、容易にするためのツールが求められています。
ニューロンのユニークな偏光形態を研究するために、多くの研究者は、マルチコンパートメント化されたマイクロ流体デバイス1、2、3、4、5、6を使用しています。 7,8,9,10,11.これらの装置は独特な細胞アクセスが付いている長い投影ニューロンの測定そして操作を可能にする。多区画化されたマイクロ流体デバイスは、軸線の成長を導くマイクログルーブで分離された2つの並列マイクロ流体コンパートメントで構成されています。ニューロンまたは神経幹細胞(NSC)は、体系デンドリティックコンパートメントでめっきされ、数分後にコンパートメント表面の底部に付着する。分化されたニューロンは成長し、マイクログルーブ領域を通して軸群/突起を隣接する分離軸子コンパートメントに拡張します。以前は、これらのデバイスは、ポリ(ジメチルシロキサン)(PDMS)レプリカ成形を使用して排他的に作られました。PDMSデバイスには、永続的な疎水性や使用直前にガラスカバースリップに組み立てる必要性など、前述の12の多くの欠点があります。組み立て済みの射出成形チップは、これらの欠点の多くを克服し、商業的に販売されています (材料の表を参照)12.これらのチップのコンパートメントは永久に親水性に作られ、チップ全体が光学的に透明な環状オレフィン共重合体(COC)で射出成形されます。
このプロトコルは、このCOCチップを使用してヒトNSCを興奮性ニューロンに区別し、長い神経突起を分離し、流動性的に分離する方法を示しています。このデモンストレーションでは、NIH承認のH9幹細胞からニューロンを分化した。同様の手順は、ヒト誘導多能性幹細胞を分化するために使用することができる。
プロトコル
注:図1A、Bは、メインチャンネルまたはコンパートメント、井戸、およびマイクログルーブの位置を含む、組み立て済みのCOCチップの概略図を示しています。コンパートメント化されたチップは、食品着色剤の分離によって示すように、コンパートメント内に異なる流体微小環境を確立することができます(図1C)。組み立て済みのマルチコンパートメントチップを準備するためのプロトコルは、Nagendranら、セクション112で与えられています。
1. hSCニューロン用マルチコンパートメントチップのコーティング
注:図2Aは、コーティング手順の概要を示しています。
- 細胞培養性蒸留水にポリL-オルニチンを溶解し、20 μg/mL作動液のチップあたり600μLの溶液を作ります。
- 井戸からチップを準備した後、残りのPBSを吸引します。吸引するときは、ピペットの先端がチャネルの開口部から離れていることを確認します。
注:マイクロ流体チャネルは、この手順全体を充填したままにする必要があります。チャネル/コンパートメントから液体を吸引しないでください, 唯一の井戸. - 右上ウェルにポリL-オルニチン作動液を150μL積み込みます。90 sを待つか、液体が右下をよく満たし始めるまで待ちます。150 μL のメディアを右下によく追加し、液体がマイクロ溝を通過するまで 5 分間待ちます。
- 150 μL のメディアを左上によく追加します。90 s を待ってから、左下によく 150 μL を追加します。チップのホルダーをパラフィルムで包み、一晩4°Cに置きます。
注:または、チップとホルダーを37°Cに1時間置きます。 - 井戸からメディアを吸引し、ピペットの先端がチャネルの開口部から離れていることを確認します。右上によく無菌水の150 μLを追加します。90 s を待ってから、右下によく 150 μL を追加します。液体がマイクロ溝を通過するまで5分間待ちます。
- 左上の井戸に150 μLの滅菌水を加え、90sを待ってから、左下の井戸にさらに150 μLを加えます。
- 手順 1.5-1.6 を繰り返します。
- ラミニンを2°C~8°Cでゆっくりと解凍し、10μg/mLの作動液を調作する。
- ラミニン加工液の150μLを右上によく積み込みます。90 sを待つか、液体が右下をよく満たし始めるまで待ちます。ピペは右下に150 μL。ラミニンがマイクロ溝を通過するのを5分間待ちます。
- 左上によく150 μLのラミニンを加えます。90 s を待ってから、左下によく 150 μL を追加します。チップをホルダー内で2時間37°Cでインキュベートします。
- PBSでチップをすすいで(Ca2+と Mg2+なし)。PBSの150 μLを右上によく積み込みます。90 sを待つか、液体が右下をよく満たし始めるまで待ちます。右下に150 μLのPBSを追加し、PBSがマイクロ溝を通過させるのを5分間待ちます。
- PBSのピペは左上によくピペ。90sピペの後150 μLを左下によく。
- チップからPBSを吸引し、NSCメディアでチップをすすいでください(材料の表を参照)。150 μL のメディアを右上に十分にロードします。90 s の後、または液体が右下の井戸に右チャネルを通過するときは、右下ウェルに 150 μL を追加します。メディアがマイクロ溝を流れるまで5分間待ちます。
- 左上に150μLのメディアを追加し、左下ウェルに150 μLを追加します。5%CO2でチップを37°Cインキュベーターでインキュベートし、NSCの種子が出来上がるまでチップを予め調整します。
注:チップは、必要に応じて一晩事前に条件付けすることができます。
2. NSCをマルチコンパートメントチップにシードする
注:このプロトコルは、ヒト胚性幹細胞5で始まった我々の以前の出版物とは異なり、商業的に購入されたNSCを使用しました。このプロトコルでは、神経幹細胞は、ニューロンに分化するプラスチックチップに直接めっきされます。細胞は、最大2つの通路のためのNSC(分化なし)として増殖させることができ、さらに使用するために液体N2のバイアルに貯蔵することができる。このプロトコルは、通路1または2の後に液体N2に格納されたNSCバイアルを使用する。図2Bは、コーティング手順の概要を示す。
- 製造元の指示に従って NSC を解凍します。
注: この手順は、H9 由来の NSC に適用されます。他のセルラインでは、細胞密度の最適化が必要になります。 - ヘモサイトメーターを使用して細胞濃度をカウントし、NSC培媒を使用して調整して、mLあたり7 x 106細胞の濃度を得る。
- チップの各井戸からメディアを吸引します。メイン チャンネルからメディアを吸引しないようにします。
- ピペト5μLの細胞溶液を右上ウェルに、続いて右下ウェルに5μL(合計70,000細胞)を続ける。セルがメイン チャネルの開口部に向かってピペットされていることを確認します。顕微鏡を使用して、細胞がチャネルに入っていることを確認します。細胞がチップの底に付着するのを5分間待ちます。
注: セルの読み込みには、どちらか一方または両方のコンパートメントを使用できます。 - 右上にNSC培媒のピペット~150 μL、右下ウェルに150μL。左側で繰り返します。5%CO 2、37°Cで適切な加湿容器内でインキュベートします。
- 48時間後、ウェルからNSC培メディアを吸引し、各トップウェルと各底部に150μLを加えることで神経分化培ったメディアに置き換えます。
- 5%CO2、37°Cインキュベーター内の培養ニューロンは、適切な加湿容器内で。
注: メディアは 2 ~ 3 日ごとに交換する必要があります。チップに使用される少量のため、加湿インキュベーター内でも蒸発が細胞の生存率に大きな影響を与える可能性があります。適切な二次容器を使用して、チップを使用した細胞の長期培養に追加の湿度を提供します(材料の表を参照)。
3. チップ内のhSC-ニューロンのウイルス蛍光標識
注:複数のウイルスを使用して、チップ内のニューロンにラベルを付けることができます。以下の手順では、G-削除された狂犬病-mCherryまたは -eGFPウイルスの使用について説明します。感染の可能性のある材料は、適用される規則や規則に従って取り扱う必要があり、追加のトレーニングと機関の承認が必要な場合があります。
- チップ当たりの新鮮な神経分化媒体を37°Cに~400μL温めます。
- 軸ゾンコンパートメントの1つの井戸から50 μLのメディアを遠心管に取り出し、100,000のウイルスユニットの改変狂犬病ウイルスをチューブに追加します。
注:使用済みのピペ状の先端とウイルスを含む遠心管を適切に廃棄します。 - 軸室から残りの神経分化媒体を取り外し、遠心管に入れます。37 °Cで保存します。
注: チャネルが液体で満たされたままであることを確認します。 - 50 μL のウイルス溶液を 150 μL の温めた媒体と混合します。ピペは軸室の1つの井戸に100 μL、他の軸室に100 μLをウェルよく。37°Cのインキュベーター内で2時間インキュベートします。
注:軸室と体性コンパートメントの間の体積の違いは、感染/インキュベーション時間中にウイルスが軸室にとどまることを保証するのに役立ちます。 - ウイルスを含むメディアを撤回して廃棄する。
注意:同封のマイクロ流体チャネル内の液体を除去しないでください。 - 新鮮なメディアの75 μLを1つの軸室に穏やかにピペットし、メディアがチャネルを通って他の軸にうまく流れ込みます。
- アクソンコンパートメントからメディアを取り外し、適切に廃棄します。
- 手順 3.6 と 3.7 を繰り返します。
- アクソンコンパートメントに保存されたメディアを入力します。必要に応じて、さらに50μLの新鮮なメディアをピプテし、チップをインキュベーターに戻します。この追加の新鮮な媒体は、プロセス中の液体移動および蒸発中の媒体の損失にカウントされる。
注:これらの改変狂犬病ウイルスを用いた目に見える蛍光標識は、感染したニューロンの細胞死が一般的にウイルス毒性のために起こる48時間および8日後までに生じる。ニューロンイメージングは、他の標準的な培養プラットフォーム(例えば、ガラス底皿)と同様に行うことができますが、蒸発損失を防ぐために十分な湿度を維持するために特別な考慮が必要です。
4. チップ内の流体分離、軸切除、免疫染色
- Nagendran et al.12.に記載されているように、チップを使用した流体単離、軸切除、および免疫染色に従ってください。
結果
分化媒体を用いたチップの1週間後(7~10日後)、NSCはニューロンに分化し、ニューロン突起は軸室に入る(図3)。チップ内では、ニューロンが体細胞内に均等に取り付け、均等に分配します。これに対し、PDMSデバイスにおけるニューロンは、分化媒体の添加後5日早くも凝集/凝集し、図3B(13日目拡大画像)に見られるように細胞の健康状態を損なう結果となる。チップ内のニューロンは、バンドルされた軸を持つ健康に見えます。健康なニューロンは、4-5週間チップ内に維持することができます.
ニューロンの成熟と樹状脊椎の発達を可視化するために、改変狂犬病ウイルスは、mCherry蛍光タンパク質を用いて、樹状脊椎を含む標識ニューロンを逆行させるために29日目に軸室に送達された。狂犬病ウイルス感染の4日後、軸ゾンを軸室に伸ばすニューロンはmCherryを発現した。分化33日目のニューロンは樹状脊椎の形成を示した(図4)。樹状脊椎の可視化は、チップ内で分化したNSC由来ニューロンが成熟シナプスを形成することを示している。
マルチコンパートメントチップは、タンパク質の細胞局在化を可視化する免疫細胞化学にも対応しています。分化培中のニューロンを維持した26日後、興奮性シナプスマーカーvGlut1(図5)についてニューロンを標識した。これらの結果は、ウイルス標識ニューロンがvGlut1(図5E)とニューロン特異的マーカー、β-チューブリンIII(図5F-H)と共局所化することを示す。
軸に分離された明確な微小環境を作成する能力は、低分子蛍光色素であるAlexa Fluor 488ヒドラジドを用いて実証された(図6)。
アクソン傷害研究は、一般的に区画化されたデバイス内で行われます。組み立て済みCOCチップを用いて分化したニューロンの軸を選択的に傷つける原理実験を行った(図7)。結果は、シリコーン区画化されたデバイス6、13、14と同等であった。

図1:組み立て済みのCOC、マルチコンパートメントマイクロ流体チップ。(A) 上部と下部のウェルを識別するチップの図面。チップのサイズは75 mm x 25 mm、標準的な顕微鏡スライドのサイズです。(B) チャンネルを区切るチャンネルとマイクログルーブを示す領域を拡大した。その他の詳細については、Nagendran et al.12を参考にしてください。(C) この写真は、食品着色剤を用いて各コンパートメント内の孤立した微小環境の作成を示しています。●このフィギュア全体は12から再現されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
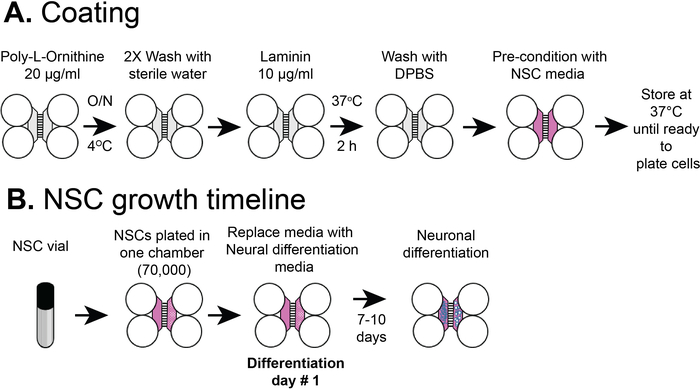
図2:プラスチックコンパートメント化チップコーティングおよびNSCセルメッキタイムライン。(A)プラスチックマルチコンパートメントチップをプレコーティング液でコーティングし、次いでポリL-オルニチンおよびラミニンをNSC培媒で事前に調整する前にコーティングした。(B)NSCをチップの体区画に7 x 104セルでめっきした。細胞はNSC培養中で24時間増殖し、その後、培方を神経分化培養媒体に置き換えた。分化ニューロンは、分化後7〜10日で観察された。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:チップおよびPDMSデバイスにおけるhSCニューロン成長比較(A) プラスチックマルチコンパートメントチップでの分化後13日目に増殖したhSC-ニューロンの位相コントラスト画像。(B) (A) の白いボックス内で培養されたhSC-ニューロンの領域と、PDMSデバイス内の同等の領域(右)にズームした。チップ内のhSCニューロンがよく付着します。集約ニューロンクラスターは、PDMSベースのデバイスで形成されます。2つの独立した実験の代表。この図のより大きなバージョンを表示するには、ここをクリックしてください。
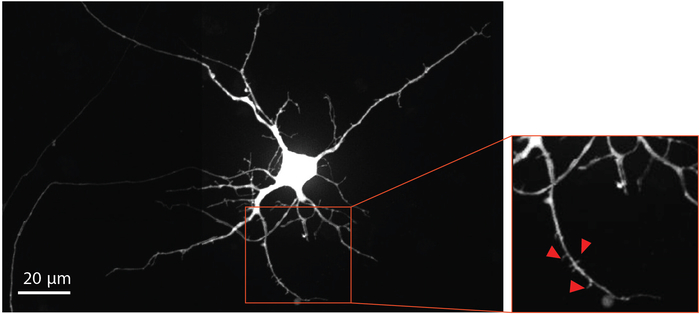
図4:ヒトNSC由来ニューロンは樹状脊椎形態を示す。逆行標識mCherryニューロンは、チップ内で成長した分化33日目に生まれた。赤で概説された拡大領域は、成熟したグルタマチン性シナプスの発達を支持する証拠を提供する樹状脊椎の存在を強調する。赤い矢印は樹状の脊椎を指しています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
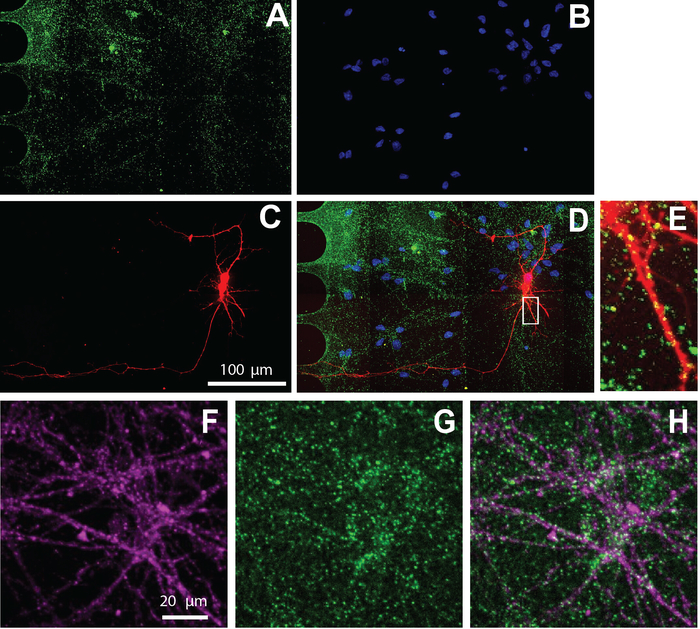
図5:チップ内で培養されたヒトNSC由来ニューロンは興奮性シナプスを示す。免疫染色は、分化26日目に行った。ニューロンイメージングは、体細胞内で行った。A)vGlut1 (緑) および (B) DAPI (青) 免疫標識。(C) mCherry標識ニューロン(赤色)は、改変狂犬病ウイルスを用いて標識された逆行性である。(D)(A-C)の結合蛍光顕微鏡写真。(E) 樹状脊椎およびvGlut1陽性穿刺はmCherry陽性デンドライトと共局在化し、(D)から領域を拡大して示す。(F)ニューロン特異的マーカーの免疫蛍光顕微鏡写真は、β-チューブリンIII(マゼンタ)、および(G)vGlut1(緑色)である。(H)βチューブリンIII、およびvGlut1のオーバーレイ。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図6:ウイルス性に感染したmCherryニューロンは、組み立て済みのCOCチップ内に確立された軸線局所的な微小環境に突起を拡張する。(A) mCherry標識ニューロンは、チップのマイクロ溝を通して、隔離された軸室に軸を伸ばします。軸ゾンコンパートメントの分離は、Alexa Fluor 488ハイドラジドを使用して可視化されます。ニューロンのイメージングは、改変狂犬病ウイルスに感染した後、分化日26日目と3日後に起こった。(B) (A) の蛍光画像はDIC画像とマージされる。マイクログルーブの位置に注意してください。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図7:COCマルチコンパートメントチップ内で行う軸切り切術。(A)分化33日目にmCherry標識ニューロンを軸筋術前に画像化した。「火」カラールックアップテーブル。(B)軸切断直後に、軸が完全に切断されたことを示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| プラスチックマルチコンパートメントチップ | PDMS マルチコンパートメント デバイス |
| 軸を分離する | 軸を分離する |
| マイクロ環境を確立する | マイクロ環境を確立する |
| 細胞をアックス化する | 細胞をアックス化する |
| 光学的に透明 | 光学的に透明 |
| 高解像度イメージングと互換性があります | 高解像度イメージングと互換性があります |
| 蛍光顕微鏡と互換性のある | 蛍光顕微鏡と互換性のある |
| 完全に組み立てられる | 必要な基板へのアセンブリ |
| 健康な軸が21日 | 健康な軸が14日 |
| 親水性培養面 | 疎水 性 |
| 不浸透性ガス | ガス透過性 |
| 丸みを帯びたマイクロ溝とチャネル | ストレートマイクログルーブ |
| レーザーアブレーションと互換性がない | PDMSチャンバーが特別なレーザーアブレーション互換スライドに組み立てられる場合、レーザーアブレーションに使用できます。 |
| デバイスを変更して上部を削除することはできません | 上部はマイクロ溝内の染色のために取り外し可能である |
| 鉱物油ベースの浸漬油と互換性がありません(シリコーンベースのオイルは良いです) | ミネラルオイルベースの浸漬油と互換性があります |
| 低分子や有機溶媒に対して不透過性 | 低分子・有機溶剤の吸収 |
| チップに漏れの問題はありません | ポリL-オルニチンとラミニンでコーティングすると、デバイスが漏れる |
| 分化されたニューロンは、試験された細胞密度で均等に分布したまま(> 4週間) | 分化したニューロンは、試験された細胞密度で培養中3~4日後に凝集し始める |
表1:ニューロンを培養するためのマルチコンパートメントCOCチップとシリコーンデバイスの比較
ディスカッション
組み立て済みのマルチコンパートメントCOCチップは、人間のNSCを長期間(>4週間)ニューロンに区別して維持するための使いやすいコンパートメント化プラットフォームです。このプロトコルでは、グルタマチング性ニューロンへのヒトNSCの分化、逆行性標識ニューロン、免疫細胞化学を行い、樹状脊椎形態を可視化し、軸膜を行うことを実証する。これらのチップは、高解像度イメージングと互換性があり、COC12と自己蛍光はありません。
COCマルチコンパートメントチップは、シリコーンベースのコンパートメント化デバイスと機能的に同等であり、前述の12のように利点と欠点があります。表1は、hSC-ニューロンを培養するためのマルチコンパートメントCOCチップとシリコーンデバイスを比較したものです。COCコンパートメント化チップは、長い培養期間にわたって幹細胞の付着および維持のためのより良い親水性表面を提供します。PDMSベースのデバイスは、ガラスカバースリップに組み立てて取り付ける必要があります。PDMSデバイスの疎水性の性質は、幹細胞の凝集を引き起こす 5;これは、細胞レベルでのイメージングにおける課題と、メディアの変化中の細胞凝集体の移動による物理的損傷に対する感受性の両方につながります。プラスチックチップは、これらの課題を克服します。COCはPDMSとは異なりガス不透過性なので、チャネル内に閉じ込められたり形成されたりするエアポケットは、ユーザーが取り外す必要があります。プレコーティングソリューションは、空気がチャネルに閉じ込められる可能性を低減します。この溶液は、エタノールおよび他の薬剤からなっている。これらのプラスチックチップ内でマウスニューロンを培養するための以前に公開されたプロトコルは、チップ12内のピペッティング細胞および媒体に関する追加の詳細を提供する。NSCは、マウスニューロンがより脆弱なので、より穏やかに扱う必要があります。また、幹細胞を上下に優しくピペッティングしてめっきする前に、幹細胞を十分に混ぜることも重要です。
インビトロ分化ヒト幹細胞由来のニューロンの使用は、医学や研究でますます人気が高まっています。これらのニューロンは、神経変性疾患や外傷性脳損傷を含む多くのCNS障害の研究および臨床応用のために重要である。これらのニューロンは、ヒト胎児ニューロン15に密接に似ています。将来的には、適切に老化したニューロンを幹細胞から生成して加齢に伴うニューロン機能を模倣し、これらの区画化されたデバイスと組み合わせて使用することができます。これらの装置は、自閉症スペクトラム障害と診断された患者のニューロンにおけるアクソン欠損および損傷後の軸ゾン再生などのアクソンの健康および機能に影響を与える疾患の研究を容易にする16,17。
開示事項
S.P.とT.N.は、競合する金銭的利益を宣言しません。V.P.は、Xonaマイクロ流体(LLC)の従業員です。J.H.は、Xonaマイクロ流体学(LLC)のメンバーです。A.M.T.は、マイクロ流体チャンバー/チップ(US 7419822 B2、EPO 2719756 B1)の発明者であり、Xonaマイクロ流体学(LLC)のメンバーです。
謝辞
著者らは、Xonaマイクロ流体学、LLC、国立精神衛生研究所(R42 MH097377)、および神経障害と脳卒中の国立研究所(R41 NS108895、P30 NS045892)からの支援を認めています。内容は著者の責任のみであり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
参考文献
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved