Method Article
Сравнение стволовых клеток человека, полученных нейронов в предварительно собранных пластиковых микрофлюидных чипов
В этой статье
Резюме
Этот протокол демонстрирует использование разрозненных микрофлюидных чипов, инъекций, отлитых в циклическом олефин-кополимере, в культивированные нейроны, отличающиеся от стволовых клеток человека. Эти микросхемы предварительно собраны и проще в использовании, чем традиционные разрозненные поли (диметилсилоксановы) устройства. Здесь описаны несколько общих экспериментальных парадигм, включая вирусную маркировку, текучную изоляцию, акотомию и иммуностогирование.
Аннотация
Использование микрофлюидных устройств для разобщенности культивированных нейронов стало стандартным методом в неврологии. Этот протокол показывает, как использовать предварительно собранный многокомпонентный чип, изготовленный в циклическом олефин-кополимере (COC), для разобщенность нейронов, отличающихся от стволовых клеток человека. След этих чипов COC такой же, как и стандартный слайд микроскопа и в равной степени совместим с микроскопией высокого разрешения. Нейроны дифференцированы от человеческих нервных стволовых клеток (NSCs) в глутаматергических нейронов в чипе и поддерживается в течение 5 недель, что позволяет достаточно времени для этих нейронов для разработки синапсов и дендритных шипов. Кроме того, мы демонстрируем несколько распространенных экспериментальных процедур с использованием этих многокомпонентных микросхем, включая вирусную маркировку, создание микросреды, акотомию и иммуноцитохимию.
Введение
Дифференцированные нейроны стволовых клеток человека (hSC-нейроны) все чаще используются для биологических исследований. Эти нейроны, которые могут быть получены из исходного материала человека, представляют большой интерес для трансляционных исследований, в том числе изучение черепно-мозговых травм и нейродегенеративных расстройств, таких как болезнь Альцгеймера. Таким образом, востребованы инструменты для улучшения и облегчения изучения hSC-нейронов.
Для изучения уникальной поляризованной морфологии нейронов, многие исследователииспользуют многокомпонентные микрофлюидные устройства 1,2,3,4,5,6, 7,8,9,10,11. Эти устройства позволяют измерения и манипуляции длинных проекционных нейронов с уникальным субклелярным доступом. Мульти-компонентные микрофлюидные устройства состоят из двух параллельных микрофлюидных отсеков, разделенных микрогрувами, которые направляют аксональный рост. Нейроны или нервные стволовые клетки (НСК) покрываются в соматодендритном отсеке, а затем прилипают к нижней поверхности отсека через несколько минут. Дифференцированные нейроны растут и расширяют свои аксоны/проекции через область микрогроув в соседний и изолированный аксональный отсек. В прошлом, эти устройства были исключительно сделаны с использованием поли (dimethylsiloxane) (PDMS) реплики литья. Устройства PDMS имеют много недостатков, описанных ранее12,включая стойкость гидрофобности и необходимость сборки на стеклянную крышку непосредственно перед использованием. Предварительно собранные инъекционные формованные чипы преодолевают многие из этих недостатков и продаются на коммерческой основе (см. Таблица материалов)12. Отсеки этих чипов постоянно производятся гидрофильные и весь чип инъекций формованных в оптически прозрачный циклический олефин copolymer (COC).
Этот протокол демонстрирует, как использовать этот чип COC, чтобы дифференцировать человеческие НСК в возбуждающие нейроны, и отделить и жидкости изолировать их длинные нейронные проекции. Для этой демонстрации, нейроны были дифференцированы от NIH утвержденных H9 стволовых клеток. Аналогичные процедуры могут быть использованы для дифференциации человека индуцированных плюрипотентных стволовых клеток.
протокол
ПРИМЕЧАНИЕ: На рисунке 1A,B показана схема предварительно собранного чипа COC, включая расположение основных каналов или отсеков, колодцев и микрогров. Разрозненный чип может установить различные жидкости микросреды в отсеке, как показано на изоляции пищевой краситель красителя(рисунок 1C). Протокол для подготовки предварительно собранного мульти-купе чипа дается в Nagendran и др., раздел 112.
1. Покрытие мульти-купе чипов для hSC-нейронов
ПРИМЕЧАНИЕ: На рисунке 2A показан обзор процедур покрытия.
- Растворите поли-L-орнитин в дистиллированной воде культуры клеток, чтобы сделать 600 л раствора на чип рабочего раствора 20 мкг/мл.
- Приготовьте оставшиеся PBS слева после подготовки чипсов из скважин. При успомении убедитесь, что кончик трубы находится вдали от открытия канала.
ПРИМЕЧАНИЕ: Микрофлюидные каналы должны оставаться заполненными в течение всей этой процедуры. Не аспирируйте жидкость из каналов/отсеков, только колодцы. - Нагрузка 150 Л поли-L-орнитинов рабочего раствора в верхнем правом колодце. Подождите 90 с или до тех пор, пока жидкость не начнет заполнять нижний правый хорошо. Добавьте 150 л носителей в нижний правый цвет и подождите 5 минут, чтобы жидкость прошла через микрогры.
- Добавьте 150 л носителей в левый верхний цвет. Подождите 90 с, а затем добавить 150 л в левом нижнем колодце хорошо. Оберните держатель чипа (ы) с parafilm и поместите на 4 кв на ночь.
ПРИМЕЧАНИЕ: В качестве альтернативы, поместите чип и держатель на 37 градусов по Цельсию в течение 1 ч. - Призадыхайтесь от носителей из скважин, гарантируя, что трубчатый наконечник находится вдали от открытия канала. Добавьте 150 л стерильной воды в верхний правый колодец. Подождите 90 с, а затем добавить 150 Л л в правом нижнем правом колодце. Подождите 5 минут, чтобы жидкость прошла через микрогры.
- Добавьте 150 л стерильной воды в левый верхний цвет, подождите 90 с, а затем добавьте еще 150 л в левый нижний.
- Повторите шаги 1.5-1.6.
- Оттаиваете ламинин медленно при 2-C до 8 градусов по Цельсию и подготовить 10 мкг /мл рабочего решения.
- Загрузите 150 л рабочего раствора ламинина в верхний правый укрядно. Подождите 90 с или до тех пор, пока жидкость не начнет заполнять нижний правый хорошо. Пипер 150 Л л в правом нижнем правом колодце. Подождите 5 минут, чтобы ламинин пройти через microgrooves.
- Добавьте 150 л ламинина в левый верхний цвет. Подождите 90 с, а затем добавить 150 л в левом нижнем колодце хорошо. Инкубировать чип в пределах его держателя в течение 2 ч при 37 градусах Цельсия.
- Промыть чип с помощью PBS (без Ca2 и Mg2 "). Загрузите 150 Л ПБС в верхний правый колодец. Подождите 90 с или до тех пор, пока жидкость не начнет заполнять нижний правый хорошо. Добавьте 150 л PBS в нижний правый колодец и подождите 5 минут, чтобы PBS пройти через микрогры.
- Пиперт 150 Л PbS в верхний левый колодец. После 90 с пайптун 150 л в левом нижнем колодце.
- Аспирировать PBS от чипа, а затем промыть чип с NSC средств массовой информации (см. Таблица материалов). Загрузите 150 л носителей в верхний правый колодец. После 90 с или когда жидкость проходит через правый канал в нижний правый хорошо, добавить 150 Зл в правом нижнем правом хорошо. Подождите 5 минут, чтобы средства массовой информации течь через microgrooves.
- Добавьте 150 л носителей к верхнему левому колодцу и еще 150 кЛ в нижний левый колодец. Инкубировать чип в инкубаторе 37 градусов с 5% CO 2, чтобы предварительно кондиционировать чип до готовности к семени NSCs.
ПРИМЕЧАНИЕ: Чипсы могут быть предварительно кондиционированы на ночь, если это необходимо.
2. Посев NSCs в многокомпонентный чип
ПРИМЕЧАНИЕ: Этот протокол используется коммерчески приобретенных NSCs, в отличие от нашей предыдущей публикации, которая началась с человеческих эмбриональных стволовых клеток5. В этом протоколе нервные стволовые клетки покрыны непосредственно в пластиковые чипы, где они дифференцируются в нейроны. Клетки могут размножаться как НСК (без дифференциации) до 2 проходов и храниться во флаконах в жидкости N2 для дальнейшего использования. Этот протокол использует флаконы NSC, хранящиеся в жидкости N2 после прохождения 1 или 2. На рисунке 2B показан обзор процедур покрытия.
- Оттепель NSCs в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Эта процедура применяется к NSCs h9-производное. Другие клеточные линии потребуют оптимизации плотности клеток. - Подсчитайте концентрацию клеток с помощью гемоцитометра и отрегулируйте с помощью носителей NSC, чтобы получить концентрацию 7 х 106 ячеек на мл.
- Аспирные носители из каждой скважины чипа. Избегайте аспирации носителей с основных каналов.
- Пипет 5 зл клеточного раствора в правом верхнем углу скважины, а затем 5 Зл в нижней правой скважине (70000 клеток всего). Убедитесь, что ячейки пипетки к основным отверстиям канала. Используйте микроскоп, чтобы проверить, что клетки вошли в канал. Подождите 5 минут, пока клетки прилипут к нижней части чипа.
ПРИМЕЧАНИЕ: Любой или оба отсека могут быть использованы для загрузки клеток. - Пипом 150 л носителей NSC в правом верхнем углу, а затем 150 зл. Повторите на левой стороне. Инкубировать при 5% CO2,37 градусов по Цельсию в подходящем увлажненного контейнере.
- После 48 часов, аспирировать NSC средств из скважин и заменить нервной дифференциации средств, добавив 150 qL к каждой верхней скважины и каждого дна хорошо.
- Культурные нейроны впределах 5% CO 2, 37 C инкубатора в подходящем увлажненного контейнере.
ПРИМЕЧАНИЕ: Средства массовой информации должны быть заменены каждые 2-3 дня. Из-за небольших объемов, используемых в чипе, испарение даже в увлажненный инкубатор может существенно повлиять на жизнеспособность клеток. Используйте подходящий вторичный контейнер для обеспечения дополнительной влажности для долгосрочной культуры клеток с чипом (см. Таблицаматериалов).
3. Вирусная флуоресцентная маркировка hSC-нейронов внутри чипа
ПРИМЕЧАНИЕ: Несколько вирусов может быть использован для обозначения нейронов в чипе. Инструкции ниже описывают использование G-удаленных бешенства-mCherry или -eGFP вируса. Потенциально инфекционные материалы должны обрабатываться в соответствии с применимыми правилами и положениями и могут потребовать дополнительной подготовки и институционального утверждения.
- Теплый 400 евро свежих нервных носителей дифференциации на чип до 37 градусов по Цельсию.
- Удалите 50 л носителей из одного колодца аксонового отсека в центрифужную трубку, а затем добавьте в трубку 100 000 вирусных единиц модифицированного вируса бешенства.
ПРИМЕЧАНИЕ: Правильно распоряжаться отработанные кончики трубы и центрифуги труб, содержащих вирус. - Удалите оставшиеся нервные дифференциации из аксонального отсека и поместите в центрифужную трубку. Хранить при 37 градусах По Цельсию.
ПРИМЕЧАНИЕ: Убедитесь, что каналы остаются заполненными жидкостью. - Смешайте 50 л раствора вируса с 150 л разогретых носителей. Пипер 100 л к одной скважине аксона отсека и 100 Зл к другому отсеку аксона хорошо. Инкубировать в течение 2 ч в пределах инкубатора 37 градусов по Цельсию.
ПРИМЕЧАНИЕ: Разница в объемах между аксональными и соматическими отсеками помогает обеспечить пребывание вируса в аксональном отсеке во время инфекции/инкубационного времени. - Изъять и избавиться от вирусных носителей.
ВНИМАНИЕ: Не удаляйте жидкость в закрытых микрофлюидных каналах. - Аккуратно pipet 75 л свежих носителей в один аксон отсек хорошо и пусть средства массовой информации текут через канал в другой аксон хорошо.
- Удалить носители из аксона отсека и распоряжаться должным образом.
- Повторите шаги 3.6 и 3.7.
- Заполните отсек аксона сохраненными носителями. Pipet дополнительные 50 л свежих носителей, если это необходимо, а затем вернуть чип в инкубатор. Это дополнительные свежие средства массовой информации, чтобы рассчитывать на потерю средств массовой информации во время передачи жидкости и испарения во время процесса.
ПРИМЕЧАНИЕ: Видимая флуоресцентная маркировка с использованием этих модифицированных вирусов бешенства происходит на 48 ч и до 8 дней, после чего клеточная смерть инфицированных нейронов обычно происходит из-за токсичности вируса. Нейронная визуализация может быть выполнена как с другими стандартными платформами культуры (например, стеклянные блюда на дне), но особое внимание необходимо для поддержания достаточной влажности, чтобы предотвратить испарительные потери.
4. Флюидическая изоляция, акотомия и иммуностоина внутри чипа
- Следуйте жидкостной изоляции, акотомии, и иммунонаблюдения с чипом, как описано в Nagendran и др.12.
Результаты
После одной недели (7-10 дней) в чипе с дифференциацией носителей, NSCs дифференцировать в нейроны и нейронных проекций ввести аксонального отсека (Рисунок 3). Внутри чипа нейроны прикрепляются и распределяются равномерно внутри соматического отсека. Для сравнения, нейроны в устройствах PDMS слипаются/агрегируются уже через 5 дней после добавления дифференциации носителей, что приводит к скомпрометированному здоровью клеток, как это видно на рисунке 3B (день 13 увеличенное изображение). Нейроны в чипах выглядят здоровыми с комплектом аксонов. Здоровые нейроны могут поддерживаться в пределах чипов в течение 4-5 недель.
Для визуализации созревания нейронов и развития дендритного позвоночника, модифицированный вирус бешенства был доставлен в аксональный отсек в 29 день для ретроградной этикетки нейронов, в том числе дендритных шипов, с флуоресцентным белком mCherry. Через четыре дня после заражения вирусом заражения, нейроны, расширяющие аксоны в аксональный отсек, выражали mCherry. Нейроны на дифференциации день 33 показали образование дендритных шипов(рисунок 4). Визуализация дендритных шипов показывает, что НСК производных нейронов дифференцированных в чипах форме зрелых синапсов.
Мульти-купе чип также совместим с иммуноцитохимии для визуализации клеточной локализации белка. После 26 дней поддержания нейронов в дифференциации средств массовой информации, нейроны были помечены для возбуждающий синаптический маркер, vGlut1 (Рисунок 5). Эти результаты показывают, что вирусно помеченные нейроны совместно локализуются с vGlut1(Рисунок 5E) и нейроном специфический маркер, К-тубулин III (Рисунок 5F-H).
Способность создавать различные микросреды, изолированные аксонов, также была продемонстрирована с помощью гидратзида Alexa Fluor 488, флуоресцентного красителя с низким молекулярным весом(рисунок 6).
Аксон травмы исследования обычно выполняются в разрозненных устройств. Доказательство принципа эксперимент был выполнен, чтобы выборочно травмировать аксоны дифференцированных нейронов с предварительно собранным чипом COC(рисунок 7). Результаты были эквивалентны силиконовымразрозненных устройствах 6,13,14.

Рисунок 1: предварительно собранный COC, многокомпонентный микрофлюидный чип. (A) Рисунок чипа, определяющего верхнюю и нижнюю скважины. Размер чипа 75 мм х 25 мм, размер стандартных слайдов микроскопа. (B) Увеличенный в регионе, показывающий каналы и микрогровы, разделяющие каналы. Дополнительная информация приведена в Nagendran et al.12. (C) Эта фотография иллюстрирует создание изолированных микросред ы в каждом отсеке с помощью пищевой краситель красителя. Вся эта цифра была воспроизведена из 12. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
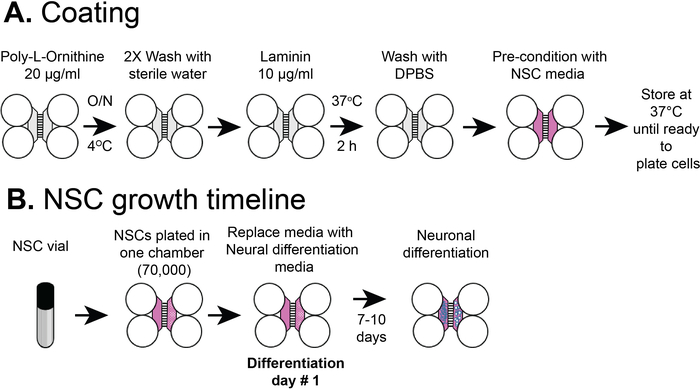
Рисунок 2: Пластиковое разрозненные чиповые покрытия и сроки покрытия ячейки НСК. (A) Пластиковые многокомпонентные чипы были покрыты предпокрытием раствором, а затем поли-L-орнитин омичи и ламинин перед предварительным кондиционированием с NSC media. (B) NSCs были покрыты 7 х 104 ячейки в соматический отсек чипа. Клетки были выращены в nSC сми в течение 24 ч, а затем средства массовой информации был заменен на нервной дифференциации средств массовой информации. Дифференцированные нейроны наблюдались 7-10 дней после дифференциации. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: сравнение роста hSC-нейронов в чипах и устройствах PDMS. (A) Фазовое контрастное изображение hSC-нейронов, выращенных в 13 дней после дифференциации в пластиковом мультикомпонентном чипе. (B) Увеличенный в области hSC-нейронов, культивируется в белом поле в (A) и эквивалентной области в устройстве PDMS (справа). hSC-нейроны внутри чипов хорошо прикрепляются. Агрегированные нейронные кластеры образуются в устройствах на основе PDMS. Представитель 2 независимых экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
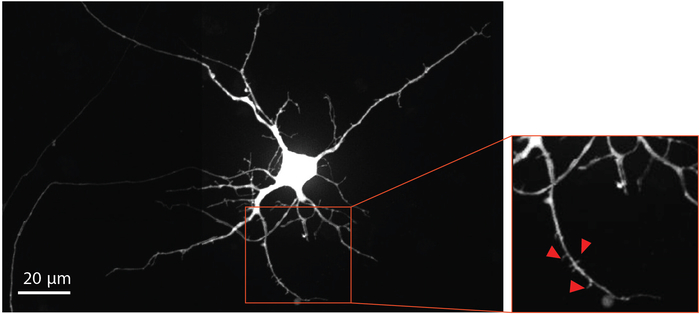
Рисунок 4: Человеческий НСК производные нейроны показывают дендритной морфологии позвоночника. Ретроградный помеченный нейрон mCherry при дифференциации 33- вырос в чипе. Увеличенный регион, изложенный красным цветом, подчеркивает наличие дендритных шипов, которые дают доказательства, подтверждающие развитие зрелых глутаматергических синапсов. Красные стрелки указывают на дендритные шипы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
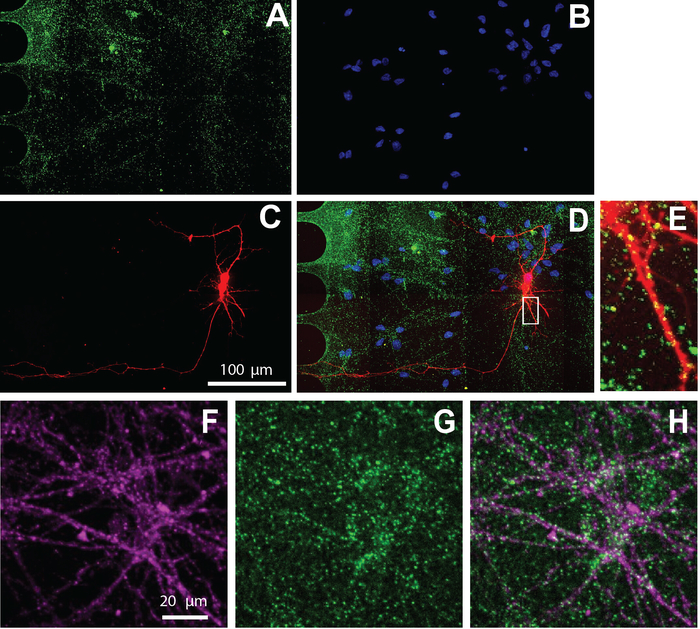
Рисунок 5: Человек NSC производных нейронов, культивируемых в чипах экспонат возбуждают синапсы. Иммуностоинг был проведен в день дифференциации 26. Нейронная визуализация была выполнена в соматическом отсеке. A) vGlut1 (зеленый) и (B)DAPI (синий) иммуномаркировки. (C) mCherry-помеченные нейроны (красные) ретроградные помечены с использованием модифицированного вируса бешенства. (D) Слитый флуоресцентный микрограф(A-C). (E) Дендритические шипы и vGlut1 положительные puncta colocalized с mCherry-положительные дендриты, показанные в увеличенном в зоне от (D). Иммунофлуоресцентные микрографы (F) нейронный специфический маркер, К-тубулин III (магента) и (G) vGlut1 (зеленый). (H) Наложение з-тубулин III, и vGlut1. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Вирусно транскорпорированные нейроны mCherry расширяют проекции в локализованную микросреду аксона, созданную в предварительно собранном чипе COC. (A) mCherry помечены нейронов продлить аксоны через microgrooves чипа и в изолированном отсеке аксона. Изоляция отсека аксона визуализирована с помощью гидразида Alexa Fluor 488. Изображение нейронов произошло в день дифференциации 26 и 3 дня после заражения модифицированным вирусом бешенства. (B) Флуоресценция изображение в (A) сливается с изображением DIC. Обратите внимание на расположение микрогров. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Аксотомия, выполненная в рамках многокомпонентного чипа COC. (A) mCherry помечены нейроны на дифференциации день 33 были изображены до акотомии. Таблица цветного поиска 'Fire'. (B) Сразу после акотомии, показывая, что аксоны полностью разорваны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Пластиковые многокомпонентные чипы | Многокомпонентные устройства PDMS |
| изолировать аксоны | изолировать аксоны |
| создание микросреды | создание микросреды |
| акотомизируют нейроны | акотомизируют нейроны |
| оптически прозрачный | оптически прозрачный |
| совместима с изображением с высоким разрешением | совместима с изображением с высоким разрешением |
| совместима с флуоресценционной микроскопией | совместима с флуоресценционной микроскопией |
| полностью собраны | сборка для субстрата требуется |
| здоровые аксоны | здоровые аксоны |
| гидрофильной культивирования поверхности | Гидрофобные |
| газ непроницаемый | газ проницаемый |
| округлые микрогры и каналы | прямые микрогры |
| не совместим с лазерной абляцией | Может быть использован для лазерной абляции, когда PDMS камеры собираются на специальных лазерной абляции совместимых слайдов. |
| устройство не может быть изменено для удаления верхней | сверху является съемным для окрашивания в microgrooves |
| не совместим с маслами погружения на основе минерального масла (масла на основе силиконовой основе в порядке) | совместим с маслами погружения на основе минерального масла |
| непроницаемый для малых молекул и органических растворителей | поглощение малых молекул и органических растворителей |
| Отсутствие проблем утечки с обломочкой | покрытие поли-L-орнитин омича и ламинин делают устройства негерметичная |
| дифференцированные нейроны остаются равномерно распределенными (Nogt; 4 недели) при испытанной плотности клеток | дифференцированные нейроны начинают агрегировать после 3-4 дней в культуре при испытанной плотности клеток |
Таблица 1: Сравнение многокомпонентных чипов COC и силиконовых устройств для культивирования нейронов
Обсуждение
Предварительно собранный многокомпонентный чип COC является простой в использовании разобщенной платформой для дифференцирования и поддержания нНК человека в нейроны в течение длительного времени (Nogt;4 недели). В этом протоколе мы демонстрируем дифференциацию нНК человека на глутаматергические нейроны, ретроградные метеорные нейроны, выполняем иммуноцитохимию, визуализируем дендритную морфологию позвоночника и выполняем акотомию. Эти микросхемы совместимы с изображением с высоким разрешением и не имеют автоматического флуоресценции с COC12.
CoC многокомпонентные чипы функционально эквивалентны силиконовой основе разрозненных устройств, и имеют преимущества и недостатки, как описано ранее12. Таблица 1 сравнивает многокомпонентные чипы COC и силиконовые устройства для культивирования hSC-нейронов. Отсеканные чипы COC обеспечивают лучшую гидрофиницу поверхности для крепления и поддержания стволовых клеток в течение длительного периода культуры. Устройства на основе PDMS должны быть собраны и прикреплены к стеклянным крышкам. Гидрофобный характер устройств PDMS вызывает агрегацию стволовых клеток5; это приводит как к проблемам в визуализации на клеточном уровне, так и к большей восприимчивости к физическому повреждению из-за движения клеточных агрегатов во время изменений в средствах массовой информации. Пластиковый чип преодолевает эти трудности. COC является газнепроницаемым, в отличие от PDMS, поэтому воздушные карманы, захваченные или сформированные в каналах, должны быть удалены пользователем. Предварительное покрытие решение уменьшает возможность для воздуха, чтобы стать в ловушке в каналах. Это решение состоит из этанола и других агентов. Ранее опубликованный протокол для культивирования нейронов мурин в этих пластиковых чипов предоставляет дополнительную информацию о трубачающих клеток и средств массовой информации в чипы12. NSCs являются более хрупкими, что нейроны, поэтому должны быть обработаны более мягко. Кроме того, важно, чтобы смешать стволовые клетки тщательно перед покрытием, мягко pipetting их вверх и вниз.
Использование нейронов, полученных из in vitro дифференцированных стволовых клеток человека становится все более популярным в медицине и исследованиях. Эти нейроны имеют важное значение для исследований и клинического применения для многих заболеваний ЦНС, в том числе нейродегенеративных заболеваний и черепно-мозговых травм. Эти нейроны очень напоминают человеческие нейроны плода15. В будущем, надлежащим образом в возрасте нейронов могут быть созданы из стволовых клеток, чтобы имитировать возрастных нейронных функций и использовать в сочетании с этими разрозненные устройства. Эти устройства будут способствовать исследованиям в области заболеваний, влияющих на здоровье аксона и функции, такие как дефицит аксона в нейронах пациентов с диагнозом расстройства аутистического спектра и аксональной регенерации после травмы16,17.
Раскрытие информации
С.П. и Т.Н. не заявляют о конкуренции в финансовых интересах. В.П. является сотрудником ООО «Ксона Микрофлюитикс». JH является членом Xona Microfluidics, LLC. A.M.T. является изобретателем микрофлюидной камеры/чипа (US 7419822 B2, EPO 2719756 B1) и является членом Xona Microfluidics, LLC.
Благодарности
Авторы признают поддержку со стороны Xona Microfluidics, LLC, Национального института психического здоровья (R42 MH097377) и Национального института неврологических расстройств и инсульта (R41 NS108895, P30 NS045892). Содержание является исключительно ответственностью авторов и не обязательно отражает официальные взгляды Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Ссылки
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены