Method Article
Unterteilung menschlicher Stammzellen-abgeleiteter Neuronen in vormontierte Mikrofluidchips aus Kunststoff
In diesem Artikel
Zusammenfassung
Dieses Protokoll demonstriert die Verwendung von kompartalisierten mikrofluidischen Chips, die in einem zyklischen Olefin-Copolymer in kultivierte Neuronen gegossen werden, die von menschlichen Stammzellen unterschieden werden. Diese Chips sind vormontiert und einfacher zu verwenden als herkömmliche, kompartalisierte Polygeräte (Dimethylsiloxan). Mehrere gängige experimentelle Paradigmen werden hier beschrieben, einschließlich viraler Etikettierung, fluidischer Isolation, Axotomie und Immunfärbung.
Zusammenfassung
Die Verwendung von mikrofluidischen Geräten zur Abschottung kultivierter Neuronen ist zu einer Standardmethode in der Neurowissenschaft geworden. Dieses Protokoll zeigt, wie ein vormontierter Multi-Fach-Chip aus einem zyklischen Olefin-Copolymer (COC) verwendet wird, um Neuronen zu unterteilen, die sich von menschlichen Stammzellen unterscheiden. Der Fußabdruck dieser COC-Chips ist derselbe wie bei einem Standard-Mikroskopschlitten und gleichermaßen kompatibel mit hochauflösender Mikroskopie. Neuronen werden von menschlichen neuronalen Stammzellen (NSCs) zu glutamatergen Neuronen innerhalb des Chips unterschieden und für 5 Wochen aufrechterhalten, so dass genügend Zeit für diese Neuronen, um Synapsen und dendritische Stacheln zu entwickeln. Darüber hinaus zeigen wir mehrere gängige experimentelle Verfahren mit diesen Multi-Compartment-Chips, einschließlich viraler Kennzeichnung, Einrichtung von Mikroumgebungen, Axotomie und Immunzytochemie.
Einleitung
Menschliche Stammzell-differenzierte Neuronen (hSC-Neuronen) werden zunehmend für die biologische Forschung verwendet. Diese Neuronen, die aus menschlichem Quellenmaterial abgeleitet werden können, sind von großem Interesse für die translationale Forschung, einschließlich der Untersuchung traumatischer Hirnverletzungen und neurodegenerativer Erkrankungen wie Alzheimer. Daher sind Instrumente zur Verbesserung und Erleichterung der Untersuchung von hSC-Neuronen gefragt.
Um die einzigartige polarisierte Morphologie von Neuronen zu untersuchen, verwenden viele Forscher multi-kompartalisierte mikrofluidische Geräte1,2,3,4,5,6, 7,8,9,10,11. Diese Geräte ermöglichen Messungen und Manipulationen von langprojektionsneuronen mit einzigartigem subzellulären Zugriff. Multi-kompartalisierte mikrofluidische Geräte bestehen aus zwei parallelen mikrofluidischen Kompartimenten, die durch Mikronuten getrennt sind und das axonale Wachstum steuern. Neuronen oder neuronale Stammzellen (NSCs) werden im somatodendritischen Fach plattiert und haften dann nach Minuten an der Unterseite der Fachoberfläche. Differenzierte Neuronen wachsen und erweitern ihre Axone/Projektionen durch die Mikronutregion in ein angrenzendes und isoliertes Axonfach. In der Vergangenheit wurden diese Geräte ausschließlich mit Poly (Dimethylsiloxan) (PDMS) Replikformhergestellt hergestellt. PDMS-Geräte haben viele Nachteile, die zuvor beschrieben wurden12, einschließlich persistenter Hydrophobie und der Notwendigkeit, sich unmittelbar vor der Verwendung zu einem Glasdeckel zusammenzusetzen. Vormontierte Spritzgusschips überwinden viele dieser Nachteile und werden kommerziell verkauft (siehe Tabelle der Materialien)12. Die Fächer dieser Chips sind permanent hydrophil und der gesamte Chip wird in optisch transparentes zyklisches Olefin-Copolymer (COC) gegossen.
Dieses Protokoll zeigt, wie man diesen COC-Chip verwendet, um menschliche NSCs in erregende Neuronen zu differenzieren und ihre langen neuronalen Projektionen zu trennen und fließend zu isolieren. Für diese Demonstration wurden Neuronen von NIH-zugelassenen H9-Stammzellen unterschieden. Ähnliche Verfahren können verwendet werden, um humaninduzierte pluripotente Stammzellen zu unterscheiden.
Protokoll
ANMERKUNG: Abbildung 1A,B zeigt einen Schaltplan des vormontierten COC-Chips, einschließlich der Positionen der Hauptkanäle oder Fächer, Brunnen und Microgrooves. Der kompartumnierte Chip kann verschiedene fluidische Mikroumgebungen innerhalb eines Fachs etablieren, wie die Isolierung von Lebensmittelfärbefarbstoffen zeigt (Abbildung 1C). Das Protokoll zur Vorbereitung des vormontierten Multi-Fach-Chips ist in Nagendran et al., Abschnitt 112angegeben.
1. Beschichtung von Multi-Fach-Chips für hSC-Neuronen
HINWEIS: Abbildung 2A zeigt einen Überblick über die Beschichtungsverfahren.
- Lösen Sie Poly-L-Ornithin in zellkulturbasiertem destilliertem Wasser auf, um 600 l Lösung pro Chip einer Arbeitslösung von 20 g/ml herzustellen.
- Aspirieren Sie die verbleibendePBS nach der Vorbereitung der Chips aus den Brunnen links. Stellen Sie beim Ansaat sicher, dass die Pipettenspitze von der Kanalöffnung entfernt ist.
HINWEIS: Die mikrofluidischen Kanäle müssen während des gesamten Verfahrens gefüllt bleiben. Beschwichtigen Sie keine Flüssigkeit aus den Kanälen/Fächern, sondern nur die Brunnen. - Laden Sie 150 l Poly-L-Ornithin-Arbeitslösung in den oberen rechten Brunnen. Warten Sie auf 90 s oder bis die Flüssigkeit beginnt, die untere rechte gut zu füllen. Fügen Sie 150 L Medien in den unteren rechten Brunnen und warten Sie 5 min, um die Flüssigkeit durch die Microgrooves passieren zu lassen.
- Fügen Sie 150 L Medien oben links gut hinzu. Warten Sie 90 s und fügen Sie dann 150 l zum unteren linken Brunnen hinzu. Den Halter des Chips mit Parafilm umwickeln und über Nacht bei 4 °C platzieren.
HINWEIS: Alternativ den Chip und den Halter bei 37 °C für 1 h platzieren. - Saugen Sie die Medien aus den Brunnen, um sicherzustellen, dass die Pipettenspitze weg von der Kanalöffnung platziert wird. Fügen Sie 150 l steriles Wasser in den oberen rechten Brunnen. Warten Sie auf 90 s und fügen Sie dann 150 l zum unteren rechten Brunnen hinzu. Warten Sie 5 min, um die Flüssigkeit durch die Microgrooves passieren zu lassen.
- Fügen Sie 150 l steriles Wasser in den oberen linken Brunnen, warten Sie 90 s und fügen Sie dann weitere 150 l auf der unteren linken Gut.
- Wiederholen Sie die Schritte 1.5-1.6.
- Laminin langsam bei 2 °C bis 8 °C auftauen und eine Arbeitslösung von 10 g/ml vorbereiten.
- 150 l der Laminin-Arbeitslösung in den oberen rechten Brunnen legen. Warten Sie auf 90 s oder bis die Flüssigkeit beginnt, die untere rechte gut zu füllen. Pipetten Sie 150 l nach unten rechts gut. Warten Sie 5 min, um das Laminin durch die Mikrorillen gehen zu lassen.
- Fügen Sie 150 l Laminin oben links gut hinzu. Warten Sie 90 s und fügen Sie dann 150 l zum unteren linken Brunnen hinzu. Den Chip in seinem Halter für 2 h bei 37 °C inkubieren.
- Spülen Sie den Chip mit PBS (ohne Ca2+ und Mg2+). Laden Sie 150 l PBS auf den oberen rechten Brunnen. Warten Sie auf 90 s oder bis die Flüssigkeit beginnt, die untere rechte gut zu füllen. Fügen Sie 150 L PBS in den unteren rechten Brunnen und warten Sie 5 min, um die PBS durch die Microgrooves gehen zu lassen.
- Pipetten Sie 150 l PBS oben links gut. Nach 90 s Pipette 150 l unten links gut.
- PBS vom Chip aussaugen und dann den Chip mit NSC-Medien abspülen (siehe Materialtabelle). Laden Sie 150 L Medien auf den oberen rechten Brunnen. Nach 90 s oder wenn Flüssigkeit durch den rechten Kanal in den unteren rechten Brunnen gelangt, fügen Sie 150 l zum unteren rechten Brunnen hinzu. Warten Sie 5 min, um die Medien durch die Microgrooves fließen zu lassen.
- Fügen Sie 150 L Medien in den oberen linken Brunnen und weitere 150 L zum unteren linken Brunnen hinzu. Inkubieren Sie den Chip in einem 37 °C Inkubator mit 5% CO2, um den Chip vorzukonditionieren, bis er zum Aussaat von NSCs bereit ist.
HINWEIS: Chips können bei Bedarf über Nacht vorkonditioniert werden.
2. Saatn-NS-Codes in den Multicompartment-Chip
HINWEIS: Dieses Protokoll verwendet kommerziell erworbene NSCs, im Gegensatz zu unserer vorherigen Veröffentlichung, die mit menschlichen embryonalen Stammzellen begann5. In diesem Protokoll werden neuronale Stammzellen direkt in die Plastikchips eintellert, wo sie sich in Neuronen differenzieren. Die Zellen können sich als NSCs (ohne Differenzierung) für bis zu 2 Passagen vermehren und in Fläschchen in Flüssigkeit N2 zur weiteren Verwendung lagern. Dieses Protokoll verwendet NSC-Fläschchen, die nach Durchgang 1 oder 2 in Flüssigkeit N2 gelagert werden. Abbildung 2B zeigt einen Überblick über die Beschichtungsverfahren.
- Thaw NSCs nach Herstelleranweisungen.
HINWEIS: Dieses Verfahren gilt für Von H9 abgeleitete NSCs. Andere Zelllinien erfordern eine Optimierung der Zelldichte. - Zählen Sie die Zellkonzentration mit einem Hämozytometer und passen Sie sie mit NSC-Medien an, um eine Konzentration von 7 x 106 Zellen pro ml zu erhalten.
- Aspirieren Sie Medien aus jedem Brunnen des Chips. Vermeiden Sie das Ansatosen von Medien von den Hauptkanälen.
- Pipetten Sie 5 l der Zelllösung auf den oberen rechten Brunnen, gefolgt von 5 l bis zum unteren rechten Brunnen (70.000 Zellen insgesamt). Stellen Sie sicher, dass die Zellen in Richtung der Hauptkanalöffnungen geleitet werden. Verwenden Sie ein Mikroskop, um zu überprüfen, ob Zellen in den Kanal eingedrungen sind. Warten Sie 5 min, bis die Zellen an der Unterseite des Chips haften.
HINWEIS: Entweder oder beide Fächer können zum Laden von Zellen verwendet werden. - Pipetten Sie 150 L NSC-Medien an den oberen rechten Brunnen und dann 150 l bis zum unteren rechten Brunnen. Wiederholen Sie dies auf der linken Seite. Inkubieren Sie bei5% CO2 , 37 °C in einem geeigneten befeuchteten Behälter.
- Nach 48 Stunden, aspirieren NSC-Medien aus den Brunnen und ersetzen sie durch neuronale Differenzierungsmedien, indem Sie 150 l zu jedem oberen Brunnen und jedem unteren Brunnen hinzufügen.
- Kulturneuronen in einem5% CO2, 37 °C Inkubator in einem geeigneten befeuchteten Behälter.
HINWEIS: Medien sollten alle 2-3 Tage ausgetauscht werden. Aufgrund der geringen Mengen, die im Chip verwendet werden, kann die Verdunstung auch innerhalb eines befeuchteten Inkubators die Zelllebensfähigkeit erheblich beeinträchtigen. Verwenden Sie einen geeigneten Sekundärbehälter, um zusätzliche Feuchtigkeit für die langfristige Zellkultur mit dem Chip bereitzustellen (siehe Tabelle der Materialien).
3. Virale fluoreszierende Kennzeichnung von hSC-Neuronen innerhalb des Chips
HINWEIS: Mehrere Viren können verwendet werden, um Neuronen innerhalb des Chips zu kennzeichnen. Die folgenden Anweisungen beschreiben die Verwendung von G-gelöschten Tollwut-mCherry oder -eGFP Virus. Potenziell infektiöse Materialien müssen gemäß den geltenden Regeln und Vorschriften behandelt werden und können zusätzliche Schulungen und institutionelle Genehmigungen erfordern.
- Warm 400 L frische neuronale Differenzierungsmedien pro Chip auf 37 °C.
- Entfernen Sie 50 L Medien aus einem Brunnen des Axonfachs in ein Zentrifugenrohr und fügen Sie dann 100.000 virale Einheiten des modifizierten Tollwutvirus in das Rohr.
HINWEIS: Entsorgen Sie verbrauchte Pipettenspitzen und Zentrifugenröhren, die Viren enthalten. - Entfernen Sie die verbleibenden neuronalen Differenzierungsmedien aus dem axonalen Fach und legen Sie sie in ein Zentrifugenrohr. Bei 37 °C lagern.
HINWEIS: Stellen Sie sicher, dass die Kanäle mit Flüssigkeit gefüllt bleiben. - Mischen Sie die 50 L Viruslösung mit 150 L erwärmten Medien. Pipetten Sie 100 l an einen Brunnen des Axonfachs und 100 l auf den anderen Axonfachbrunnen. Inkubieren Sie für 2 h in einem 37 °C Inkubator.
HINWEIS: Der Volumenunterschied zwischen den axonalen und somatischen Fächern trägt dazu bei, dass das Virus während der Infektions-/Inkubationszeiten im Axonfach verbleibt. - Zurückziehen und virushaltige Medien entsorgen.
VORSICHT: Entfernen Sie keine Flüssigkeit innerhalb der geschlossenen mikrofluidischen Kanäle. - 75 L Frischmedien vorsichtig auf ein Axonfach gut pfeifen und die Medien durch den Kanal in ein anderes Axon gut fließen lassen.
- Entfernen Sie die Medien aus dem Axonfach und entsorgen Sie sie ordnungsgemäß.
- Wiederholen Sie die Schritte 3.6 und 3.7.
- Füllen Sie das Axonfach mit dem gespeicherten Medium. Pipet ein zusätzliches 50 L frisches Medium, falls erforderlich, und geben Sie den Chip dann an den Inkubator zurück. Diese zusätzlichen Frischmedien sollen auf Medienverlust während des Flüssigkeitstransfers und der Verdunstung während des Prozesses angerechnet werden.
HINWEIS: Sichtbare fluoreszierende Kennzeichnung mit diesen modifizierten Tollwutviren tritt um 48 h und bis zu 8 Tage auf, nach denen der Zelltod infizierter Neuronen in der Regel aufgrund von Virustoxizität auftritt. Neuronenbildgebung kann wie bei anderen Standard-Kulturplattformen (z. B. Glasbodenschalen) durchgeführt werden, aber besondere Aufmerksamkeit ist erforderlich, um genügend Feuchtigkeit zu erhalten, um Verdunstungsverluste zu verhindern.
4. Fluidische Isolierung, Axotomie und Immunfärbung innerhalb des Chips
- Folgen Sie der fluidischen Isolierung, Axotomie und Immunfärbung mit dem Chip, wie in Nagendran et al.12beschrieben.
Ergebnisse
Nach einer Woche (7-10 Tage) im Chip mit Differenzierungsmedien differenzieren sich NSCs in Neuronen und neuronale Projektionen gelangen in das axonale Fach (Abbildung 3). Innerhalb des Chips befestigen und verteilen Neuronen gleichmäßig im somatischen Fach. Im Vergleich dazu verklumpen/aggregatieren Neuronen in PDMS-Geräten bereits 5 Tage nach der Zugabe von Differenzierungsmedien, was zu einer beeinträchtigten Zellgesundheit führt, wie in Abbildung 3B (Tag 13 vergrößertes Bild) zu sehen ist. Neuronen in den Chips sehen mit gebündelten Axonen gesund aus. Gesunde Neuronen können innerhalb der Chips für 4-5 Wochen gepflegt werden.
Um die Neuronenreifung und die Entwicklung der dendritischen Wirbelsäule zu visualisieren, wurde das modifizierte Tollwutvirus an Tag 29 in das axonale Fach geliefert, um retrograde Etikettenneuronen, einschließlich dendritischer Stacheln, mit mCherry fluoreszierendem Protein zu erhalten. Vier Tage nach der Tollwut-Virusinfektion drückten Neuronen, die Axone in das Axonfach ausdehnten, mCherry aus. Die Neuronen am Differenzierungstag 33 zeigten die Bildung von dendritischen Stacheln (Abbildung 4). Die Visualisierung dendritischer Dornen zeigt, dass NSC-abgeleitete Neuronen, die innerhalb der Chips differenziert sind, reife Synapsen bilden.
Der Multi-Kompartier-Chip ist auch mit der Immunzytochemie kompatibel, um die zelluläre Lokalisierung von Proteinen zu visualisieren. Nach 26 Tagen der Aufrechterhaltung der Neuronen in Differenzierungsmedien wurden Neuronen für den exzitatorischen synaptischen Marker, vGlut1 (Abbildung 5) gekennzeichnet. Diese Ergebnisse zeigen, dass viral markierte Neuronen mit vGlut1 (Abbildung 5E) und neuronspezifischem Marker, s-Tubulin III (Abbildung 5F-H) kolokalisieren.
Die Fähigkeit, unterschiedliche Mikroumgebungen zu erstellen, die zu Axonen isoliert sind, wurde auch mit Alexa Fluor 488 Hydrazid, einem niedermolekularen Fluoreszenzfarbstoff, demonstriert (Abbildung 6).
Axon-Verletzungsstudien werden häufig in abgeteilten Geräten durchgeführt. Ein Proof-of-Prinzip-Experiment wurde durchgeführt, um selektiv Axone von differenzierten Neuronen mit dem vormontierten COC-Chip zu verletzen (Abbildung 7). Die Ergebnisse entsprachen Silikon-Fachgeräten6,13,14.

Abbildung 1: Der vormontierte COC, Multi-Fach-Mikrofluid-Chip. (A) Eine Zeichnung des Chips, der die oberen und unteren Brunnen identifiziert. Die Größe des Chips ist 75 mm x 25 mm, die Größe der Standard-Mikroskop-Dias. (B) Ein vergrößerter Bereich, der die Kanäle und Microgrooves zeigt, die die Kanäle trennen. Weitere Informationen finden Sie in Nagendran et al.12. (C) Dieses Foto zeigt die Schaffung von isolierten Mikroumgebungen in jedem Fach mit Lebensmittelfärbefarbstoff. Diese ganze Zahl wurde von 12reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
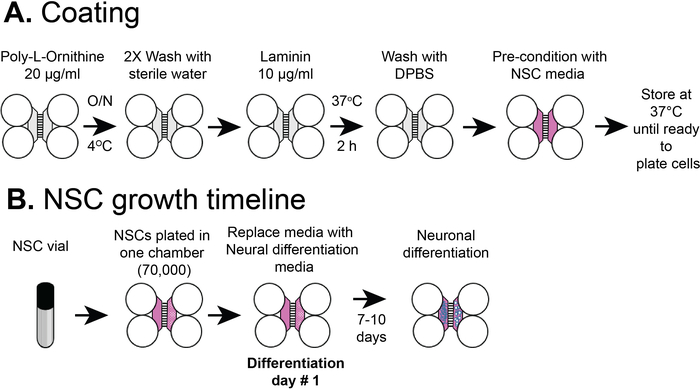
Abbildung 2: Kunststoff-Fachspanbeschichtung und NSC-Zellbeschichtungs-Timeline. (A) Kunststoff-Multifach-Chips wurden mit einer Vorbeschichtungslösung beschichtet, und dann Poly-L-Ornithin und Laminin vor der Vorkonditionierung mit NSC-Medien. (B) NSCs wurden mit 7 x 104 Zellen im somatischen Fach des Chips plattiert. Die Zellen wurden in NSC-Medien für 24 h angebaut und dann wurden die Medien durch neuronale Differenzierungsmedien ersetzt. Differenzierte Neuronen wurden durch 7-10 Tage nach der Differenzierung beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: hSC-Neuron-Wachstumsvergleich bei Chips und PDMS-Geräten. (A) Ein Phasenkontrastbild von hSC-Neuronen, die 13 Tage nach der Differenzierung im Kunststoff-Multifachchip gewachsen sind. (B) Ein vergrößerter Bereich von hSC-Neuronen, die innerhalb des weißen Feldes in (A) und einem äquivalenten Bereich innerhalb eines PDMS-Geräts (rechts) kultiviert sind. hSC-Neuronen in den Chips befestigen gut. Aggregierte Neuronencluster bilden sich in PDMS-basierten Geräten. Vertreter von 2 unabhängigen Experimenten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
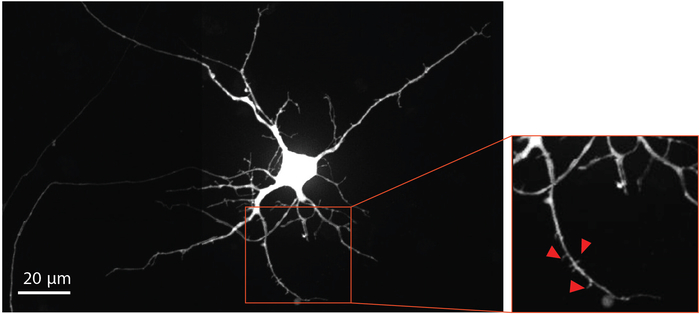
Abbildung 4: Menschliche NSC-abgeleitete Neuronen zeigen dendritische Wirbelsäulenmorphologie. Retrograde beschriftet mCherry Neuron an DifferenzierungTag 33 innerhalb des Chips gewachsen. Die rot umrissene vergrößerte Region hebt das Vorhandensein von dendritischen Stacheln hervor, die die Entwicklung reifer glutamatergischer Synapsen belegen. Rote Pfeile zeigen auf dendritische Stacheln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
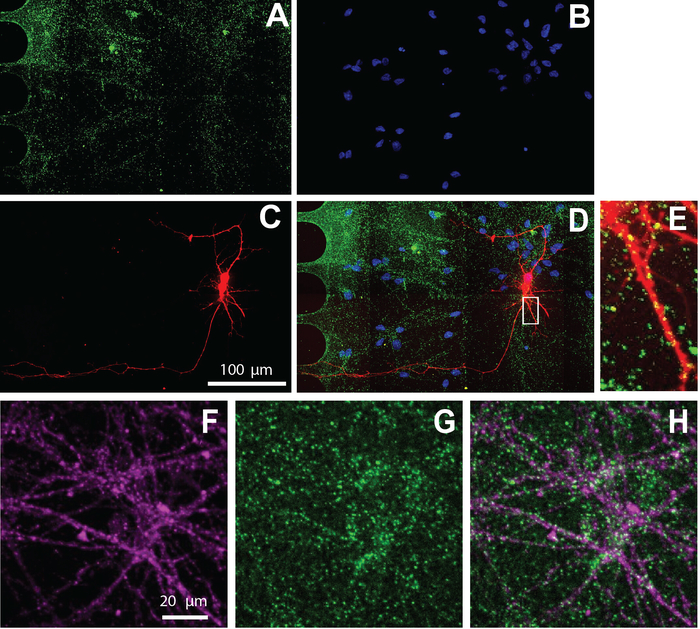
Abbildung 5: Menschliche NSC abgeleitete Neuronen, die in Chips kultiviert werden, weisen exzitatorische Synapsen auf. Die Immunostainierung wurde am Differenzierungstag 26 durchgeführt. Neuronenbildgebung wurde im somatischen Fach durchgeführt. A) vGlut1 (grün) und (B) DAPI (blau) Immunolabeling. (C) mCherry-markierte Neuronen (rot) retrograde mit einem modifizierten Tollwutvirus gekennzeichnet. (D) Eine zusammengeführte fluoreszierende Mikrographie von (A-C). (E) Dendritische Stacheln und vGlut1 positive Puncta kolokalisiert mit mCherry-positiven Dendriten, in einem vergrößerten Bereich von (D) gezeigt. Immunfluoreszenz-Mikrographen von (F) neuronspezifischen Marker, s-Tubulin III (Magenta) und (G) vGlut1 (grün). (H) Überlagerung von S-Tubulin III und vGlut1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Viral transduzierte mCherry-Neuronen erweitern Projektionen in eine axonlokalisierte Mikroumgebung, die innerhalb des vormontierten COC-Chips eingerichtet ist. (A) mCherry beschriftet Neuron enden Axone durch die Mikrogrooves des Chips und in ein isoliertes Axonfach. Die Isolierung des Axonfachs wird mit Alexa Fluor 488 Hydrazid visualisiert. Die Bildgebung der Neuronen erfolgte am Differenzierungstag 26 und 3 Tage nach der Infektion mit dem modifizierten Tollwutvirus. (B) Das Fluoreszenzbild in (A) wird mit einem DIC-Bild verschmolzen. Beachten Sie die Position der Microgrooves. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Axotomie, die innerhalb des COC-Multifachchips durchgeführt wird. (A) mCherry beschriftete Neuronen am Differenzierungstag 33 wurden vor der Axotomie abgebildet. 'Fire' Farb-Look-up-Tabelle. (B) Unmittelbar nach der Axotomie, die zeigt, dass Axone vollständig abgetrennt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Kunststoff-Multi-Fach-Chips | PDMS Multi-Fach-Geräte |
| Axone isolieren | Axone isolieren |
| Mikroumgebungen einrichten | Mikroumgebungen einrichten |
| axotomisieren Neuronen | axotomisieren Neuronen |
| optisch transparent | optisch transparent |
| kompatibel mit hochauflösender Bildgebung | kompatibel mit hochauflösender Bildgebung |
| kompatibel mit fluoreszenzmikroskopie | kompatibel mit fluoreszenzmikroskopie |
| komplett montiert | Montage auf Substrat erforderlich |
| gesunde Axone >21 Tage | gesunde Axone >14 Tage |
| hydrophile Kultivierungsfläche | Hydrophobe |
| Gas undurchlässig | Gas durchlässig |
| abgerundete Microgrooves und Kanäle | gerade Microgrooves |
| nicht kompatibel mit Laserablation | Kann zur Laserablation verwendet werden, wenn PDMS-Kammern auf speziellen laserablationskompatiblen Dias montiert werden. |
| Gerät kann nicht geändert werden, um | Top ist abnehmbar für die Färbung in Microgrooves |
| nicht kompatibel mit Mineralöl-basierten Tauchölen (Silikon-basierte Öle sind fein) | kompatibel mit Mineralöl-basierten Tauchölen |
| undurchlässig für kleine Moleküle und organische Lösungsmittel | Absorption von kleinen Molekülen & organischen Lösungsmitteln |
| Keine Leckageprobleme mit dem Chip | Beschichtung mit Poly-L-Ornithin und Laminin machen die Geräte undicht |
| differenzierte Neuronen bleiben gleichmäßig verteilt (> 4 Wochen) an den getesteten Zelldichten | differenzierte Neuronen beginnen sich nach 3-4 Tagen in kulturan der getesteten Zelldichten zu aggregieren |
Tabelle 1: Vergleich von Multi-Kompartier-COC-Chips und Silikongeräten zur Kultivierung von Neuronen
Diskussion
Der vormontierte Multi-Kompartier-COC-Chip ist eine einfach zu bedienende, unterteilte Plattform, um menschliche NSCs langfristig zu unterscheiden und in Neuronen zu halten (>4 Wochen). In diesem Protokoll zeigen wir die Differenzierung menschlicher NSCs in glutamaterge Neuronen, retrograde Etikettenneuronen, führen Immunzytochemie durch, visualisieren die dendritische Wirbelsäulenmorphologie und führen Axotomie durch. Diese Chips sind mit hochauflösender Bildgebung kompatibel und es gibt keine Autofluoreszenz mit dem COC12.
COC Multi-Compartment-Chips sind funktional äquivalent zu silikonbasierten kompartalisierten Geräten und haben Vorteile und Nachteile, wie zuvor beschrieben12. Tabelle 1 vergleicht MULTI-Kompartier-COC-Chips und Silikongeräte zur Kultivierung von hSC-Neuronen. Die COC-teilverfeinerten Chips bieten eine bessere hydrophile Oberfläche für die Befestigung und Wartung von Stammzellen über einen langen Kulturzeitraum. PDMS-basierte Geräte müssen montiert und an Glasabdeckungen befestigt werden. Die hydrophobe Natur der PDMS-Geräte bewirkt die Aggregation von Stammzellen5; Dies führt sowohl zu Herausforderungen bei der Bildgebung auf zellulärer Ebene als auch zu einer größeren Anfälligkeit für physische Schäden durch die Bewegung von Zellaggregaten während Medienveränderungen. Der Kunststoffchip überwindet diese Herausforderungen. COC ist gasundurchlässig, im Gegensatz zu PDMS, so dass Lufttaschen, die in den Kanälen eingeschlossen oder gebildet werden, vom Benutzer entfernt werden müssen. Die Vorbeschichtungslösung reduziert die Möglichkeit, dass Luft in den Kanälen gefangen wird. Diese Lösung besteht aus Ethanol und anderen Wirkstoffen. Ein zuvor veröffentlichtes Protokoll zur Kultivierung von murinen Neuronen innerhalb dieser Plastikchips liefert zusätzliche Details über Pipettierzellen und Medien innerhalb der Chips12. NSCs sind zerbrechlicher als murine Neuronen, so muss sanfter behandelt werden. Es ist auch wichtig, die Stammzellen gründlich zu mischen, bevor sie plattieren, indem Sie sie sanft nach oben und unten pipetieren.
Die Verwendung von Neuronen aus in vitro differenzierten menschlichen Stammzellen wird in Medizin und Forschung immer beliebter. Diese Neuronen sind wichtig für die Forschung und klinische Anwendungen für viele ZNS-Erkrankungen, einschließlich neurodegenerative Erkrankungen und traumatische Hirnverletzungen. Diese Neuronen ähneln den menschlichen fetalen Neuronen15. In Zukunft könnten entsprechend gealterte Neuronen aus Stammzellen erzeugt werden, um die altersbedingte neuronale Funktion nachzuahmen und in Verbindung mit diesen abgeschotteten Geräten zu verwenden. Diese Geräte werden die Erforschung von Krankheiten erleichtern, die die Gesundheit und Funktion des Axons beeinträchtigen, wie z. B. Axondefizite in Neuronen von Patienten, bei denen Autismus-Spektrum-Störungen diagnostiziert wurden, und axonale Regeneration nach Verletzung16,17.
Offenlegungen
S.P. und T.N. erklären keine konkurrierenden finanziellen Interessen. V.P. ist Mitarbeiter von Xona Microfluidics, LLC. J.H. ist Mitglied von Xona Microfluidics, LLC. A.M.T. ist Erfinder der mikrofluidischen Kammer/Chip (US 7419822 B2, EPO 2719756 B1) und Mitglied von Xona Microfluidics, LLC.
Danksagungen
Die Autoren würdigen die Unterstützung von Xona Microfluidics, LLC, dem National Institute of Mental Health (R42 MH097377) und dem National Institute of Neurological Disorders and Stroke (R41 NS108895, P30 NS045892). Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der National Institutes of Health dar.
Materialien
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Referenzen
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten