Method Article
预组装塑料微流体芯片中人类干细胞衍生神经元的分段化
摘要
该协议演示了使用分门分割的微流体芯片,注射成型在循环烯烃共聚物培养的神经元区别于人类干细胞。这些芯片是预先组装的,比传统的分块聚(二甲基硅氧烷)器件更容易使用。这里描述了多种常见的实验模式,包括病毒标记、流体隔离、轴切除术和免疫染色。
摘要
使用微流体设备对培养的神经元进行分门别类已成为神经科学的标准方法。该协议演示如何使用循环烯烃共聚物(COC)制成的预组装多腔芯片对与人类干细胞不同的神经元进行分门别类。这些 COC 芯片的占地面积与标准显微镜幻灯片相同,与高分辨率显微镜同样兼容。神经元从人类神经干细胞 (NSC) 分化为芯片内的谷氨酸神经元,并维持 5 周,为这些神经元留出足够的时间来发展突触和树突状脊柱。此外,我们演示了使用这些多腔芯片的多种常见实验程序,包括病毒标记、建立微环境、轴切除术和免疫细胞化学。
引言
人类干细胞分化神经元(hSC-神经元)越来越多地用于生物学研究。这些神经元,可以从人类来源材料,是极大的兴趣的翻译研究,包括研究创伤性脑损伤和神经退行性疾病,如阿尔茨海默氏病。因此,需要改进和促进hSC神经元研究的工具。
为了研究神经元独特的极化形态,许多研究人员使用多节分微流体装置1,2,3,4,5,6, 7,8,9,10,11.这些设备支持测量和操作具有独特亚细胞接入的长投影神经元。多条形微流体器件由两个平行的微流体隔间组成,由微槽隔开,这些微流体节子引导着斧子生长。神经元或神经干细胞 (NSCs) 在体素室中镀层,几分钟后粘附到隔间表面的底部。分化的神经元通过微槽区域生长并延伸其斧子/投影到相邻和隔离的斧室。过去,这些设备是专门使用聚(二甲基硅氧烷)(PDMS)复制成型制成的。PDMS设备有许多缺点,前面描述的12,包括持久性的疏水性和需要组装到玻璃盖玻片前立即使用。预组装注塑成型芯片克服了许多这些缺点,并出售商业(见材料表)12。这些芯片的隔间是永久的亲水性,整个芯片被注射成型在光学透明的循环烯烃共聚物(COC)。
该协议演示如何使用此 COC 芯片将人类 NSC 分化为兴奋神经元,并分离和流畅地分离其长神经元投影。在本演示中,神经元与NIH批准的H9干细胞进行了分化。类似的程序可用于区分人类诱导的多能干细胞。
研究方案
注:图1A,B显示了预组装的COC芯片的示意图,包括主通道或隔间、井和微槽的位置。分离芯片可以在隔间内建立独特的流体微环境,食品着色染料的分离证明了这一点(图1C)。Nagendran等人给出了制备预组装多腔室芯片的协议,第1节第12节。
1. hSC-神经元多腔芯片的涂层
注:图2A显示了涂装程序的概述。
- 在细胞培养级蒸馏水中溶解聚L-球基,使20μg/mL工作溶液的芯片上产生600μL的溶液。
- 在准备油井的芯片后,吸出剩余的PBS。吸气时,确保移液头远离通道开口。
注: 在整个此过程过程中,微流体通道必须保持填充。不要从通道/隔间吸出液体,只有井。 - 在右上角井中加载 150 μL 的多L-金属质溶液。等待 90 s 或直到液体开始填充右下角的井。将 150 μL 的介质添加到右下角,等待 5 分钟,让液体通过微槽。
- 将 150 μL 的介质添加到左上角井。等待 90 s,然后将 150 μL 添加到左下井。用副膜包裹芯片支架,并在4°C处过夜。
注:或者,将芯片和支架置于 37°C 1 小时。 - 从井中吸出介质,确保移液器尖端远离通道开口。在右上方井中加入150 μL无菌水。等待 90 s,然后将 150 μL 添加到右下角。等待 5 分钟,让液体通过微槽。
- 向左上井添加150 μL无菌水,等待90s,然后将另外150μL添加到左下井。
- 重复步骤 1.5-1.6。
- 在2°C至8°C下缓慢解冻层压,并准备10μg/mL工作溶液。
- 将150 μL的层压工作溶液加载到右上方井。等待 90 s 或直到液体开始填充右下角的井。移液 150 μL 到右下角井。等待 5 分钟,让层宁穿过微槽。
- 在左上部井中加入150 μL的层宁。等待 90 s,然后将 150 μL 添加到左下井。在37°C下孵育芯片支架2小时。
- 用 PBS 冲洗芯片(不含 Ca2+和 Mg2+)。将 150 μL 的 PBS 加载到右上角的井上。等待 90 s 或直到液体开始填充右下角的井。将 150 μL 的 PBS 添加到右下角的井中,等待 5 分钟,让 PBS 穿过微槽。
- 将 PBS 的 150 μL 移至左上井。90s 移液后 150 μL 到左下井。
- 从芯片中吸出PBS,然后用NSC介质冲洗芯片(见材料表)。将 150 μL 的介质加载到右上角的井上。90 s 后或液体通过右下通道进入右下角井时,向右下角井添加 150 μL。等待 5 分钟,让介质流过微槽。
- 向左上井添加 150 μL 的介质,向左下井添加 150 μL 的介质。在 37°C 的培养箱中孵育芯片,其中 5% CO2可预置芯片,直到准备好播种 NSC。
注:如果需要,芯片可以隔夜预调节。
2. 将 NSC 播种到多隔间芯片中
注:该协议使用商业购买的NSCs,不像我们以前出版的出版物,开始于人类胚胎干细胞5。在这个协议中,神经干细胞被直接镀入塑料芯片中,在那里它们分化成神经元。细胞可以增殖作为NSCs(无差别)多达2个通道,并存储在液体N2的瓶中供进一步使用。 该协议使用在通道 1 或 2 之后存储在液体 N2中的 NSC 小瓶。图 2B显示了涂装程序的概述。
- 根据制造商的说明解冻 NSC。
注: 此过程适用于 H9 派生的 NSC。其他细胞系需要细胞密度优化。 - 使用血细胞计计算细胞浓度,并使用 NSC 介质进行调整,以获得每 mL 7 x 106细胞的浓度。
- 从芯片的每个井中吸出介质。避免从主通道吸气介质。
- 将5μL的细胞溶液移至右上井,后至右下井5μL(共70,000个细胞)。确保电池移向主通道开口。使用显微镜检查细胞已进入通道。等待 5 分钟,让细胞粘附在芯片底部。
注: 任一或两个隔间可用于称重传感器。 - 移液 +150 μL 的 NSC 介质到右上角的井,然后 150 μL 到右下角井。在左侧重复上述步骤。在合适的加湿容器内孵育5%CO 2,37°C。
- 48小时后,从井中吸出NSC介质,并在每个顶部井和每个底井中加入150μL,用神经分化介质替换。
- 培养神经元在5%CO 2,37°C培养箱内一个合适的加湿容器内。
注:介质应每 2-3 天更换一次。由于芯片中使用的体积小,即使在加湿培养箱内的蒸发也会对细胞的生存能力产生重大影响。使用合适的二次容器为芯片细胞的长期培养提供额外的湿度(参见材料表)。
3. 芯片内hSC神经元的病毒荧光标记
注:多种病毒可用于标记芯片内的神经元。以下说明描述了 G-删除狂犬病-mCherry 或 @eGFP 病毒的使用。可能感染性的材料必须按照适用的规则和条例进行处理,并且可能需要额外的培训和机构批准。
- 将每个芯片的新鲜神经分化介质加热 ±400 μL 至 37°C。
- 将50μL的介质从斧车厢的一个井中取出到离心管中,然后将100,000个经过改良的狂犬病病毒的病毒单位添加到管中。
注:妥善处理含有病毒的废移液器尖端和离心管。 - 从斧室中取出剩余的神经分化介质,并放入离心管中。储存在37°C。
注:确保通道仍充满液体。 - 将 50 μL 的病毒溶液与 150 μL 的加热介质混合。将 100 μL 移至安克斯子仓的一个井,将 100 μL 移至另一个安克斯子仓井。在37°C培养箱内孵育2小时。
注:斧状和体细胞间之间的体积差异有助于确保病毒在感染/孵育期间停留在斧室中。 - 提取并处置包含病毒的介质。
注意:请勿去除封闭微流体通道内的液体。 - 轻轻将 75 μL 的新鲜介质移至一个安克斯子仓井,让介质通过通道流入其他安克斯井。
- 从斧子隔间中取出介质并正确处置。
- 重复步骤 3.6 和 3.7。
- 用保存的介质填充斧子隔间。如果需要,再管一个50μL的新鲜介质,然后将芯片返回到孵化器。这种额外的新介质将计入液体转移和过程中蒸发过程中的介质损失。
注:使用这些改良狂犬病病毒的可见荧光标记在48小时和8天内发生,此后受感染神经元的细胞死亡通常由于病毒毒性而发生。神经元成像可以像其他标准培养平台(例如玻璃底盘)一样进行,但需要特别考虑,以保持足够的湿度,以防止蒸发损失。
4. 芯片内的流体隔离、异形和免疫染色
- 按照Nagendran等人12所述的芯片进行流体隔离、异形和免疫染色。
结果
在具有分化介质的芯片中一周(7-10天)后,NSCs分化成神经元,神经元投影进入斧室(图3)。在芯片内,神经元在体腔内均匀地连接和分布。相比之下,PDMS 设备中的神经元早在加入分化介质后 5 天就聚集/聚集,从而导致细胞健康受损,如图3B(第 13 天放大图像)所示。芯片中的神经元看起来健康与捆绑的斧子。健康的神经元可以在芯片内维持4-5周。
为了可视化神经元成熟和树突状脊柱发育,经过修饰的狂犬病病毒在第29天被送到斧室,用mCherry荧光蛋白逆行标记神经元,包括树突状脊柱。狂犬病病毒感染四天后,将斧子伸入斧腔室的神经元表示mCherry。在分化日33处的神经元显示树突状脊柱的形成(图4)。树突状脊柱的可视化表明,NSC衍生神经元在芯片内分化形成成熟的突触。
多腔芯片还与免疫细胞化学兼容,以可视化蛋白质的细胞定位。在分化培养基中维持神经元26天后,神经元被标记为兴奋性突触标记,vGlut1(图5)。这些结果表明,病毒标记的神经元与vGlut1(图5E)和神经元特异性标记,β-图布林III(图5F-H)共同本地化。
使用AlexaFluor 488氢化物(一种低分子量荧光染料)来证明能够创建与斧子分离的独特微环境(图6)。
斧类损伤研究通常在隔离装置内进行。进行了原理证明实验,用预组装的COC芯片选择性地伤害分化神经元的斧子(图7)。结果相当于硅胶分块装置6,13,14。

图1:预组装的COC,多腔室微流体芯片。(A) 识别上井和下井的芯片的图纸.芯片尺寸为75毫米x25毫米,相当于标准显微镜幻灯片的大小。(B) A 放大区域,显示分隔通道的通道和微槽。其他细节见纳根德兰等人12。(C) 这张照片说明了使用食用色素染料在每个隔间内建立孤立的微环境。整个数字已由12日转载。请点击此处查看此图的较大版本。
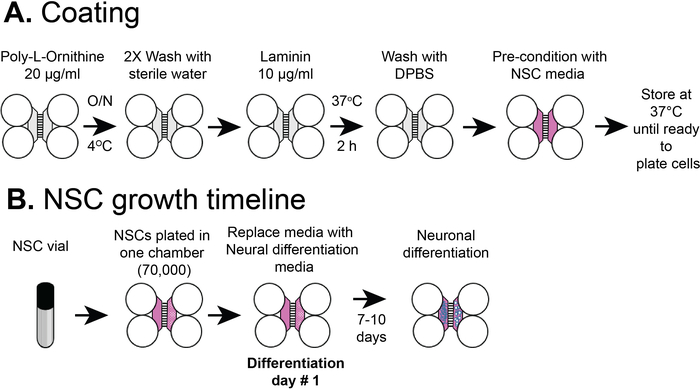
图2:塑料隔板芯片涂层和NSC电池电镀时间线。(A) 塑料多隔间芯片涂覆预涂层溶液,然后聚-L-ornithine 和层宁,然后用 NSC 介质进行预调。(B) NSC在芯片的体腔中装有7 x 104个单元。细胞在NSC培养基中生长24小时,然后用神经分化介质替换。分化后7-10天观察到分化神经元。请点击此处查看此图的较大版本。

图3:芯片和PDMS器件的hSC神经元生长比较。(A) hSC-神经元的相对比图像在塑料多隔间芯片分化后13天生长。(B) 在 (A) 中的白色框中培养的 hSC 神经元区域和 PDMS 设备中的等效区域(右)的放大区域。芯片内的 hSC 神经元附着良好。在基于 PDMS 的设备中形成聚合神经元聚类。代表2个独立实验。请点击此处查看此图的较大版本。
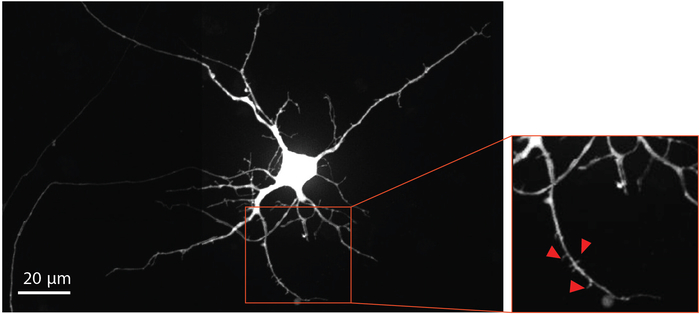
图4:人类NSC衍生神经元显示树突状脊柱形态。在芯片内生长的分化日33处,逆行标记mCherry神经元。以红色勾勒的放大区域突出了树突状脊柱的存在,这为成熟谷氨酸突触的发展提供了证据。红色箭头指向树突状脊柱。请点击此处查看此图的较大版本。
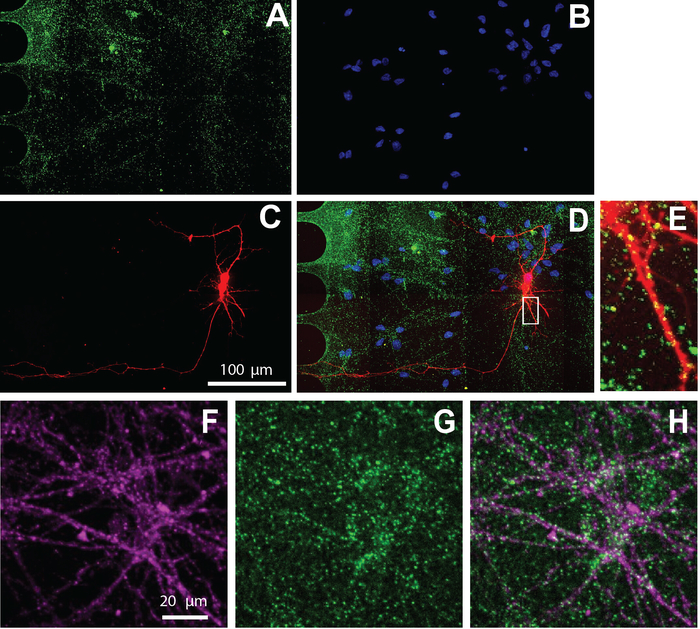
图5:在芯片内培养的人类NSC衍生神经元表现出兴奋突触。免疫染色在分化第26天进行。在体室中进行了神经元成像。A) vGlut1 ( 绿色) 和 (B) DAPI ( 蓝色) 免疫标签.(C) mCherry 标记的神经元 (红色) 逆行标记使用改良狂犬病病毒。(D)A-C的合并荧光显微图 .(E) 丹德林基脊柱和 vGlut1 阳性双子项与 mCherry 阳性树突共发生,显示在从 (D) 放大的区域中。(F) 神经元特异性标记子的免疫荧光显微图,β-图布林III(品红色)和(G) vGlut1(绿色)。(H) β-图布林 III 和 vGlut1 的覆盖。请点击此处查看此图的较大版本。

图6:病毒性转导的mCherry神经元将投影扩展到预组装的COC芯片内建立的斧子局部微环境。(A) mCherry 标记神经元通过芯片的微槽将斧子延伸,并进入一个隔离的斧子隔间.使用 Alexa Fluor 488 氢化物可可视化斧子隔间隔离。神经元成像发生在感染改性狂犬病病毒后的第26天和第3天。(B)A中的荧光图像与 DIC 图像合并.注意微槽的位置。请点击此处查看此图的较大版本。

图7:在COC多腔芯片内执行的异形。(A) mCherry 标记的神经元在分化第33天被成像前进行切除术."火"颜色查找表。(B) 轴向切除术后立即发生,表明轴子被完全割断。请点击此处查看此图的较大版本。
| 塑料多隔间芯片 | PDMS 多腔室设备 |
| 隔离斧子 | 隔离斧子 |
| 建立微环境 | 建立微环境 |
| 原子化神经元 | 原子化神经元 |
| 光学透明 | 光学透明 |
| 兼容高分辨率成像 | 兼容高分辨率成像 |
| 与荧光显微镜兼容 | 与荧光显微镜兼容 |
| 完全组装 | 组件到基板需要 |
| 健康斧急 >21 天 | 健康斧急 >14 天 |
| 亲水培养表面 | 疏 水 |
| 气体不透气 | 透气 |
| 圆微槽和通道 | 直微槽 |
| 与激光消融不兼容 | 当 PDMS 腔室组装在特殊的激光消融兼容幻灯片上时,可用于激光消融。 |
| 无法更改设备以删除顶部 | 顶部可拆卸,用于在微槽内染色 |
| 与矿物油基浸入油不兼容(硅基油是精细的) | 与矿物油基浸入油兼容 |
| 不透渗透小分子和有机溶剂 | 吸收小分子和有机溶剂 |
| 芯片无泄漏问题 | 涂有聚L-氨基苯和拉米宁,使设备泄漏 |
| 差异化神经元在测试的细胞密度下保持均匀分布(> 4 周) | 分化神经元在被测试的细胞密度下培养3-4天后开始聚集 |
表1:培养神经元的多腔COC芯片和硅胶装置的共性
讨论
预组装的多腔COC芯片是一个易于使用的分门式平台,用于长期将人类NSC区分和维护到神经元中(>4周)。在此协议中,我们演示了人类NSCs分化为谷胱甘肽神经元,逆行标签神经元,执行免疫细胞化学,可视化树突状脊柱形态,并进行弓形切除术。这些芯片与高分辨率成像兼容,与COC12没有自荧光。
COC多腔芯片在功能上相当于硅基的隔板设备,具有优点和缺点,如前12所述。表 1比较了用于培养 hSC 神经元的多腔 COC 芯片和硅胶设备。COC分块芯片为在漫长的培养期内的干细胞的附着和维护提供了更好的亲水表面。基于 PDMS 的设备需要组装并连接到玻璃盖玻片上。PDMS装置的疏水性导致干细胞聚集5;这导致在细胞水平上成像方面的挑战,以及由于介质变化期间细胞聚集物的移动而造成物理损伤的更大易感性。塑料芯片克服了这些挑战。与 PDMS 不同,COC 是气体不渗透的,因此用户必须清除在通道内滞留或形成的气囊。预涂布解决方案可降低空气滞留在通道中的可能性。这种溶液由乙醇和其他制剂组成。先前公布的一种在塑料芯片内培养鼠神经元的协议提供了有关切液细胞和芯片12内介质的其他细节。NSC比鼠神经元更脆弱,所以必须更温和地处理。在电镀之前,通过轻轻上下移液来彻底混合干细胞也是至关重要的。
使用从体外分化的人类干细胞衍生的神经元在医学和研究中正变得越来越流行。这些神经元对于许多中枢神经系统疾病(包括神经退行性疾病和创伤性脑损伤)的研究和临床应用非常重要。这些神经元非常类似于人类胎儿神经元15。将来,可以从干细胞中生成适当的老化神经元,以模拟与年龄相关的神经元功能,并与这些分离的装置结合使用。这些设备将促进研究影响斧子健康和功能的疾病,如诊断为自闭症谱系障碍的患者神经元的斧子缺陷和损伤16、17后的斧子再生。
披露声明
标准普尔和T.N.宣布没有相互竞争的经济利益。V.P. 是 Xona 微流体有限责任公司的雇员。J.H. 是 Xona 微流体有限责任公司的成员。A.M.T. 是微流体室/芯片的发明者(US 741982B2,EPO 2719756 B1),是 Xona 微流体有限责任公司的成员。
致谢
作者承认来自Xona微流体学,LLC,国家心理健康研究所(R42 MH097377),和国家神经疾病和中风研究所(R41 NS108895,P30 NS045892)的支持。内容完全由作者负责,不一定代表国家卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
参考文献
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。