Method Article
Compartimentazione dei neuroni derivati da cellule staminali umane all'interno di chip microfluidici in plastica pre-assemblati
In questo articolo
Riepilogo
Questo protocollo dimostra l'uso di chip microfluidici compartimentati, iniezione modellata in un copolimero ciclico olefin a neuroni coltivati differenziati dalle cellule staminali umane. Questi chip sono preassemblati e più facili da usare rispetto ai tradizionali dispositivi di poli(dimetilsiloxane) compartimentati. Qui sono descritti più paradigmi sperimentali comuni, tra cui l'etichettatura virale, l'isolamento fluido, l'asaxtomia e l'immunostaining.
Abstract
L'uso di dispositivi microfluidici per compartimentare i neuroni coltivati è diventato un metodo standard nelle neuroscienze. Questo protocollo mostra come utilizzare un chip multicompartivo preassemblato realizzato in un copolimero ciclico di olefin (COC) per compartimentare i neuroni differenziati dalle cellule staminali umane. L'impronta di questi chip COC è la stessa di un vetrino a microscopio standard e sono ugualmente compatibili con la microscopia ad alta risoluzione. I neuroni sono differenziati dalle cellule staminali neurali umane (NSC) in neuroni glutamatergici all'interno del chip e mantenuti per 5 settimane, consentendo tempo sufficiente per questi neuroni per sviluppare sinapsi e spine dendritiche. Inoltre, dimostriamo molteplici procedure sperimentali comuni utilizzando questi chip multi-compartimenti, tra cui l'etichettatura virale, la creazione di microambienti, l'assiotomia e l'immunocitochimica.
Introduzione
I neuroni differenziati delle cellule staminali umane (neuroni hSC) sono sempre più utilizzati per la ricerca biologica. Questi neuroni, che possono essere derivati da materiale di origine umana, sono di grande interesse per la ricerca traslazionale, compreso lo studio delle lesioni cerebrali traumatiche e disturbi neurodegenerativi come il morbo di Alzheimer. Così, strumenti per migliorare e facilitare lo studio dei neuroni hSC sono richiesti.
Per studiare l'esclusiva morfologia polarizzata dei neuroni, molti ricercatori utilizzano dispositivi microfluidici multi-compartimentati1,2,3,4,5,6, 7,8,9,10,11. Questi dispositivi consentono misurazioni e manipolazioni di neuroni a proiezione lunga con accesso subcellulare unico. I dispositivi microfluidici multi-compartmentalizzati sono costituiti da due compartimenti microfluidici paralleli separati da microgroove, che guidano la crescita assonale. I neuroni o le cellule staminali neurali (NSC) sono placcati nel compartimento somatodendritico, e quindi aderiscono alla parte inferiore della superficie del compartimento dopo minuti. I neuroni differenziati crescono ed estendono i loro assoni/proiezioni attraverso la regione microgroove in un compartimento assonale adiacente e isolato. In passato, questi dispositivi sono stati realizzati esclusivamente utilizzando lo stampaggio di replica poli (pdMS) (PDMS). I dispositivi PDMS hanno molti inconvenienti descritti in precedenza12, tra cui l'idrofobicità persistente e la necessità di assemblare su un coperchio di vetro immediatamente prima dell'uso. I chip stampati a iniezione pre-assemblati superano molti di questi inconvenienti e sono venduti commercialmente (vedi Tabella deimateriali)12. I compartimenti di questi chip sono permanentemente fatti idrofilo e l'intero chip viene stampato in ainiezione otticamente trasparente copolimero di olefin (COC).
Questo protocollo dimostra come utilizzare questo chip COC per differenziare le NSC umane in neuroni eccitatori e per separare e isolare in modo fluido le loro lunghe proiezioni neuronali. Per questa dimostrazione, i neuroni sono stati differenziati dalle cellule staminali H9 approvate dal NIH. Procedure simili possono essere utilizzate per differenziare le cellule staminali pluripotenti indotte dall'uomo.
Protocollo
NOTA: La figura 1A,B mostra uno schema del chip COC preassemblato, incluse le posizioni dei canali principali o dei compartimenti, dei pozzi e dei microgroove. Il chip compartimentato può stabilire microambienti fluidici distinti all'interno di un compartimento, come dimostra l'isolamento del colorante alimentare (Figura 1C). Il protocollo per la preparazione del chip multicompartino preassemblato è indicato in Nagendran et al., Sezione 112.
1. Rivestimento di chip multi-compartimenti per neuroni hSC
NOTA: la figura 2A mostra una panoramica delle procedure di rivestimento.
- Sciogliere la poli-L-ornitina nell'acqua distillata di coltura cellulare per fare 600 l- di soluzione per chip di una soluzione di lavoro di 20 g/mL.
- Aspirati il pbS rimanente lasciato dopo aver preparato i chip dai pozzi. Quando si aspira, assicurarsi che la punta del pipet sia lontana dall'apertura del canale.
NOTA: i canali microfluidici devono rimanere riempiti per l'intera procedura. Non aspirare liquido dai canali / scomparti, solo i pozzi. - Caricare 150 l di soluzione di lavoro poli-L-ornitina nel pozzo superiore destro. Attendere 90 s o fino a quando il liquido inizia a riempire il pozzo in basso a destra. Aggiungere 150 l di supporti nel pozzo in basso a destra e attendere 5 min per far passare il liquido attraverso i microgrooves.
- Aggiungere 150 l di supporti nel pozzo in alto a sinistra. Attendere 90 s e poi aggiungere 150 L nel pozzo in basso a sinistra. Avvolgere il supporto del/dei chip con parafilm e posizionarlo a 4 gradi durante la notte.
NOTA: In alternativa, posizionare il chip e il supporto a 37 gradi centigradi per 1 ora. - Aspirare il supporto dai pozzi, assicurandoche la punta del pipet sia posizionata lontano dall'apertura del canale. Aggiungere 150 l di acqua sterile nel pozzo superiore destro. Attendere 90 s e quindi aggiungere 150 L nel pozzo in basso a destra. Attendere 5 min per far passare il liquido attraverso i microgrooves.
- Aggiungere 150 l di acqua sterile nel pozzo superiore sinistro, attendere 90 s e poi aggiungere altri 150 L al pozzo in basso a sinistra.
- Ripetere i passaggi da 1.5 a 1.6.
- Scongelare la laminina lentamente da 2 a 8 gradi centigradi e preparare una soluzione di lavoro di 10 g/mL.
- Caricare 150 l della soluzione di lavoro laminin a destra. Attendere 90 s o fino a quando il liquido inizia a riempire il pozzo in basso a destra. Pipet 150 -L in basso a destra bene. Attendere 5 min per far passare la laminin attraverso i microgrooves.
- Aggiungere 150 l di laminina nel pozzo superiore sinistro. Attendere 90 s e poi aggiungere 150 L nel pozzo in basso a sinistra. Incubare il chip all'interno del suo supporto per 2 h a 37 gradi centigradi.
- Sciacquare il chip con PBS (senza Ca2 e Mg2). Caricare 150 - L di PBS sul pozzo superiore destro. Attendere 90 s o fino a quando il liquido inizia a riempire il pozzo in basso a destra. Aggiungere 150 l di PBS nel pozzo in basso a destra e attendere 5 min per far passare il PBS attraverso i microgrooves.
- Tubo 150 -L di PBS in alto a sinistra bene. Dopo 90 s pipet 150 l nel pozzo in basso a sinistra.
- Aspirate PBS dal chip e poi risciacquare il chip con supporti NSC (vedere Tabella dei materiali). Caricare 150 - L di supporti in alto a destra bene. Dopo 90 s o quando il liquido passa attraverso il canale destro nel pozzo in basso a destra, aggiungere 150 L nel pozzo inferiore destro. Attendere 5 min per far scorrere il supporto attraverso i microgrooves.
- Aggiungere 150 l di supporti in alto a sinistra e altri 150 L in basso a sinistra bene. Incubare il chip in un'incubatrice a 37 gradi centigradi con il 5% di CO2 per pre-condizionare il chip fino a quando non è pronto a seedare le NSC.
NOTA: I trucioli possono essere precondizionati durante la notte, se necessario.
2. Seeding NSC nel chip multicompartment
NOTA: Questo protocollo utilizzava NSC acquistati commercialmente, a differenza della nostra precedente pubblicazione che è iniziata con le cellule staminali embrionali umane5. In questo protocollo le cellule staminali neurali vengono placcate direttamente nei chip di plastica dove si differenziano in neuroni. Le cellule possono essere lasciate proliferare come NSC (senza differenziazione) per un massimo di 2 passaggi e conservati in fiale in liquido N2 per un ulteriore uso. Questo protocollo utilizza fiale NSC memorizzate nel liquido N2 dopo il passaggio 1 o 2. La figura 2B mostra una panoramica delle procedure di rivestimento.
- Scongelare i NSC secondo le istruzioni del produttore.
NOTA: questa procedura si applica agli NSC derivati da H9. Altre linee cellulari richiederanno l'ottimizzazione della densità delle celle. - Contare la concentrazione cellulare utilizzando un emocitometro e regolare utilizzando supporti NSC per ottenere una concentrazione di 7 x 106 cellule per mL.
- Aspirati supporti da ogni pozzo del chip. Evitare di aspirare i media dai canali principali.
- Pipet 5 - L della soluzione cellulare in alto a destra bene, seguito da 5 L al pozzo inferiore destro (70.000 celle in totale). Assicurarsi che le celle siano reindirizzate verso le aperture principali del canale. Utilizzare un microscopio per verificare che le cellule siano entrate nel canale. Attendere 5 min per le cellule di aderire al fondo del chip.
NOTA: uno o entrambi i compartimenti possono essere utilizzati per caricare le celle. - Pipet 150 dollari di nsC media al pozzo superiore destro e poi 150 l nel pozzo in basso a destra. Ripetere sul lato sinistro. Incubare al 5% di CO2, 37 gradi centigradi all'interno di un contenitore umidificato adatto.
- Dopo 48 ore, aspirare i supporti NSC dai pozzi e sostituirli con supporti di differenziazione neurale aggiungendo 150 l a ogni pozzo superiore e ogni pozzo inferiore.
- I neuroni della coltura all'interno di un 5% di CO2, 37 gradi centigradi all'interno di un contenitore umidizzato adatto.
NOTA: i supporti devono essere sostituiti ogni 2-3 giorni. A causa dei piccoli volumi utilizzati nel chip, l'evaporazione anche all'interno di un'incubatrice umidificata può avere un impatto sostanziale sulla vitalità cellulare. Utilizzare un contenitore secondario adatto per fornire umidità aggiuntiva per la coltura a lungo termine di cellule con il chip (vedere Tabella dei materiali).
3. Etichettatura fluorescente virale dei neuroni hSC all'interno del chip
NOTA: Più virus possono essere utilizzati per etichettare i neuroni all'interno del chip. Le istruzioni riportate di seguito descrivono l'uso del virus Rabies-mCherry o –eGFP eliminato da G. I materiali potenzialmente infettivi devono essere trattati secondo le norme e i regolamenti applicabili e possono richiedere una formazione aggiuntiva e l'approvazione istituzionale.
- Caldo da 400 dollari a l di nuovi supporti di differenziazione neurale per chip a 37 gradi centigradi.
- Rimuovere 50 -L di supporti da un pozzo del vano assone in un tubo di centrifuga e quindi aggiungere 100.000 unità virali del virus della rabbia modificato al tubo.
NOTA: smaltire correttamente le punte di pipet esaurite e i tubi di centrifuga contenenti virus. - Rimuovere il supporto di differenziazione neurale rimanente dal vano assonale e posizionarlo in un tubo di centrifuga. Conservare a 37 gradi centigradi.
NOTA: Assicurarsi che i canali rimangano riempiti di liquido. - Mescolare i 50 - L di soluzione antivirus con 150 - L di supporti riscaldati. Pipet 100 L in un pozzo del vano assone e 100 L all'altro vano assone bene. Incubare per 2 h all'interno di un'incubatrice di 37 gradi centigradi.
NOTA: La differenza di volumi tra i compartimenti assonali e somatici aiuta a garantire che il virus rimanga nel compartimento assonale durante l'infezione/incubazione. - Ritirare e smaltire i supporti contenenti virus.
AVVISO: Non rimuovere il liquido all'interno dei canali microfluidici chiusi. - Pipet 75 - L di supporti freschi in un vano assone bene e lasciare che il supporto fluire attraverso il canale in altro pozzo assone.
- Rimuovere il supporto dal vano assone e smaltire correttamente.
- Ripetere i passaggi 3.6 e 3.7.
- Riempire il vano assone con il supporto salvato. Convogliare altri 50 - l'uomo, se necessario, e poi restituire il chip all'incubatrice. Questo ulteriore supporto fresco è quello di contare per la perdita di supporti durante il trasferimento di liquido e l'evaporazione durante il processo.
NOTA: L'etichettatura fluorescente visibile con questi virus della rabbia modificati si verifica da 48 h e fino a 8 giorni dopo i quali la morte cellulare di neuroni infetti si verifica generalmente a causa della tossicità del virus. L'imaging del neurone può essere eseguito come con altre piattaforme di coltura standard (ad esempio, piatti di fondo in vetro), ma è necessaria una considerazione speciale per mantenere l'umidità sufficiente per evitare perdite evaporative.
4. Isolamento fluido, asaxtomia e immunostaining all'interno del chip
- Seguire l'isolamento fluido, l'asotomia e l'immunostaining con il chip come descritto in Nagendran et al.12.
Risultati
Dopo una settimana (7-10 giorni) nel chip con mezzi di differenziazione, LE NSC si differenziano in neuroni e proiezioni neuronali entrano nel compartimento assonale (Figura 3). All'interno del chip, i neuroni si attaccano e si distribuiscono uniformemente all'interno del compartimento somatico. In confronto, i neuroni nei dispositivi PDMS clump/ aggregati già 5 giorni dopo l'aggiunta di supporti di differenziazione, che porta alla salute delle cellule compromessa come si può vedere nella Figura 3B (giorno 13 immagine ingrandita). I neuroni nei chip sembrano sani con assoni in bundle. I neuroni sani possono essere mantenuti all'interno dei chip per 4-5 settimane.
Per visualizzare la maturazione dei neuroni e lo sviluppo della colonna vertebrale dendritica, il virus della rabbia modificato è stato consegnato al compartimento assonale al giorno 29 per etichettare i neuroni retrogradi, comprese le spine dendritiche, con proteina fluorescente mCherry. Quattro giorni dopo l'infezione da virus della rabbia, i neuroni che estendono gli assoni nel compartimento assonale hanno espresso mCherry. I neuroni al giorno di differenziazione 33 hanno mostrato la formazione di spine dendritiche (Figura 4). La visualizzazione delle spine dendritiche dimostra che i neuroni derivati da NSC differenziati all'interno dei chip formano sinapsi mature.
Il chip multi-compartimento è anche compatibile con l'immunocitochimica per visualizzare la localizzazione cellulare delle proteine. Dopo 26 giorni di mantenimento dei neuroni nei mezzi di differenziazione, i neuroni sono stati etichettati per il marcatore sinaptico eccitatorio, vGlut1 (Figura 5). Questi risultati mostrano che i neuroni etichettati viralmente co-localizzano con vGlut1 (Figura 5E) e marcatore specifico del neurone, z-tubulina III (Figura 5F-H).
È stata inoltre dimostrata la capacità di creare microambienti distinti isolati dagli assoni utilizzando Alexa Fluor 488 hydrazide, un tinto fluorescente a basso peso molecolare (Figura 6).
Gli studi sulle lesioni ascia sono comunemente eseguiti all'interno di dispositivi compartimentati. È stato eseguito un esperimento di prova di principio per ferire selettivamente gli assoni di neuroni differenziati con il chip COC preassemblato (Figura 7). I risultati sono stati equivalenti ai dispositivi compartimentati in silicone6,13,14.

Figura 1: Il chip microfluidico multicompartido preassemblato COC. (A) Un disegno del chip che identifica i pozze superiori e inferiori. La dimensione del chip è 75 mm x 25 mm, la dimensione dei vetrini standard del microscopio. (B) Una regione ingrandita che mostra i canali e i microgroove che separano i canali. Ulteriori dettagli sono forniti in Nagendran et al. (C) Questa fotografia illustra la creazione di microambienti isolati all'interno di ogni compartimento utilizzando coloranti alimentari. L'intera figura è stata riprodotta da 12. Fare clic qui per visualizzare una versione più grande di questa figura.
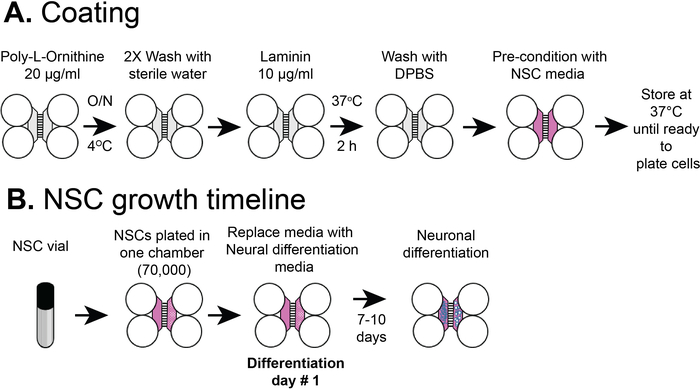
Figura 2: Rivestimento chip compartimentato in plastica e sequenza temporale di placcatura delle cellule NSC. (A) I chip multicomparti in plastica sono stati rivestiti con una soluzione di pre-rivestimento, e poi poli-L-ornina e laminina prima del pre-condizionamento con i supporti NSC. (B) le NSC sono state placcate con 7 x 104 celle nel compartimento somatico del chip. Le cellule sono state coltivate in supporti NSC per 24 h e poi i media sono stati sostituiti con supporti di differenziazione neurale. I neuroni differenziati sono stati osservati da 7-10 giorni dopo la differenziazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: confronto della crescita del neurone hSC nei chip e nei dispositivi PDMS. (A) Un'immagine a contrasto di fase dei neuroni hSC coltivati a 13 giorni dopo la differenziazione nel chip multicompartino in plastica. (B) Una regione ingrandita di neuroni hSC coltivati all'interno della scatola bianca in (A) e una regione equivalente all'interno di un dispositivo PDMS (a destra). hSC-neuroni all'interno dei chip si attaccano bene. Cluster di neuroni aggregati si formano in dispositivi basati su PDMS. Rappresentante di 2 esperimenti indipendenti. Fare clic qui per visualizzare una versione più grande di questa figura.
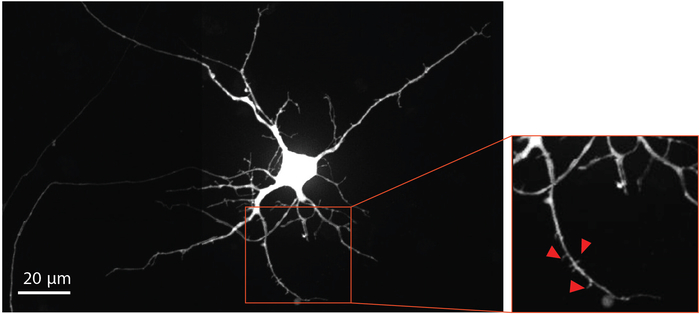
Figura 4: I neuroni derivati dall'NSC umana mostrano la morfologia della colonna vertebrale dendritica. Neurone mCherry etichettato retrogrado al giorno di differenziazione 33 cresciuto all'interno del chip. La regione ingrandita delineata in rosso, evidenzia la presenza di spine dendritiche, che forniscono prove a sostegno dello sviluppo di sinapsi glutamategiche mature. Le frecce rosse puntano verso spine dendritiche. Fare clic qui per visualizzare una versione più grande di questa figura.
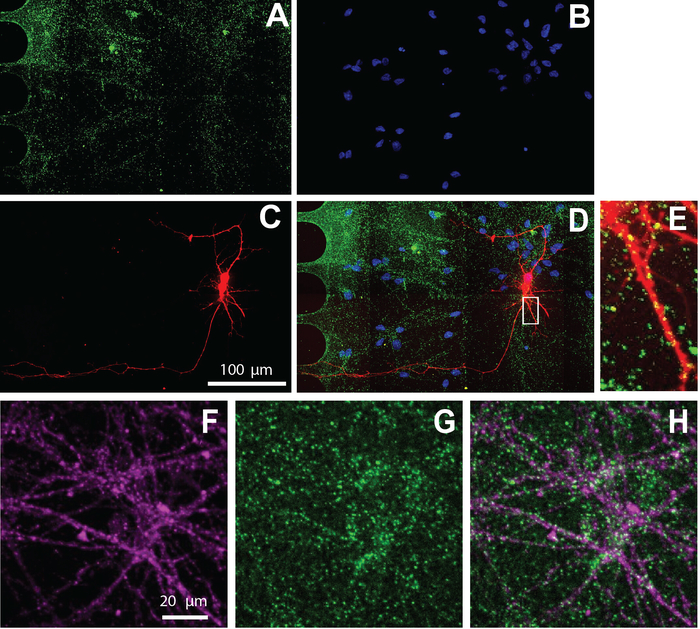
Figura 5: Neuroni derivati dall'NSC umano coltivati all'interno di chip presentano sinapsi eccitatorie. L'immunostaining è stato eseguito al giorno di differenziazione 26. L'imaging del neurone è stato eseguito nel compartimento somatico. A) vGlut1 (verde) e (B) DAPI (blu) immunolabeling. (C) neuroni mCherry-labeled utilizzando un virus della rabbia modificato. (D) Un micrografo fluorescente unito di (A-C). (E) Spine dendritiche e puncta positivo vGlut1 colocalizzati con dendriti mCherry positivi, mostrati in una regione ingrandita da (D). Immunofluorescenza micrografie di (F) neurono marcatore specifico, z-tubulina III (magenta), e (G) vGlut1 (verde). (H) Sovrapposizione di z-tubulina III e vGlut1. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: I neuroni mCherry tradotti viralmente estendono le proiezioni in un microambiente localizzato assonato stabilito all'interno del chip COC preassemblato. (A) il neurone etichettato mCherry estende gli assoni attraverso i microgroove del chip e in un compartimento assonale isolato. L'isolamento del compartimento assonale viene visualizzato utilizzando l'hydrazide Alexa Fluor 488. L'imaging dei neuroni si è verificato al giorno di differenziazione 26 e 3 giorni dopo l'infezione con il virus della rabbia modificato. (B) L'immagine a fluorescenza in (A) viene unita a un'immagine DIC. Si noti la posizione dei microgrooves. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Anotomia eseguita all'interno del chip multicompartno COC. (A) i neuroni etichettati mCherry al giorno di differenziazione 33 sono stati immagine prima dell'assiotomia. Tabella di ricerca dei colori "Fuoco". (B) Immediatamente dopo l'assiotomia, dimostrando che gli assoni sono completamente recisi. Fare clic qui per visualizzare una versione più grande di questa figura.
| Chip multicomparti in plastica | Dispositivi PDMS multi-compartimento |
| isolare gli assoni | isolare gli assoni |
| stabilire microambienti | stabilire microambienti |
| astomizza i neuroni | astomizza i neuroni |
| otticamente trasparente | otticamente trasparente |
| compatibile con l'imaging ad alta risoluzione | compatibile con l'imaging ad alta risoluzione |
| compatibile con microscopia a fluorescenza | compatibile con microscopia a fluorescenza |
| completamente assemblato | assemblaggio per il substrato richiesto |
| assoni sani >21 giorni | assoni sani >14 giorni |
| superficie di coltura idrofila | idrofobo |
| gas impermeabile | gas permeabile |
| microgroove e canali arrotondati | microgroove stridi |
| non compatibile con l'ablazione laser | Può essere utilizzato per l'ablazione laser quando le camere PDMS sono assemblate su speciali vetrini compatibili con l'ablazione laser. |
| dispositivo non può essere modificato per rimuovere | superiore è rimovibile per la colorazione all'interno di microgrooves |
| non compatibile con oli di immersione a base di olio minerale (gli oli a base di silicone vanno bene) | compatibile con oli di immersione a base di olio minerale |
| impermeabile a piccole molecole e solventi organici | assorbimento di piccole molecole e solventi organici |
| Nessun problema di perdita con il chip | rivestimento con poli-L-ornitina e laminina rendono i dispositivi persi |
| neuroni differenziati rimangono distribuiti uniformemente (> 4 settimane) alle densità cellulari testate | i neuroni differenziati iniziano ad aggregarsi dopo 3-4 giorni di coltura alle densità cellulari testate |
Tabella 1: Confronto di chip COC multi-compartment e dispositivi in silicone per la coltura dei neuroni
Discussione
Il chip COC multicompartiuso preassemblato è una piattaforma compartimentata di facile utilizzo per differenziare e mantenere le NSC umane in neuroni per lunghi rapporti (>4 settimane). In questo protocollo, dimostriamo la differenziazione delle NSC umane in neuroni glutamatergici, neuroni di etichette retrograde, eseguire immunocitochimica, visualizzare la morfologia della colonna vertebrale dendritica ed eseguire l'asotomia. Questi chip sono compatibili con l'imaging ad alta risoluzione e non c'è autofluorescenza con il COC12.
I chip multicompartidico COC sono funzionalmente equivalenti ai dispositivi compartimentati in silicone e presentano vantaggi e svantaggi come descritto in precedenza12. La tabella 1 confronta i chip COC multi-compartment e i dispositivi in silicone per la coltura di neuroni hSC. I chip compartimentati COC forniscono una superficie idrofila migliore per l'attaccamento e il mantenimento delle cellule staminali per un lungo periodo di coltura. I dispositivi basati su PDMS devono essere assemblati e collegati a coperchi in vetro. La natura idrofobica dei dispositivi PDMS provoca l'aggregazione delle cellule staminali5; questo porta sia a sfide nell'imaging a livello cellulare che a una maggiore suscettibilità ai danni fisici a causa del movimento delle aggregazioni cellulari durante i cambiamenti dei media. Il chip di plastica supera queste sfide. CoC è impermeabile a gas, a differenza di PDMS, quindi le sacche d'aria intrappolate o formate all'interno dei canali devono essere rimosse dall'utente. La soluzione di pre-rivestimento riduce la possibilità che l'aria rimanga intrappolata nei canali. Questa soluzione è costituita da etanolo e altri agenti. Un protocollo precedentemente pubblicato per la coltura di neuroni murini all'interno di questi chip di plastica fornisce ulteriori dettagli sulle cellule di pipettaggio e supporti all'interno dei chip12. Le NSC sono più fragili che i neuroni murini, quindi devono essere gestiti più delicatamente. È anche fondamentale mescolare accuratamente le cellule staminali prima della placcatura pipettandole delicatamente su e giù.
L'uso di neuroni derivati da cellule staminali umane differenziate in vitro sta diventando sempre più popolare in medicina e ricerca. Questi neuroni sono importanti per la ricerca e applicazioni cliniche per molti disturbi del SNC, tra cui malattie neurodegenerative e lesioni cerebrali traumatiche. Questi neuroni assomigliano molto ai neuroni fetali umani15. In futuro, neuroni opportunamente invecchiati potrebbero essere generati da cellule staminali per imitare la funzione neuronale legata all'età e utilizzati in combinazione con questi dispositivi compartimentati. Questi dispositivi faciliteranno la ricerca in malattie che colpiscono la salute degli assoni e funzionano come i deficit degli assoni nei neuroni di pazienti diagnosticati con disturbi dello spettro autistico e rigenerazione assonale dopo la lesione16,17.
Divulgazioni
S.P. e T.N. non dichiarano interessi finanziari concorrenti. V.P. è un dipendente di Xona Microfluidics, LLC. J.H. è membro della Xona Microfluidics, LLC. A.M.T. è un inventore della camera/chip microfluidico (US 7419822 B2, EPO 2719756 B1) ed è membro di Xona Microfluidics, LLC.
Riconoscimenti
Gli autori riconoscono il sostegno di Xona Microfluidics, LLC, l'Istituto Nazionale di Salute Mentale (R42 MH097377) e il National Institute of Neurological Disorders and Stroke (R41 NS108895, P30 NS045892). Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali dei National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Riferimenti
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of <em>In Vitro</em> Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611 (2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625 (2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon