Method Article
Compartmentalisation des neurones dérivés des cellules souches humaines dans des puces microfluidiques en plastique pré-assemblées
Dans cet article
Résumé
Ce protocole démontre l'utilisation de puces microfluidiques compartimentées, injection moulée dans un copolymère olefin cyclique aux neurones cultivés différenciés des cellules souches humaines. Ces puces sont préassemblées et plus faciles à utiliser que les dispositifs traditionnels compartimentés poly (diméthysiloxane). Plusieurs paradigmes expérimentaux communs sont décrits ici, y compris l'étiquetage viral, l'isolement fluidique, l'axotomie, et l'immunostaining.
Résumé
L'utilisation d'appareils microfluidiques pour compartimenter les neurones cultivés est devenue une méthode standard en neurosciences. Ce protocole montre comment utiliser une puce multi-compartiment pré-assemblée fabriquée dans un copolymère olefin cyclique (COC) pour compartimenter les neurones différenciés des cellules souches humaines. L'empreinte de ces puces COC est la même qu'une lame de microscope standard et est également compatible avec la microscopie à haute résolution. Les neurones sont différenciés des cellules souches neurales humaines (NSC) en neurones glutamatergiques dans la puce et maintenus pendant 5 semaines, ce qui laisse suffisamment de temps pour ces neurones de développer des synapses et des épines dendritiques. En outre, nous démontrons de multiples procédures expérimentales communes utilisant ces puces multi-compartiment, y compris l'étiquetage viral, établissant des microenvironnements, l'axotomy, et l'immunocytochimie.
Introduction
Les neurones différenciés par cellules souches humaines (hSC-neurones) sont de plus en plus utilisés pour la recherche biologique. Ces neurones, qui peuvent être dérivés de matériel de source humaine, sont d'un grand intérêt pour la recherche translationnelle, y compris l'étude des lésions cérébrales traumatiques et des troubles neurodégénératifs tels que la maladie d'Alzheimer. Ainsi, des outils pour améliorer et faciliter l'étude des hSC-neurones sont en demande.
Pour étudier la morphologie polarisée unique des neurones, de nombreux chercheurs utilisent des dispositifs microfluidiques multi-compartimentés1,2,3,4,5,6, 7,8,9,10,11. Ces dispositifs permettent des mesures et des manipulations de longs neurones de projection avec un accès sous-cellulaire unique. Les dispositifs microfluidiques multicompartimentisés se composent de deux compartiments microfluidiques parallèles séparés par des microgrooves, qui guident la croissance axonale. Les neurones ou les cellules souches neurales (CNS) sont plaqués dans le compartiment somatodendritic, puis adhèrent au fond de la surface du compartiment après quelques minutes. Les neurones différenciés se développent et étendent leurs axones/projections à travers la région de microgroove dans un compartiment axonal adjacent et isolé. Dans le passé, ces dispositifs étaient exclusivement fabriqués à l'aide de moulage poly (diméthylsiloxane) (PDMS). Les dispositifs PDMS ont de nombreux inconvénients précédemment décrits12, y compris l'hydrophobicité persistante et la nécessité d'assembler à un couvercle de verre immédiatement avant l'utilisation. Les puces moulées par injection pré-assemblées surmontent bon nombre de ces inconvénients et sont vendues commercialement (voir Tableau des matériaux)12. Les compartiments de ces puces sont rendus hydrophiles en permanence et la puce entière est moulée par injection en copolymère cyclique à nageoires optiques transparentes (COC).
Ce protocole démontre comment utiliser cette puce COC pour différencier les NSC humains en neurones excitatrices, et pour séparer et isoler fluidement leurs longues projections neuronales. Pour cette démonstration, les neurones ont été différenciés des cellules souches H9 approuvées par les NIH. Des procédures similaires peuvent être utilisées pour différencier les cellules souches pluripotentes induites par l'homme.
Protocole
REMARQUE : La figure 1A, B montre un schéma de la puce COC préassemblée, y compris l'emplacement des canaux ou compartiments principaux, des puits et des microgrooves. La puce compartimentée peut établir des microenvironnements fluides distincts dans un compartiment, comme le démontre l'isolement du colorant alimentaire (Figure 1C). Le protocole de préparation de la puce multi-compartimentpré e est donné à Nagendran et coll., Section 112.
1. Revêtement de puces multi-compartimentpour hSC-neurones
REMARQUE : La figure 2A montre un aperçu des procédures de revêtement.
- Dissoudre la poly-L-ornithine dans l'eau distillée de culture cellulaire pour faire 600 L de solution par puce d'une solution de travail de 20 g/mL.
- Aspirez le PBS restant à gauche après avoir préparé les jetons des puits. Lors de l'aspiration, assurez-vous que la pointe de la tuyauterie est éloignée de l'ouverture du canal.
REMARQUE : Les canaux microfluidiques doivent rester remplis pendant toute la durée de cette procédure. N'aspirez pas de liquide des canaux/compartiments, seulement des puits. - Chargez 150 L de solution de travail poly-L-ornithine dans le puits supérieur droit. Attendez 90 s ou jusqu'à ce que le liquide commence à remplir le puits inférieur droit. Ajouter 150 l de support en bas à droite et attendre 5 min pour laisser passer le liquide à travers les microgrooves.
- Ajouter 150 l de support en haut à gauche. Attendez 90 s, puis ajoutez 150 L au puits inférieur gauche. Envelopper le support de la puce avec du parafilm et le placer à 4 oC pendant la nuit.
REMARQUE : Sinon, placez la puce et le support à 37 oC pendant 1 h. - Aspirez les médias des puits, en veillant à ce que la pointe de la tuyauterie soit placée loin de l'ouverture du canal. Ajouter 150 l'eau stérile au puits supérieur droit. Attendez 90 s, puis ajoutez 150 L au puits inférieur droit. Attendez 5 min pour laisser passer le liquide à travers les microgrooves.
- Ajouter 150 l d'eau stérile au puits supérieur gauche, attendre 90 s, puis ajouter 150 l au puits inférieur gauche.
- Répétez les étapes 1.5-1.6.
- Décongeler la laminine lentement à 2 oC à 8 oC et préparer une solution de travail de 10 g/mL.
- Chargez 150 l de la solution de travail de laminin e au puits supérieur droit. Attendez 90 s ou jusqu'à ce que le liquide commence à remplir le puits inférieur droit. Pipet 150 l vers le puits inférieur droit. Attendez 5 min pour laisser passer la laminine à travers les microgrooves.
- Ajouter 150 ll de laminin en haut à gauche. Attendez 90 s, puis ajoutez 150 L au puits inférieur gauche. Incuber la puce à l'intérieur de son support pendant 2 h à 37 oC.
- Rincer la puce avec PBS (sans Ca2 et Mg2). Chargez 150 L de PBS vers le puits supérieur droit. Attendez 90 s ou jusqu'à ce que le liquide commence à remplir le puits inférieur droit. Ajouter 150 L de PBS au puits inférieur droit et attendre 5 min pour laisser passer le PBS à travers les microgrooves.
- Pipet 150 'L de PBS à la partie supérieure gauche. Après 90 s pipet 150 L vers le puits inférieur gauche.
- Aspirez PBS à partir de la puce, puis rincez la puce avec les médias NSC (voir Tableau des matériaux). Chargez 150 l de support vers le haut à droite. Après 90 s ou lorsque le liquide passe par le canal droit dans le puits inférieur droit, ajouter 150 L au puits inférieur droit. Attendez 5 min pour laisser les médias circuler à travers les microgrooves.
- Ajouter 150 l de support au puits supérieur gauche et 150 l au puits inférieur gauche. Incuber la puce dans un incubateur de 37 oC avec 5 % de CO2 pour préconditionner la puce jusqu'à ce qu'elle soit prête à ensemencer les CNS.
REMARQUE : Les copeaux peuvent être conditionnés pendant la nuit si nécessaire.
2. Ensemencement des CNS dans la puce multi-compartiments
REMARQUE : Ce protocole utilisait des CNS achetés commercialement, contrairement à notre publication précédente qui commençait avec des cellules souches embryonnaires humaines5. Dans ce protocole, les cellules souches neurales sont plaquées directement dans les puces plastiques où elles se différencient en neurones. Les cellules peuvent proliférer sous forme de NSC (sans différenciation) jusqu'à 2 passages et stockées dans des flacons dans le liquide N2 pour une utilisation ultérieure. Ce protocole utilise des flacons NSC stockés dans le liquide N2 après le passage 1 ou 2. La figure 2B montre un aperçu des procédures de revêtement.
- Décongeler les CNS selon les instructions du fabricant.
REMARQUE : Cette procédure s'applique aux CNS dérivés du H9. D'autres lignées cellulaires nécessiteront une optimisation de la densité cellulaire. - Comptez la concentration cellulaire à l'aide d'un hémocytomètre et ajustez-les à l'aide de supports NSC pour obtenir une concentration de 7 x 106 cellules par mL.
- Aspirez les médias de chaque puits de la puce. Évitez d'aspirater les médias à partir des canaux principaux.
- Pipet 5 l de la solution cellulaire au puits supérieur droit, suivi de 5 l à la droite inférieure (70 000 cellules au total). Assurez-vous que les cellules sont canalées vers les ouvertures du canal principal. Utilisez un microscope pour vérifier que les cellules sont entrées dans le canal. Attendez 5 min pour que les cellules adhèrent au fond de la puce.
REMARQUE : L'un ou l'autre des compartiments ou les deux peuvent être utilisés pour charger des cellules. - Pipet 150 'L de nSC médias à la droite supérieure bien, puis 150 L vers le puits inférieur droit. Répéter l'opération sur le côté gauche. Incuber à 5% de CO 2, 37 oC dans un contenant humidifié approprié.
- Après 48 heures, aspirez les supports NSC des puits et remplacez-les par des supports de différenciation neuronale en ajoutant 150 L à chaque puits supérieur et à chaque puits de fond.
- Neurones de culture dans un incubateur de 5% co2, 37 oC dans un récipient humidifié approprié.
REMARQUE : Les médias doivent être remplacés tous les 2-3 jours. En raison des petits volumes utilisés dans la puce, l'évaporation même à l'intérieur d'un incubateur humidifié peut avoir un impact important sur la viabilité des cellules. Utilisez un contenant secondaire approprié pour fournir une humidité supplémentaire pour la culture à long terme des cellules avec la puce (voir tableau des matériaux).
3. Étiquetage fluorescent viral des neurones hSC dans la puce
REMARQUE : Plusieurs virus peuvent être utilisés pour étiqueter les neurones de la puce. Les instructions ci-dessous décrivent l'utilisation du virus de la rage-mCherry ou du virus eGFP supprimé par G. Les matériaux potentiellement infectieux doivent être manipulés conformément aux règles et règlements applicables et peuvent nécessiter une formation supplémentaire et l'approbation institutionnelle.
- Réchauffer 400 euros de supports de différenciation neuronale frais par puce à 37 oC.
- Retirez 50 l de support d'un puits du compartiment d'axone dans un tube de centrifugeuse, puis ajoutez 100 000 unités virales du virus de la rage modifié au tube.
REMARQUE : Disposer correctement les pointes de pipet suséies et les tubes centrifugeuses contenant le virus. - Retirez le reste du support de différenciation neuronale du compartiment axonal et placez-le dans un tube de centrifugeuse. Conserver à 37 oC.
REMARQUE : Assurez-vous que les canaux restent remplis de liquide. - Mélanger les 50 l'une de la solution de virus avec 150 l de supports réchauffés. Pipet 100 l à un puits du compartiment d'axone et 100 l à l'autre compartiment d'axone bien. Incuber pendant 2 h dans un incubateur de 37 oC.
REMARQUE : La différence de volumes entre les compartiments axonal et somatique permet de s'assurer que le virus reste dans le compartiment axonal pendant les périodes d'infection/incubation. - Retirez et jetez les médias contenant des virus.
CAUTION: Ne pas enlever le liquide dans les canaux microfluidiques fermés. - Doucement pipet 75 'L de médias frais à un compartiment d'axone bien et laisser le flux de médias à travers le canal dans d'autres axone bien.
- Retirer les supports du compartiment axone et disposer correctement.
- Répétez les étapes 3.6 et 3.7.
- Remplissez le compartiment axone avec les supports enregistrés. Pipet un autre 50 'L médias frais, si nécessaire, puis retourner la puce à l'incubateur. Ce nouveau média supplémentaire est de compter pour la perte de médias lors du transfert de liquide et l'évaporation au cours du processus.
REMARQUE : L'étiquetage fluorescent visible à l'aide de ces virus de la rage modifiés se produit par 48 h et jusqu'à 8 jours après quoi la mort cellulaire des neurones infectés se produit généralement en raison de la toxicité du virus. L'imagerie neuronale peut être effectuée comme avec d'autres plates-formes de culture standard (par exemple, les plats en verre), mais une attention particulière est nécessaire pour maintenir une humidité suffisante pour prévenir les pertes d'évaporation.
4. Isolement fluidique, axotomie et immunostaining dans la puce
- Suivez l'isolement fluide, l'axotomie et l'immunostaining avec la puce telle que décrite dans Nagendran et al.12.
Résultats
Après une semaine (7-10 jours) dans la puce avec des supports de différenciation, les CNS se différencient en neurones et les projections neuronales pénètrent dans le compartiment axonal (Figure 3). Dans la puce, les neurones se fixent et se répartissent uniformément dans le compartiment somatique. En comparaison, les neurones des dispositifs PDMS s'agglutinent dès 5 jours après l'ajout de supports de différenciation, ce qui entraîne des problèmes de santé cellulaire comme on peut le voir dans la figure 3B (image agrandie du jour 13). Les neurones dans les puces semblent sains avec des axones groupés. Les neurones sains peuvent être maintenus dans les puces pendant 4-5 semaines.
Pour visualiser la maturation des neurones et le développement de la colonne vertébrale dendritique, le virus de la rage modifié a été livré au compartiment axonal au jour 29 pour rétrogradeneurones étiquette, y compris les épines dendritiques, avec la protéine fluorescente mCherry. Quatre jours après l'infection de virus de la rage, les neurones prolongeant des axones dans le compartiment axonal ont exprimé mCherry. Les neurones au jour de différenciation 33 ont montré la formation des épines dendritiques (figure 4). La visualisation des épines dendritiques démontre que les neurones dérivés du NSC différenciés dans les puces forment des synapses matures.
La puce multi-compartiment est également compatible avec l'immunocytochimie pour visualiser la localisation cellulaire des protéines. Après 26 jours de maintien des neurones dans les médias de différenciation, les neurones ont été étiquetés pour le marqueur synaptique excitateur, vGlut1 (Figure 5). Ces résultats montrent que les neurones étiquetés viralement colocalisent avec vGlut1 (Figure 5E) et marqueur spécifique aux neurones, '-tubulin III (figure 5F-H).
La capacité de créer des microenvironnements distincts isolés aux axones a également été démontrée à l'aide d'hydrazide Alexa Fluor 488, un colorant fluorescent de faible poids moléculaire (figure6).
Les études sur les blessures d'Axon sont généralement effectuées dans des dispositifs compartimentés. Une expérience de preuve de principe a été réalisée pour blesser sélectivement les axones de neurones différenciés avec la puce COC pré-assemblée (Figure 7). Les résultats étaient équivalents aux dispositifs compartimentés en silicone6,13,14.

Figure 1 : La puce microfluidique microfluidique pré-assemblée coc, multi-compartiments. (A) Un dessin de la puce identifiant les puits supérieurs et inférieurs. La taille de la puce est de 75 mm x 25 mm, la taille des lames de microscope standard. (B) Un zoom dans la région montrant les canaux et les microgrooves séparant les canaux. Des détails supplémentaires sont fournis dans Nagendran et al.12. (C) Cette photographie illustre la création de microenvironnements isolés dans chaque compartiment à l'aide de colorant alimentaire. Ce chiffre entier a été reproduit à partir de 12. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
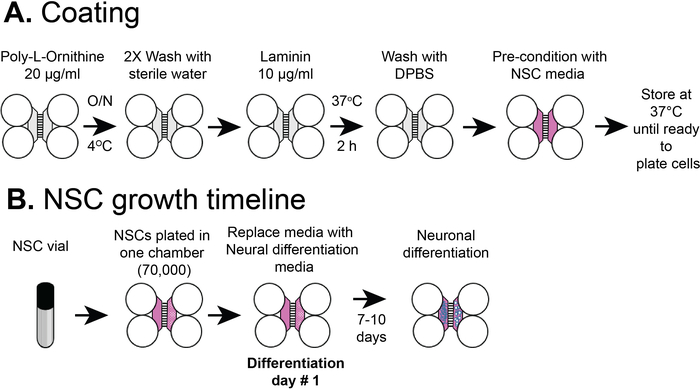
Figure 2 : Revêtement de copeaux compartimenté en plastique et calendrier de placage cellulaire NSC. (A) Les copeaux multicompartiments en plastique ont été recouverts d'une solution de pré-enrobage, puis de poly-L-ornithine et de lamininine avant d'être préconditionnés avec des supports NSC. (B) Les CNS ont été plaqués avec 7 x 104 cellules dans le compartiment somatique de la puce. Les cellules ont été cultivées dans les médias NSC pendant 24 h, puis les médias ont été remplacés par des supports de différenciation neuronale. Des neurones différenciés ont été observés par 7-10 jours après différenciation. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : comparaison de la croissance des neurones hSC dans les puces et les dispositifs PDMS. (A) Une image de contraste de phase des hSC-neurones cultivés à 13 jours après différenciation dans la puce multi-compartiment en plastique. (B) Un zoom dans la région de hSC-neurones cultivés dans la boîte blanche dans (A) et une région équivalente dans un dispositif PDMS (à droite). hSC-neurones dans les puces se fixent bien. Des amas de neurones agrégés se forment dans des dispositifs basés sur le PDMS. Représentant de 2 expériences indépendantes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
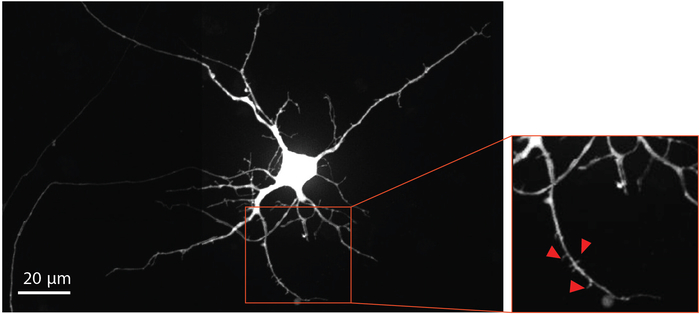
Figure 4 : Les neurones dérivés du NSC humain montrent la morphologie de la colonne vertébrale dendritique. Rétrograde étiqueté mCherry neurone au jour de différenciation 33 cultivé dans la puce. La région agrandie décrite en rouge, met en évidence la présence d'épines dendritiques, qui fournissent des preuves soutenant le développement des synapses glutamatergiques mûres. Les flèches rouges pointent vers les épines dendritiques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
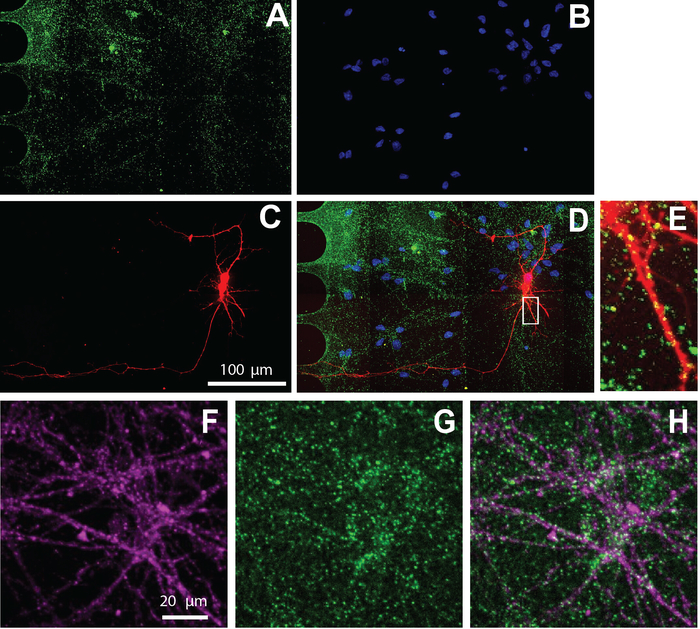
Figure 5 : Les neurones dérivés du NSC humains cultivés dans les puces présentent des synapses excitatrices. L'immunostaining a été exécuté au jour de différenciation 26. La formation image de neurone a été exécutée dans le compartiment somatique. A) vGlut1 (vert) et (B) DAPI (bleu) immunolabeling. (C) mCherry-labeled neurons (red) retrograde labeled using a modified rabies virus. (D) Une micrographie fluorescente fusionnée de (A-C). (E) Épines dendritiques et ponctua positive vGlut1 colocalisé avec des dendrites mCherry-positives, montrées dans un zoom dans la région de (D). Micrographies d'immunofluorescence de (F) marqueur spécifique de neurone, '-tubulin III (magenta), et (G) vGlut1 (vert). (H) La mise au-dessus de la tubuline III et du vGlut1. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Les neurones mCherry transmis viralement étendent les projections dans un microenvironnement localisé à l'axone établi dans la puce COC préassemblée. (A) mCherry neuron étiqueté étendre les axones à travers les microgrooves de la puce et dans un compartiment d'axone isolé. L'isolement du compartiment axone est visualisé à l'aide d'hydrazide Alexa Fluor 488. L'imagerie des neurones s'est produite au jour de différenciation 26 et 3 jours après infection avec le virus modifié de rage. (B) L'image de fluorescence dans (A) est fusionnée avec une image DIC. Notez l'emplacement des microgrooves. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Axotomie réalisée à l'intérieur de la puce multi-compartiments COC. (A) mCherry les neurones étiquetés au jour de différenciation 33 ont été imaged avant l'axotomie. Table de recherche couleur 'Fire'. (B) Immédiatement après l'axotomie, montrant que les axones sont complètement coupés. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Puces multi-compartiments en plastique | Dispositifs multicompartiment PDMS |
| isoler les axones | isoler les axones |
| établir des microenvironnements | établir des microenvironnements |
| axotomiser les neurones | axotomiser les neurones |
| optiquement transparente | optiquement transparente |
| compatible avec l'imagerie haute résolution | compatible avec l'imagerie haute résolution |
| compatible avec la microscopie à fluorescence | compatible avec la microscopie à fluorescence |
| entièrement assemblé | assemblage au substrat requis |
| axones sains -21 jours | axones sains 'gt;14 jours |
| surface de culture hydrophile | Hydrophobe |
| gaz imperméable | gaz perméable |
| microgrooves et canaux arrondis | microgrooves droites |
| non compatible avec l'ablation au laser | Peut être utilisé pour l'ablation au laser lorsque les chambres PDMS sont assemblées sur des diapositives spéciales compatibles d'ablation laser. |
| l'appareil ne peut pas être modifié pour supprimer le | le dessus est amovible pour la coloration dans les microgrooves |
| non compatible avec les huiles d'immersion à base d'huile minérale (les huiles à base de silicone sont fines) | compatible avec les huiles d'immersion à base d'huile minérale |
| imperméable aux petites molécules et solvants organiques | l'absorption de petites molécules et de solvants organiques |
| Aucun problème de fuite avec la puce | revêtement avec poly-L-ornithine et laminine faire les dispositifs fuite |
| les neurones différenciés restent uniformément distribués (4 semaines) aux densités cellulaires testées | neurones différenciés commencent à s'agréger après 3-4 jours dans la culture aux densités cellulaires testées |
Tableau 1 : Comparaison de puces COC multi-compartiments et d'appareils en silicone pour la culture des neurones
Discussion
La puce COC multi-compartiments préassemblée est une plate-forme compartimentée facile à utiliser pour différencier et maintenir les NSC humains en neurones pendant une longue période(m. Dans ce protocole, nous démontrons la différenciation des NSC humains en neurones glutamatergiques, neurones rétrogrades d'étiquette, effectuons l'immunocytochimie, visualisons la morphologie dendritique de la colonne vertébrale et effectuons l'axotomie. Ces puces sont compatibles avec l'imagerie à haute résolution et il n'y a pas d'autofluorescence avec le COC12.
Les puces multi-compartiments COC sont fonctionnellement équivalentes aux dispositifs compartimentés à base de silicone, et ont des avantages et des inconvénients comme décrit précédemment12. Le tableau 1 compare les puces COC multi-compartiments et les dispositifs en silicone pour la culture des neurones hSC. Les copeaux compartimentés coC offrent une meilleure surface hydrophile pour l'attachement et l'entretien des cellules souches sur une longue période de culture. Les dispositifs à base de PDMS doivent être assemblés et fixés aux couvercles en verre. La nature hydrophobe des dispositifs PDMS provoquel'agrégation des cellules souches 5; ceci mène aux deux défis dans l'imagerie au niveau cellulaire et à une plus grande susceptibilité aux dommages physiques dus au mouvement des agrégats cellulaires pendant des changements de médias. La puce en plastique surmonte ces défis. Le COC est imperméable au gaz, contrairement au PDMS, de sorte que les poches d'air emprisonnées ou formées dans les canaux doivent être enlevées par l'utilisateur. La solution de pré-enrobage réduit la possibilité pour l'air de se coincer dans les canaux. Cette solution se compose d'éthanol et d'autres agents. Un protocole précédemment publié pour la culture des neurones murines dans ces puces en plastique fournit des détails supplémentaires sur les cellules pipetting et les médias dans les puces12. Les CNS sont plus fragiles que les neurones murins, donc doivent être manipulés plus doucement. Il est également essentiel de bien mélanger les cellules souches avant de les placage en les faisant doucement monter et descendre.
L'utilisation de neurones dérivés de cellules souches humaines différenciées in vitro est de plus en plus populaire en médecine et en recherche. Ces neurones sont importants pour la recherche et les applications cliniques pour de nombreux troubles du SNC, y compris les maladies neurodégénératives et les lésions cérébrales traumatiques. Ces neurones ressemblent étroitement aux neurones fœtaux humains15. À l'avenir, des neurones bien vieillis pourraient être générés à partir de cellules souches pour imiter la fonction neuronale liée à l'âge et utilisés en conjonction avec ces dispositifs compartimentés. Ces dispositifs faciliteront la recherche dans les maladies affectant la santé et la fonction d'axone telles que des déficits d'axone dans des neurones des patients diagnostiqués avec des désordres de spectre d'autisme et la régénération axonale après la blessure16,17.
Déclarations de divulgation
S.P. et T.N. ne déclarent aucun intérêt financier concurrent. V.P. est un employé de Xona Microfluidics, LLC. J.H. est membre de Xona Microfluidics, LLC. A.M.T. est un inventeur de la chambre microfluidique /puce (US 7419822 B2, EPO 2719756 B1) et est membre de Xona Microfluidics, LLC.
Remerciements
Les auteurs reconnaissent le soutien de Xona Microfluidics, LLC, le National Institute of Mental Health (R42 MH097377), et le National Institute of Neurological Disorders and Stroke (R41 NS108895, P30 NS045892). Le contenu est uniquement de la responsabilité des auteurs et ne représente pas nécessairement les vues officielles des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Références
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon