Method Article
Compartimentalização de neurônios derivados de células-tronco humanas dentro de chips de plástico Microfluídico pré-montados
Neste Artigo
Resumo
Este protocolo demonstra o uso de microplaquetas microfluídicos compartimentadas, injeção moldada em um copolímero cíclico do olefinas aos neurônios cultivados diferenciados das pilhas de haste humanas. Estes chips são pré-montados e mais fáceis de usar do que os tradicionais dispositivos de poli (dimetilsiloxano) compartimentalizados. Vários paradigmas experimentais comuns são descritos aqui, incluindo a rotulagem viral, o isolamento fluídico, a axotomia e a imunocoloração.
Resumo
O uso de dispositivos microfluílicos para compartimentalizar os neurônios cultivados tornou-se um método padrão na neurociência. Este protocolo mostra como usar uma microplaqueta pre-assembled do multi-compartimento feita em um copolímero cíclico do olefinas (COC) para compartimentar os neurônios diferenciados das pilhas de haste humanas. A pegada destas microplaquetas de COC é a mesma que uma corrediça padrão do microscópio e é ingualmente compatível com a microscopia de alta resolução. Os neurônios são diferenciados de células-tronco neurais humanas (NSCs) em neurônios glutamatérgicos dentro do chip e mantidas por 5 semanas, permitindo tempo suficiente para que esses neurônios desenvolvam sinapses e espinhas dendríticas. Além disso, demonstramos vários procedimentos experimentais comuns usando esses chips multicompartimento, incluindo a rotulagem viral, estabelecendo microambientes, axotomia e imunocioquímica.
Introdução
Os neurônios diferenciados da pilha de haste humana (hSC-neurônios) são usados cada vez mais para a pesquisa biológica. Esses neurônios, que podem ser derivados de material de origem humana, são de grande interesse para a pesquisa translacional, incluindo o estudo de lesões cerebrais traumáticas e distúrbios neurodegenerativos, como a doença de Alzheimer. Assim, ferramentas para melhorar e facilitar o estudo de hSC-neurônios estão na demanda.
Para estudar a morfologia polarizada única dos neurônios, muitos pesquisadores usam dispositivos microfluílicos multicompartimentalizados1,2,3,4,5,6, 7,8,9,10,11. Esses dispositivos permitem medições e manipulações de neurônios de projeção longa com acesso subcelular exclusivo. Os dispositivos microfluílicos multicompartimentalizados consistem em dois compartimentos microfluílicos paralelos separados por microranhuras, que orientam o crescimento axonal. Neurônios ou células-tronco neurais (NSCs) são chapeados no compartimento somatodendrítico e, em seguida, aderir à parte inferior da superfície do compartimento após minutos. Os neurônios diferenciados crescem e estendem seus axônios/projeções através da região do microsulco em um compartimento axonal adjacente e isolado. No passado, estes dispositivos foram feitos exclusivamente usando poli (dimetilsiloxano) (PDMS) de moldagem por réplica. Os dispositivos de PDMS têm muitos inconvenientes descritos previamente12, incluindo o hidrofobicidade persistente e a necessidade de montar a um lamela de vidro imediatamente antes do uso. As microplaquetas moldadas injeção pre-montadas superam muitas destas desvantagens e são vendidas comercialmente (veja a tabela dos materiais)12. Os compartimentos destas microplaquetas são feitos permanentemente hidrófilo e a microplaqueta inteira é injeção moldada no copolímero cíclico opticamente transparente do olefinas (COC).
Este protocolo demonstra como usar esta microplaqueta de COC para diferenciar NSCS humanos em neurônios excitatórios, e para separar e isolar cria suas projeções neuronal longas. Para essa demonstração, os neurônios foram diferenciados das células-tronco de H9 aprovadas pela NIH. Os procedimentos similares podem ser usados para diferenciar as pilhas de haste pluripotentes induzidas humanas.
Protocolo
Nota: a Figura 1a, B mostra um esquema do chip COC pré-montado, incluindo os locais dos principais canais ou compartimentos, poços e microranhuras. O chip compartimentalizado pode estabelecer microambientes fluídico distintos dentro de um compartimento como demonstram o isolamento da coloração corante alimentar (Figura 1C). O protocolo para a preparação do chip multicompartimento pré-montado é dado em Nago et al., seção 112.
1. revestimento de multi-compartimento de chips para hSC-neurônios
Nota: a Figura 2a mostra uma visão geral dos procedimentos de revestimento.
- Dissolva a poli-L-ornitina em água destilada de grau de cultura celular para fazer 600 μL de solução por chip de uma solução de trabalho de 20 μg/mL.
- Aspirar a PBS restante à esquerda depois de preparar as fichas dos poços. Ao aspirar, assegure-se de que a ponta do Pipet esteja longe da abertura do canal.
Nota: os canais microfluílicos devem permanecer preenchidos para a totalidade deste procedimento. Não aspirar líquido dos canais/compartimentos, apenas os poços. - Carga 150 μL de solução de trabalho de poli-L-ornitina no poço direito superior. Aguarde 90 s ou até que o líquido começa a encher o poço direito inferior. Adicione 150 μL de mídia ao poço inferior direito e aguarde 5 min para deixar o líquido passar pelos microgrooves.
- Adicione 150 μL de mídia ao poço esquerdo superior. Aguarde 90 s e, em seguida, adicione 150 μL à parte inferior esquerda bem. Enrole o suporte do chip (s) com parafilm e coloque a 4 ° c durante a noite.
Nota: Alternativamente, coloque o chip e o suporte a 37 ° c durante 1 h. - Aspirar a mídia dos poços, assegurando que a ponta Pipet é colocada longe da abertura do canal. Adicione 150 μL de água estéril ao poço direito superior. Aguarde 90 s e, em seguida, adicione 150 μL à direita inferior bem. Aguarde 5 min para deixar o líquido passar através dos microgrooves.
- Adicione 150 μL de água estéril ao poço esquerdo superior, aguarde 90 s e, em seguida, adicione outro 150 μL ao poço inferior esquerdo.
- Repita os passos 1.5-1.6.
- Descongelar a laminina lentamente a 2 ° c a 8 ° c e preparar uma solução de trabalho de 10 μg/mL.
- Carregar 150 μL da solução de trabalho de laminina para o poço superior direito. Aguarde 90 s ou até que o líquido começa a encher o poço direito inferior. Pipet 150 μL para a parte inferior direita bem. Aguarde 5 min para deixar a laminina passar pelos microgrooves.
- Adicionar 150 μL de laminina ao poço superior esquerdo. Aguarde 90 s e, em seguida, adicione 150 μL à parte inferior esquerda bem. Incubar a microplaqueta dentro de seu suporte para 2 h em 37 ° c.
- Enxague o chip com PBS (sem CA2 + e mg2 +). Carregar 150 μL de PBS para o canto superior direito. Aguarde 90 s ou até que o líquido começa a encher o poço direito inferior. Adicione 150 μL de PBS ao poço inferior direito e aguarde 5 min para deixar o PBS passar pelas microranhuras.
- Pipet 150 μL de PBS para a parte superior esquerda bem. Depois de 90 s Pipet 150 μL para o poço esquerdo inferior.
- Aspirar PBS do chip e, em seguida, enxaguar o chip com NSC Media (ver tabela de materiais). Carregar 150 μL de suportes para o canto superior direito. Após 90 s ou quando o líquido passa através do canal direito no poço direito mais baixo, adicione 150 μL à direita mais baixa bem. Aguarde 5 min para deixar a mídia fluir através dos microgrooves.
- Adicione 150 μL de mídia ao poço esquerdo superior e outro 150 μL ao poço esquerdo inferior. Incubar o chip em uma incubadora de 37 ° c com 5% de CO2 para pré-condicionar o chip até estar pronto para semente de NSCS.
Nota: os chips podem ser pré-condicionados durante a noite, se necessário.
2. semeando NSCs na microplaqueta do multicompartimento
Nota: Este protocolo utilizado comercialmente comprado NSCs, ao contrário de nossa publicação anterior, que começou com células de hastes embrionárias humanas5. Neste protocolo as pilhas de haste neural são chapeadas diretamente nos chips plásticos onde se diferenciam em neurônios. As células podem ser autorizadas a proliferar como NSCs (sem diferenciação) para até 2 passagens e armazenadas em frascos em líquido N2 para uso posterior. Este protocolo utiliza frascos NSC armazenados no líquido N2 após a passagem 1 ou 2. A Figura 2b mostra uma visão geral dos procedimentos de revestimento.
- Thaw NSCs de acordo com as instruções do fabricante.
Observação: este procedimento se aplica a H9-derivado NSCs. Outras linhas celulares exigirá otimização da densidade celular. - Conte a concentração celular usando um hemociômetro e ajuste usando a mídia NSC para obter uma concentração de 7 x 106 células por ml.
- Aspirar a mídia de cada poço do chip. Evite aspirantes a mídia dos canais principais.
- Pipet 5 μL da solução celular para o poço direito superior, seguido de 5 μL para o poço direito inferior (70.000 total de células). Certifique-se de que as células são pipetadas para as aberturas do canal principal. Use um microscópio para verificar se as células entraram no canal. Aguarde 5 minutos para as células aderirem à parte inferior do chip.
Observação: um ou ambos os compartimentos podem ser usados para carregar células. - Pipet ~ 150 μL de mídia NSC para o canto superior direito e, em seguida, 150 μL para o direito inferior bem. Repita no lado esquerdo. Incubar a 5% CO2, 37 ° c dentro de um recipiente humidificado adequado.
- Após 48 horas, aspirar mídia NSC dos poços e substituir com meios de diferenciação neural adicionando 150 μL para cada poço superior e cada poço inferior.
- Neurônios da cultura dentro de uma incubadora de 5% CO2, 37 ° c dentro de um recipiente humidificado apropriado.
Nota: a mídia deve ser substituída a cada 2-3 dias. Por causa dos volumes pequenos usados na microplaqueta, a evaporação mesmo dentro de uma incubadora humidificada pode impactar substancialmente a viabilidade da pilha. Use um recipiente secundário apropriado para fornecer a umidade adicional para a cultura a longo prazo das pilhas com a microplaqueta (veja a tabela de materiais).
3. rotulagem fluorescente viral de hSC-neurônios dentro do chip
Nota: o vírus múltiplo pode ser usado para etiquetar neurônios dentro do chip. As instruções abaixo descrevem o uso do vírus G-Deleted raiva-mCherry ou – eGFP. Materiais potencialmente infecciosos devem ser manipulados de acordo com as regras e regulamentos aplicáveis, podendo requerer treinamento adicional e aprovação institucional.
- Aqueça ~ 400 μL de meios de diferenciação neural frescos por a microplaqueta a 37 ° c.
- Remova 50 μL dos meios de um poço do compartimento do AXON em um tubo de centrifugação e adicione 100.000 unidades virais do vírus de raiva modificado ao tubo.
Nota: descarte corretamente as pontas de Pipet gastas e os tubos de centrifugação contendo vírus. - Retire os suportes de diferenciação neural restantes do compartimento axonal e coloque-o num tubo de centrifugação. Conservar a 37 ° c.
Nota: Certifique-se de que os canais permanecem preenchidos com líquido. - Misture o 50 μL de solução de vírus com 150 μL de meios aquecidos. Pipet 100 μL a um poço do compartimento do AXON e 100 μL ao outro compartimento do AXON bem. Incubar por 2 h dentro de uma incubadora de 37 ° c.
Nota: a diferença de volumes entre os compartimentos axonal e somático ajuda a garantir que o vírus permaneça no compartimento axonal durante os tempos de infecção/incubação. - Retire e elimine os suportes contendo vírus.
PRECAUÇÃO: não retire o líquido dentro dos canais microfluílicos fechados. - Gentilmente Pipet 75 μL de mídia fresca para um compartimento AXON bem e deixar a mídia fluir através do canal em outro AXON bem.
- Remova a mídia do compartimento do AXON e descarte-a corretamente.
- Repita as etapas 3,6 e 3,7.
- Encha o compartimento do AXON com os meios conservados. Pipet um adicional 50 μL de mídia fresca, se necessário, e depois devolver o chip para a incubadora. Esta mídia fresca adicional é contar para a perda de mídia durante a transferência líquida e evaporação durante o processo.
Nota: a rotulagem fluorescente visível que usa estes vírus de raiva modificados ocorre por 48 h e até 8 dias depois que a morte de pilha de neurônios contaminados ocorre geralmente devido à toxicidade do vírus. A imagem latente de Neuron pode ser executada como com outras plataformas padrão da cultura (por exemplo, pratos inferiores de vidro), mas a consideração especial é precisada de manter a umidade suficiente para impedir perdas evaporativas.
4. isolamento fluídico, axotomia, e imunocoloração dentro do chip
- Siga o isolamento fluídico, a axotomia e a imunocoloração com o chip, conforme descrito em Nago et al.12.
Resultados
Após uma semana (7-10 dias) no chip com meios de diferenciação, as NSCs diferenciam-se em neurônios e projeções neuronais entram no compartimento axonal (Figura 3). Dentro do chip, os neurônios se unem e distribuem uniformemente dentro do compartimento somático. Em comparação, os neurônios em dispositivos PDMS Clump/agregado tão cedo quanto 5 dias após a adição de meios de diferenciação, levando à saúde celular comprometida como pode ser visto na Figura 3B (dia 13 imagem ampliada). Os neurônios nas microplaquetas olham saudáveis com axônios empacotados. Os neurônios saudáveis podem ser mantidos dentro dos chips por 4-5 semanas.
Para visualizar a maturação do neurônio e o desenvolvimento da coluna dendrítica, o vírus da raiva modificado foi entregue ao compartimento axonal no dia 29 para os neurônios de rótulo retrógrado, incluindo espinhos dendríticos, com proteína fluorescente de mCherry. Quatro dias após a infecção do vírus da raiva, os neurônios que estendem axônios no compartimento axonal expressaram mCherry. Os neurônios no dia de diferenciação 33 mostraram formação de espinhas dendríticas (Figura 4). Visualização de espinhos dendríticos demonstra que os neurônios derivados do NSC diferenciados dentro dos chips formam sinapses maduros.
A microplaqueta do multi-compartimento é igualmente compatível com o Immunocytochemistry para visualizar a localização celular da proteína. Após 26 dias de manutenção dos neurônios em meios de diferenciação, os neurônios foram rotulados para o marcador sináptico excitatória, vGlut1 (Figura 5). Estes resultados mostram que os neurônios virally etiquetados colocalizam com vGlut1 (Figura 5E) e marcador específico do neurônio, β-TUBULIN III (Figura 5F-H).
A capacidade de criar microambientes distintos isolados aos axônios também foi demonstrada usando Alexa fluor 488 hidrazida, um corante fluorescente de baixo peso molecular (Figura 6).
Os estudos de ferimento de AXON são executados geralmente dentro dos dispositivos compartimentada. Um experimento de prova de princípio foi realizado para ferir seletivamente os axônios de neurônios diferenciados com o chip COC pré-montado (Figura 7). Os resultados foram equivalentes aos dispositivos de silicone compartimentalizados6,13,14.

Figura 1: o COC pré-montado, chip microfluídico multicompartimento. (A) um desenho da microplaqueta que identifica os poços superiores e mais baixos. O tamanho da microplaqueta é 75 milímetros x 25 milímetros, o tamanho de corrediças padrão do microscópio. (B) um zoom na região que mostra os canais e ranhuras separando os canais. Detalhes adicionais são fornecidos em Nago et al.12. (C) esta fotografia ilustra a criação de microambientes isolados dentro de cada compartimento com corante alimentar. Este número inteiro foi reproduzido de 12. Por favor clique aqui para ver uma versão maior desta figura.
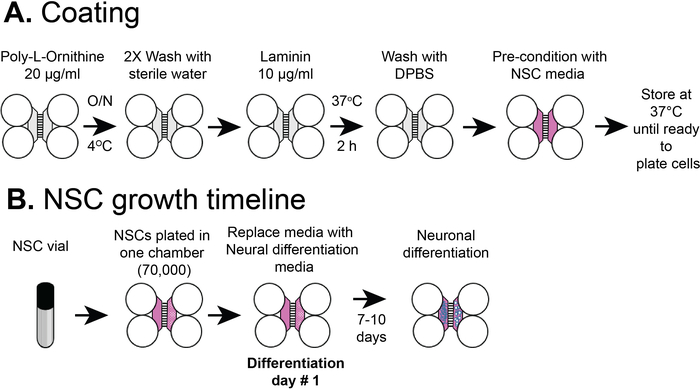
Figura 2: revestimento compartimentalizado plástico da microplaqueta e linha do tempo do chapeamento de pilha de NSC. (A) as microplaquetas plásticas do multicompartimento foram revestidas com uma solução do pre-revestimento, e então poli-L-ornithine e laminina antes de pre-condicionamento com meios de NSC. (B) as NSCS foram banhadas com 7 x 104 células no compartimento somático do chip. As células foram cultivadas em mídia NSC por 24 h e, em seguida, a mídia foi substituída por meios de diferenciação neural. Os neurônios diferenciados foram observados por 7-10 dias após a diferenciação. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: comparação do crescimento do hSC-Neuron em chips e dispositivos PDMS. (A) uma imagem de contraste de fase de HSC-neurônios cultivadas aos 13 dias após a diferenciação no chip multicompartimento de plástico. (B) um ampliada na região de HSC-neurônios cultivados dentro da caixa branca em (a) e uma região equivalente dentro de um dispositivo PDMS (direito). hSC-neurônios dentro dos chips anexar bem. Clusters de Neurons agregados formam em dispositivos baseados em PDMS. Representante de 2 experimentos independentes. Por favor clique aqui para ver uma versão maior desta figura.
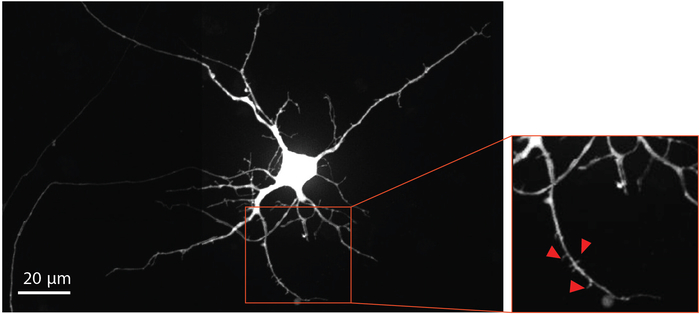
Figura 4: neurônios derivados do NSC humano mostram morfologia da coluna dendrítica. Retrógrado rotulado neurônio mcherry no dia de diferenciação 33 cresceu dentro do chip. A região ampliada delineada em vermelho, destaca a presença de espinhos dendríticos, que fornecem evidências que apoiam o desenvolvimento de sinapses glutamatérgicas maduras. As setas vermelhas apontam para espinhas dendríticas. Por favor clique aqui para ver uma versão maior desta figura.
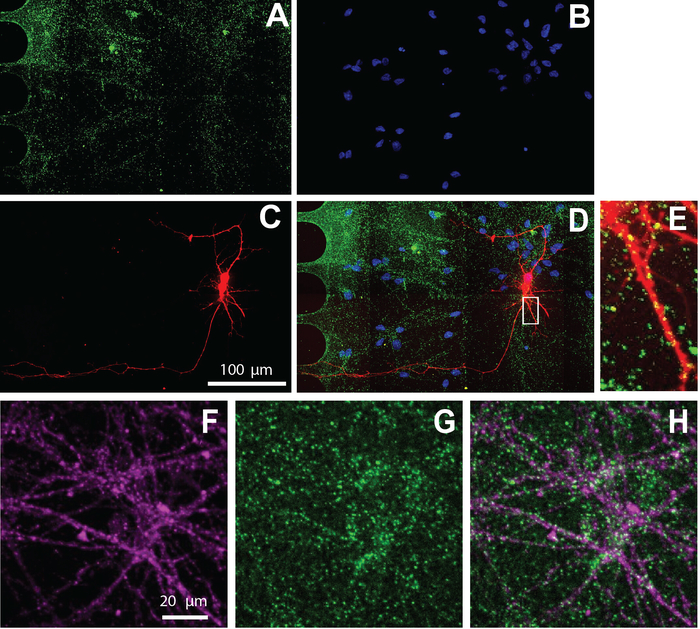
Figura 5: neurônios derivados do NSC humano cultivados dentro de fichas exibem sinapses excitatórias. A imunocoloração foi realizada no dia 26 de diferenciação. A imagem latente do Neuron foi executada no compartimento somático. A) vGlut1 (verde) e (B) DAPI (azul) Immunolabeling. (C) neurônios rotulados com mcherry (vermelho) retrógrado rotulado usando um vírus da raiva modificado. (D) uma micrografia fluorescente mesclada de (A-C). (E) espinhos dendríticos e Puncta vGlut1 positivo colocalizados com dendritos mcherry-positivos, mostrados em uma região ampliada de (D). Micrografias da imunofluorescência de (F) marcador específico do neurônio, β-tubulin III (magenta), e (G) vGlut1 (verde). (H) sobreposição de β-TUBULINA III e vGlut1. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: os neurônios virally Transvitimados de mCherry estendem projeções em um microambiente localizado no axônio estabelecido dentro do chip COC pré-montado. (A) o neurônio etiquetado mcherry estende axônios através dos ranhuras da microplaqueta e em um compartimento isolado do AXON. A isolação do compartimento do AXON é visualizada usando o hydrazide de Alexa fluor 488. A imagem latente dos neurônios ocorreu na diferenciação dia 26 e 3 dias após a infecção com o vírus de raiva modificado. (B) a imagem de fluorescência em (a) é mesclada com uma imagem DIC. Anote a localização das microranhuras. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7: Axotomia realizada no chip multicompartimento COC. (A) mcherry rotulados neurônios no dia de diferenciação 33 foram imaged antes da axotomia. Tabela de look-up de cor ' Fire '. (B) imediatamente após a axotomia, mostrando que os axônios estão completamente cortados. Por favor clique aqui para ver uma versão maior desta figura.
| Microplaquetas plásticas do multi-compartimento | Dispositivos multicompartimentos PDMS |
| isolar axônios | isolar axônios |
| estabelecer microambientes | estabelecer microambientes |
| neurônios axotomize | neurônios axotomize |
| opticamente transparente | opticamente transparente |
| compatível com imagem de alta resolução | compatível com imagem de alta resolução |
| compatível com microscopia de fluorescência | compatível com microscopia de fluorescência |
| totalmente montados | montagem à carcaça exigida |
| axônios saudáveis > 21 dias | axônios saudáveis > 14 dias |
| hidrofílico cultivando superfície | Hidrofóbico |
| gás impermeável | gás permeável |
| microranhuras arredondadas e canais | microranhuras retas |
| Não compatível com ablação a laser | Pode ser usado para a ablação do laser quando as câmaras de PDMS são montadas em corrediças compatíveis da ablação do laser especial. |
| dispositivo não pode ser alterado para remover | a parte superior é removível para manchar dentro dos ranhuras |
| Não é compatível com óleos minerais de imersão à base de óleo (óleos à base de silicone são finos) | compatível com óleos minerais de imersão à base de óleo |
| impermeáveis a pequenas moléculas e solventes orgânicos | absorção de pequenas moléculas & solventes orgânicos |
| Sem problemas de vazamento com o chip | revestimento com poli-L-ornitina e laminina fazer os dispositivos de vazamento |
| os neurônios diferenciados permanecem distribuídos uniformente (> 4 semanas) nas densidades testadas da pilha | os neurônios diferenciados começam a agregar após 3-4 dias na cultura nas densidades testadas da pilha |
Tabela 1: comparision de chips COC multicompartimento e dispositivos de silicone para a cultura de neurônios
Discussão
O chip de COC multicompartimento pré-montado é uma plataforma compartimentada fácil de usar para diferenciar e manter as NSCs humanas em neurônios para longo prazo (> 4 semanas). Neste protocolo, nós Demonstramos a diferenciação de NSCS humanos em neurônios glutamatérgico, os neurônios retrógrado da etiqueta, executam Immunocytochemistry, visualizam a morfologia dendríticas da espinha e executam a axotomia. Estes chips são compatíveis com imagens de alta resolução e não há autofluorescência com o COC12.
As microplaquetas do multi-compartimento de COC são funcionalmente equivalentes aos dispositivos compartimentalizados silicone-baseados, e têm benefícios e desvantagens como descrito previamente12. A tabela 1 compara chips COC multicompartimento e dispositivos de silicone para a cultura de neurônios HSC. Os chips compartimentalizados COC proporcionam uma superfície hidrofílica melhor para fixação e manutenção de células-tronco durante um longo período de cultura. Os dispositivos baseados em PDMS precisam ser montados e anexados a coberturas de vidro. A natureza hidrofóbica dos dispositivos PDMS provoca a agregação de células-tronco5; Isto conduz a ambos os desafios na imagem latente a nível celular e a uma maior susceptibilidade aos danos físicos devido ao movimento de agregados da pilha durante mudanças dos meios. O chip de plástico supera esses desafios. COC é impermeável a gás, ao contrário do PDMS, então os bolsos de ar presos ou formados dentro dos canais devem ser removidos pelo usuário. A solução de pré-revestimento reduz a possibilidade de o ar ficar preso nos canais. Esta solução consiste em etanol e outros agentes. Um protocolo previamente publicado para a cultura de neurônios murinos dentro desses chips de plástico fornece detalhes adicionais sobre as células de pipetagem e mídia dentro dos chips12. Os NSCs são mais frágeis que os neurônios murinos, portanto, devem ser manuseados com mais suavidade. É igualmente crítico misturar completamente as pilhas de haste antes de galvanizar delicadamente pipetando os acima e para baixo.
O uso de neurônios derivados de células-tronco humanas diferenciadas in vitro está se tornando cada vez mais popular na medicina e na pesquisa. Estes neurônios são importantes para a pesquisa e aplicações clínicas para muitos distúrbios do SNC, incluindo doenças neurodegenerativas e lesões cerebrais traumáticas. Estes neurônios assemelham-se intimamente aos neurônios fetais humanos15. No futuro, os neurônios apropriadamente envelhecidos podiam ser gerados das pilhas de haste para imitar a função neuronal age-related e usado conjuntamente com estes dispositivos compartimentalizados. Esses dispositivos facilitarão a pesquisa em doenças que afetam a saúde do axônio e funcionam como déficits de axônio em neurônios de pacientes diagnosticados com transtornos do espectro do autismo e regeneração axonal após lesão16,17.
Divulgações
S.P. e T.N. não declaram interesses financeiros concorrentes. VP é um funcionário da Xona Microfluidics, LLC. A JH é membro da Xona Microfluidics, LLC. A.M.T. é um inventor da câmara microfluídico/chip (US 7419822 B2, EPO 2719756 B1) e é um membro da Xona Microfluidics, LLC.
Agradecimentos
Os autores reconhecem o apoio da Xona Microfluidics, LLC, do Instituto Nacional de saúde mental (R42 MH097377), e do Instituto Nacional de distúrbios neurológicos e AVC (R41 NS108895, p30 NS045892). O conteúdo é unicamente da responsabilidade dos autores e não representa necessariamente os pontos de vista oficiais dos institutos nacionais de saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Referências
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados