Method Article
Ön montajlı plastik mikrofluidik cips içinde ınsan kök hücresi türeyen neurons compartmentalization
Bu Makalede
Özet
Bu protokol, bölümlenmiş mikrofluidik çiplerin kullanımını gösterir, insan kök hücrelerinden ayırt edilen kültürlü nöronlara döngüsel olefin kopolimer enjeksiyon kalıplı. Bu cips önceden montajlı ve daha kolay-geleneksel bölümleşmiş Poly (dimetilsiloxane) cihazlar daha kullanımı. Viral etiketleme, fluidik izolasyon, akotomi ve immünostasyon gibi çoklu yaygın deneysel paradigmalar burada açıklanmıştır.
Özet
Mikrofluidik cihazların kullanımı kültürlü nöronlar bölümleştirmek için Nörobilim standart bir yöntem haline gelmiştir. Bu protokol, insan kök hücrelerinden ayırt edilen nöronlar Bölümlendirici için bir döngüsel olefin kopolimer (COC) yapılan önceden montajlı çok bölmeli çip nasıl kullanılacağını gösterir. Bu COC yongaları ayak izi standart bir mikroskop slayt ile aynıdır ve yüksek çözünürlüklü mikroskopla eşit uyumludur. Nöronlar, insan nöral kök hücrelerinden (NSCs) çipin içinde glutamatergik nöronlara ayrılır ve 5 hafta boyunca korunur, bu nöronların sinaps ve dendritik spinler geliştirmek için yeterli zaman sağlar. Ayrıca, viral etiketleme, mikroortamlar, akotomi ve immünsitokimya kurulması da dahil olmak üzere bu çok bölmeli yongaları kullanarak birden çok ortak deneysel prosedür gösteriyoruz.
Giriş
İnsan kök hücresi farklılaşmış nöronlar (hSC-nöronlar) biyolojik araştırmalar için giderek daha fazla kullanılır. İnsan kaynağı materyalinden elde edilebilir bu nöronlar, travmatik beyin yaralanmaları ve Alzheimer hastalığı gibi nörodejeneratif bozukluklar çalışma dahil translasyonel araştırma için büyük ilgi vardır. Böylece, hSC-nöronlar çalışma geliştirmek ve kolaylaştırmak için Araçlar talep vardır.
Nöronların benzersiz polarize morfolojisi incelemek için, birçok araştırmacı Multi-compartmentalized mikroakışkan cihazlar1,2,3,4,5,6, kullanmak 7,8,9,10,11. Bu cihazlar, benzersiz alt hücresel erişime sahip uzun projeksiyon nöronların ölçümlerini ve manipülasyonlarını etkinleştirir. Çok bölümlü mikrofluidik cihazlar, akal büyümeyi yönlendirerek mikrokanallarla ayrılan iki paralel mikrofluidik bölmeden oluşur. Nöronlar veya nöron kök hücreleri (NSCs) somatodendritik bölme kaplamadır ve sonra dakika sonra bölme yüzeyinin altına uyur. Farklılaşan nöronlar büyür ve akons/projeksiyonları mikrooluk bölgesi üzerinden bitişik ve yalıtılmış bir aksal bölmesine genişletir. Geçmişte, bu cihazlar sadece Poly (dimethylsiloxane) (PDMS) Replica kalıplama kullanılarak yapılmıştır. PDMS cihazların daha önce açıklanan birçok dezavantajları var12, kalıcı hidrophobicity dahil olmak üzere ve ihtiyaç hemen önce bir cam lamel magazini için montajı. Önceden montajlı enjeksiyon kalıplı cips bu dezavantajları çoğunu üstesinden ve ticari satılır (bkz. malzeme tablosu)12. Bu yongaları bölmeleri kalıcı hidrofilik yapılır ve tüm çip optik şeffaf döngüsel olefin kopolimer (COC) kalıplanmış enjeksiyon.
Bu protokol, insan NSCs 'yi uyarıcı nöronlara ayırmak ve ayrı ve akıcı bir şekilde uzun nöronal projeksiyonları izole etmek için bu COC çipini nasıl kullanacağınızı gösterir. Bu gösteri için, nöronlar NIH onaylı H9 kök hücrelerinden farklılaşmış. Benzer prosedürler, insan kaynaklı pluripotent kök hücrelerini ayırt etmek için kullanılabilir.
Protokol
Not: Şekil 1a, B ana kanallar veya bölmeleri, kuyuları ve Mikrokanal konumları da dahil olmak üzere, önceden montajlı COC çip bir şematik gösterir. Bölümleşmiş çip, gıda boyama boyasının yalıtımına göre bir bölme içinde farklı fluidik mikroortamlar oluşturabilir (Şekil 1C). Önceden montajlı çok bölme yongası hazırlamak için protokol nag, et al., Bölüm 112verilir.
1. hSC-nöronlar için çok bölmeli çiplerin kaplama
Not: Şekil 2a kaplama prosedürlerine genel bir bakış gösterir.
- 20 μg/mL çalışma çözeltisi çip başına 600 μL çözüm yapmak için hücre kültürü sınıfı distile suda Poly-L-ornitin çözülür.
- Fişleri kuyulardan hazırladıktan sonra kalan PB 'lerden sol aspirate. Aspirasyon yapılırken, pipet ucunun kanal açından uzak olduğundan emin olun.
Not: mikrofluidik kanallar bu yordamın tamamı için doldurulmalıdır. Kanallar/bölmeler, sadece kuyular sıvı Aspire etmeyin. - Yük 150 μL Poly-L-ornitin çalışma çözeltisi sağ üst iyi. 90 s veya sıvı kadar sağ alt doğru doldurmaya başlar bekleyin. Sağ alt sağa iyi 150 μL medya ekleyin ve sıvı mikrokanalların geçmesine izin vermek için 5 dakika bekleyin.
- 150 μL medya sol üst iyi ekleyin. Bekleyin 90 s ve sonra 150 μL sol alt iyi ekleyin. Çip (s) tutucusunu Parafilm ve yer ile 4 °C ' de bir gecede sarın.
Not: Alternatif olarak, çip ve tutucuyu 37 °C ' de 1 saat boyunca yerleştirin. - Pipet ucunun kanal açından uzağa yerleştirilmesini sağlayarak medyayı kuyulardan aspirate. 150 μL 'ye, sağ üstteki steril su ekleyin. 90 s bekleyin ve sonra 150 μL sağ aşağı iyi ekleyin. Sıvı microgrooves geçmesine izin vermek için 5 dakika bekleyin.
- Sol üst iyi, 90 s bekleyin ve sonra başka bir 150 μL sol alt iyi ekleyin 150 μL steril su ekleyin.
- 1,5-1.6 arasındaki adımları yineleyin.
- Laminin yavaşça 2 °C ila 8 °C ' de çözülmesi ve 10 μg/mL çalışma çözeltisi hazırlamak.
- Yük 150 μL laminin çalışma çözeltisi sağ üst iyi. 90 s veya sıvı kadar sağ alt doğru doldurmaya başlar bekleyin. Pipet 150 μL sağ aşağı iyi. Laminin mikrokanalların içinden geçmesine izin vermek için 5 dakika bekleyin.
- 150 Ekle μL laminin sol üst iyi. Bekleyin 90 s ve sonra 150 μL sol alt iyi ekleyin. 37 °C ' de 2 saat için çipin tutucusunu inkulat.
- Yongası PBS ile durulayın (CA2 + ve mg2 +olmadan). Yük 150 μL PBS sağ üst iyi. 90 s veya sıvı kadar sağ alt doğru doldurmaya başlar bekleyin. Sağ alt doğru iyi PBS 150 μL ekleyin ve PBS Mikrokanal geçmesi izin vermek için 5 dakika bekleyin.
- Pipet 150 μL PBS sol üst iyi. Sonra 90 s pipet 150 μL sol alt iyi.
- Yongadan PBS aspirate ve sonra NSC medya ile çip durulayın (bkz. malzeme tablosu). Yük 150 μL medya sağ üst iyi. 90 s veya sıvı sağ alt sağ kanala geçtiğinde sonra sağ alt iyi 150 μL ekleyin. Mikro kanallar üzerinden medya akışına izin vermek için 5 dakika bekleyin.
- Sol üst iyi ve başka bir 150 μL sol alt iyi için medya 150 μL ekleyin. Chip 'i, NSCs 'ye hazır olana kadar ön koşul için 5% CO2 Ile 37 °c ' lik bir kuluçta olarak inkübe etmek.
Not: cips gerekirse bir gecede önceden Klima olabilir.
2. NSCs 'leri multicompartment yongasına diktir
Not: Bu protokol, ticari olarak satın alınan NSCs kullanılır, önceki yayınımızın aksine insan embriyonik hücrelerle başlayan hücreler5. Bu protokol nöron kök hücreleri doğrudan plastik yongaları içine kaplamaları nerede nöronlar ayırt. Hücreler, 2 geçiş için NSCs (farklılaşma olmaksızın) olarak proliferasyon ve daha fazla kullanım için sıvı N2 ' de şişeler içinde depolanmasına izin verebilir. Bu protokol, 1 veya 2 geçişinden sonra sıvı N2 ' de saklanan NSC şişeleri kullanır. Şekil 2B kaplama prosedürlerine genel bir bakış gösterir.
- Üreticinin talimatlarına göre NSCs çözüyor.
Not: Bu yordam H9 türetilen NSCs için geçerlidir. Diğer hücre hatları, hücre yoğunluğu optimizasyonu gerektirir. - Bir hemokytometer kullanarak hücre konsantrasyonunu saymak ve mL başına 7 x 106 hücre konsantrasyonu elde etmek için NSC medya kullanarak ayarlayın.
- Çip her kuyunda medya aspirate. Ana kanallardan kaçının medya duman çekiş.
- Hücre çözeltisi pipet 5 μL sağ üst iyi, ardından 5 μL sağ alt iyi (70.000 hücreleri toplam). Hücrelerin ana kanal açılımlarına doğru pipetleme yapılacağını emin olun. Hücrelerin kanala girdiğini kontrol etmek için mikroskop kullanın. Hücreleri Chip altına uymak için 5 dk bekleyin.
Not: hücreleri yüklemek için ya da her iki bölmeler kullanılabilir. - Pipet ~ 150 μL NSC medyası sağ üst ve sonra 150 μL sağ alt iyi. Sol tarafta tekrar edin. Uygun bir nemlendirilmiş konteynır içinde% 5 CO2, 37 °c ' de Inküye yapın.
- 48 saat sonra, kuyulardan NSC medya Aspire ve her üst iyi ve her alt iyi 150 μL ekleyerek nöral farklılaşma medya ile değiştirin.
- % 5 CO2, 37 ° c 'de kültür nöronlar uygun bir nemlendirici konteyner içinde kuluçta.
Not: medya her 2-3 gün değiştirilmesi gerekir. Çipte kullanılan küçük hacimler nedeniyle, nemlendirilmiş bir kuluçsa içinde bile buharlaşma büyük ölçüde hücre viability etkileyebilir. Yonga ile hücrelerin uzun vadeli kültürü için ek nem sağlamak için uygun bir ikincil konteyner kullanın (bkz. malzeme tablosu).
3. çip içinde hSC-nöronların viral floresan etiketleme
Not: birden fazla virüs çip içinde nöronlar etiket için kullanılabilir. Aşağıdaki talimatlar G-Deleted Rabies-mCherry veya – eGFP virüsü kullanımını tarif eder. Potansiyel olarak bulaşıcı maddeler uygulanabilir kurallar ve düzenlemelere göre ele alınmalıdır ve ek eğitim ve kurumsal onay gerektirebilir.
- Sıcak ~ 400 μL, çip başına 37 °C ' ye kadar taze nöral farklılaşma medyası.
- 50 μL medyaya bir iyi Axon bölmesinin bir santrifüjle tüp içine çıkarın ve sonra tüp değiştirilmiş kuduz virüsü 100.000 viral birimleri ekleyin.
Not: düzgün harcanan pipet ipuçları ve virüs içeren santrifüj tüpler atın. - Kalan nöral farklılaşma ortamını aksonal bölmesinden çıkarın ve santrifüj tüpüne yerleştirin. 37 °C ' de saklayın.
Not: kanallar sıvı ile dolu kalır emin olun. - 50 μL virüsü çözeltisi ile 150 μL ısıtılmış medyaya karıştırın. Pipet 100 μL 'nin bir iyi aksiyon bölmesine ve 100 μL 'ye de diğer Akon bölmesine doğru. 37 °C ' lik inküvatör içinde 2 saat boyunca kuluçat.
Not: akal ve somatik bölmeler arasındaki hacimlerdeki fark, virüsün enfeksiyon/kuluçka süreleri sırasında aksal bölmede kalmasını sağlar. - Virüs içeren medyayı çekin ve imha edin.
DIKKAT: kapalı mikrofluidik kanallar içinde sıvı çıkarmayın. - Yavaşça pipet 75 μL taze medya bir Axon bölmesine iyi ve medya diğer Akon iyi içine kanal akışı sağlar.
- Aksiyon bölmesinden medyayı çıkarın ve düzgün bir şekilde atın.
- 3,6 ve 3,7 adımları yineleyin.
- Axon bölmesini kaydedilmiş medyadan doldurun. Pipet bir ek 50 μL taze medya, gerekirse, ve sonra çipli için çip geri dönün. Bu ek taze medya işlem sırasında sıvı transferi ve buharlaşma sırasında medya kaybına doğru saymak etmektir.
Not: Bu değiştirilmiş kuduz virüsleri kullanarak görünür floresan etiketleme 48 h tarafından oluşur ve en fazla 8 gün sonra virüslü nöronların hücre ölümü genellikle virüs toksisitesi nedeniyle oluşur. Nöron görüntüleme diğer standart kültür platformları (örn. cam alt yemekleri) ile yapılabilir, ancak evaporatif kayıpları önlemek için yeterli nemi korumak için özel bir dikkat gereklidir.
4. yonga içinde fluidik izolasyon, akotomi ve immünostasyon
- Fluidik izolasyon, akotomi, ve falı ile immünostasyon takip nag, ve al.12açıklandığı gibi.
Sonuçlar
Ayrım medyası ile çipte bir hafta (7-10 gün) sonra, NSCs nöronlar ve nöronal projeksiyonlar ayırt akonal bölmesine girin (Şekil 3). Çip içinde, nöronlar iliştirmek ve somatik bölmesi içinde eşit olarak dağıtın. Karşılaştırıldığında, PDMS cihazlarda nöronlar/toplu olarak erken 5 gün farklılaşma medya ek sonrası, Şekil 3B görülebilir olarak tehlikeye hücre sağlığı lider (gün 13 büyütülmüş görüntü). Yongaları içinde nöronlar birlikte akons ile sağlıklı görünüyorsun. Sağlıklı nöronlar 4-5 hafta boyunca cips içinde muhafaza edilebilir.
Nöron olgunlaşma ve dendritik omurga gelişimi görselleştirmek için, değiştirilmiş kuduz virüsü, dendritik sinirler de dahil olmak üzere retrograd etiket nöronlar, MCherry floresan protein ile gün 29 ' da aksonal bölmesine teslim edildi. Kuduz virüsü enfeksiyonuna dört gün geçtikten sonra, akonları aksonlar 'a uzanan nöronlar MCherry ifade etti. Farklılaşma gününde nöronlar 33 dendritik spinler oluşumunu gösterdi (Şekil 4). Dendritik dikenler görselleştirme NSC türeyen nöronların cips formu olgun sinaps içinde ayırt gösterir.
Çok bölmeli çip, proteinin hücresel lokalizasyonunu görselleştirmek için immünosittokimya ile de uyumludur. Farklılaşma medyasında nöronlar koruyarak 26 gün sonra, nöronlar uyarıcı sinaptik marker için etiketli, vGlut1 (Şekil 5). Bu sonuçlar, virally etiketli nöronlar vGlut1 (Şekil 5e) ve nöron özel Marker, β-tubulin III (Şekil 5F-H) ile ortak yerelleştirmek gösterir.
Akonlara izole edilmiş farklı mikroortamlar oluşturma yeteneği, Alexa Fluor 488 hydrazide, düşük moleküler ağırlığında floresan boya kullanılarak da gösterilmiştir (Şekil 6).
Axon yaralanma çalışmaları bölümleşmiş cihazlarda yaygın olarak gerçekleştirilir. Önceden montajlı COC yongası ile farklılaşmış nöronların akonlarının seçici olarak yaralanmalı olması için prensip deneyi kanıtlanması yapıldı (Şekil 7). Sonuçlar silikon bölümleşmiş cihazlar6,13,14eşdeğerdir.

Şekil 1: önceden montajlı COC, multicompartment mikrofluidik çip. (A) üst ve alt kuyuları tanımlayan çip çizimi. Çip boyutu 75 mm x 25 mm, standart mikroskop slaytlar boyutudur. (B) kanalları ayıran kanalları ve mikrokanalları gösteren yakınlaştırılmış bir bölge. Ek ayrıntılar nag, et al.12adresinde sağlanmaktadır. (C) bu fotoğraf, her bölme içinde gıda boyama boyası kullanarak yalıtılmış mikroortamlar oluşturulmasını göstermektedir. Tüm bu rakam 12' den itibaren çoğaltılmıştır. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
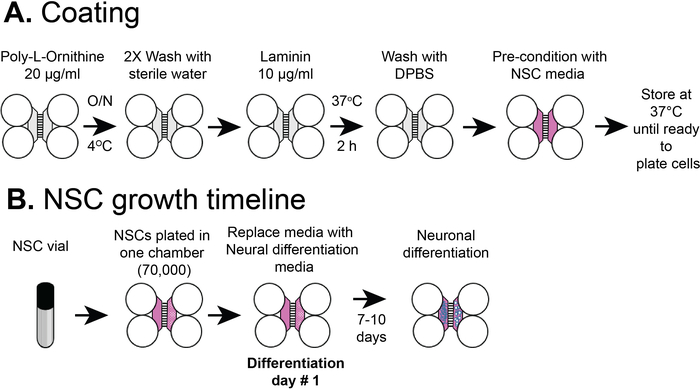
Şekil 2: plastik bölümleşmiş çip kaplama ve NSC hücre kaplama zaman çizelgesi. (A) plastik multicompartment yongaları ön kaplama çözeltisi ile kaplanmıştır ve sonra poli-L-ornitin ve LAMININ NSC medya ile ön klima önce. (B) nscs, yongasının somatik bölmesinde 7 x 104 hücreli kaplamadır. Hücreler NSC medyada 24 saat büyüdü ve sonra medya nöral farklılaşma medyası ile değiştirildi. Farklılaşmış nöronlar 7-10 gün sonrası farklılaşma ile gözlenmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3: yongaları ve PDMS cihazlarında hSC-neuron büyüme karşılaştırması. (A) plastik multicompartment yongasında farklılaşma sonrasında 13 gün Içinde yetiştirilen HSC-nöronların faz kontrast görüntüsü. (B) (a) içinde beyaz kutu içinde kültürlü HSC-neurons bölgesinde yakınlaştırılmış BIR bölge ve bir PDMS aygıtı içinde eşdeğer bir bölge (sağ). Fişler içinde hSC-nöronlar iyi takın. PDMS tabanlı aygıtlarda toplanan nöron kümeleri formu. 2 bağımsız deneylerin temsilcisi. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
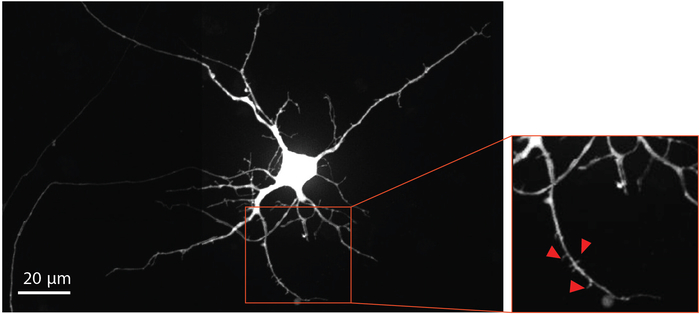
Şekil 4: insan NSC türetilen nöronlar dendritik omurga morfolojisi gösterir. Farklılaşma gününde retrograd etiketli mCherry nöron 33 çip içinde büyüdü. Büyütülmüş bölge kırmızı özetlenmiştir, dendritik spines varlığını vurgular, hangi kanıtlar olgun glutamaterjik sinaps gelişimini destekleyen sağlar. Kırmızı oklar dendritik spines doğru işaret. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
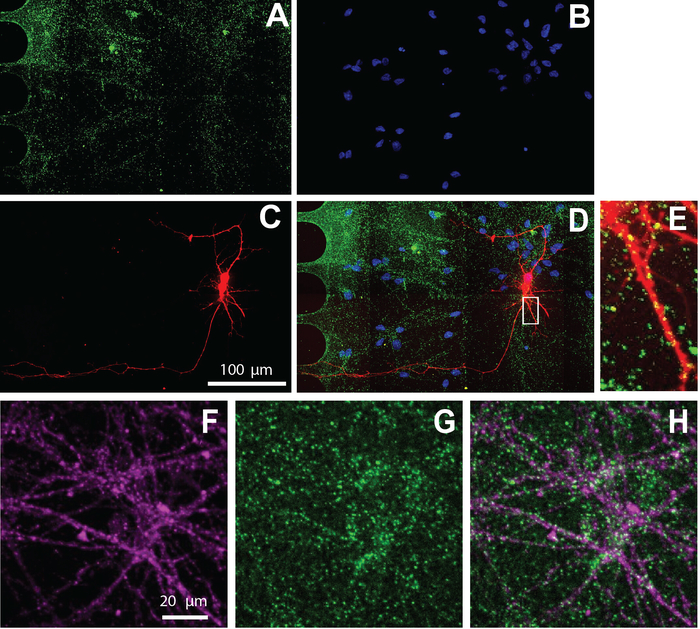
Şekil 5: insan NSC türetilen nöronlar cips sergi uyarıcı sinaps içinde kültürlü. 26. farklılaşma gününde immünostasyon yapıldı. Somatik bölmede neuron görüntüleme yapıldı. A) vGlut1 (yeşil) ve (B) dapi (mavi) immünolabeling. (C) MCherry etiketli nöronlar (kırmızı) retrograd değiştirilmiş bir kuduz virüsü kullanılarak etiketlenmiş. (D) birleştirilmiş bir floresan mikrograf (a-C). (E) dendritik dikenler ve vGlut1 pozitif puan MCherry-pozitif dendrites ile lokalize, bir bölgede yakınlaştırılmış gösterilen (D). İmmünofluorescence (F) nöron spesifik Marker, β-tubulin III (macenta) ve (G) vGlut1 (yeşil) mikrografileri. (H) β-tubulin III kaplama ve vGlut1. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 6: virally traned mCherry nöronlar önceden MONTAJLı COC yongası içinde kurulan bir Akon lokalize mikroçevre içine projeksiyonları genişletir. (A) MCherry etiketli nöron, akonları çipin mikrokanallarını ve izole bir Akon bölmesine uzatır. Axon bölmesinin izolasyonu Alexa Fluor 488 hydrazide kullanılarak görselleştirildi. Nöronların görüntülenmesi, değiştirilmiş kuduz virüsü ile enfeksiyondan sonra 26 ve 3 gün farklılaşma gününde meydana gelmiştir. (B) (a) içindeki floresan görüntü bir DIC görüntüyle birleştirilir. Microgrooves konumunu not alın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 7: COC multicompartment yongası Içinde Axotomi yapılmıştır. (A) 33 farklılaşma gününde MCherry etiketli nöronlar akotomi öncesinde görüntülenmiştir. ' Ateş ' renkli görünüm tablosu. (B) axotominin hemen ardından, akonların tamamen kesilmiş olduğunu gösteriyor. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
| Plastik çok bölmeli cips | PDMS çok bölmeli aygıtlar |
| akonları izole et | akonları izole et |
| Mikro ortamlar kurmak | Mikro ortamlar kurmak |
| axotomize nöronlar | axotomize nöronlar |
| Optik şeffaf | Optik şeffaf |
| yüksek çözünürlüklü görüntüleme ile uyumlu | yüksek çözünürlüklü görüntüleme ile uyumlu |
| fluoresan mikroskobu ile uyumludur | fluoresan mikroskobu ile uyumludur |
| tamamen monte edilmiş | gerekli substrat montajı |
| sağlıklı akons > 21 gün | sağlıklı akons > 14 gün |
| Hidrofilik kültür yüzeyi | Hidrofobik |
| gaz geçirmez | gaz geçirgen |
| yuvarlak microgrooves ve kanallar | düz microgrooves |
| Lazer ablasyon ile uyumlu değil | PDMS odaları özel lazer ablasyon uyumlu slaytlar üzerinde monte edildiğinde lazer ablasyon için kullanılabilir. |
| cihazı üst kaldırmak için değiştirilemez | üst Mikrokanal içinde boyama için çıkarılabilir |
| Mineral yağ bazlı daldırma yağları ile uyumlu değildir (silikon bazlı yağlar iyidir) | Mineral yağ bazlı daldırma yağları ile uyumludur |
| küçük moleküllere ve organik çözücüler için geçirmez | küçük moleküllerin & organik çözücüler emilimi |
| Çip ile sızıntı sorunu yok | Poly-L-ornitin ve laminin ile kaplama cihazları sızdıran hale |
| farklılaşmış nöronlar, test edilen hücre yoğunluklarında eşit olarak dağıtılmış (> 4 hafta) kalır | farklılaşmış nöronlar, test edilen hücre yoğunluklarında kültür 3-4 gün sonra toplama başlar |
Tablo 1: çok bölmeli COC yongaları ve silikon cihazların kültür nöronlar için karşılaştırılması
Tartışmalar
Önceden montajlı çok bölmeli COC yongası, insan NSCs 'leri uzun vadeli (> 4 hafta) boyunca nöronlara ayırmak ve korumak için kullanımı kolay bir bölümleşmiş platformdur. Bu protokolde, insan NSCs 'lerin glutamatergik nöronlara, retrograd etiket nöronlarının farklılaşması, immunsitokimya gerçekleştirmek, dendritik omurga morfolojisi görselleştirilmesi ve akotomi gerçekleştirmek. Bu çipleri yüksek çözünürlüklü görüntüleme ile uyumludur ve COC12ile otomatik osilesan yoktur.
COC çok bölmeli yongaları işlevsel olarak silikon bazlı bölümlere ayrılmış cihazlara eşdeğerdir ve daha önce12' de açıklandığı gibi avantajlar ve dezavantajları vardır. Tablo 1 , çok BÖLMELI COC yongaları ve silikon cihazları, HSC-neurons kültürü için karşılaştırır. COC bölümleşmiş yongaları uzun bir kültür döneminde kök hücrelerin montaj ve bakımı için daha iyi bir hidrofilik yüzey sağlar. PDMS tabanlı cihazların monte edilmesi ve cam kapaklara takılı olması gerekir. PDMS cihazlarının hidrofobik doğası kök hücrelerin toplanmasına neden olur5; Bu, hücresel seviyede görüntülemede her iki zorluklara yol açar ve medya değişiklikleri sırasında hücre toplamaların hareketi nedeniyle fiziksel hasara karşı daha fazla duyarlılığını verir. Plastik çip bu zorlukları üstesinden gelir. COC gaz geçirmez, PDMS aksine, böylece hava cepleri sıkışmış veya kanallar içinde oluşturulan kullanıcı tarafından kaldırılması gerekir. Ön kaplama çözümü, havanın kanallarda sıkışıp kalabilme olasılığını azaltır. Bu çözüm, etanol ve diğer ajanlar oluşur. Bu plastik yongalar içinde duvar nöronlar kültürü için daha önce yayımlanan bir protokol cips12içinde pipetleme hücreleri ve medya hakkında ek ayrıntılar sağlar. NSCs daha kırılgan o duvar nöronlar, bu yüzden daha nazikçe ele alınmalıdır. Aynı zamanda yavaşça yukarı ve aşağı pipetleme tarafından kaplama önce iyice kök hücreleri karıştırmak için önemlidir.
İn vitro farklılaşmış insan kök hücrelerinden elde edilen nöronların kullanımı, tıp ve araştırmalarda giderek daha popüler hale gelmektedir. Bu nöronlar, nörodejeneratif hastalıklar ve travmatik beyin yaralanmaları da dahil olmak üzere birçok CNS bozuklukları için araştırma ve klinik uygulamalar için önemlidir. Bu nöronlar yakından insan fetal nöronlar benzer15. Gelecekte, uygun yaşlanılan nöronlar, Yaş ile ilgili nöronal fonksiyonu taklit etmek ve bu bölümleşmiş cihazlarla birlikte kullanılan kök hücrelerden oluşturulabilir. Bu cihazlar, otizm spektrumlu bozukluklar ve aksal rejenerasyon tanısı konulan hastaların nöronlar olarak Axon sağlık ve fonksiyon etkileyen hastalıklarda araştırma kolaylaştıracaktır yaralanma sonra16,17.
Açıklamalar
S.P. ve T.N. hiçbir rekabet mali çıkarları beyan. Başkan Yardımcısı, Xona Microfluidics, LLC 'nin bir çalışanı. J.H., Xona Microfluidics, LLC üyesidir. A.M.T. mikrofluidik Oda/çipin mucidi (US 7419822 B2, EPO 2719756 B1) ve Xona Microfluidics, LLC üyesidir.
Teşekkürler
Yazarlar Xona Microfluidics, LLC, Ulusal Ruh Sağlığı Enstitüsü (R42 MH097377), ve Ulusal Enstitüsü nörolojik bozukluklar ve Inme (R41 NS108895, P30 NS045892) destek kabul. İçerik sadece yazarlar sorumluluğundadır ve mutlaka Ulusal Sağlık Enstitüleri resmi görüşlerini temsil etmez.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alexa Fluor hydrazide 488 | ThermoFisher Scientific | A10436 | |
| Alexa Fluor secondary antibodies | ThermoFisher Scientific | 1:1000 | |
| anti_beta-tubulin III | Aves | TUJ | 1:1000 |
| anti-vGAT antibody | Synaptic Systems | 131 003 | 1:1000 |
| anti-vGlut1 antibody | NeuroMab | 75-066 | clone N28/9, 1:100 |
| complete neural stem cell media: | |||
| REC HU EGF 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0314 | 20ng/mL |
| REC HU FGF BASIC 10 UG BIOSOURCE (TM) | ThermoFisher Scientific | PHG0024 | 20ng/mL |
| GlutaMAX Supplement (100X) | ThermoFisher Scientific | 35050061 | 2mM |
| KnockOut DMEM/F-12 | ThermoFisher Scientific | 12660012 | |
| StemPro Neural Supplement | ThermoFisher Scientific | A1050801 | 2% |
| Epifluorescence imaging system | EVOS Fluorescence imaging system | AMF4300 | 10x objective |
| fluorinated ethylene propylene film | American Durafilm | 50A | 0.5 mil thickness |
| Fluoromount G | ThermoFisher Scientific | 00-4958-02 | |
| Gibco DPBS without Calcium and Magnesium | ThermoFisher Scientific | 14190144 | |
| GIBCO HUMAN NSC (H9) KIT COMBO KIT | Gibco | N7800200 | |
| Gibco Laminin | ThermoFisher Scientific | 23017015 | |
| Glass Pasteur pipettes | Sigma-Aldrich | CLS7095D5X SIGMA | 5.75 in length |
| H9-DERIVED HU NEURAL STEM CELL 1E6 CELLS/VIAL; 1 ML | ThermoFisher Scientific | 510088 | |
| hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Incubator, 5% CO2 37 °C | |||
| Laser scanning confocal imaging system | Olympus | FV3000RS | 30x silicone oil objective |
| modified rabies virus | Salk Institute for Biological Studies | G-deleted Rabies-eGFP | Material Transfer Agreement required |
| Mr. Frosty | ThermoFisher Scientific | 5100-0001 | |
| Neural differentiation media | Per 100 mL. | ||
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240112 | 1mL (100X) |
| Ascorbic acid | Sigma Aldrich | A8960 | 200mM |
| BDNF | ThermoFisher Scientific | PHC7074 | 40 ng/mL |
| Gibco B27 Plus Supplement (50X) | FisherScientific | A3582801 | 2mL (50X) |
| Gibco CultureOne Supplement (100X) | FisherScientific | A3320201 | 1mL (100X) |
| Gibco Neurobasal Plus Medium | FisherScientific | A3582901 | |
| StemPro Accutase Cell Dissociation Reagent | ThermoFisher Scientific | A1110501 | |
| Taylor Wharton Liquid N2 dewar | FisherScientific | 20HCB11M | |
| triton X-100 | ThermoFisher Scientific | 28314 | |
| XC pre-coat | Xona Microfluidics, LLC | XC Pre-Coat | included with XonaChips |
| XonaChip | Xona Microfluidics, LLC | XC450 | 450 µm length microgroove barrier |
| Humidifier Tray | Xona Microfluidics, LLC | humidifier tray |
Referanslar
- Taylor, A. M., Wu, J., Tai, H. C., Schuman, E. M. Axonal translation of beta-catenin regulates synaptic vesicle dynamics. The Journal of Neuroscience. 33 (13), 5584-5589 (2013).
- Virlogeux, A., et al. Reconstituting Corticostriatal Network on-a-Chip Reveals the Contribution of the Presynaptic Compartment to Huntington’s Disease. Cell Reports. 22 (1), 110-122 (2018).
- Neto, E., et al. Compartmentalized Microfluidic Platforms: The Unrivaled Breakthrough of In Vitro Tools for Neurobiological Research. The Journal of Neuroscience. 36 (46), 11573-11584 (2016).
- Pinto, M. J., et al. The proteasome controls presynaptic differentiation through modulation of an on-site pool of polyubiquitinated conjugates. The Journal of Cell Biology. 212 (7), 789-801 (2016).
- Bigler, R. L., Kamande, J. W., Dumitru, R., Niedringhaus, M., Taylor, A. M. Messenger RNAs localized to distal projections of human stem cell derived neurons. Scientific Reports. 7 (1), 611(2017).
- Nagendran, T., et al. Distal axotomy enhances retrograde presynaptic excitability onto injured pyramidal neurons via trans-synaptic signaling. Nature Communications. 8 (1), 625(2017).
- Van Laar, V. S., et al. Evidence for compartmentalized axonal mitochondrial biogenesis: Mitochondrial DNA replication increases in distal axons as an early response to Parkinson's disease-relevant stress. The Journal of Neuroscience. , (2018).
- del Río, J. A., Ferrer, I., Gavín, R. Role of cellular prion protein in interneuronal amyloid transmission. Progress in Neurobiology. 165-167, 87-102 (2018).
- Jia, L., et al. MiR-34a Regulates Axonal Growth of Dorsal Root Ganglia Neurons by Targeting FOXP2 and VAT1 in Postnatal and Adult Mouse. Molecular Neurobiology. , (2018).
- Taylor, A. M., Dieterich, D. C., Ito, H. T., Kim, S. A., Schuman, E. M. Microfluidic local perfusion chambers for the visualization and manipulation of synapses. Neuron. 66 (1), 57-68 (2010).
- Menon, S., et al. The E3 Ubiquitin Ligase TRIM9 Is a Filopodia Off Switch Required for Netrin-Dependent Axon Guidance. Developmental cell. 35 (6), 698-712 (2015).
- Nagendran, T., Poole, V., Harris, J., Taylor, A. M. Use of Pre-Assembled Plastic Microfluidic Chips for Compartmentalizing Primary Murine Neurons. Journal of visualized experiments : JoVE. (141), (2018).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Axonal mRNA in uninjured and regenerating cortical mammalian axons. The Journal of Neuroscience. 29 (15), 4697-4707 (2009).
- Oh, J. H., Jung, C. R., Lee, M. O., Kim, J., Son, M. Y. Comparative analysis of human embryonic stem cellderived neural stem cells as an in vitro human model. International Journal of Molecular Medicine. 41 (2), 783-790 (2018).
- Lazar, M., Miles, L. M., Babb, J. S., Donaldson, J. B. Axonal deficits in young adults with High Functioning Autism and their impact on processing speed. Neuroimage Clinical. 4, 417-425 (2014).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Combinatory repair strategy to promote axon regeneration and functional recovery after chronic spinal cord injury. Scientific Reports. 7 (1), 9018(2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır