Method Article
テレオストの嗅覚神経からの細胞外多単位記録
要約
嗅覚神経からの細胞外多単位記録は、海洋魚の嗅覚感受性を評価するための敏感で堅牢で再現性の高い方法である。それは一次感覚入力を記録し、外部の分量に依存しない。
要約
最近の研究では、海洋酸性化は魚の嗅覚駆動行動に影響を与えることを示しています。これは、高PCO2/低pH水中の嗅覚感受性の低下に起因する可能性がある。海洋魚全般における海洋酸性化、または嗅覚感受性の影響を評価するために、嗅覚神経からの細胞外多単位記録が選択方法であることを提案する。侵襲的であるが、それは敏感で、強く、再現性があり、外部の食前性とは無関係である(例えば、電気オルファクトグラム[EOG]とは異なる)。さらに、中央処理の前に、一次感覚入力をCNSに記録します。この方法は、一時的および臭気に依存する嗅覚感受性の低下を示し、一定のアミノ酸を用いて濃度応答曲線を構築し、検出の閾値を計算できることを示す。
概要
魚は、食べ物を見つけること、捕食者を避けること、潜在的な仲間と移住を評価するなど、彼らの生活の多くの側面1のために嗅覚に大きく依存しています1,2,3.したがって、魚の嗅覚感受性を評価する(彼らは何においがしますか?彼らはこれらの化合物にどのくらい敏感ですか?これらのプロセスを完全に理解するためには不可欠です。さらに、海洋酸性化や汚染などの環境に対する人為的効果は、周囲の水4と必ずしも密接に接触しているため、亜致死レベルであっても嗅覚系に深い影響を及ぼす可能性がある。生体内電気生理学は、魚の嗅覚感受性を評価する実験的アプローチです。電気オルファクトグラム(EOG)、嗅球から記録された電気脳波(EEG)、および嗅覚神経5からのマルチユニット記録の3つの主要な技術が利用可能である。
EOGは、これらの3つの6の中で最も広く使用されています。これは、嗅上皮の上に記録された直流(DC)フィールド電位であり、所与の臭気に反応する嗅覚受容体ニューロン(ORN)の合計発生器電位であると考えられている。しかし、魚の内部ではなく水中に記録されるとともに、応答の振幅は魚が生成する信号だけでなく、周囲の水の導電性にも依存します。導電率が高いほど(または抵抗力が低い)、低い方が振幅になります。これは、EOGが淡水7よりも海水中の感度が低い方法であることを意味するかもしれません。
嗅球から記録されたEEGは、魚の嗅覚の調査にも広く使用されています。しかし、嗅球は嗅覚感覚入力8の一次処理センターである。それは糸球体に高度に組織され、その結果、記録された応答は、記録電極の位置に大きく依存する。例えば、ORNから検出するアミノ酸からの入力は、嗅球の横領域で糸球体によって処理され、一方、単発性由来の化学物質からは、内側領域99、10、11、1210,11,12に向けられる。フェロモナル入力は、嗅球内の高度に局在した糸球体に向けられてもよい。問題の種の解剖学にも依存して、与えられた臭気のための理想的な記録位置は容易にアクセスできないかもしれない。
嗅覚神経からのマルチユニット記録は、上記で概説したEOGおよびEEGの主な問題を回避する。上皮から電球にORNの軸索を通過する可能性のある行動を記録するので、それは一次感覚信号です。そして、魚の中に記録されているように、応答の振幅は外部の食分とは無関係です。それにもかかわらず、もちろん、それはいくつかの欠点を持っています。まず、種の解剖学に応じて、EOGよりも嗅覚神経を露出させるためにより広範な手術が必要である。第二に、信号はEOGよりも小さいため、少し洗練された、したがって高価な機器が必要です。他の実験的アプローチの一般的な説明は、ジョンカプリオ5によって与えられています。本稿の目的は、この技術の一例として、海層の嗅覚神経(スパルス・オーラータ)からアミノ酸臭気への細胞外多単位応答を記録する方法と、そのような実験で遭遇する一般的な問題のいくつかを特定し、克服する方法を概説することである。
プロトコル
動物の維持と実験は認定実験施設で行われ、ポルトガルの農業農村開発水産省獣医総局による「グループ1」ライセンスの下でポルトガルの国の法律(DL 113/2013)に従いました。このプロトコルは動物の取り扱いを伴うため、科学的実験に使用される動物の福祉を規制する地方および/または国の機関によって承認されなければならない。
1. 刺激準備
注:ほとんどの魚は非常に敏感な嗅覚システムを持っているので、実験で使用される嗅覚刺激を準備する際に細心の注意を払う必要があります。刺激を補うために使用されるガラス製品は、5%漂白剤(次亜塩素酸ナトリウム)で洗浄し、水道水で十分に洗い流し、乾燥させる必要があります。使用する直前に、海水(刺激希釈を行うために使用されるのと同じ水)でガラス製品を十分に洗い流します。この水のどれも裸の皮膚に接触しないのに注意してください。
- 10-2 M L-グルタミン、L-ロイシン、L-セリンの100 mLを作ります;使用するまで-20 °Cで各々の1mLのアリコートを保管してください。
- 実験の当日に、これらのアリコートから、制御と高CO2海水の両方を用いて10-3 M〜10-7 M溶液(x10希釈のステップで)を調製する。-7
注: L-セリン (10-3 M) は正のコントロール、または標準として使用されます。刺激の希釈を構成するために使用される水は、刺激とまったく同じ方法で処理されるが、臭気を添加することなく、陰性対照またはブランクとして使用される。
2. 制御と高CO2水の調製
- 炭を濾過した海水を1L回収して、制御水を準備します。
- pH プローブを使用して、pH をチェックします。それは約8.2でなければなりません。もしそうでなければ、このpHに達するまで大気で泡立つ。
- アルカリ性の滴定器を用いて、水のアルカリ度を測定する。
- 水温と水分量を測定します。
- 海水1Lをろ過して高CO2 水を調製し、その後、所望のpHに達するまでCO2 を泡立て。
- pH プローブを使用して、pH をチェックします。7.7前後であるはずです。
- アルカリ性滴定器を用いて、水のアルカリ度を測定する。
- 水温と水分量を測定します。
- 水中のCO2パラメータを計算するように設計されたソフトウェアを使用して、制御水と高CO2水の両方でCO2圧力を決定します(例えば、CO2Calcソフトウェア213)。
- 入力ウィンドウに、水pH、温度、アルカリ度、総アルカリ度の値を加算します(図1)。
- 定数、単位、およびスケールを選択します ( 図 2の推奨値を参照)。
- ボタン プロセス を押して、CO2 圧力を決定します。
注: 図 3 は 、結果シートの例を示しています。
3. 魚の準備
注: このプロトコルでは、200-400 g の海のブリームが使用されます。
- MS222(エチル-3-アミノ安息香酸メタンスルホン酸塩)を含む気泡天然海水中で魚を浸漬して麻酔します。尾のピンチへの応答が停止したら、神経筋ブロッカーギャラミントリエチオ化物(生理食塩水中10mg·kg-1) を脇腹筋に注入する。
注:使用される麻酔薬の濃度は種によって異なります。シーブリーム 200-400 g の場合、200 mg を使用してください。L-1 400 mgでバッファリング·L-1 ナフコ3. - 麻酔魚をクッション付きのサポートの上に置きます。正確な形状とサイズはモデル種によって異なります。シーブリーム(200-400 g)の場合は、埋め込まれたV字型のサポートを使用します。
- シリコンチューブ(直径=10mm)を口の中に入れ、麻酔薬含有、通気海水の貯留部の水中ポンプにチューブを接続し、エラの上に水をポンプで覆い、〜100 mL·min-1·kg-1で送ります。-1
注:使用するシリコンチューブのサイズは、魚の大きさによって異なります。 - 接地ピンを側面の筋肉に挿入し、アンプのヘッドステージに接続します)。
- 魚を湿った布(またはペーパータオル)で覆い、頭だけを露出して、覆いがエラからの水の出口を妨げないようにします。
注:目は湿った紙/布または黒いプラスチックで覆うことができます。 - 刺激送電システムのチューブ、すなわち、背景海水の供給に接続されたガラス管を鼻孔に位置付ける。
注:マイクロヘマトクリットチューブ(長さ = 75ミリメートル、ID = 1.15ミリメートル、OD = 1.55ミリメートル)を使用することができます。これらは、より小さな魚で使用するために電極引き手の上のより細かい点に引っ張ることができます。手術中に嗅上皮が濡れ保たれていることを確認することが重要です(後述)。 - 目の間の頭蓋骨の皮膚と骨(通常は目の間で一緒に走る嗅覚神経)を、解剖顕微鏡(ファラデーケージ内)の下で、歯科または趣味(例えば、ドレメル)ドリルまたはジュエラーのポリッシャー(歯科ドリルビット付き)の助けを借りて、嗅覚神経を露出させる。
- 海のブリームでは、目のすぐ上の頭蓋骨の部分を、円形の鋸で、目の前部から後ろまで取り除きます。次に、ドリルビットを使用して、目の間の骨を取り除きます。嗅覚神経は目の間にある。
- 十分な骨がクリアされたら、細かい鉗子を使用して神経の上に脂肪と結合組織を取り除きます。神経を傷つけたり、血管を穿刺しないように注意してください。
注:経験は解剖を洗練するのに役立ちます。解剖が小さいほど、準備はより安定します。しかし、十分な組織をクリアする必要があります。未経験のために、嗅球がちょうど見えるとき、彼らは電極の正しい位置を可能にするために電球に加わるように神経の一部を露出させるために少し前もってクリア。 - 使用前に電極を3V DC電源の負極(直列の2つのAA電池)に接続し、20-30 sの生理食塩水(または淡水で1:3希釈した海水)に先端を置くことによって、電極をきれいにします。先端から来る小さな泡の安定した流れを見る必要があります。
- 嗅覚神経が露出したら、標準(例えば、10-3 M L-セリン)に対して最大の応答を与える位置に記録電極(マイクロマニピュレータに保持)を挿入し、ブランクに対する最小限の応答を挿入します。交流(AC)プリアンプのヘッドステージに接続されたパリレンコーティングタングステン電極(材料表)を使用します。
注:海皮では、アミノ酸に対する最も強い応答は、通常、嗅球に結合する場所の近くに、神経の側面に置かれた電極で見られます。球根の糸球体組織は種間で広く類似しているので、これは他の種にも当てはまるかもしれない。しかし、経験は常に最高の教師です。
4. 電気生理学的記録
注:ほとんどの電気生理学と同様に、マルチユニットの記録はファラデーケージ内で行われる必要があります。しかし、細胞外記録は通常、防振テーブルを必要としません。ほとんどの動きは魚から来ます。それにもかかわらず、マイクロマニピュレータースタンドの磁気ベースを固定するために、金属表面を用いて強く安定したテーブルが必要です。
- ソレノイド作動式三方弁を用いて、きれいな背景水から刺激含有水への迅速な切り替えを可能にする刺激送達システムを設置する。共通の出口を水を運ぶ管に管を接続し、一方のラインを海水貯留所に、もう一方のラインを試験溶液に置きます。
注:バルブが切り替わる場合(DC電流を流すことで)、水の流れは、背景水から臭気を含む水に切り替わります。刺激は、統合された応答の明確なピークを見るのに十分な長さのために与えられ、その後に宿泊施設の期間が続く。現在のプロトコルで使用される時間は4 sですが、種によっては長い時間が必要な場合があります。 - バルブドライバをアナログデジタルコンバータ(例えば、Digidata)のトリガに接続します。バルブがバックグラウンドから刺激を含むラインに切り替えられると、データの記録が開始されます。トリガー・イベントで記録を開始し、所定の期間(例えば10 s)まで継続するようにソフトウェアを構成します。
注:10秒で十分ですが、実験的な質問に応じて、これを短くしたり長くすることができます。 - 試験(積分応答の振幅を記録・測定)を標準で繰り返し、この場合は10-3M L-セリン、連続した刺激の間に1分経過させることにより、調製物の安定性を確認する。
注:種や臭気のある程度に応じて、応答は(経験則として)互いの10%以内の振幅を持ち、急速な発症を有し、最大の活性に上昇し、刺激が存在しなかった後にベースラインに戻る必要があります(図4)。 - コントロール海水中のアミノ酸に対する嗅覚神経応答を記録し(最も低い濃度から最高濃度まで)、連続した刺激の間に1分経過させます。
注:いくつかの種および/またはいくつかの臭気のために、より多くの時間が必要である可能性があります。アミノ酸や海鯛の場合は1分で十分です。 - 10-3 Mセリンと制御水ブランク溶液への応答を記録します。
- 高CO2海水とボトルに背景線を配置することにより、制御海水から高CO2海水に背景水を変更します。
注:水に触れないように、刺激と背景の線の端に別のヘマトクリットチューブ(または同等物)を挿入し、チューブの端が水に残っていることを確認することをお勧めします。 - 高CO2 海水中のアミノ酸に対する嗅覚神経の応答を試験する前に、嗅上皮上皮上皮上に高CO2 水を数分間にわたって従うことによって、嗅上皮を高CO2 水で条件条件する。
注:経験から、海のブリームの場合は5分で十分です。 - 高CO2 海水中のアミノ酸に対する嗅覚神経応答を記録する(最も低い濃度から最高濃度まで)。
- 高CO2 水ブランク溶液への応答を記録します。
- 10-3 Mセリンと制御水ブランク溶液への応答を記録します。
注:生信号(神経活動)は、フィルタ(約2,000〜5,000 Hz、ハイパス50-300 Hz)にフィルタリングされ、アナログデジタルコンバータ(材料表)に渡されるべきです。神経活動の定量を容易にするために、生信号は漏れインテグレーター(材料表)を使用して統合され、アナログデジタルコンバータに渡され、そこから、適切なソフトウェア(例えばAxoscope)を実行しているコンピュータに生信号と統合信号の両方を渡すことができます。
5. データ分析
- すべての刺激に対する統合応答の振幅から、ブランク(mV)に対する統合応答の振幅を差し引きます。
- 標準(10-3 Mセリン)に対する以前の応答の振幅を分割することによって刺激に対する応答を正規化する。これにより、魚間および魚内の変動性が低下します。
- 濃度応答曲線の線形回帰(半対数プロット上)による検出の閾値をb計算し、式ログ(N+1.5)=NログC+B、Cはモル濃度、Nは正規化された応答振幅、aとbは定数7、1414である。7
注: 検出のしきい値は xの値でy = 0.1761 (つまり、log 1.5;N = 0);応答が見られる以上の濃度(すなわち、魚はそれを嗅ぐことができます)。一部の臭気は、半対数でプロットするとシグモイド濃度応答曲線を呼び起こす(例えば、カルシウム15、16、この場合、正規化されたデータは3パラメータヒルプロットに適合し、最大応答振幅とEC50(すなわち、半分の最大応答を与える[臭気]および感受性の尺度)を与えることができる。15, - 制御水でテストした検出の閾値および/または最大応答振幅とEC50 の刺激と高CO2 水で試験された刺激を比較します。
結果
陽性コントロールに対する典型的な応答 (10-3 M L-セリン; 図 4A) と負のコントロール (ブランク; 図4B)は、海鯛の嗅覚神経から記録した 図4に示す。刺激(黒い水平バー;嗅覚空洞内、嗅覚上皮に接触する)の存在下で、刺激発覚の約1秒以内のピークへの活性(統合信号の上方偏向に反映される)の急速な増加に注意し、続いて調節期間(刺激がまだ存在している間)、および刺激が終了した後のベースライン活性への復帰を記録する。応答の絶対振幅は電極位置に大きく依存します。低振幅応答が記録されている場合は、電極位置を変更してみてください。ピーク活性への上昇が遅いのは、上皮から離れすぎて配置されている嗅上皮に刺激含有水を運ぶ管による可能性があります;鼻管を上皮に近づけるように(しかし触らない)してみてください。対照的に、空白は応答をほとんどまたはまったく呼び起こさなくなります。ブランクに対する有意な肯定的な反応(すなわち、活性の増加)は、刺激の希釈を行うために使用される水の汚染を示し得る。きれいな水(とガラス製品)で新鮮な希釈を作ることは、これを解決する必要があります。もしそうでなければ、水系(活性炭フィルターを含む)のより徹底的な洗浄が必要な場合があります。負の応答(すなわち、活動の減少)は、例えばバルブの閉塞により弁が切り替えられたときに流量のわずかな変化を示し得る。
典型的な濃度応答曲線(半対数的にプロット)を、この場合はL-ロイシン(10-7 M〜10-3M)に対して、図5Aに示す。-7 -3なお、臭気の濃度の上昇は、活性の増加を増大させ、したがって、統合応答の振幅に増加させることに注意してください。正規化されたデータのプロットとそれに対応する線形回帰を図 5Bに示します。検出の推定しきい値は、y = 0.1761 (つまり、log1.5; N = 0) の場合、xの値から計算できます。この場合、この値は -7.48 です。つまり、この魚のL-ロイシンの計算された閾値は10-7.48 Mです。指数αは、対数対数プロット上の正規化されたデータの線形回帰から同様に推定することができます。ログN = αlog[臭い]+ 一定。因子γは、その後、応答振幅を1 log単位で増加させるために必要な臭気濃度の増加を与えます。すなわち、濃度応答曲線17の急峻性の推定値である。この例では、α = 0.277、γ = 3.61;したがって、応答振幅を10倍に増やすには(すなわち、1つの対数単位;log10 = 1)、刺激濃度を103.61倍(4,074倍)増加させる必要がある。
典型的なシグモイド濃度応答曲線(図6A)を半対数でプロットした場合、この場合はL-グルタミンに、図6BBを示す。応答振幅の同様の濃度依存性の増加が見られます。しかし、高濃度では、この増加は、応答振幅が最大値(Nmax)に達するように少なくなります。これにより、データを 3 つのパラメーターの Hill 方程式に適合させることができます。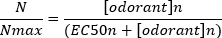
このようにして、EC50(50% の最大応答が呼び起こされる臭気濃度)とヒル共効率(シグモイド曲線の線形部分の傾きの急峻さの尺度)を算出することができる。
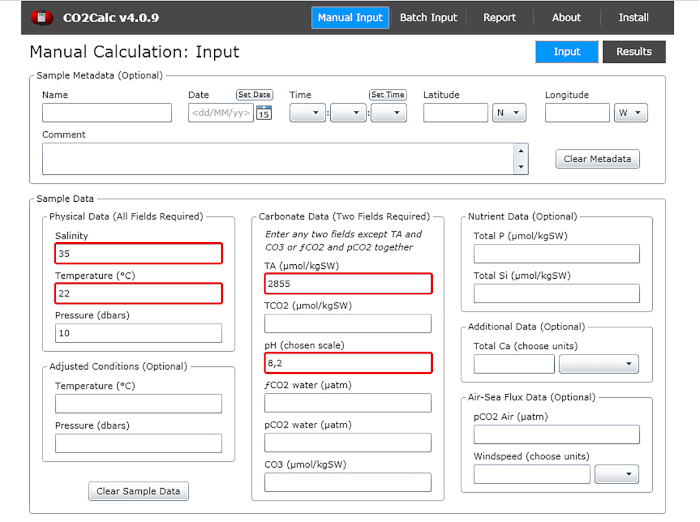
図1:プログラムCO2Calcからの入力ウィンドウを示すソフトウェアのスクリーンショット。 強調表示された (赤いボックス) は、カーボネート パラメータ計算に必要なフィールドです。 この図の大きなバージョンを表示するには、ここをクリックしてください。
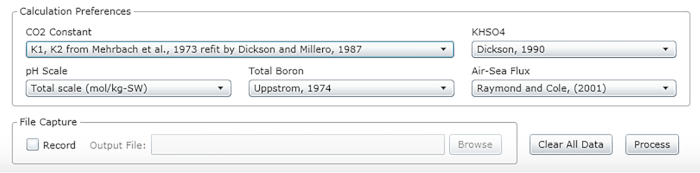
図2:適切な定数、単位、およびスケールの入力ウィンドウを示すソフトウェアのスクリーンショット。 示された値は、説明した実験が行われた条件に推奨されます。変更される可能性があります。 この図の大きなバージョンを表示するには、ここをクリックしてください。
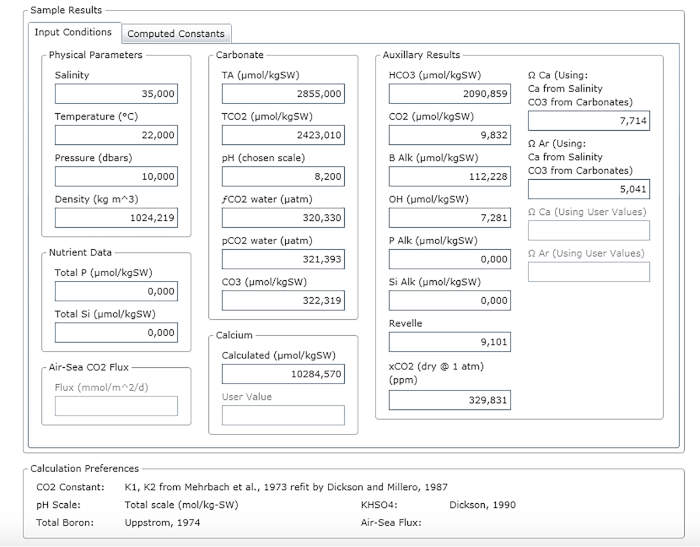
図 3: 結果ウィンドウを示すソフトウェアのスクリーンショット。この図の大きなバージョンを表示するには、ここをクリックしてください。
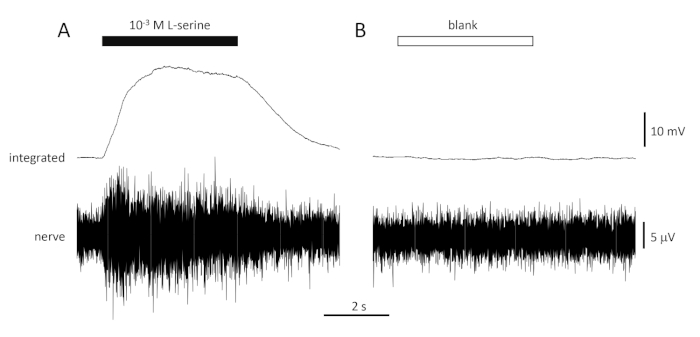
図4:典型的な多単位応答は、10-3 M L-セリン(A)およびブランク(B)に応答してインビボの海皮の嗅覚神経から細胞外に記録された。 上のトレースは統合された応答を示し、下のトレースは生の(神経)信号を示す。刺激は、嗅上皮(水平バー)に適用された。1回の曝露中の活動の急激な増加、活動のピーク、続いて宿泊施設の期間(臭気はまだ上皮に送達された)と、臭気送達が停止した後のベースラインレベルへの復帰に注意してください。臭気希釈剤と同じように処理された水による刺激に続いて、活性の増加はほとんどまたは全く見られないが、臭気(ブランク)を加える点を除く。 この図の大きなバージョンを表示するには、ここをクリックしてください。
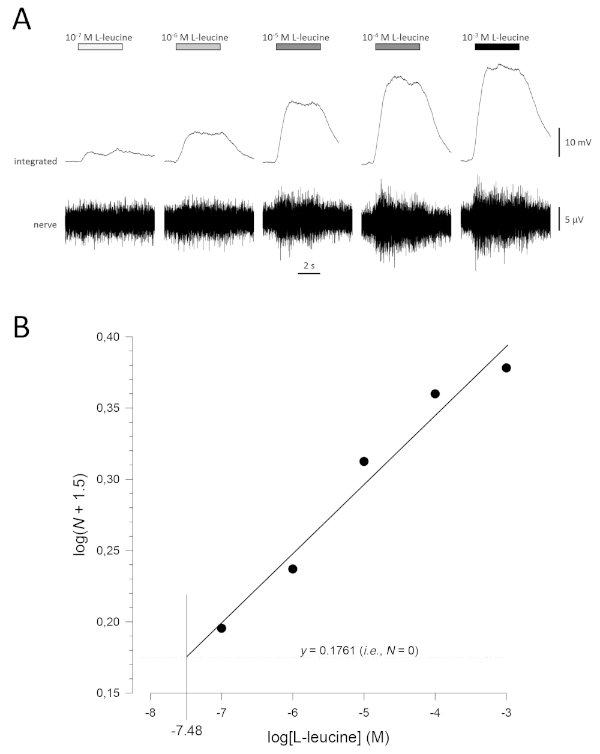
図5:生体内の嗅覚神経から細胞外に記録されたL-ロイシンの典型的な濃度応答曲線。(A)嗅上皮(水平バー)に適用されるL-leucineの濃度が10-7 Mから10-3 Mに-3増加するにつれて、神経に対する活性の増加が同時に見られる。上のトレースは統合された応答を示し、下のトレースは生の(神経)信号を示す。(B) 正規化されたデータの線形回帰 (R2 = 0.97) は、log( N + 1.5) = 0.1761 (すなわち、N = 0) の場合、検出の閾値を計算するために半対数的にプロットした。この例では、この値は -7.48 です。したがって、この魚のL-leucineの検出の推定閾値は10-7.48 Mです。
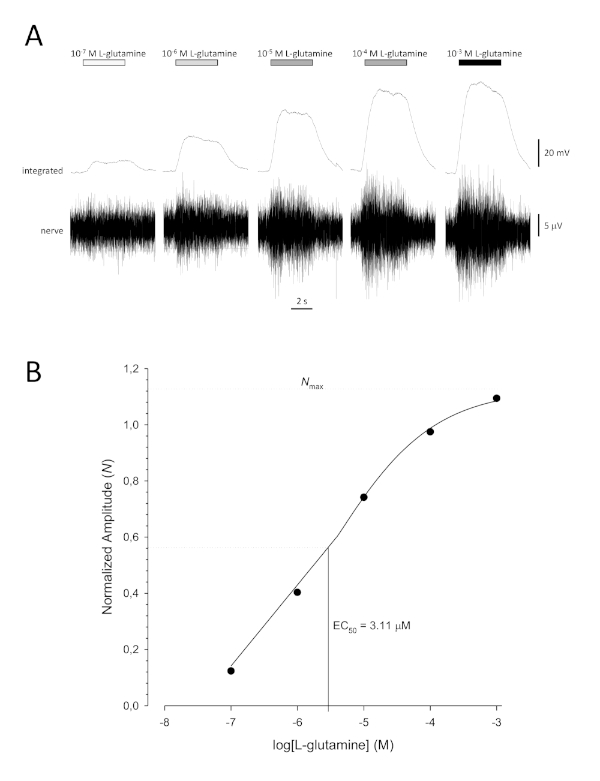
図6:生体内の嗅覚神経から細胞外に記録されたL-グルタミンの典型的な濃度応答曲線。(A)嗅上皮(水平バー)に適用されるL-グルタミンの濃度が10-7 Mから10-3 Mに増加-3するにつれて、神経に同時に増加する活性が見られる。上のトレースは統合された応答を示し、下のトレースは生の(神経)信号を示す。(B) 3 パラメータのヒル方程式(R2 = 0.99)に適合した正規化データの半対数プロット。この例では、計算された EC50 = 3.11 μM、ヒル共効率 = 0.565)。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
現在の研究では、海産栽培において非常に重要な海洋スパリッドである海鯛(S.aurata)の嗅覚神経からのマルチユニット(細胞外)記録の使用について説明している。しかし、この実験的アプローチは他の魚に広く適用することができます。手術と電極の正確な配置は、明らかに嗅覚系の解剖学に依存し、麻酔薬の選択と濃度は、研究中の種に依存する可能性があります。例えば、金魚の嗅覚神経(カラシウス・オーラトゥス)は短い。この場合、嗅球からEEGを記録する方が簡単です。臭気の選択は、ある程度、種に依存することもある。現在の研究は、アミノ酸を使用しました.著者らの知る限りでは、これまでに調査されたすべての魚種はアミノ酸1,18,18に対する嗅覚感受性を有する。この感度は、食品の位置、化学的通信、出生水の認識などの多様なプロセスに関係しています19,,20 ,21,,2222,23.しかし、異なる種の感受性は、大まかに言えば、むしろ似ており、ライフスタイルや生息地に依存しません。また、明確に定義された分子であり、安価かつ簡単に入手できます。これらの理由は、魚の嗅分に関する研究、特にヒト起源の障害(例えば、酸性化または汚染)の影響を調査する研究のための理想的な試験刺激を作り、結果は種24にわたって容易に比較することができる。
問題の種に応じて、マルチユニット記録のための準備は数時間安定したままでいることができます。内部標準(現在の研究では10-3 M L-セリン)に対する応答の振幅は、連続したテストの間で10%以上変化してはならない。この経験則からの有意な偏差は、魚の(i)動き、したがって電極および/または鼻管の変位に起因する可能性があります。(ii) 水の汚染は、例えば、実験者の手に接触することによって(特に与えられた臭気の低い濃度がより高い濃度よりも大きな応答を与える場合)または(iii)製剤の健康状態の悪化。(i)の場合、魚が移動したことを確認する必要があります。もしそうなら、それを再配置し、水に麻酔剤を追加し、/またはギャラミントリエチオ化の別の用量を与える。5分を許し、標準を再テストします。応答がまだ小さい場合は、十分に大きな応答が記録されるまで電極および/または鼻管を再配置します。(ii)の場合は、きれいなガラス製品と水を使用して、臭気の新鮮な希釈シリーズを作り直すだけです。(iii)の場合、魚のエラの上の水の流れが十分であり、水がエラの上を流れている(すなわち、口ではなくオペルキュラを介して出て)、水が十分に通気していることを確認してください。異なる魚種は、広く異なる温度の好みを持っています。実験室の温度(および魚と接触する水の温度)が魚ができるだけ温度に近いものであることを確認してください。魚がストレスを感じないようにし、記録の前に少なくとも1週間は(タンクから別のタンクにでも)移動しないようにしてください。電気的ノイズは、もちろん、電気生理学者の生命の悩みである。ただし、この問題を解決する方法と削減方法については、現在の記事では適切なメディアではありません。それにもかかわらず、「Axonガイド」(メーカーのウェブサイトからダウンロードするためのPDFとして自由に入手可能)は、ノイズ最小化に関する実用的なアドバイスの源です。一度大きな安定した応答が標準的な刺激によって呼び起こされ、濃度系列は、空白への最小応答で、振幅の濃度依存性の増加を与え、テスト刺激への応答を記録することができます。著者の中には同じ刺激を3回与え、その後のデータ分析のために算術平均を計算する人もいます。ただし、これらは技術的な複製であり、このアプローチでは、記録セッションにかかる時間が 3 倍に増加します。現在の著者は、特定の臭気を一度テストすることを好むが、常に濃度応答曲線の一部である。これは、検出またはEC50 の閾値の計算を可能にするだけでなく(説明されているように)、魚がその自然環境で経験するものに近い濃度をテストすることを保証します(これは常に知られていません)。さらに、汚染などの外れ値の応答は、見つけやすくなります。これらは、必要に応じて作りたてのサンプルを使用して繰り返すことができます。
嗅覚神経からのマルチユニット記録は侵襲的であってもよいが、外部の食分に依存しない海水7に記録するとEOGよりも敏感である。したがって、カルシウムやナトリウムなどの臭気に対する嗅覚感受性を評価するために使用することができ、その濃度の変化は導電率にも影響を与え、その結果、電圧は15を記録した。特定の臭気に反応するORNの数の推定値として(すなわち、嗅上皮から球根にORN軸索に沿って移動する作用電位)は、未処理の未処理信号を表す(嗅球内で嗅覚入力の初期処理が始まる)。したがって、EOGやEEG24、25よりも、pHなどの汚染物質の直接的な影響を25嗅覚システムに評価する方が良いパラメータです。高いPCO2(したがって低pH)と海水中の嗅球からの記録は、神経処理に対するpHの中心効果の影響を受ける可能性があります。海洋酸性化26の'GABAA受容体理論'は、水pHの減少により、CSFにおけるCl-およびHCO3-イオンの再分配と、その結果、阻害(過分極)から興奮(脱分極)へのGABAergic活性化のシフトを引き起こす。3-さらに、このような研究では、魚がその自然環境で遭遇する可能性が高いものと同様の臭気濃度を用いて酸性化または汚染物質の影響を評価することが重要である。アミノ酸の場合、ナノからマイクロモルの範囲27、28、2928,29です。27魚1、18,18でこれらの化合物の検出の閾値に近い。特定の臭気に対する検出の閾値の推定は、嗅覚感受性の重要性および/または生物学的役割の考えを与えることができる。例えば、海のランプレー(ペトロマイゾンマリヌス)は、幼虫によって放出される特定の胆汁酸に対して高い嗅覚感受性を有し、10-13 M30の閾値まで下がった。-13この感度は、成人が適切な産卵場を見つけて特定することを可能にし、したがって、長距離にわたって回遊フェロモンとして機能する。同様に、熟した雌の海のランプレーは、スペルミン(閾値10-14 M)に対して高い嗅覚感受性を有し、男性によってミルト中に放出されるポリアミンであり、その後、精子化した雄の巣31に引き付ける。他の魚はまた、ポリアミン32、33、34、3533,34に嗅覚感受性を有するが、35同様のフェロモナルの役割をサポートするために十分に低い検出閾値を有しない。32代わりに、魚の腐敗の回避が示唆される。それにもかかわらず、このような高嗅覚感度を有する、感度のわずかな低下(すなわち、閾値の増加)を想像することができ、応答振幅が劇的に低下しない場合であっても、魚24に対して深刻な問題を引き起こす可能性がある。
半対数でプロットすると、臭気に対する濃度応答曲線は指数、線形、またはシグモイド18であり得る。アミノ酸の場合、このような半対数濃度応答曲線は、線形(すなわち、対数)、シグモイドまたはパワー機能7のいずれかである。応答の飽和が見られないこと(すなわち、集中応答曲線にプラトーがなく、超環境濃度であっても)は、特定の受容体に結合する各アミノ酸ではなく、個々のアミノ酸に結合するいくつかの受容体によるものと考えられます。与えられたアミノ酸の濃度が増加するにつれて、より多くの受容体がそれを結合し、したがって応答することができる。それにもかかわらず、魚はアミノ酸の混合物を区別することができます36, 37,37,38,39;これは、嗅球12,40,40に誘発される活動の組み合わせパターンによる可能性が高い。同じ受容体タンパク質を発現する全てのORNの軸索は、嗅球体41、42において同じ糸球体で終止し、142つのアミノ酸は複数の糸球体を活性化することができる。
しかし、フェロモンのような非常に特異的な臭気は、シグモイドまたは準シグモイド濃度応答曲線43,44,44を呼び起こす可能性がある。推論は、経験的にテストされていないが、これらの嗅覚応答はフェロモン分子と他にほとんど結合する非常に特異的な受容体によるものである。したがって、所定の濃度を超えると、すべての受容体が占有され、さらに増加しても、他のORNではそれ以上の応答は起こらない。したがって、これらのデータは、3パラメータヒルプロットに適合することができ、最大応答、EC50とヒル共効率は15、45、4645,46を計算することができます。15これは、線形または指数濃度応答曲線が与えることができない、見かけの親和性や明らかな受容体数などの貴重な情報を与えることができます。
開示事項
著者らは開示するものは何もない。
謝辞
著者の研究室での作業は、フンダソン・パラ・ア・シエンシア・エ・ア・テクノロジア(FCT)、ポルトガル、PTDC/BIA-BMA/30262/2017、UID/Multi/04326/2019、契約プログラムDL57/2016/CP1361/CT041によってZVVに支援されています。
資料
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
参考文献
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C. Chemoreception. The Physiology of Fishes. Evans, D. H., Claiborne, J. B. , CRC Press. Boca Raton, FL. 471-497 (2006).
- Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. Sorensen, P. W., Wisenden, B. D. , John Wiley & Sons Inc. Ames, IA. 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. Spielman, A. I., Brand, J. G. , CRC Press. Boca Raton, FL. 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, TN. (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor? Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P. Jr, Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633(2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. Schulte, B., Goodwin, T., Ferkin, M. , Springer. Cham, Switzerland. 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731(2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332(2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved