Method Article
Gravação multi-unitular extracelular do nervo olfativo dos teleóstos
Neste Artigo
Resumo
O registro multi-unitular extracelular do nervo olfativo é um método sensível, robusto e reprodutível para avaliar a sensibilidade olfativa em peixes marinhos. Registra entrada sensorial primária e é independente da salinidade externa.
Resumo
Estudos recentes mostraram que a acidificação dos oceanos afeta o comportamento olfativo em peixes. Isso pode ser devido, em parte, a uma redução da sensibilidade olfativa em alta PCO2/baixa água pH. Para avaliar os efeitos da acidificação dos oceanos, ou sensibilidade olfativa em peixes marinhos em geral, propomos que o registro extracelular de várias unidades do nervo olfativo seja o método de escolha. Embora invasivo, é sensível, robusto, reprodutível e independente da salinidade externa (ao contrário do eletro-olfactograma [EOG], por exemplo). Além disso, registra uma entrada sensorial primária no CNS, antes de qualquer processamento central. Mostramos que este método pode mostrar uma redução da sensibilidade olfativa que é temporária e dependente de odorantes, utilizando uma gama de aminoácidos para construir curvas de concentração-resposta e calcular os limiares de detecção.
Introdução
Os peixes dependem fortemente da olfação para muitos aspectos de suas vidas, incluindo encontrar alimentos, evitar predadores, avaliar potenciais companheiros e migração, entre outros1,,2,3. Portanto, avaliando a sensibilidade olfativa em peixes (o que eles cheiram? Quão sensíveis eles são para esses compostos?) é vital para entender completamente esses processos. Além disso, os efeitos antropogênicos sobre o meio ambiente, como a acidificação dos oceanos e a poluição, podem ter efeitos profundos no sistema olfativo, mesmo em níveis subletais, pois está necessariamente em contato íntimo com a água circundante4. A eletrofisiologia in vivo é a abordagem experimental escolhida para avaliar a sensibilidade olfativa em peixes. Três técnicas principais estão disponíveis: o eletro-olfactograma (EOG), o eletro-encefalograma (EEG) registrado a partir da lâmpada olfativa e o registro multi-unitário do nervo olfativo5.
O EOG é o mais utilizado destes três6. É um potencial de campo de corrente direta (DC) registrado acima do epitélio olfativo e acredita-se ser o potencial gerador somado desses neurônios receptores olfativos (ORNs) respondendo a um determinado odorante. No entanto, como é registrado na água, e não dentro do peixe, a amplitude de resposta não depende apenas do sinal gerado pelos peixes, mas também da condutividade da água circundante; quanto maior a condutividade (ou menor a resistência), menor será a amplitude. Isso pode significar que o EOG é um método menos sensível na água do mar do que a água doce7.
O EEG registrado a partir da lâmpada olfativa também é amplamente utilizado na investigação da olfação em peixes. No entanto, a lâmpada olfativa é o centro de processamento de primeira ordem para entrada sensorial olfativa8; é altamente organizado em glomeruli, e consequentemente a resposta registrada depende fortemente da posição dos eletrodos de gravação. Por exemplo, a entrada de ORNs detectando aminoácidos é processada por glomeruli na região lateral das lâmpadas olfativas, enquanto que a partir de produtos químicos derivados conespecíficos é direcionada para a região medial9,,10,,11,12. A entrada feromônio pode ser direcionada para glomeruli altamente localizado dentro da lâmpada olfativa. Dependendo também da anatomia da espécie em questão, a posição de gravação ideal para um determinado odorno pode não ser facilmente acessível.
O registro multi-unidade do nervo olfativo contorna os principais problemas com o EOG e o EEG descritos acima. Como registra potenciais de ações passando os axônios dos ORNs do epitélio para a lâmpada, é um sinal sensorial primário. E como é registrado dentro do peixe, a amplitude de resposta é independente da salinidade externa. No entanto, é claro que tem algumas desvantagens. Em primeiro lugar, dependendo da anatomia da espécie, uma cirurgia mais extensa é necessária para expor o nervo olfativo do que para o EOG. Em segundo lugar, como o sinal é menor que o EOG, requer equipamentos um pouco mais sofisticados e, portanto, caros. Uma descrição geral de outras abordagens experimentais é dada por John Caprio5. O objetivo deste artigo é descrever como registrar respostas extracelulares multi-unidades do nervo olfativo do seabream (Sparus aurata) in vivo aos odores aminoácidos como exemplo dessa técnica, e como identificar, e superar, alguns dos problemas mais comuns encontrados em tal experimento.
Protocolo
A manutenção e experimentação de animais foi realizada em instalações experimentais certificadas e seguiu a legislação nacional portuguesa (DL 113/2013) sob licença de "grupo-1" pela Direção Geral Veterinária, Ministério da Agricultura, Desenvolvimento Rural e Pesca de Portugal. Como este protocolo envolve o manejo animal, ele tem que ser aprovado pelo órgão local e/ou nacional que regula o bem-estar dos animais utilizados em experimentos científicos, além disso os pesquisadores precisam ter o treinamento e licenças adequados para realizar tais procedimentos.
1. Preparação de estímulos
NOTA: A maioria dos peixes tem sistema olfativo altamente sensível, portanto, deve-se tomar muito cuidado ao preparar os estímulos olfativos a serem utilizados no experimento. Os vidros utilizados para compor os estímulos devem ser lavados em 5% de alvejante (hipoclorito de sódio), enxaguado completamente com água da torneira e seco. Imediatamente antes de usar enxágue bem o vidro com água do mar (a mesma água usada para fazer as diluições de estímulo). Tome cuidado para que nenhuma dessas águas entre em contato com a pele nua.
- Faça 100 mL de 10-2 M L-glutamina, L-leucina e L-serine; armazenar 1 mL de alíquotas de cada um a -20 °C até usar.
- No dia do experimento, prepare-se a partir dessas alíquotas, soluções de 10-3 M a 10-7 M (em etapas de diluição x10) usando tanto controle quanto alta água do mar CO2.
NOTA: L-serine (10-3 M) será usado como um controle positivo, ou padrão. A água usada para compor as diluições dos estímulos, e tratada exatamente da mesma forma que os estímulos, mas sem adição de qualquer odorante, será usada como controle negativo ou em branco.
2. Preparação de controle e água de CO2 alta
- Prepare a água de controle coletando 1 L de água do mar filtrada por carvão.
- Usando uma sonda de pH, verifique o pH; deve ser em torno de 8.2. Se não, bolha com ar atmosférico até que este pH seja atingido.
- Usando um titrador de alcalinidade mede a alcalinidade da água.
- Meça a temperatura da água e a salinidade.
- Prepare água de CO2 alta filtrando 1 L de água do mar e, em seguida, bolha CO2 até que o pH desejado seja atingido.
- Usando uma sonda de pH, verifique o pH; deve ser em torno de 7.7.
- Usando um titrador de alcalinidade, meça a alcalinidade da água.
- Meça a temperatura da água e a salinidade.
- Determine a pressão de CO2 tanto no controle quanto na água de CO2 alta usando um software projetado para calcular parâmetros de CO2 na água (por exemplo, software CO2Calc13).
- Na janela de entrada adicione os valores de pH de água, temperatura, salinidade e alcalinidade total(Figura 1).
- Selecione as constantes, unidades e escalas (veja os valores recomendados na Figura 2).
- Pressione o processo do botão para determinar a pressão do CO2.
NOTA: A Figura 3 mostra um exemplo de uma folha de resultado.
3. Preparação do peixe
NOTA: Um seabream de 200-400 g é usado neste protocolo.
- Anestesiar o byimmersion do peixe em água do mar natural arejada contendo MS222 (sal metanosulfonato de metano etílico etílico etílico etílico etílico etílico etílico. Quando a resposta a uma pitada de cauda parou, injete no músculo flanco o bloqueador neuromuscular gallamina trietodida (10 mg·kg-1 em soro fisiológico).
NOTA: A concentração de anestésico utilizado varia entre as espécies; para um seabream de 200-400 g, use 200 mg· L-1 tamponado com 400 mg· L-1 NaHCO3. - Coloque o peixe anestesiado em um suporte amortecido. A forma exata e o tamanho dependem da espécie modelo; para seabream (200-400 g), use um suporte acolchoado em forma de V, feito em casa.
- Coloque um tubo de silício (diâmetro = 10 mm) na boca, conecte o tubo a uma bomba submersível em um reservatório de água do mar anestesiada, arejada e bombeie água sobre as brânquias a ~100 mL·min-1·kg-1.
NOTA: O tamanho do tubo de silício utilizado dependerá do tamanho do peixe. - Insira o pino de terra no músculo flanco e conecte-o ao estágio da cabeça do amplificador).
- Cubra o peixe com pano úmido (ou toalha de papel) apenas com a cabeça exposta, garantindo que a cobertura não impeça a saída de água das brânquias.
NOTA: Os olhos podem ser cobertos com pedaços de papel/pano úmido ou plástico preto. - Posicione o tubo do sistema de estimulação-entrega, ou seja, o tubo de vidro conectado a um suprimento de água do mar de fundo, na narina.
NOTA: Podem ser utilizados tubos micro-hematócritos (comprimento = 75 mm, ID = 1,15 mm, OD = 1,55 mm); estes podem ser puxados para um ponto mais fino em um puxador de eletrodos para uso com peixes menores. É importante garantir que o epitélio olfativo seja mantido molhado durante a cirurgia (descrito abaixo). - Exponha os nervos olfativos removendo a pele e o osso do crânio entre os olhos (os nervos olfativos geralmente correm juntos entre os olhos) com o auxílio de uma broca dentária (idealmente) ou hobby (por exemplo, Dremel) ou polidor de joalheiro (com brocas dentárias) sob um microscópio dissecando (dentro de uma gaiola faraday).
- No mar, remova a parte do crânio imediatamente acima dos olhos, com uma serra circular, de apenas anterior aos olhos para apenas posterior a eles. Em seguida, usando uma broca, remova o osso entre os olhos; os nervos olfativos estão entre os olhos.
- Uma vez que o osso suficiente tenha sido limpo, remova a gordura e o tecido conjuntivo sobreopendo os nervos usando fórceps finos; tome cuidado para não danificar os nervos ou perfurar quaisquer vasos sanguíneos.
NOTA: A experiência ajudará a refinar a dissecção; quanto menor a dissecação, mais estável será a preparação. No entanto, o tecido suficiente deve ser limpo; para os não-experimentais, quando as lâmpadas olfativas são apenas visíveis, claramente mais anteriormente para expor a parte dos nervos à medida que se juntam às lâmpadas para permitir o posicionamento correto dos eletrodos. - Limpe os eletrodos antes de serem usados conectando-os ao polo negativo de uma fonte DC de 3V (por exemplo, duas baterias AA em série) e colocando a ponta em soro fisiológico (ou água do mar diluída 1:3 em água doce) para 20-30 s; um fluxo constante de pequenas bolhas deve ser visto vindo da ponta.
- Uma vez expostos os nervos olfativos, insira os eletrodos de gravação (mantidos em micro-manipuladores) em uma posição que dê uma resposta máxima ao padrão (por exemplo, 10-3 M L-serine) e uma resposta mínima ao branco. Use eletrodos de tungstênio revestidos de parileno(Tabela de Materiais)conectados ao estágio da cabeça de um preamplificador de corrente alternada (AC).
NOTA: No feixe de mar, as respostas mais fortes aos aminoácidos são geralmente vistas com os eletrodos colocados no lado lateral do nervo, perto de onde se junta à lâmpada olfativa. Isso pode ser verdade para outras espécies, já que a organização glomerular da lâmpada é amplamente semelhante entre as espécies. No entanto, a experiência é sempre a melhor professora.
4. Gravação eletrofisiológica
NOTA: Como na maioria das eletrofisiologia, a gravação multi-unidade precisa ocorrer dentro de uma gaiola de Faraday. No entanto, a gravação extracelular geralmente não requer uma tabela anti-vibração; a maioria dos movimentos virá dos peixes. No entanto, uma tabela forte e estável é necessária com uma superfície metálica para proteger as bases magnéticas dos suportes de micro-manipuladores.
- Configure um sistema de entrega de estímulos para permitir a mudança rápida da água de fundo limpa para a água contendo estímulos, por exemplo, usando uma válvula tridirecional operada por solenoides. Conecte a saída comum ao tubo que transporta água para a roseta olfativa, e coloque uma linha em um reservatório de água do mar e a outra na solução de teste.
NOTA: Quando a válvula é comutada (passando a corrente DC), o fluxo de água muda da água de fundo para aquela que contém o odorante. O estímulo deve ser dado por tempo suficiente para ver um pico claro na resposta integrada, seguido de um período de acomodação; o tempo utilizado no protocolo atual é de 4 s, mas o tempo mais longo pode ser necessário dependendo da espécie. - Conecte o driver da válvula ao gatilho de um conversor analógico-digital (por exemplo, Digidata); quando a válvula é mudada de fundo para linha contendo estímulos, isso iniciará a gravação dos dados. Configure o software para iniciar a gravação no evento de acionamento e continue por um período predeterminado (por exemplo, 10 s).
NOTA: Dez segundos devem ser suficientes, mas isso pode ser encurtado ou alongado, dependendo da questão experimental. - Verifique a estabilidade da preparação testando (registrando e medindo a amplitude da resposta integrada) repetidamente com o padrão, 10-3 M L-serino neste caso, e permitindo que 1 min decora entre estímulos sucessivos.
NOTA: Dependendo, em certa medida, das espécies e do odorante, as respostas devem ter uma amplitude dentro de 10% uma da outra (como regra geral), e devem ter um início rápido, subir à atividade máxima e retornar à linha de base após a ausência do estímulo(Figura 4). - Registre as respostas nervosas olfativas aos aminoácidos no controle da água do mar (da menor à maior concentração) e permita que 1 minuto decorrido entre estímulos sucessivos.
NOTA: É possível que, para algumas espécies e/ou alguns odores, mais tempo seja necessário. Mas para aminoácidos e seabream, 1 min é suficiente. - Regisso responder a10-3 M serino e uma solução em branco de água de controle.
- Mude a água de fundo do controle da água do mar para a água do mar de CO2 alta, colocando a linha de fundo na garrafa com alta água do mar CO2.
NOTA: É aconselhável inserir outro tubo hematócrito (ou equivalente) na extremidade do estímulo e linhas de fundo para evitar tocar na água e garantir que a extremidade do tubo permaneça na água. - Antes de testar a resposta do nervo olfativo aos aminoácidos na água do mar de CO2, condicionar o epitélio olfativo com água co2 alta seguindo a água alta de CO2 sobre o epitélio olfativo por alguns minutos.
NOTA: A experiência mostrou que, para o seabream, 5 min é suficiente. - Registre as respostas nervosas olfativas aos aminoácidos na água do mar de CO2 (da menor à maior concentração).
- Regisso a resposta a uma solução em branco de água de CO2 alta.
- Regisso responder a10-3 M serino e uma solução em branco de água de controle.
NOTA: O sinal bruto (atividade nervosa) deve ser filtrado (passe baixo em torno de 2.000-5.000 Hz, passe alto de 50-300 Hz) e passado para um conversor analógico-digital(Tabela de Materiais). Para facilitar a quantificação da atividade nervosa, o sinal bruto também pode ser integrado usando um integrador de vazamento(Tabela de Materiais) e passado para o conversor analógico-digital, e a partir daí, sinais brutos e integrados para um computador executando o software apropriado (por exemplo, Axoscope).
5. Análise de dados
- Subtraia a amplitude da resposta integrada ao em branco (em mV) da amplitude das respostas integradas a todos os estímulos.
- Normalizar as respostas aos estímulos dividindo a amplitude da resposta anterior à norma (serina de 10a 3 M); isso reduz a variabilidade entre inter e intra-peixes.
- Calcule os limiares de detecção por regressão linear das curvas de concentração-resposta (em um plot semi-logarítmico), de acordo com o registro de fórmula(N + 1,5) = umtronco C + B,onde C é a concentração molar, N é a amplitude de resposta normalizada, e a e b são constantes7,,14.
NOTA: O limiar de detecção é, então, o valor para x onde y = 0,1761 (ou seja, log 1.5; N = 0); a concentração acima da qual uma resposta será vista (ou seja, o peixe pode cheirá-lo). Alguns odores evocam curvas de concentração-resposta sigmoidal quando plotados semi-logaritmicamente (por exemplo, cálcio15,16; neste caso, os dados normalizados podem ser ajustados a um lote de colina de três parâmetros que dará a amplitude máxima de resposta e a EC50 (ou seja, [odora) que dá resposta meio máxima; também uma medida de sensibilidade). - Compare os limiares de detecção e/ou a amplitude máxima de resposta e a EC50 de estímulos testados em água de controle e aqueles testados em alta água de CO2.
Resultados
Uma resposta típica ao controle positivo (10-3 M L-serine; Figura 4A) e controle negativo (em branco; Figura 4B) registrada a partir do nervo olfativo de um feixe de mar é mostrada na Figura 4. Na presença do estímulo (barra horizontal preta; na cavidade olfativa, em contato com o epitélio olfativo), observe o rápido aumento da atividade (refletido na deflexão ascendente do sinal integrado) para um pico dentro de cerca de um segundo do início do estímulo, seguido por um período de acomodação (enquanto o estímulo ainda está presente), e um retorno à atividade de linha de base uma vez que o estímulo tenha terminado. A amplitude absoluta da resposta é altamente dependente da posição do eletrodo; se uma resposta de baixa amplitude for registrada, tente alterar as posições do eletrodo. Um aumento mais lento para o pico de atividade pode ser devido ao tubo que transporta a água contendo estímulos para o epitélio olfativo sendo colocado muito longe do epitélio; tente mover o tubo do nariz mais perto (mas não tocar) o epitélio. Note que, em contraste, o espaço em branco evoca pouca ou nenhuma resposta. Uma resposta positiva significativa (ou seja, aumento da atividade) ao espaço em branco pode indicar contaminação da água utilizada para fazer as diluições dos estímulos; fazer diluições frescas com água limpa (e vidros) deve resolver isso. Caso não, pode ser necessária uma limpeza mais completa do sistema de água (incluindo filtros de carvão ativados). Uma resposta negativa (ou seja, diminuição da atividade) pode indicar uma ligeira mudança na taxa de fluxo quando a válvula é comutada devido, por exemplo, a um bloqueio na válvula.
Uma curva típica de concentração-resposta (plotada semi-logaritmicamente), neste caso para L-leucine (10-7 M a 10-3 M), é mostrada na Figura 5A. Note-se que as concentrações crescentes do odor evocam aumentos cada vez maiores na atividade e, portanto, na amplitude das respostas integradas. Um gráfico dos dados normalizados, e sua regressão linear correspondente, é mostrado na Figura 5B. O limiar estimado de detecção pode ser calculado a partir do valor de x quando y = 0,1761 (i.e., log1.5; onde N = 0). Neste caso, esse valor é de -7,48; ou seja, o limiar calculado para L-leucina neste peixe é de 10-7,48 M. O expoente α pode ser estimado da regressão linear dos dados normalizados em um plot log-log; logN = αlog[odorante] + constante. O fator γ então dá o aumento da concentração de odorante necessária para aumentar a amplitude de resposta por uma unidade de registro; ou seja, é uma estimativa da inclinação da curva concentração-resposta17. Neste exemplo, α = 0,277 e γ = 3,61; portanto, para aumentar a amplitude de resposta dez vezes (ou seja, uma unidade de tronco; log10 = 1), a concentração de estímulo precisa ser aumentada em 103,61vezes (4.074 vezes).
Uma típica curva sigmoidal de concentração-resposta(Figura 6A) quando plotada semi-logaritmicamente, neste caso para L-glutamina, é mostrada na Figura 6B. É observado um aumento semelhante dependente da concentração na amplitude de resposta; no entanto, nas concentrações mais elevadas, esse aumento torna-se menor para que a amplitude de resposta atinja um máximo(Nmax). Isso permite que os dados sejam instalados em uma equação de três parâmetros de Hill: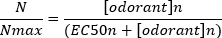
Dessa forma, a EC50 (a concentração de odorante na qual uma resposta máxima de 50% é evocada) e a Colina coeficiente (uma medida da inclinação da inclinação da parte linear da curva sigmoidal) podem ser calculadas.
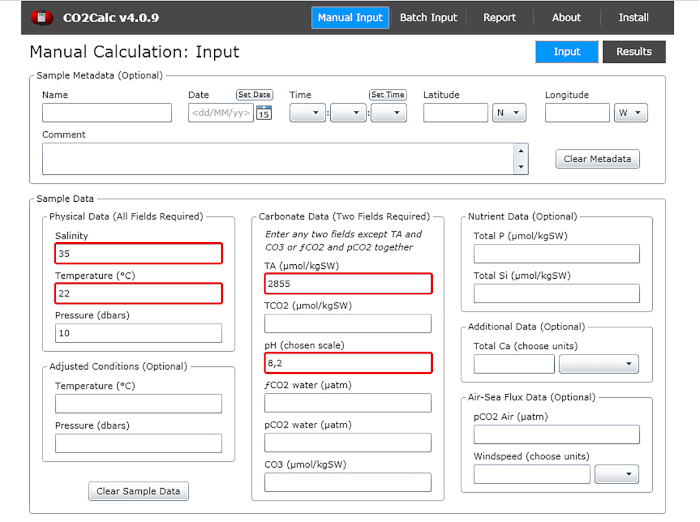
Figura 1: Captura de tela de software mostrando a janela de entrada do programa CO2Calc. Destacados (caixas vermelhas) são os campos necessários para o cálculo do parâmetro de carbonato. Clique aqui para ver uma versão maior desta figura.
Figura 2: Captura de tela de software mostrando a janela de entrada para as constantes, unidades e escalas apropriadas. Os valores apresentados são recomendados para condições sob as quais os experimentos descritos foram realizados; eles podem mudar. Clique aqui para ver uma versão maior desta figura.
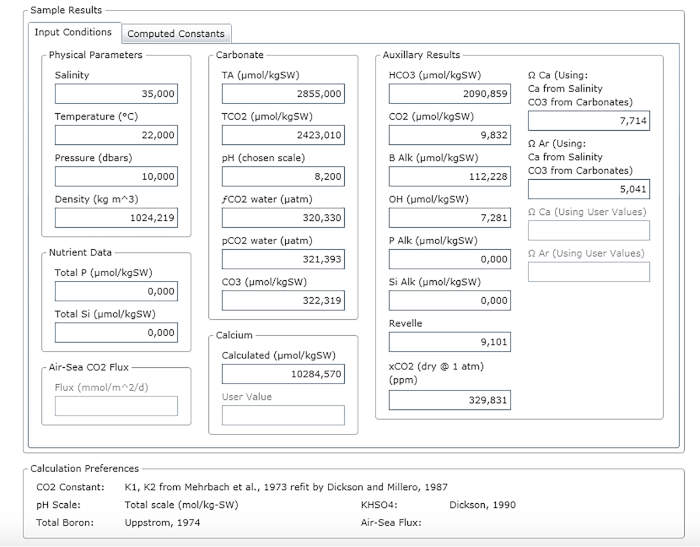
Figura 3: Captura de tela de software mostrando a janela de resultados. Clique aqui para ver uma versão maior desta figura.
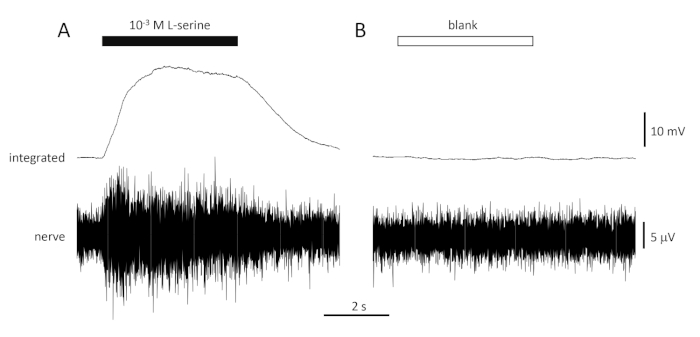
Figura 4: Respostas típicas de várias unidades registradas extracelularmente a partir do nervo olfativo do seabream in vivo em resposta a 10-3 M L-serine (A) e em branco (B). Traços superiores mostram as respostas integradas e traços inferiores mostram o sinal bruto (nervoso). Os estímulos foram aplicados ao epitélio olfativo (barras horizontais). Observe o rápido aumento da atividade durante os 1 s de exposição, um pico de atividade, seguido de um período de acomodação (enquanto o odor ainda foi entregue ao epitélio) e um retorno aos níveis de linha de base uma vez que a entrega do odor tenha cessado. Pouco ou nenhum aumento na atividade é visto após a estimulação com água tratada da mesma forma que diluições odorantes, com exceção da adição de qualquer odorante (em branco). Clique aqui para ver uma versão maior desta figura.
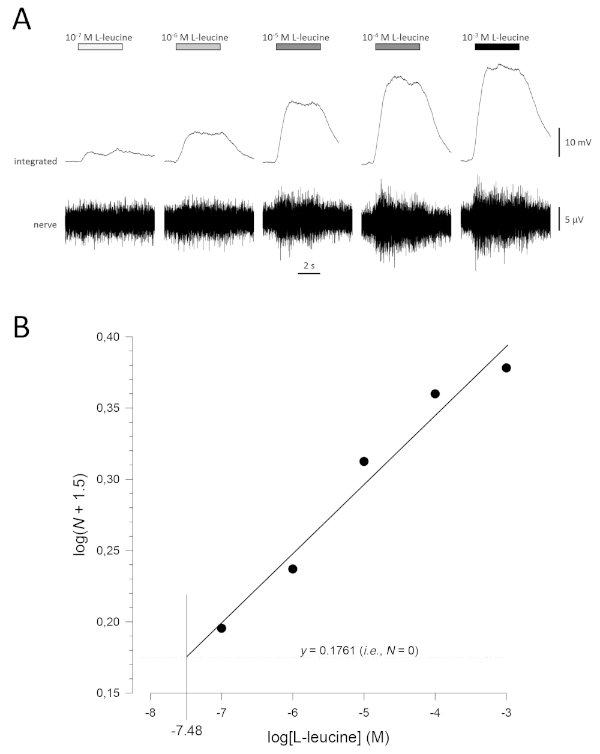
Figura 5: Curva típica de concentração-resposta para L-leucina registrada extracelularmente do nervo olfativo in vivo. (A) À medida que a concentração de L-leucina aplicada ao epitélio olfativo (barras horizontais) aumenta de 10-7 M para 10-3 M, um aumento concomitante na atividade é visto no nervo. Traços superiores mostram as respostas integradas e traços inferiores mostram o sinal bruto (nervoso). (B) Regressão linear (R2 = 0,97) de dados normalizados plotados semi-logaritmicamente para calcular limiar de detecção como o valor para log[L-leucine] quando log (N + 1,5) = 0,1761 (i.e., onde N = 0). Neste exemplo, esse valor é de -7,48; o limite estimado de detecção de L-leucina neste peixe é, portanto, de 10-7,48 M. Por favor clique aqui para ver uma versão maior deste número.
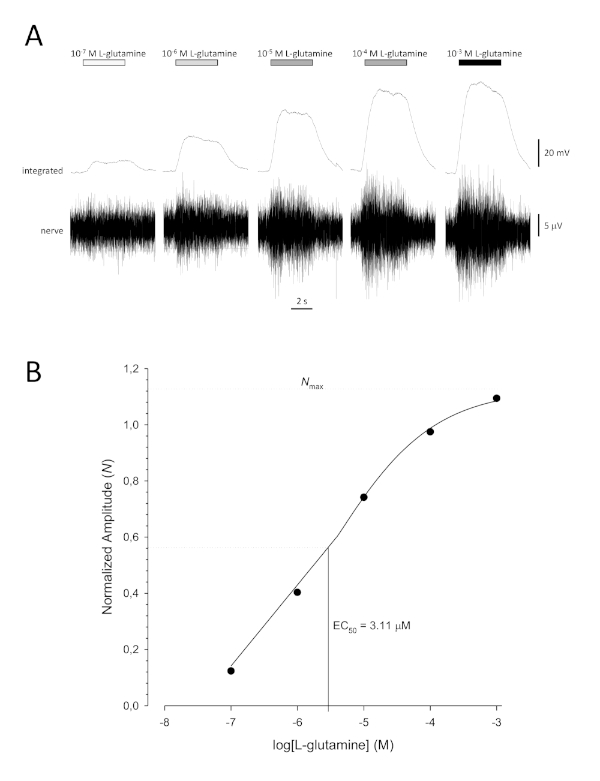
Figura 6: Curva típica de concentração-resposta para L-glutamina registrada extracelularmente do nervo olfativo in vivo. (A) À medida que a concentração de L-glutamina aplicada ao epitélio olfativo (barras horizontais) aumenta de 10-7 M para 10-3 M, um aumento concomitante na atividade é visto no nervo. Traços superiores mostram as respostas integradas e traços inferiores mostram o sinal bruto (nervoso). (B) Parcela semi-logarítmica de dados normalizados encaixado em uma equação de colina de três parâmetros (R2 = 0,99). Para este exemplo, a ECcalculada 50 = 3,11 μM, e a Colina coeficiente = 0,565). Clique aqui para ver uma versão maior desta figura.
Discussão
O presente estudo descreve o uso de registro multi-unitular (extracelular) a partir do nervo olfativo da ave(S. aurata),um espaávido marinho de grande importância na aquicultura. No entanto, essa abordagem experimental pode ser amplamente aplicada a outros peixes; a cirurgia e a colocação exata de eletrodos dependerá claramente da anatomia do sistema olfativo, e a escolha e concentração de anestésicos podem depender das espécies em estudo. Por exemplo, o nervo olfativo do peixinho dourado (Carassius auratus) é curto; neste caso, gravar o EEG da lâmpada olfativa seria mais fácil. A escolha do odor também pode depender, em certa medida, da espécie. O presente estudo utilizou aminoácidos. Até onde os autores sabem, todas as espécies de peixes investigadas até o momento têm sensibilidade olfativa aos aminoácidos1,,18. Essa sensibilidade tem sido implicada em diversos processos como localização alimentar, comunicação química e reconhecimento das águas natalinas19,20,21,,22,,23. No entanto, as sensibilidades de diferentes espécies são, em linhas gerais, bastante semelhantes e não dependem do estilo de vida ou habitat. Eles também são moléculas bem definidas e estão baratos e facilmente disponíveis. Essas razões os tornam estímulos de teste ideais para estudos sobre olfação em peixes, especialmente aqueles que investigam os efeitos de distúrbios antropogênicos (por exemplo, acidificação ou poluição), onde os resultados podem ser facilmente comparados entre as espécies24.
Dependendo da espécie em questão, os preparativos para o registro multi-unidade podem permanecer estáveis por várias horas; a amplitude de resposta ao padrão interno (10-3 M L-serino no presente estudo) não deve variar em mais de 10% entre os testes sucessivos. Qualquer desvio significativo desta regra de ouro pode ser devido a: (i) movimento do peixe e, portanto, deslocamento dos eletrodos e/ou tubo de nariz; (ii) a contaminação da água, por exemplo, ao entrar em contato com as mãos do experimentador (especialmente se concentrações menores de um determinado odor dão respostas maiores do que concentrações mais elevadas); ou (iii) deterioração da saúde da preparação). No caso (i), o peixe deve ser verificado por ter se mudado; se assim for, reposicione-o e adicione mais anestésico à água e/ou dê outra dose de trietodeida de gallamina. Permita 5 min e teste novamente o padrão. Se a resposta ainda for menor, reposicione os eletrodos e/ou tubo de nariz até que uma resposta suficientemente grande seja registrada. No caso (ii), basta refazer uma série de diluição fresca do odor, usando vidros limpos e água. No caso (iii), verifique se o fluxo de água sobre as brânquias do peixe é adequado, que a água está fluindo sobre as brânquias (ou seja, saindo através da opercula, em vez da boca), e a água está bem arejada. Diferentes espécies de peixes têm preferências de temperatura amplamente diferentes; garantir que a temperatura do laboratório (e a da água em contato com o peixe) seja o mais próximo possível da temperatura em que os peixes são mantidos. Certifique-se, também, que os peixes não estão estressados, e evite movê-los (mesmo de um tanque para outro) por pelo menos uma semana antes da gravação. O ruído elétrico é, naturalmente, a bane da vida de um eletrofisiologista; no entanto, o artigo atual não é o meio apropriado para discutir como superar/reduzir isso. No entanto, 'The Axon Guide' (disponível livremente como pdf para download no site do fabricante) é uma fonte de conselhos práticos sobre minimização de ruídos. Uma vez que uma resposta grande e estável é evocada pelo estímulo padrão, e uma série de concentração dá um aumento dependente da concentração em amplitude, com resposta mínima ao espaço em branco, as respostas de gravação aos estímulos de teste podem começar. Alguns autores dão o mesmo estímulo três vezes, e calculam a média aritmética para análise de dados subsequente. No entanto, essas são réplicas técnicas, e essa abordagem aumentará o tempo que uma sessão de gravação leva em três vezes. Os autores atuais preferem testar um determinado odor uma vez, mas sempre parte de uma curva de concentração-resposta. Isso não só permite o cálculo do limiar de detecção ou EC50 (como descrito), mas também garante que as concentrações próximas às que o peixe experimentaria em seu ambiente natural sejam testadas (isso nem sempre é conhecido). Além disso, quaisquer respostas outlier, devido à contaminação, por exemplo, são mais fáceis de detectar; estes podem então ser repetidos usando uma amostra recém-feita, se necessário.
O registro multi-unitário do nervo olfativo pode ser invasivo, mas é mais sensível do que o EOG quando registrado na água do mar7,pois é independente da salinidade externa. Pode, portanto, ser utilizado para avaliar a sensibilidade olfativa aos odores, como cálcio e sódio, alterações nas concentrações das quais também afetariam a condutividade e, consequentemente, tensões registradas15. Como estimativa do número de ORNs respondendo a um determinado odor (ou seja, potenciais de ação viajando ao longo de axônios ORN do epitélio olfativo para a lâmpada), ele representa um sinal bruto e não processado (o processamento inicial de entrada olfativa começa nas lâmpadas). Portanto, é melhor parâmetro avaliar os efeitos diretos dos poluentes, como metais pesados, e mudanças ambientais, como o pH, no sistema olfativo do que o EOG ou EEG24,25. O registro da lâmpada olfativa na água do mar com alto COP 2 (e, portanto, baixo pH) pode ser afetado por efeitos centrais do pH no processamento neural; a 'teoria do receptor GABAA' da acidificação do oceano26, pela qual a redução do pH da água causa uma redistribuição de Cl- e HCO3- íon no CSF e uma consequente mudança da ativação GABAérgica de inibidor (hiperpolarizante) para excitatório (despolarizante). Além disso, em tais estudos, é importante avaliar os efeitos da acidificação ou poluentes utilizando concentrações odorantas semelhantes às que o peixe provavelmente encontrará em seu ambiente natural. Para aminoácidos, este é na faixa nano a micromolar27,28,29; próximo ao limiar de detecção desses compostos em peixes1,,18. A estimativa do limiar de detecção de um determinado odorno pode dar alguma ideia da importância e/ou papel biológico da sensibilidade olfativa. Por exemplo, o lamprey marinho (Petromyzon marinus) tem alta sensibilidade olfativa a ácidos biliais específicos liberados por larvas até um limiar de 10-13 M30; essa sensibilidade permite que os adultos localizem e identifiquem motivos adequados de desova e, portanto, atuem como feromônio migratório a longa distância. Da mesma forma, lamprey marinho fêmea madura tem alta sensibilidade olfativa à espermatozoide (limiar de 10-14 M), uma poliamina liberada no milt pelos machos, que então os atrai para os ninhos de machos espermatozoides31. Outros peixes também têm sensibilidade olfativa às poliaminas32,,33,,34,,35, mas não com limiares suficientemente baixos de detecção para suportar um papel feromônio semelhante; em vez disso, a prevenção de peixes em decomposição é sugerida. No entanto, com sensibilidades olfativas tão altas, é possível imaginar que uma ligeira redução da sensibilidade (ou seja, aumento do limiar), mesmo quando a amplitude de resposta não é drasticamente reduzida, poderia causar graves problemas para os peixes24.
Quando plotadas semi-logaritmicamente, as curvas de concentração-resposta aos odores podem ser exponenciais, lineares ou sigmoidal18. No caso dos aminoácidos, tais curvas de concentração-resposta semi-logarítmicas são lineares (ou seja, logarítmicas), sigmoidal ou funções de potência7. Que nenhuma saturação da resposta é vista (ou seja, nenhum platô na curva concentração-resposta, mesmo em concentrações supra-ambientais) é provavelmente devido a vários receptores ligados a aminoácidos individuais, dependendo de sua concentração, em vez de cada aminoácido ligado a um receptor específico; à medida que a concentração de um dado aminoácido aumenta, mais receptores são capazes de ligá-lo e, portanto, responder. No entanto, os peixes podem distinguir entre misturas de aminoácidos36,37,38,39; isso é provável devido a padrões combinatórios de atividade evocados nas lâmpadas olfativas12,40; os axônios de todos os ORNs expressando a mesma proteína receptora terminam no mesmo glomeruli nas lâmpadas olfativas41,,42, e um aminoácido pode ativar mais de um glomerulus.
No entanto, odores altamente específicos, como feromônios, podem evocar curvas de concentração-resposta sigmoidal ou quase sigmoidal43,44. A inferência, embora não testada empiricamente, é que essas respostas olfativas são devido a receptores altamente específicos que ligam a molécula de feromônio e pouco mais. Portanto, acima de uma dada concentração, todos os receptores estão ocupados, e novos aumentos não evocarão respostas adicionais em outros ORNs. Portanto, esses dados podem ser ajustados a um gráfico de três parâmetros hill, e a resposta máxima, EC50 e Hill co-eficiente pode ser calculada15,45,,46. Isso pode dar informações valiosas, como afinidade aparente e número aparente de receptor, que curvas lineares ou exponenciais de concentração-resposta não podem dar.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho no laboratório de autores é apoiado pela Fundação para a Ciência e a Tecnologia (FCT), Portugal, projetos PTDC/BIA-BMA/30262/2017 e UID/Multi/04326/2019 e programa de contratos DL57/2016/CP1361/CT0041 à ZV.
Materiais
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
Referências
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C., Evans, D. H., Claiborne, J. B. Chemoreception. The Physiology of Fishes. , 471-497 (2006).
- Wisenden, B. D., Sorensen, P. W., Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. , 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J., Spielman, A. I., Brand, J. G. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. , 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor?. Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P., Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633 (2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C., Schulte, B., Goodwin, T., Ferkin, M. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. , 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731 (2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332 (2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados