Method Article
Extrazelluläre Multi-Unit-Aufnahme vom Olfaktornerv von Teleosts
In diesem Artikel
Zusammenfassung
Die extrazelluläre Multi-Unit-Aufnahme vom Riechnerv ist eine empfindliche, robuste und reproduzierbare Methode zur Beurteilung der Geruchsempfindlichkeit bei Meeresfischen. Es zeichnet den primären sensorischen Eingang auf und ist unabhängig vom externen Salzgehalt.
Zusammenfassung
Jüngste Studien haben gezeigt, dass die Ozeanversauerung das geruchsgetriebene Verhalten von Fischen beeinflusst. Dies kann zum Teil auf eine Verringerung der Geruchsempfindlichkeit in hohem PCO2/low pH-Wasser zurückzuführen sein. Um die Auswirkungen der Ozeanversauerung oder der Geruchsempfindlichkeit bei Meeresfischen im Allgemeinen zu bewerten, schlagen wir vor, dass die extrazelluläre Multi-Unit-Aufzeichnung vom Riechnerv die Methode der Wahl ist. Obwohl invasiv, ist es empfindlich, robust, reproduzierbar und unabhängig von externem Salzgehalt (im Gegensatz zum Elektro-Olfactogramm [EOG], zum Beispiel). Darüber hinaus zeichnet es einen primären sensorischen Eingang in das CNS auf, bevor eine zentrale Verarbeitung vorgeht. Wir zeigen, dass diese Methode eine Verringerung der Geruchsempfindlichkeit zeigen kann, die sowohl temporär als auch geruchsabhängig ist, indem eine Reihe von Aminosäuren verwendet wird, um Konzentrations-Antwort-Kurven zu konstruieren und die Nachweisschwellen zu berechnen.
Einleitung
Fische sind stark auf Olfaction für viele Aspekte ihres Lebens einschließlich der Suche nach Nahrung, Vermeidung von Raubtieren, Bewertung potenzieller Kumpels und Migration, unter anderem1,2,3. Daher, Bewertung der Geruchsempfindlichkeit bei Fischen (Was riechen sie? Wie empfindlich sind sie auf diese Verbindungen?) ist entscheidend, um diese Prozesse vollständig zu verstehen. Darüber hinaus können anthropogene Auswirkungen auf die Umwelt, wie die Versauerung und Verschmutzung der Ozeane, tiefgreifende Auswirkungen auf das Geruchssystem haben, selbst auf subletalen Ebenen, da es notwendigerweise in intimem Kontakt mit dem umgebenden Wasser steht4. In vivo Elektrophysiologie ist der experimentelle Ansatz der Wahl, um die Geruchsempfindlichkeit bei Fischen zu bewerten. Es stehen drei Haupttechniken zur Verfügung: das Elektro-Olfactogramm (EOG), das Elektroenzephalogramm (EEG), das von der Olfaktor-Lampe aufgezeichnet wurde, und die Multi-Unit-Aufnahme vom Geruchsnerv5.
Die EOG ist die am weitesten verbreitete dieser drei6. Es ist ein Gleichstrom (DC) Feldpotential über dem olfaktorischen Epithel aufgezeichnet und wird geglaubt, um die summierten Generator Potenziale dieser olfaktorischen Rezeptor neuronen (ORNs) reagieren auf ein bestimmtes Geruchsmittel sein. Da es jedoch im Wasser und nicht im Inneren des Fisches aufgezeichnet wird, hängt die Amplitude der Reaktion nicht nur vom Signal der Fische ab, sondern auch von der Leitfähigkeit des umgebenden Wassers; Je höher die Leitfähigkeit (oder je niedriger der Widerstand), desto geringer ist die Amplitude. Dies kann bedeuten, dass die EOG eine weniger empfindliche Methode im Meerwasser als Süßwasser7ist.
Das aus der Olfaktorbirne aufgezeichnete EEG wird auch häufig bei der Untersuchung der Geruchsbelästigung bei Fischen verwendet. Die Olfaktor-Glühbirne ist jedoch das Verarbeitungszentrum erster Ordnung für olfaktorische sensorische Eingaben8; es ist stark in Glomeruli organisiert, und folglich hängt die aufgezeichnete Reaktion stark von der Position der Aufnahmeelektroden ab. Zum Beispiel wird der Input von ORNs, die Aminosäuren erkennen, von Glomeruli im seitlichen Bereich der Olfaktorierzwiebeln verarbeitet, während der aus konspezifizierten Chemikalien in den medialen Bereich9,10,11,12geleitet wird. Pheromonale Eingaben können auf stark lokalisierte Glomeruli innerhalb der Riechbirne gerichtet werden. Je nach Anatomie der betreffenden Art ist die ideale Aufnahmeposition für ein bestimmtes Geruchsmittel möglicherweise nicht leicht zugänglich.
Die Multi-Unit-Aufnahme vom Riefaktornerv umgeht die oben beschriebenen Hauptprobleme mit dem EOG und EEG. Wenn es Aktionspotentiale aufzeichnet, die die Axone der ORNs vom Epithel an die Glühbirne weitergeben, ist es ein primäres sensorisches Signal. Und da es innerhalb des Fisches aufgezeichnet wird, ist die Amplitude der Reaktion unabhängig von äußerem Salzgehalt. Dennoch hat es natürlich einige Nachteile. Erstens ist je nach Anatomie der Art eine umfangreichere Operation erforderlich, um den Riechnerv zu entlarven als für die EOG. Zweitens, weil das Signal kleiner als die EOG ist, erfordert es etwas anspruchsvollere und daher teure Ausrüstung. Eine allgemeine Beschreibung anderer experimenteller Ansätze wird von John Caprio5gegeben. Das Ziel dieses Artikels ist es, zu skizzieren, wie extrazelluläre Multi-Unit-Antworten vom Riechnerv der Seebrasse (Sparus aurata) in vivo zu Aminosäuren-Geruchsstoffen als Beispiel für diese Technik aufzuzeichnen sind, und wie man einige der häufigsten Probleme in einem solchen Experiment identifiziert und überwunden.
Protokoll
Die Tierpflege und -experimente wurden in zertifizierten Versuchsanlagen durchgeführt und folgten den portugiesischen nationalen Rechtsvorschriften (DL 113/2013) im Rahmen einer "Group-1"-Lizenz der Generaldirektion Veterinärwesen, ministerium für Landwirtschaft, ländliche Entwicklung und Fischerei Portugals. Da dieses Protokoll den Umgang mit Tieren betrifft, muss es von der lokalen und/oder nationalen Stelle genehmigt werden, die das Wohlergehen von Tieren regelt, die in wissenschaftlichen Experimenten verwendet werden, außerdem müssen die Forscher über die entsprechende Ausbildung und Lizenzen verfügen, um solche Verfahren durchzuführen.
1. Stimulus-Vorbereitung
HINWEIS: Die meisten Fische haben ein hochempfindliches Geruchssystem, daher ist bei der Vorbereitung der olfaktorischen Reize, die im Experiment verwendet werden sollen, sehr vorsichtig. Die Glaswaren, die zur Herstellung der Reize verwendet werden, sollten in 5% Bleichmittel (Natriumhypochlorit) gewaschen, gründlich mit Leitungswasser gespült und getrocknet werden. Unmittelbar vor der Verwendung spülen Sie das Glas gut mit Meerwasser (das gleiche Wasser verwendet, um die Reizverdünnungen zu machen). Achten Sie darauf, dass kein wasserförmiges Wasser mit nackter Haut in Kontakt kommt.
- 100 ml von 10-2 M L-Glutamin, L-Leucin und L-Serin machen; 1 ml Aliquots bei -20 °C bis zur Verwendung lagern.
- Am Tag des Experiments aus diesen Aliquots 10-3 M bis 10-7 M Lösungen (in Schritten der x10 Verdünnung) mit Kontrolle und hohemCO2-Meerwasser vorbereiten.
HINWEIS: L-Serin (10-3 M) wird als Positivsteuerung oder Standard verwendet. Wasser, das verwendet wird, um die Verdünnungen der Reize zu bilden, und in genau der gleichen Weise wie die Reize behandelt, aber ohne Zugabe von Geruchsbelästigung, wird als Negativkontrolle oder Leerung verwendet werden.
2. Vorbereitung der Steuerung und hoheCO2-Wasser
- Bereiten Sie Kontrollwasser vor, indem Sie 1 L mit Holzkohle gefiltertem Meerwasser sammeln.
- Überprüfen Sie mit einer pH-Sonde den pH-Wert; sie sollte um 8,2 betragen. Wenn nicht, Blase mit atmosphärischer Luft, bis dieser pH-Wert erreicht ist.
- Mit einem Alkalinitätstitrat messen Sie die Alkalität des Wassers.
- Messen Sie die Wassertemperatur und den Salzgehalt.
- Bereiten Sie hoheCO2-Wasser durch Filterung 1 L Meerwasser, dann Blase CO2, bis der gewünschte pH-Wert erreicht ist.
- Überprüfen Sie mit einer pH-Sonde den pH-Wert; sie sollte bei 7,7 sein.
- Messen Sie mit einem Alkalinitätstitrat die Alkalität des Wassers.
- Messen Sie die Wassertemperatur und den Salzgehalt.
- Bestimmen Sie denCO2-Druck sowohl in der Steuerung als auch im hohenCO2-Wasser mit einer Software zur Berechnung vonCO2-Parametern im Wasser (z. B. CO2Calc-Software13).
- Fügen Sie im Eingangsfenster die Werte wasserpH, Temperatur, Salzgehalt und Gesamtalkalinität hinzu (Abbildung 1).
- Wählen Sie die Konstanten, Einheiten und Skalen aus (siehe die empfohlenen Werte in Abbildung 2).
- Drücken Sie den Knopfprozess, um denCO2-Druck zu bestimmen.
ANMERKUNG: Abbildung 3 zeigt ein Beispiel für ein Ergebnisblatt.
3. Zubereitung des Fisches
HINWEIS: In diesem Protokoll wird eine Seebrasse von 200 bis 400 g verwendet.
- Anästhesisieren Sie die Fische durch Eintauchen in belüftetes natürliches Meerwasser, das MS222 (Ethyl-3-Aminobenzoat-Methansulfonatsalz) enthält. Wenn die Reaktion auf eine Schwanzprise gestoppt hat, injizieren Sie in den Flankenmuskel den neuromuskulären Blocker Gallamin Triethiodid (10mg-kg -1 in physiologischer Salin).
ANMERKUNG: Die Konzentration des verwendeten Anästhetikums variiert je nach Art; für eine Seebrasse von 200 bis 400 g verwenden Sie 200 mg L-1 gepuffert mit 400 mg L-1 NaHCO3. - Legen Sie den anästhesierten Fisch auf eine gepolsterte Stütze. Die genaue Form und Größe hängt von der Modellart ab; für Seebrassen (200-400 g), verwenden Sie eine gepolsterte V-förmige Stütze, im Haus hergestellt.
- Legen Sie ein Siliziumrohr (Durchmesser = 10 mm) in den Mund, verbinden Sie das Rohr mit einer Tauchpumpe in einem Reservoir aus anästhetischem, belüftetem Meerwasser und pumpen Sie Wasser über die Kiemen bei 100 mL-min-1kg-1.
HINWEIS: Die Größe des verwendeten Silikonrohres hängt von der Größe des Fisches ab. - Setzen Sie den Erdungsstift in den Flankenmuskel ein und schließen Sie ihn an die Kopfstufe des Verstärkers an).
- Bedecken Sie den Fisch mit einem feuchten Tuch (oder Papiertuch) und bedecken Sie nur den Kopf, um sicherzustellen, dass die Abdeckung den Austritt von Wasser aus den Kiemen nicht behindert.
HINWEIS: Die Augen können mit feuchtem Papier/Tuch oder schwarzem Kunststoff bedeckt werden. - Positionieren Sie das Rohr des Stimulus-Liefersystems, d.h. das Glasrohr, das mit einer Versorgung mit Hintergrundmeerwasser verbunden ist, in das Nasenloch.
ANMERKUNG: Es können Mikrohämatokritrohre verwendet werden (Länge = 75 mm, ID = 1,15 mm, OD = 1,55 mm); diese können an einen feineren Punkt auf einem Elektrodenzieher gezogen werden, um sie mit kleineren Fischen zu verwenden. Es ist wichtig, sicherzustellen, dass das olfaktorische Epithel während der Operation nass gehalten wird (siehe unten). - Setzen Sie die riechigen Nerven aus, indem Sie die Haut und den Knochen des Schädels zwischen den Augen entfernen (die riechigen Nerven laufen in der Regel zwischen den Augen zusammen) mit Hilfe eines Zahnbohrers (idealerweise) oder Hobbys (z. B. Dremel) oder Juwelierpolierers (mit Zahnbohrer) unter einem Sezierendes Mikroskop (innerhalb eines Faraday-Käfigs).
- Entfernen Sie in der Seebrasse den Teil des Schädels unmittelbar über den Augen, mit einer Kreissäge, von nur vorder als die Augen, um nur nach hinten zu ihnen. Dann, mit einem Bohrer, entfernen Sie den Knochen zwischen den Augen; die riechen Nerven liegen zwischen den Augen.
- Sobald genügend Knochen gelöscht wurde, entfernen Sie das Fett und Bindegewebe über den Nerven mit feinen Zangen; achten Sie darauf, die Nerven nicht zu beschädigen oder Blutgefäße zu punktieren.
HINWEIS: Die Erfahrung wird helfen, die Sezieren zu verfeinern; Je kleiner die Sezierung, desto stabiler ist die Vorbereitung. Es muss jedoch ausreichend Gewebe gerodet werden; für die Unerfahrenen, wenn die Riechbirnen nur sichtbar sind, klar etwas vorderlich, um den Teil der Nerven zu belichten, wie sie die Glühbirnen verbinden, um die richtige Positionierung der Elektroden zu ermöglichen. - Reinigen Sie die Elektroden vor der Verwendung, indem Sie sie an den Negativenpol einer 3V-DC-Quelle (z. B. zwei AA-Batterien in Reihe) anschließen und die Spitze in physiologische reine (oder Meerwasser verdünnt 1:3 in Süßwasser) für 20 bis 30 s legen; ein stetiger Strom von kleinen Blasen sollte von der Spitze kommen gesehen werden.
- Sobald die Geruchsnerven freigelegt sind, legen Sie die Aufnahmeelektroden (auf Mikromanipulatoren gehalten) in eine Position ein, die eine maximale Reaktion auf den Standard (z. B. 10-3 M L-Serin) und eine minimale Reaktion auf den Rohling gibt. Verwenden Sie Parylen-beschichtete Wolframelektroden (Materialtabelle), die mit der Kopfstufe eines Wechselstromvorverstärkers verbunden sind.
HINWEIS: In der Seebrasse sind die stärksten Reaktionen auf Aminosäuren in der Regel mit den Elektroden in der Seitlichen Seite des Nervs platziert, in der Nähe, wo es die Riechbirne verbindet. Dies kann für andere Arten gelten, da die glomeruläre Organisation der Zwiebel bei den Arten weitgehend ähnlich ist. Erfahrung ist jedoch immer der beste Lehrer.
4. Elektrophysiologische Aufzeichnung
HINWEIS: Wie bei den meisten Elektrophysiologien muss die Multi-Unit-Aufnahme in einem Faraday-Käfig stattfinden. Die extrazelluläre Aufzeichnung erfordert jedoch in der Regel keinen Anti-Vibrations-Tisch; die meiste Bewegung wird von den Fischen kommen. Dennoch ist ein starker, stabiler Tisch mit einer Metalloberfläche erforderlich, um die magnetischen Basen der Mikromanipulatorständer zu sichern.
- Richten Sie ein Stimulus-Liefersystem ein, um das schnelle Umschalten von sauberem Hintergrundwasser auf reizhaltiges Wasser zu ermöglichen, z. B. durch verwendung eines magnetioidbetriebenen Dreiwegeventils. Schließen Sie den gemeinsamen Auslass an das Rohr an, das Wasser mit der olfaktorischen Rosette transportiert, und legen Sie eine Linie in ein Meerwasserreservoir und die andere in die Testlösung.
HINWEIS: Wenn das Ventil geschaltet wird (durch Leitung von Gleichstrom), schaltet der Wasserdurchfluss von Hintergrundwasser zu dem, das das Geruchsmittel enthält. Der Anreiz sollte lange genug gegeben werden, um einen klaren Höhepunkt in der integrierten Reaktion zu sehen, gefolgt von einer Zeit der Unterbringung; die im aktuellen Protokoll verwendete Zeit beträgt 4 s, aber je nach Art kann eine längere Zeit erforderlich sein. - Schließen Sie den Ventiltreiber an den Auslöser eines analog-digitalen Wandlers (z. B. Digidata) an; Wenn das Ventil vom Hintergrund auf eine stimulushaltige Leitung umgeschaltet wird, beginnt die Aufzeichnung der Daten. Konfigurieren Sie die Software so, dass die Aufzeichnung beim Triggerereignis gestartet wird, und fahren Sie für einen vorgegebenen Zeitraum (z. B. 10 s) fort.
HINWEIS: Zehn Sekunden sollten ausreichen, aber dies kann verkürzt oder verlängert werden, je nach experimenteller Frage. - Überprüfen Sie die Stabilität der Zubereitung, indem Sie (Aufzeichnung und Messung der Amplitude des integrierten Ansprechvorgangs) wiederholt mit dem Standard 10-3 M L-Serin in diesem Fall testen und 1 min zwischen aufeinanderfolgenden Reizen verstreichen lassen.
ANMERKUNG: Je nach Art und Geruchsmittel sollten die Antworten eine Amplitude innerhalb von 10 % voneinander haben (als Faustregel), einen schnellen Beginn haben, auf maximale Aktivität steigen und nach Dem ulanten Stimulus zur Basislinie zurückkehren(Abbildung 4). - Erfassen Sie die geruchsriegennervenreaktionen auf Aminosäuren im kontrollierten Meerwasser (von der niedrigsten bis zur höchsten Konzentration) und lassen Sie 1 min zwischen aufeinanderfolgenden Reizen vergehen.
HINWEIS: Es ist möglich, dass für einige Arten und/oder einige Geruchsstoffe mehr Zeit erforderlich ist. Aber für Aminosäuren und Seebrassen ist 1 min ausreichend. - Zeichnen Sie die Antwort auf 10-3 M Serin und eine Kontrollwasser-Rohlingslösung auf.
- Ändern Sie das Hintergrundwasser von2 Kontrollmeerwasser zu hohem CO2-Meerwasser, indem Sie die Hintergrundlinie in die Flasche mit hohemCO2-Meerwasser legen.
HINWEIS: Es ist ratsam, ein weiteres Hämatokritrohr (oder gleichwertig) in das Ende der Reiz- und Hintergrundlinien einzufügen, um zu vermeiden, dass das Wasser berührt wird und das Ende der Röhre im Wasser verbleibt. - Bevor Sie die Reaktion des Riechners auf Aminosäuren in hochCO2-Meerwasser testen, konditionieren Sie das olfaktorische Epithel mit hohemCO2-Wasser, indem Sie dem hohenCO2-Wasser über dem olfaktorischen Epithel für einige Minuten folgen.
HINWEIS: Die Erfahrung hat gezeigt, dass für Seebrasse 5 min ausreichend ist. - Erfassen Sie die geruchsriegennervenreaktionen auf Aminosäuren in hoherCO2-Meerwasser (von der niedrigsten bis zur höchsten Konzentration).
- Zeichnen Sie die Reaktion2 auf eine hohe CO2-Wasser-Leerlösung auf.
- Zeichnen Sie die Antwort auf 10-3 M Serin und eine Kontrollwasser-Rohlingslösung auf.
HINWEIS: Das Rohsignal (Nervenaktivität) sollte gefiltert (Tiefpass um 2.000 bis 5.000 Hz, Hochpass 50 bis 300 Hz) gefiltert und an einen analog-digitalen Konverter(Materialtabelle)übergeben werden. Zur einfacheren Quantifizierung der Nervenaktivität kann das Rohsignal auch über einen undichten Integrator (Materialtabelle) integriert und an den analog-digitalen Konverter übergeben werden, und von dort aus sowohl Rohe als auch integrierte Signale an einen Computer mit entsprechender Software (z.B. Axoscope).
5. Datenanalyse
- Subtrahieren Sie die Amplitude der integrierten Reaktion auf das Leer (in mV) von der Amplitude der integrierten Reaktionen auf alle Reize.
- Normalisieren Sie die Reaktionen auf Reize, indem Sie die Amplitude der vorherigen Reaktion auf den Standard (10-3 M Serin) dividieren; dies reduziert die Inter- und Intra-Fisch-Variabilität.
- Berechnen Sie die Erkennungsschwellen durch lineare Regression der Konzentrations-Antwort-Kurven (auf einem semilogarithmischen Diagramm), entsprechend der Formel log(N + 1.5) = einLog C + B, wobei C die Molkonzentration ist, N die normalisierte Antwortamplitude und a und b konstanten7,14sind.
ANMERKUNG: Der Erkennungsschwellenwert ist dann der Wert für x, wobei y = 0,1761 (d. h. Log 1.5; N = 0); die Konzentration, über der eine Reaktion zu sehen ist (d. h., der Fisch kann es riechen). Einige Geruchsstoffe evozieren sigmoidale Konzentrations-Antwort-Kurven, wenn sie halblogarithmisch dargestellt werden (z.B. Kalzium15,16; in diesem Fall können die normalisierten Daten an ein Dreiparameter-Hill-Diagramm angepasst werden, das die maximale Antwortamplitude und die EC50 (d.h. [Geruchsmittel], die halbmaximale Sypermie gibt; auch ein Maß an Empfindlichkeit) ergibt. - Vergleichen Sie die Nachweisschwellen und/oder die maximale Ansprechamplitude und die im Kontrollwasser getesteten Anregungen von EC50 und die in hohemCO2-Wasser getesteten.
Ergebnisse
Eine typische Reaktion auf die Positivkontrolle (10-3 M L-Serin; Abbildung 4A) und Negativkontrolle (leer; Abbildung 4B) aus dem Geruchsnerv einer Seebrasse ist in Abbildung 4dargestellt. Beachten Sie in Gegenwart des Stimulus (schwarzer horizontaler Balken; in der olfaktorischen Höhle, in Kontakt mit dem olfaktorischen Epithel), die schnelle Zunahme der Aktivität (reflektiert in der Nachwärtsverformung des integrierten Signals) auf einen Spitzenwert innerhalb von etwa einer Sekunde des Stimulusbeginns, gefolgt von einer Periode der Anpassung (während der Stimulus noch vorhanden ist) und eine Rückkehr zur Basisaktivität, sobald der Stimulus beendet ist. Die absolute Amplitude des Ansprechgangs ist stark von der Elektrodenposition abhängig; Wenn eine Reaktion mit niedriger Amplitude aufgezeichnet wird, versuchen Sie, die Elektrodenpositionen zu ändern. Ein langsamerer Anstieg der Spitzenaktivität kann darauf zurückzuführen sein, dass das Rohr, das das reizhaltige Wasser zum olfaktorischen Epithel trägt, zu weit vom Epithel entfernt platziert wird; versuchen Sie, das Nasenrohr näher an das Epithel zu bewegen (aber nicht zu berühren). Beachten Sie, dass der Rohling dagegen wenig oder gar keine Antwort hervorruft. Eine signifikante positive Reaktion (d. h. Erhöhung der Aktivität) auf den Rohling kann auf eine Kontamination des Wassers hinweisen, das verwendet wird, um die Verdünnungen der Reize zu machen; frische Verdünnungen mit sauberem Wasser (und Glaswaren) sollten dies lösen. Andernfalls kann eine gründlichere Reinigung des Wassersystems (einschließlich Aktivkohlefilter) erforderlich sein. Eine negative Reaktion (d. h. eine Abnahme der Aktivität) kann auf eine leichte Änderung der Durchflussmenge hinweisen, wenn das Ventil z. B. aufgrund einer Verstopfung des Ventils geschaltet wird.
Eine typische Konzentrations-Antwort-Kurve (halblogarithmisch), in diesem Fall zu L-Leucin (10-7 M bis 10-3 M), ist in Abbildung 5Adargestellt. Beachten Sie, dass steigende Konzentrationen des Geruchs bewirken immer größere Aktivitätssteigerungen, und damit in der Amplitude der integrierten Reaktionen. Abbildung 5Bzeigt ein Diagramm der normalisierten Daten und die entsprechende lineare Regression. Der geschätzte Nachweisschwellenwert kann aus dem Wert von x berechnet werden, wenn y = 0,1761 (d. h. log1.5; wobei N = 0) ist. In diesem Fall ist dieser Wert -7.48; d. h., der berechnete Schwellenwert für L-Leucin bei diesem Fisch beträgt 10-7,48 M. Der Exponent , der auf ähnliche Weise anhand der linearen Regression der normalisierten Daten in einem Log-Log-Plot geschätzt werden kann; logN = slog[odorant] + konstant. Der Faktor - gibt dann die Erhöhung der Geruchskonzentration an, die erforderlich ist, um die Ansprechamplitude um eine Log-Einheit zu erhöhen; d. h., es ist eine Schätzung der Steilheit der Konzentrations-Antwort-Kurve17. In diesem Beispiel werden die Werte n = 0,277 und - = 3,61; Um die Ansprechamplitude um das Zehnfache zu erhöhen (d. h. eine Log-Einheit; log10 = 1), muss die Stimuluskonzentration um das 103,61-fache(4.074-fache) erhöht werden.
Eine typische sigmoidale Konzentrations-Antwort-Kurve (Abbildung 6A), wenn sie halblogarithmisch, in diesem Fall zu L-Glutamin, dargestellt wird, ist in Abbildung 6Bdargestellt. Eine ähnliche konzentrationsabhängige Erhöhung der Antwortamplitude ist zu beobachten; Bei den höheren Konzentrationen wird dieser Anstieg jedoch geringer, so dass die Antwortamplitude ein Maximum erreicht (Nmax). Dadurch können die Daten an eine Drei-Parameter-Hill-Gleichung angepasst werden: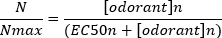
Auf diese Weise können die EC50 (die Geruchskonzentration, bei der eine maximale Reaktionsmenge von 50 % evoziert wird) und der Hill-Koeffizient (ein Maß für die Steilheit der Steigung des linearen Teils der Sigmoidalkurve) berechnet werden.
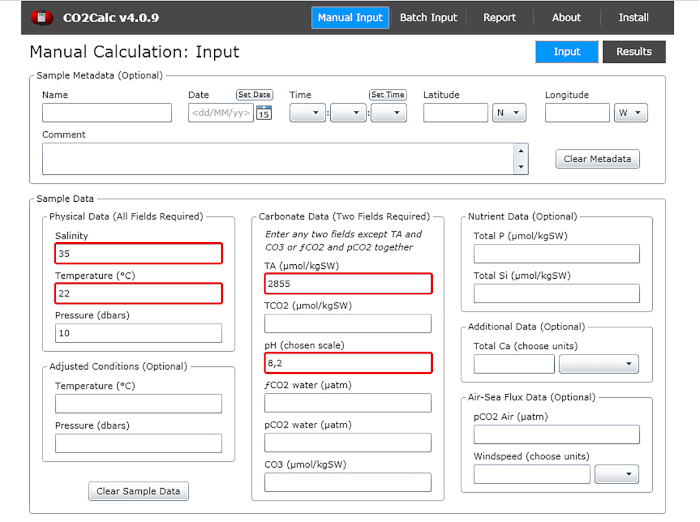
Abbildung 1: Software-Screenshot mit dem Eingabefenster des Programms CO2Calc. Hervorgehoben (rote Felder) sind die Felder, die für die Berechnung von Karbonatparametern erforderlich sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
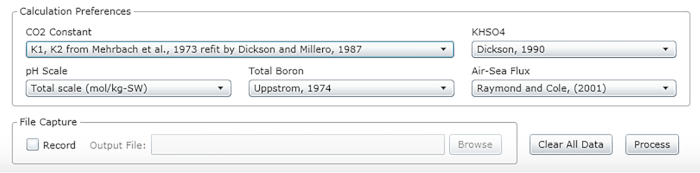
Abbildung 2: Software-Screenshot mit dem Eingabefenster für die entsprechenden Konstanten, Einheiten und Skalen. Die angegebenen Werte werden für Bedingungen empfohlen, unter denen die beschriebenen Experimente durchgeführt wurden; sie können sich ändern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
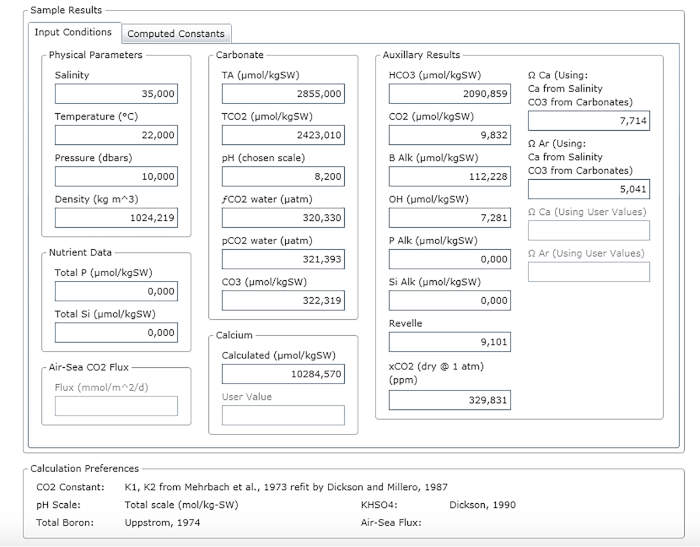
Abbildung 3: Software-Screenshot mit dem Ergebnisfenster. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
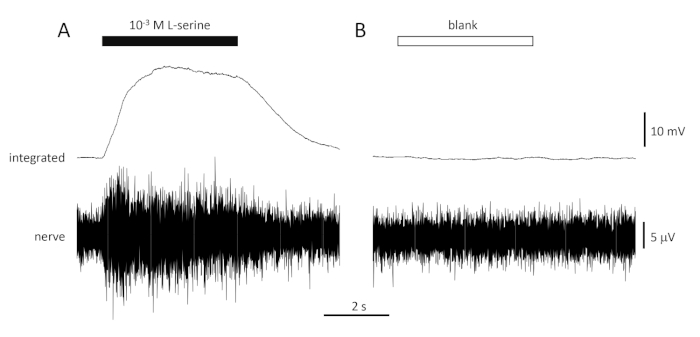
Abbildung 4: Typische Multi-Unit-Antworten, die extrazellulär vom Riefaktornerv der Seebrasse in vivo als Reaktion auf 10-3 M L-Serin (A) und leer (B) aufgezeichnet wurden. Obere Spuren zeigen die integrierten Reaktionen und niedrigere Spuren zeigen das rohe (Nerven-)Signal. Stimuli wurden auf das olfaktorische Epithel (horizontale Balken) aufgebracht. Beachten Sie die rasche Zunahme der Aktivität während der 1 s der Exposition, ein Höhepunkt in der Aktivität, gefolgt von einer Periode der Unterkunft (während das Geruchsmittel noch an das Epithel geliefert wurde) und eine Rückkehr auf Basisniveaus, sobald die Geruchsabgabe eingestellt wurde. Nach der Stimulation mit Wasser, das auf die gleiche Weise wie Geruchsverdünnungen behandelt wird, mit Ausnahme der Zugabe von Geruchsbelästigungen (leer) ist eine geringe oder keine Zunahme der Aktivität zu beobachten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
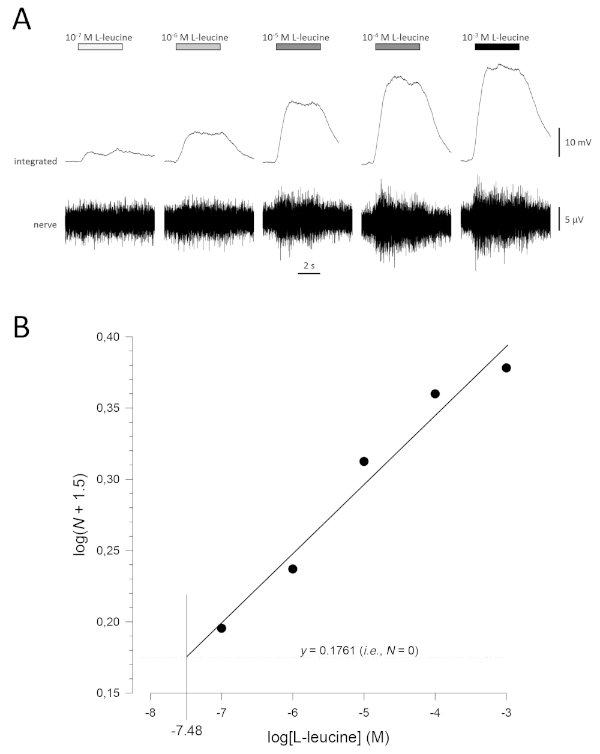
Abbildung 5: Typische Konzentrations-Antwort-Kurve für L-Leucin, extrazellulär vom Geruchsnerv in vivo aufgezeichnet. (A) Da die Konzentration von L-Leucin auf das olfaktorische Epithel (horizontale Balken) von 10-7 M auf 10-3 M ansteigt, wird eine gleichzeitige Zunahme der Aktivität im Nerv beobachtet. Obere Spuren zeigen die integrierten Reaktionen und niedrigere Spuren zeigen das rohe (Nerven-)Signal. (B) Lineare Regression (R2 = 0,97) normalisierter Daten, die halblogarithmisch dargestellt werden, um den Nachweisschwellenwert als Wert für log[L-Leucin] zu berechnen, wenn log(N + 1.5) = 0,1761 (d. h. wobei N = 0) ist. In diesem Beispiel ist dieser Wert -7.48; Die geschätzte Nachweisschwelle für L-Leucin bei diesem Fisch beträgt daher 10-7,48 M. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
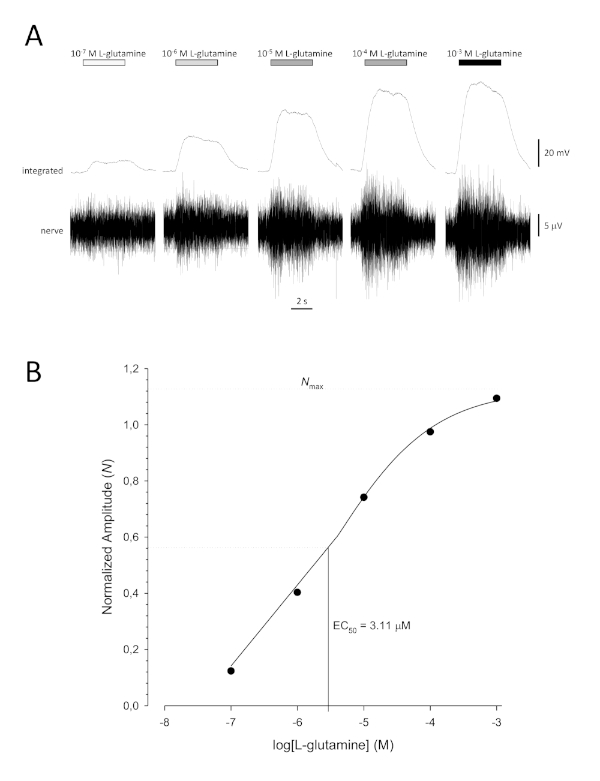
Abbildung 6: Typische Konzentrations-Antwort-Kurve für L-Glutamin extrazellulär vom Geruchsnerv in vivo aufgezeichnet. (A) Da die Konzentration von L-Glutamin, die auf das olfaktorische Epithel (horizontale Balken) aufgebracht wird, von 10-7 M auf 10-3 M ansteigt, wird eine gleichzeitige Zunahme der Aktivität im Nerv beobachtet. Obere Spuren zeigen die integrierten Reaktionen und niedrigere Spuren zeigen das rohe (Nerven-)Signal. (B) Halblogarithmische Darstellung normalisierter Daten, die an eine Hill-Gleichung mit drei Parametern angepasst sind (R2 = 0,99). In diesem Beispiel werden die berechnete EC50 = 3,11 M und der Hill-Koeffizient = 0,565) berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die aktuelle Studie beschreibt die Verwendung von Multi-Unit (extrazelluläre) Aufzeichnung aus dem Riechnerv der Seebrasse (S. aurata), ein Meeressparid von großer Bedeutung in der Aquakultur. Dieser experimentelle Ansatz kann jedoch weitgehend auf andere Fische angewandt werden; die Operation und die genaue Platzierung der Elektroden hängt eindeutig von der Anatomie des Geruchssystems ab, und die Wahl und Konzentration des Anästhetikums kann von der untersuchten Art abhängen. Zum Beispiel ist der Riechnerv des Goldfisches (Carassius auratus) kurz; in diesem Fall wäre die Aufzeichnung des EEG von der Olfaktorbirne einfacher. Die Wahl des Geruchs kann auch in gewissem Maße von der Art abhängen. In der aktuellen Studie wurden Aminosäuren verwendet. Soweit den Autoren bekannt ist, haben alle bisher untersuchten Fischarten eine olfaktorische Empfindlichkeit gegenüber Aminosäuren1,18. Diese Empfindlichkeit wurde involviert ist verschiedene Prozesse wie Lebensmittelstandort, chemische Kommunikation und Erkennung von Geburtsgewässern19,20,21,22,23. Die Empfindlichkeiten verschiedener Arten sind jedoch im Großen und Ganzen ziemlich ähnlich und hängen nicht von Lebensstil oder Lebensraum ab. Sie sind auch gut definierte Moleküle und sind billig und einfach verfügbar. Diese Gründe machen sie zu idealen Testreizen für Studien zur Olfaction bei Fischen, insbesondere solchen, die die Auswirkungen anthropogener Störungen (z. B. Versauerung oder Verschmutzung) untersuchen, bei denen die Ergebnisse leicht über Die Art24hinweg verglichen werden können.
Je nach Art können die Vorbereitungen für die Aufzeichnung mehrerer Einheiten mehrere Stunden stabil bleiben; die Amplitude des Ansprechens auf den internen Standard (10-3 M L-Serin in der aktuellen Studie) sollte zwischen den aufeinanderfolgenden Tests nicht um mehr als 10 % variieren. Jede signifikante Abweichung von dieser Faustregel könnte auf folgende Angaben zurückzuführen sein: (i) Bewegung des Fisches und damit Verschiebung der Elektroden und/oder Nasenröhre; ii) Kontamination des Wassers, z. B. durch Kontakt mit den Händen des Experimentators (insbesondere wenn niedrigere Konzentrationen eines bestimmten Geruchs größere Reaktionen geben als höhere Konzentrationen); oder (iii) Verschlechterung der Gesundheit des Präparats). Falls (i) sollte der Fisch auf Dievinibewegt überprüft werden; wenn ja, positionieren Sie es neu, und fügen Sie dem Wasser mehr Anästhetikum hinzu und/oder geben Sie eine weitere Dosis Gallamintriethiodid. Lassen Sie 5 min und testen Sie den Standard erneut. Wenn die Antwort noch kleiner ist, positionieren Sie die Elektroden und/oder das Nasenrohr neu, bis eine ausreichend große Reaktion aufgezeichnet wird. In Fall (ii), einfach eine frische Verdünnungsserie des Geruchsstoffes mit sauberem Glas und Wasser neu erstellen. In den Fällen (iii) überprüfen Sie, ob der Wasserfluss über die Kiemen der Fische ausreichend ist, dass das Wasser über die Kiemen fließt (d. h. über die Opercula und nicht über den Mund austritt), und das Wasser ist gut belüftet. Verschiedene Fischarten haben sehr unterschiedliche Temperaturpräferenzen; sicherzustellen, dass die Labortemperatur (und die des Wassers, das mit den Fischen in Berührung kommt) so nahe wie möglich an der Temperatur liegt, bei der die Fische gehalten werden. Achten Sie auch darauf, dass die Fische nicht gestresst sind, und vermeiden Sie, sie (auch von einem Tank in einen anderen) für mindestens eine Woche vor der Aufnahme zu bewegen. Elektrisches Rauschen ist natürlich der Fluch des Lebens eines Elektrophysiologen; Der aktuelle Artikel ist jedoch nicht das geeignete Medium, um zu diskutieren, wie dies überwunden/verringert werden kann. Dennoch ist "The Axon Guide" (kostenlos als pdf zum Download auf der Website des Herstellers verfügbar) eine Quelle praktischer Ratschläge zur Lärmminimierung. Sobald eine große, stabile Reaktion durch den Standardreiz evoziert wird, und eine Konzentrationsreihe eine konzentrationsabhängige Erhöhung der Amplitude ergibt, mit minimaler Reaktion auf das Leerzeichen, können Aufzeichnungsreaktionen auf Testreize beginnen. Einige Autoren geben den gleichen Stimulus dreimal und berechnen das arithmetische Mittel für die nachfolgende Datenanalyse. Dies sind jedoch technische Replikationen, und dieser Ansatz erhöht die Zeit, die eine Aufzeichnungssitzung benötigt, um das Dreifache. Die aktuellen Autoren ziehen es vor, ein bestimmtes Geruchsmittel einmal zu testen, aber immer Teil einer Konzentrations-Antwort-Kurve. Dies ermöglicht nicht nur die Berechnung des Nachweisschwellenwerts oder der EC50 (wie beschrieben), sondern stellt auch sicher, dass Konzentrationen in der Nähe der Konzentrationen, die der Fisch in seiner natürlichen Umgebung erleben würde, getestet werden (dies ist nicht immer bekannt). Darüber hinaus sind ausreißerantworten, z. B. aufgrund von Verunreinigungen, leichter zu erkennen; diese können bei Bedarf mit einer frisch zubereiteten Probe wiederholt werden.
Multi-Unit-Aufnahme vom Riechnerv kann invasiv sein, aber es ist empfindlicher als die EOG, wenn sie im Meerwasseraufgenommen 7, da es unabhängig von externem Salzgehalt ist. Es kann daher verwendet werden, um die Geruchsempfindlichkeit gegenüber Geruchsstoffen wie Kalzium und Natrium zu beurteilen, deren Konzentrationen sich ebenfalls auf die Leitfähigkeit auswirken würden und folglich die Spannungen15. Als Schätzung der Anzahl der ORNs, die auf einen gegebenen Geruch reagieren (d. h. Aktionspotentiale, die entlang ORN-Axone vom olfaktorischen Epithel zur Glühbirne wandern), stellt es ein rohes, unverarbeitetes Signal dar (die anfängliche Verarbeitung der Olfaktorinzine beginnt in den Glühbirnen). Daher ist es ein besserer Parameter, die direkten Auswirkungen von Schadstoffen wie Schwermetallen und Umweltveränderungen, wie pH, auf das Geruchssystem zu bewerten als die EOG oder EEG24,25. Die Aufzeichnung der Olfaktorinde im Meerwasser mit hohem PCO2 (und damit niedrigem pH-Wert) kann durch zentrale Auswirkungen des pH-Werts auf die neuronale Verarbeitung beeinträchtigt werden; die "GABA-A-Rezeptor-Theorie" der Ozeanversauerung26, wobei die Senkung des wasserlichen pH-Werts eine Umverteilung von Cl- und HCO3- Ionen im CSF und eine daraus resultierende Verschiebung der GABAergen Aktivierung von hemmungshemmer (hyperpolarisierender) zu exzitatorischer (depolarisierender) verursacht.A Darüber hinaus ist es in solchen Studien wichtig, die Auswirkungen von Versauerung oder Schadstoffen unter Verwendung von Geruchskonzentrationen zu bewerten, die denen ähneln, denen die Fische in ihrer natürlichen Umgebung wahrscheinlich begegnen. Bei Aminosäuren liegt dies im Nano-Mikromolaren-Bereich27,28,29; nahe der Nachweisschwelle dieser Verbindungen in Fischen1,18. Die Abschätzung der Nachweisschwelle für ein bestimmtes Geruchsmittel kann eine Vorstellung von der Bedeutung und/oder biologischen Rolle der Geruchsempfindlichkeit vermitteln. Zum Beispiel hat die Seelamprey (Petromyzon marinus) eine hohe Geruchsempfindlichkeit gegenüber bestimmten Gallensäuren, die von Larven bis zu einer Schwelle von 10-13 M30freigesetzt werden; Diese Empfindlichkeit ermöglicht es Erwachsenen, geeignete Laichgründe zu lokalisieren und zu identifizieren und somit über weite Strecken als wanderndes Pheromon zu fungieren. In ähnlicher Weise haben reife weibliche Seelamprey eine hohe Geruchsempfindlichkeit gegenüber Spermin (Schwellenwert 10-14 M), ein Polyamin, das in der Milt von Männchen freigesetzt wird, das sie dann zu den Nestern der spermiierenden Männchen anzieht31. Andere Fische haben auch olfaktorische Empfindlichkeit gegenüber Polyamen32,33,34,35, aber nicht mit ausreichend niedrigen Nachweisschwellen, um eine ähnliche pheromale Rolle zu unterstützen; stattdessen wird die Vermeidung von verwesenden Fischen vorgeschlagen. Dennoch kann man sich bei so hohen Geruchsempfindlichkeiten vorstellen, dass eine leichte Verringerung der Empfindlichkeit (d. h. eine Erhöhung der Schwelle), selbst wenn die Ansprechamplitude nicht dramatisch reduziert wird, schwere Probleme für Fische verursachen könnte24.
Bei halblogarithmischer Aufnahme können Konzentrations-Antwort-Kurven zu Geruchsstoffen exponentiell, linear oder sigmoidal18sein. Bei Aminosäuren sind solche semilogarithmischen Konzentrations-Reaktionskurven entweder linear (d.h. logarithmisch), sigmoidal oder Leistungsfunktionen7. Dass keine Sättigung der Reaktion zu beobachten ist (d.h. kein Plateau in der Konzentrations-Wirkungskurve, auch bei über-ökologischen Konzentrationen), ist wahrscheinlich auf mehrere Rezeptoren zurückzuführen, die je nach Konzentration an einzelne Aminosäuren binden, und nicht auf jede Aminosäure, die an einen bestimmten Rezeptor bindet; wenn die Konzentration einer gegebenen Aminosäure zunimmt, sind mehr Rezeptoren in der Lage, sie zu binden und daher zu reagieren. Dennoch können Fische zwischen Mischungen von Aminosäuren36,37,38,39unterscheiden; dies ist wahrscheinlich auf kombinatorische Aktivitätsmuster zurückzuführen, die in den Olfaktorzwiebeln12,40hervorgerufen werden; Die Axone aller ORNs, die das gleiche Rezeptorprotein exemiten, enden bei den gleichen Glomeruli in den Olfaktoriden41,42, und eine Aminosäure kann mehr als einen Glomerulus aktivieren.
Hochspezifische Geruchsstoffe, wie Pheromone, können jedoch sigmoidale oder quasi-sigmoidale Konzentrations-Reaktionskurven43,44evozieren. Die Schlussfolgerung, obwohl nicht empirisch getestet, ist, dass diese olfaktorischen Reaktionen auf hochspezifische Rezeptoren zurückzuführen sind, die das Pheromonmolekül binden und wenig anderes. Daher werden über einer bestimmten Konzentration alle Rezeptoren belegt, und weitere Erhöhungen werden keine weiteren Reaktionen in anderen ORNs hervorrufen. Daher können diese Daten an ein Hill-Diagramm mit drei Parametern angepasst werden, und die maximale Antwort, EC50 und Hill-Koeffizient können berechnet werden15,45,46. Dies kann wertvolle Informationen liefern, wie die scheinbare Affinität und die scheinbare Rezeptorzahl, die lineare oder exponentielle Konzentrations-Antwort-Kurven nicht liefern können.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Arbeit im Autorenlabor wird unterstützt von Fundaéo para a Ciéncia e a Tecnologia (FCT), Portugal, den Projekten PTDC/BIA-BMA/30262/2017 und UID/Multi/04326/2019 und dem Vertragsprogramm DL57/2016/CP1361/CT0041 an ZV.
Materialien
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
Referenzen
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C. Chemoreception. The Physiology of Fishes. Evans, D. H., Claiborne, J. B. , CRC Press. Boca Raton, FL. 471-497 (2006).
- Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. Sorensen, P. W., Wisenden, B. D. , John Wiley & Sons Inc. Ames, IA. 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. Spielman, A. I., Brand, J. G. , CRC Press. Boca Raton, FL. 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, TN. (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor? Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P. Jr, Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633(2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. Schulte, B., Goodwin, T., Ferkin, M. , Springer. Cham, Switzerland. 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731(2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332(2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten