Method Article
Внеклеточная многоразовая запись с обонятельного нерва телеостов
В этой статье
Резюме
Внеклеточная многоразовая запись обонятельного нерва является чувствительным, надежным и воспроизводимым методом оценки обонятельной чувствительности морских рыб. Он записывает первичный сенсорный вход и не зависит от внешней солености.
Аннотация
Недавние исследования показали, что подкисление океана влияет на обонятельное поведение рыб. Отчасти это может быть связано со снижением обонятельной чувствительности в воде с высоким содержанием PCO2/lowpH. Для оценки последствий подкисления океана, или обонятельной чувствительности в морских рыб в целом, мы предлагаем, чтобы внеклеточная многоступенчатая запись из обонятельного нерва является методом выбора. Несмотря на инвазивность, он чувствителен, надежн, воспроизводим и не зависит от внешней солености (в отличие, например, от электроолфактограммы. Кроме того, он записывает первичный сенсорный вход в ЦНС, до любой центральной обработки. Мы показываем, что этот метод может показать снижение обонятельной чувствительности, которая является временной и зависит от запаха, используя ряд аминокислот для построения кривых реакции концентрации и расчета пороговых значений обнаружения.
Введение
Рыбы в значительной степени полагаются на olfaction для многих аспектов их жизни, включая поиск пищи, избегая хищников, оценки потенциальных товарищейи миграции, среди прочего 1,2,3. Поэтому, оценивая обонятельную чувствительность у рыб (что они пахнут? Насколько они чувствительны к этим соединениям?) имеет жизненно важное значение для полного понимания этих процессов. Кроме того, антропогенное воздействие на окружающую среду, такое как подкисление океана и загрязнение окружающей среды, может иметь глубокие последствия для обонятельной системы, даже на сублетных уровнях, потому что она обязательно находится в непосредственном контакте с окружающейводой 4. В виво электрофизиология является экспериментальным подходом выбора для оценки обонятельной чувствительности у рыб. Доступны три основных метода: электро-олфактограмма (EOG), электроэнцефалограмма (ЭЭГ), записанная из обонятельной лампы, и многоа блоке записи из обонятельногонерва 5.
EOG является наиболее широко используемым из этих трех6. Это прямой ток (DC) полевой потенциал, записанный выше обонятельного эпителия и, как полагают, подытожил генератор потенциалов этих обонятельных рецепторов нейронов (ORNs) в ответ на данный запах. Однако, как записано в воде, а не внутри рыбы, амплитуда реакции зависит не только от сигнала, генерируемого рыбой, но и от проводимости окружающей воды; чем выше проводимость (или чем ниже сопротивление), тем ниже будет амплитуда. Это может означать, что EOG является менее чувствительным методом в морской воде, чем преснаявода 7.
ЭЭГ, записанный из обонятельной луковицы, также широко используется в исследовании ольфакции у рыб. Тем не менее, обонятельная лампа является центром обработки первого порядка для обонятельного сенсорного ввода8; он высоко организован в гломерули, и, следовательно, записанный ответ сильно зависит от положения записывающих электродов. Например, вход от ORNs обнаружения аминокислот обрабатывается glomeruli в боковой области обонятельных луковиц, в то время как из конспецифических полученных химических веществ направлен в медиальнойобласти 9,10,11,12. Феромональный вход может быть направлен на высоко локализованный гломерули в обонятельной лампе. В зависимости также от анатомии вида, о котором идет речь, идеальное положение записи для данного запаха не может быть легко доступны.
Многодиа блоке записи от обонятельного нерва обходит основные проблемы с EOG и ЭЭГ, изложенные выше. Как он записывает действия потенциалов, проходящих вниз аксонов ORNs от эпителия к лампе, это основной сенсорный сигнал. И так как это записано внутри рыбы, амплитуда реакции не зависит от внешней солености. Тем не менее, конечно, у него есть некоторые недостатки. Во-первых, в зависимости от анатомии вида, требуется более обширная операция, чтобы разоблачить обонятельный нерв, чем для EOG. Во-вторых, поскольку сигнал меньше EOG, он требует чуть более сложного и, следовательно, дорогостоящего оборудования. Общее описание других экспериментальных подходов дается Джоном Каприо5. Цель этой статьи состоит в том, чтобы изложить, как записывать внеклеточные многофункциональные реакции от обонятельного нерва морского волокна (Sparus aurata) in vivo к аминокислотным запахам в качестве примера этого метода, и как определить и преодолеть некоторые из наиболее распространенных проблем, с которыми сталкиваются в таком эксперименте.
протокол
Обслуживание и экспериментирование животных проводилось на сертифицированных экспериментальных объектах и осуществлялось в соответствии с португальским национальным законодательством (DL 113/2013) в соответствии с лицензией «группы-1» Генерального управления ветеринарии, Министерства сельского хозяйства, развития сельских районов и рыболовства Португалии. Поскольку этот протокол включает обращение с животными, он должен быть одобрен местным и/или национальным органом, который регулирует благосостояние животных, используемых в научных экспериментах, кроме того, исследователи должны иметь соответствующую подготовку и лицензии для проведения таких процедур.
1. Стимулная подготовка
ПРИМЕЧАНИЕ: Большинство рыб имеют очень чувствительную обонятельную систему, поэтому при подготовке обонятельных стимулов, которые будут использоваться в эксперименте, необходимо придать большую осторожность. Стеклянную посуду, используемую для того, чтобы составить стимулы, следует промыть 5% отбеливателем (гипохлоритом натрия), тщательно промыть водопроводной водой и высушить. Непосредственно перед использованием тщательно промыть стеклянную посуду морской водой (та же вода, используемая для разбавления стимула). Позаботьтесь о том, чтобы ни одна из этой воды не соего контакта с голой кожей.
- Сделать 100 мл 10-2 M L-глутамин, L-лейцин и L-серин; хранить 1 мл aliquots каждого при -20 градусов по Цельсию до использования.
- В день эксперимента, подготовить из этих aliquots, 10-3 M до 10 -7 M решений (в шагах x10 разбавления) с использованием как контроля и высокой CO2 морской воды.
ПРИМЕЧАНИЕ: L-серин (10-3 M) будет использоваться в качестве положительного контроля, или стандарта. Вода, используемая для разбавления стимулов, и рассматриваться точно так же, как стимулы, но без добавления любого запаха, будет использоваться в качестве отрицательного контроля или пустой.
2. Подготовка контроля и высокой воды CO2
- Подготовьте контрольную воду, собрав 1 л морской воды, фильтруемой из древесного угля.
- Используя зонд рН, проверьте рН; она должна быть около 8,2. Если нет, пузырь с атмосферным воздухом, пока этот рН не будет достигнут.
- С помощью щелочности титратор измерить щелочность воды.
- Измерьте температуру воды и соленость.
- Подготовка высокой воды CO2 путем фильтрации 1 л морской воды, а затем пузырь CO2 до желаемого рН не будет достигнута.
- Используя зонд рН, проверьте рН; она должна быть около 7,7.
- Используя щелочный титратор, измерьте щелочность воды.
- Измерьте температуру воды и соленость.
- Определите давление CO2 как в воде контроля, так и в воде с высоким содержанием CO2 с помощьюпрограммного обеспечения, предназначенного для расчета параметров CO 2 в воде (например, программное обеспечение CO2Calc13).
- В входное окно добавляют значения рН воды, температуру, соленость и общую щелочность(рисунок 1).
- Выберите константы, единицы и весы (см. рекомендуемые значения на рисунке 2).
- Нажмите на кнопку процесса для определения давления CO2.
ПРИМЕЧАНИЕ: На рисунке 3 показан пример листа результатов.
3. Приготовление рыбы
ПРИМЕЧАНИЕ: В этом протоколе используется морской бивно 200–400 г.
- Обезболивать рыбу путем погружения в газированную естественную морскую воду, содержащую MS222 (этил-3-аминогензоатная метансульфонатная соль). Когда реакция на щепотку хвоста прекратилась, ввините в фланговую мышцу нервно-мышечный блокатор галлетамина триэтиодида (10 мгкг -1 при физиологическом солевом растворе).
ПРИМЕЧАНИЕ: Концентрация анестезии, используемой варьируется между видами; для морскогоbream 200-400 г, используйте 200 мг L-1 буфер с 400 мг L-1 НаХКО3. - Поместите анестезировалую рыбу на мягкую опору. Точная форма и размер зависят от вида модели; для морского дерева (200–400 г) используйте проложенную V-образную опору, изготовленную в доме.
- Поместите силиконовую трубку (диаметр 10 мм) во рту, соедините трубку с погладким насосом в резервуаре обезболивающе-содержащей, газированной морской воды и перекачите воду над жабрами при 100 мл-1 кг-1.
ПРИМЕЧАНИЕ: Размер используемой кремниевой трубки будет зависеть от размера рыбы. - Вставьте земляной штифт в фланговую мышцу и соедините его с головной стадией усилителя).
- Обложка рыбы влажной тканью (или бумажное полотенце) только с головой подвергаются, гарантируя, что покрытие не препятствует выходу воды из жабры.
ПРИМЕЧАНИЕ: Глаза могут быть покрыты кусочками влажной бумаги / ткани или черного пластика. - Распоить трубку системы стимула-доставки, т.е. стеклянную трубку, соединенную с запасом фоновой морской воды, в ноздрю.
ПРИМЕЧАНИЕ: Можно использовать микро-гематокритные трубки (длина - 75 мм, ID - 1,15 мм, OD - 1,55 мм); они могут быть вытащил к тонкой точке на электрод шкив для использования с меньшими рыбами. Важно, чтобы обонятельный эпителий был влажным во время операции (описано ниже). - Разоблачить обонятельные нервы, удалив кожу и кость черепа между глазами (обонятельные нервы обычно работают вместе между глазами) с помощью стоматологического (в идеале) или хобби (например, Dremel) сверла или ювелира полировки (с зубной дрель-бит) под рассечением микроскопа (внутри клетки Фарадея).
- В морской пилы, удалить часть черепа непосредственно над глазами, с круговой пилой, от только передние глаза только задние к ним. Затем, используя сверло бит, удалить кость между глазами; обонятельные нервы лежат между глазами.
- После того, как достаточная кость была очищена, удалить жир и соединительной ткани overlying нервы с помощью тонкой типсов; заботиться, чтобы не повредить нервы или прокол кровеносных сосудов.
ПРИМЕЧАНИЕ: Опыт поможет усовершенствовать вскрытие; чем меньше вскрытие, тем стабильнее будет препарат. Тем не менее, достаточно ткани должны быть очищены; для неопытных, когда обонятельные луковицы просто видны, ясно немного более передней подвергать часть нервов, как они присоединяются к луковицы, чтобы правильное позиционирование электродов. - Очистите электроды перед использованием, подключив их к отрицательному полюсу источника 3V DC (например, две батареи АА в серии) и поместив наконечник в физиологический солевой раствор (или морскую воду, разбавленную 1:3 в пресной воде) на 20-30 с; устойчивый поток небольших пузырьков следует рассматривать исходя из кончика.
- Как только обонятельные нервы подвергаются воздействию, вставьте записывающие электроды (удерживаемые на микромипуляторах) в положение, которое дает максимальный ответ на стандарт (например, 10-3 M L-серин), и минимальный ответ на пробел. Используйте вольфрамовых электродов с покрытием парилена(Table of Materials),подключенных к головной стадии предустановки переменного тока (AC).
ПРИМЕЧАНИЕ: В морском бибрее, самые сильные реакции на аминокислоты, как правило, видели с электродами, помещенными в боковой стороне нерва, близко к где он присоединяется к обонятельной лампы. Это может справедливо и для других видов, так как шаровая организация луковицы в целом похожа среди видов. Тем не менее, опыт всегда лучший учитель.
4. Электрофизиологическая запись
ПРИМЕЧАНИЕ: Как и в большинстве электрофизиологии, многоразовая запись должна происходить в клетке Фарадея. Тем не менее, внеклеточная запись обычно не требует анти-вибрации таблицы; большинство движения будет исходить от рыбы. Тем не менее, сильный, стабильный стол требуется с металлической поверхностью для обеспечения магнитных оснований микро-манипулятора стоит.
- Настройка системы доставки стимулов для быстрого перехода от чистой фоновой воды к стимулосодержащей воде, например, с помощью селеноидного трехголомного клапана. Подключите общую розетку к трубе, несущей воду, к обонятельной розетке и поместите одну линию в резервуар морской воды, а другую в испытательный раствор.
ПРИМЕЧАНИЕ: Когда клапан переключается (путем прохождения тока постоянного тока), поток воды переключается с фоновой воды на пахант. Стимул должен быть дан достаточно долго, чтобы увидеть четкий пик в комплексной реакции, а затем период размещения; время, используемое в текущем протоколе, составляет 4 с, но в зависимости от вида может потребоваться больше времени. - Подключите драйвер клапана к спусковому крючку аналогово-цифрового преобразователь (например, Digidata); когда клапан переключается с фона на стимулосодержащую линию, это позволит начать запись данных. Настройте программное обеспечение, чтобы начать запись на триггерном событии и продолжайте в течение определенного периода (например, 10 с).
ПРИМЕЧАНИЕ: Десять секунд должно быть достаточно, но это может быть сокращено или удлинено, в зависимости от экспериментального вопроса. - Проверьте стабильность подготовки путем тестирования (запись и измерение амплитуды комплексного ответа) неоднократно со стандартом, 10-3 M L-серин в этом случае, и позволяет 1 мин, чтобы прошло между последовательными стимулами.
ПРИМЕЧАНИЕ: В зависимости в некоторой степени от вида и запаха, ответы должны иметь амплитуду в пределах 10% друг от друга (как правило, большого пальца), и должны иметь быстрое начало, рост максимальной активности, и вернуться к исходной линии после того, как стимул отсутствует (Рисунок 4). - Запись обонятельных нервных реакций на аминокислоты в управлении морской водой (от самой низкой до самой высокой концентрации) и позволяют 1 мин, чтобы прошло между последовательными стимулами.
ПРИМЕЧАНИЕ: Вполне возможно, что для некоторых видов и / или некоторых одорантов, больше времени необходимо. Но для аминокислот и морскогоbream, 1 мин достаточно. - Запись ответа на 10-3 M серин и контроль воды пустой раствор.
- Измените фоновую воду с контрольной морской воды на высокую co2 морской воды, поместив фоновую линию в бутылку с высоким содержанием CO2 морской воды.
ПРИМЕЧАНИЕ: Рекомендуется вставить еще один гематоцит трубки (или эквивалент) в конце стимула и фоновых линий, чтобы избежать прикосновения к воде и обеспечить конец трубки остается в воде. - До тестирования реакции обонятельного нерва на аминокислоты в высокой CO2 морской воды, состояние обонятельного эпителия с высоким содержанием CO2 воды, следуя высокой ВОДЫ CO2 над обонятельным эпителием в течение нескольких минут.
ПРИМЕЧАНИЕ: Опыт показал, что для морского бибра достаточно 5 минут. - Запись обонятельных нервных реакций на аминокислоты в высокой CO2 морской воды (от самой низкой до самой высокой концентрации).
- Завехать реакцию на высокий co2 пустой раствор воды.
- Запись ответа на 10-3 M серин и контроль воды пустой раствор.
ПРИМЕЧАНИЕ: Необработанный сигнал (нервная активность) должен быть отфильтрован (низкий проход около 2000–5000 Гц, высокий проход 50–300 Гц) и передан аналогово-цифровому преобразовательу(Таблица материалов). Для более легкой количественной оценки нервной активности необработанный сигнал также может быть интегрирован с помощью вытекающей интегратора(Таблицаматериалов) и передан аналогово-цифровому преобразовательу, а оттуда как сырые, так и интегрированные сигналы на компьютер, работающий под управлением соответствующего программного обеспечения (например, Axoscope).
5. Анализ данных
- Вычесть амплитуду интегрированной реакции на пустой (в мВ) из амплитуды интегрированных реакций на все раздражители.
- Нормализация реакции на раздражители путем деления амплитуды предыдущего ответа на стандарт (10-3 М серин); это снижает изменчивость между рыбами и внутри рыб.
- Рассчитайте пороговые значения обнаружения путем линейной регрессии кривых концентрации-реакции (на полулогаритмическом участке), согласно журналу формулы(N No 1.5) -журналу C и B, где C является концентрацией молара, N является нормализованной амплитудой реакции, а a и b являются константами 7,,14. N
ПРИМЕЧАНИЕ: Порог обнаружения является значением для x, где y 0.1761 (т.е. журнал 1.5; N No 0); концентрация, над которой будет виден ответ (т.е. рыба может чувствовать его запах). Некоторые одоранты вызывают сигмоидные кривые концентрации реакции при построении полу-логартмически (например,кальций 15,16;в этом случае, нормализованные данные могут быть установлены на трех параметров Хилл участок, который даст максимальную амплитуду ответа и EC50 (т.е., «одорант», который дает половину максимальной реакции; также мера чувствительности). - Сравните пороговые значения обнаружения и/или максимальную амплитудуреакции и 50 стимулов ЕС, протестированных в контролируемой воде, и те, которые были протестированы в воде с высоким содержанием CO2.
Результаты
Типичная реакция на положительный контроль (10-3 M L-серин; Рисунок 4A)и отрицательный контроль (пустой; Рисунок 4B), записанный из обонятельного нерва морского брима, показан на рисунке 4. При наличии стимула (черный горизонтальный бар; в обонятельной полости, в контакте с обонятельным эпителием), обратите внимание на быстрое увеличение активности (отражается в восходящем отклонении интегрированного сигнала) до пика в течение примерно одной секунды начала стимула, а затем период размещения (в то время как стимул все еще присутствует), и возвращение к базовой активности, как только стимул закончился. Абсолютная амплитуда реакции сильно зависит от положения электрода; если зафиксирована низкая амплитуда реакции, попробуйте изменить положение электрода. Более медленный рост пиковой активности может быть связан с трубкой, несущей стимулосодержащую воду к обонятельному эпителию, помещенной слишком далеко от эпителия; попробуйте приблизить носовую трубку к (но не касаясь) эпителия. Обратите внимание, что, напротив, пробел вызывает мало или в отсутствие ответа. Значительный положительный ответ (т.е. увеличение активности) на пробел может свидетельствовать о загрязнении воды, используемой для разбавления стимулов; сделать свежие разбавления с чистой водой (и стеклянной посуды) должны решить эту проблему. В этом случае может потребоваться более тщательная очистка системы водоснабжения (включая фильтры с активированным углем). Отрицательный ответ (т.е. снижение активности) может свидетельствовать о незначительном изменении скорости потока при переключелении клапана из-за, например, закупорки клапана.
Типичная кривая концентрации реакции (построенная полулогаритмически), в данном случае L-лейцин (10-7 М до 10-3 М), показана на рисунке 5A. Обратите внимание, что увеличение концентраций одоранта вызывает все большее увеличение активности, а значит, и амплитуды интегрированных реакций. Сюжет нормализованных данных и их соответствующая линейная регрессия показаны на рисунке 5B. Предполагаемый порог обнаружения может быть x рассчитан из значения x, когда y 0.1761 (т.е. журнал1.5; где N No 0). В этом случае это значение составляет -7,48; то есть рассчитанный порог для L-лейцина в этой рыбе составляет 10-7,48 М. Экспонент q можно аналогичным образом оценить по линейной регрессии нормализованных данных на участке журнала; бревенчатый журналN и «логодорант» и константа. Затем этот фактор дает увеличение концентрации одорантов, необходимых для увеличения амплитуды реакции на одну единицу журнала; то есть, это оценка крутизны кривой концентрации реакции17. В этом примере, No 0,277 и No 3,61; таким образом, чтобы увеличить амплитуду отклика в десять раз (т.е. один бревенчатый блок; журнал10 и 1), концентрация стимулов должна быть увеличена в 103,61раза (4074 раза).
Типичная сигмоидная кривая концентрации реакции(рисунок 6A) при построении полу-логартмически, в данном случае L-глутамин, показан на рисунке 6B. Наблюдается аналогичное увеличение амплитуды реакции, зависящее от концентрации; однако, при более высоких концентрациях, это увеличение становится меньше, так что амплитуда отклика достигает максимума (Nмакс). Это позволяет приуставить данные к уравнению Хилла с тремя параметрами: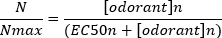
Таким образом,можно рассчитать EC 50 (концентрация одоранта, при которой вызывается 50% максимальный ответ) и со-эффективность Холма (мера крутизны наклона линейной части сигмоидной кривой).
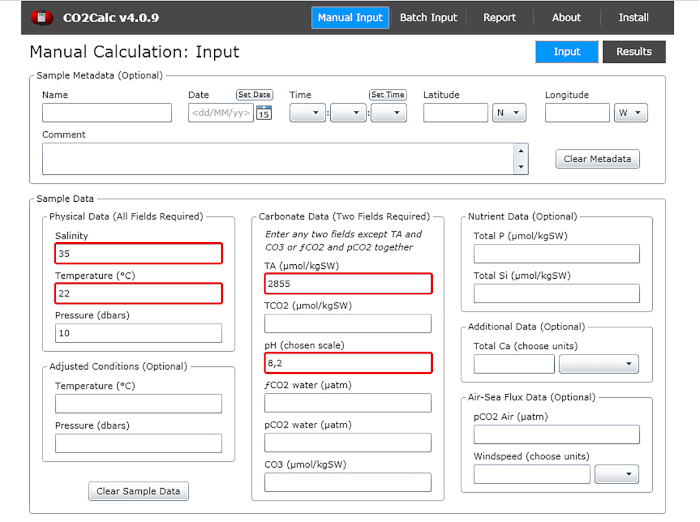
Рисунок 1: Программное обеспечение скриншот, показывающий входное окно из программы CO2Calc. Выделенные (красные ящики) — поля, необходимые для расчета карбонатных параметров. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
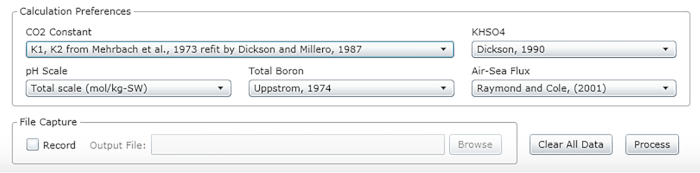
Рисунок 2: Скриншот программного обеспечения, показывающий окно ввода для соответствующих констант, единиц и весов. Значения, показанные, рекомендуются для условий, при которых были проведены описанные эксперименты; они могут измениться. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
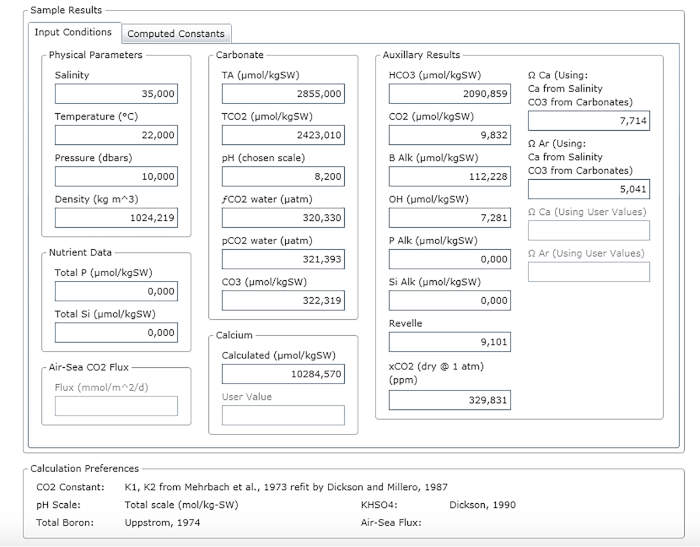
Рисунок 3: Программное обеспечение скриншот, показывающий результаты окна. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
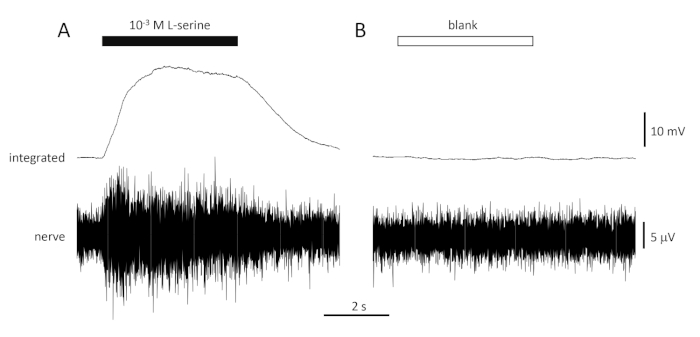
Рисунок 4: Типичные многофункциональные реакции, записанные внеклеточно от обонятельного нерва морского брима in vivo в ответ на 10-3 M L-серин (A) и пустой (B). Верхние следы показывают интегрированные реакции и более низкие следы показывают сырцовой (нервный) сигнал. Стимулы применялись к обонятельному эпителию (горизонтальным прутьям). Обратите внимание на быстрый рост активности в течение 1 с воздействия, пик активности, а затем период размещения (в то время как запах по-прежнему доставляется в эпителий) и возвращение к базовым уровням, как только доставка запаха прекратилась. Мало или в отсутствие увеличения активности наблюдается после стимуляции с водой рассматривается так же, как разбавления пахантов, за исключением добавления любого запаха (пустой). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
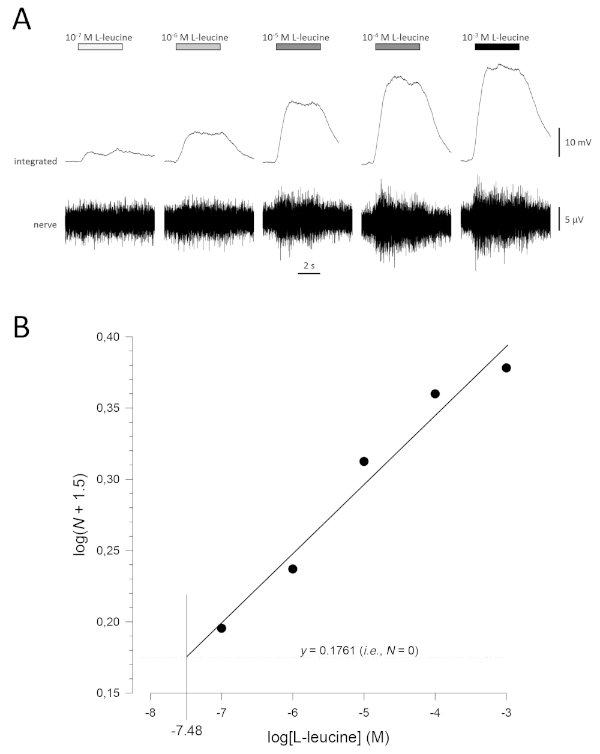
Рисунок 5: Типичная кривая концентрации реакции для L-лейцина, записанная внеклеточно от обонятельного нерва in vivo. (A) По мере того как концентрация L-лейцина, применяемая к обонятельному эпителию (горизонтальным брусьям), увеличивается с 10-7 Мдо 10 -3 М, в нерве наблюдается сопутствующий рост активности. Верхние следы показывают интегрированные реакции и более низкие следы показывают сырцовой (нервный) сигнал. (B) Линейная регрессия (R2 и 0.97) нормализованных данных, построенных полулогаритмически для расчета порога обнаружения в качестве значения для журнала «L-leucine» прижурнале (N No 1.5) 0.1761 (т.е. где N No 0). В этом примере это значение составляет -7,48; Оценочный порог обнаружения L-лейцина в этой рыбе составляет, следовательно, 10-7,48 М. Пожалуйста, нажмите здесь, чтобы просмотреть более широкую версию этой цифры.
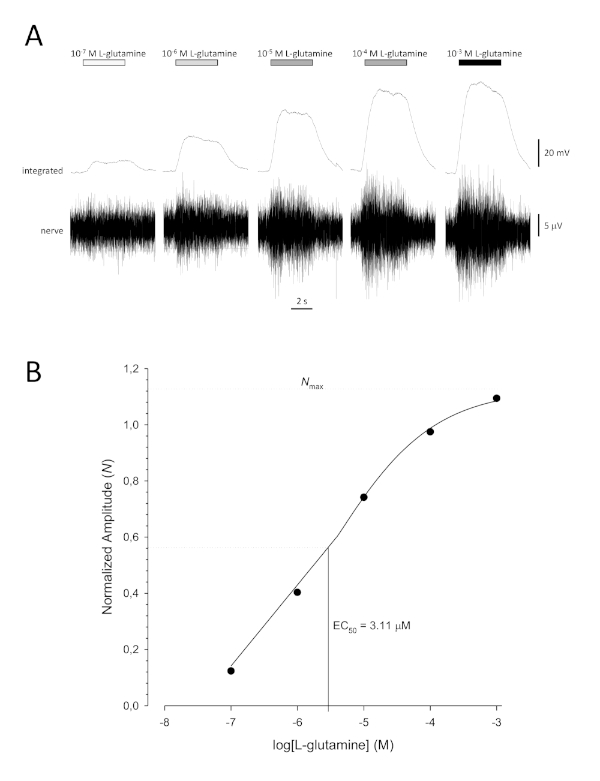
Рисунок 6: Типичная кривая концентрации реакции на L-глутамин регистрируется внеклеточно от обонятельного нерва in vivo. (A) По мере того как концентрация L-глутамина, применяемого к обонятельному эпителию (горизонтальным прутьям), увеличивается с 10-7 Мдо 10 -3 М, в нерве наблюдается сопутствующий рост активности. Верхние следы показывают интегрированные реакции и более низкие следы показывают сырцовой (нервный) сигнал. (B)Полулогаритмический участок нормализованных данных, приспособленных к уравнению холмас тремя параметрами (R 2 и 0.99). Для этого примера, рассчитанный EC50 и 3.11 МКМ, и Холм со-эффективный 0,565). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Текущее исследование описывает использование многофункциональных (внеклеточных) записи из обонятельного нерва морского волокна(S. aurata), морской спарид большое значение в аквакультуре. Однако этот экспериментальный подход может широко применяться к другим рыбам; хирургическое вмешательство и точное размещение электродов будет явно зависеть от анатомии обонятельной системы, а выбор и концентрация анестезии может зависеть от изучаемого вида. Например, обонятельный нерв золотой рыбки(Carassius auratus)короток; в этом случае, запись ЭЭГ из обонятельной лампы было бы проще. Выбор одоранта может также зависеть, в некоторой степени, от вида. В текущем исследовании использовались аминокислоты. Насколько известно авторам, все исследуемые на сегодняшний день виды рыб имеют обонятельную чувствительность каминокислотам 1,,18. Эта чувствительность была вовлечена в различные процессы, такие как расположение пищи, химическая связь и признание натальных вод19,,20,,21,,22,,23. Тем не менее, чувствительность различных видов, в широком смысле, довольно похожи и не зависят от образа жизни или среды обитания. Они также являются четко определенными молекулами и дешево и легко доступны. Эти причины делают их идеальными тестовыми стимулами для исследований по олфакции у рыб, особенно тех, которые изучают влияние антропогенных нарушений (например, подкисления или загрязнения), где результаты можно легко сравнить междувидами 24.
В зависимости от вида, о котором идет речь, подготовка к многоразовой записи может оставаться стабильной в течение нескольких часов; амплитуда ответа на внутренний стандарт (10-3 M L-серин в текущем исследовании) не должна варьироваться более чем на 10% между последовательными тестами. Любое значительное отклонение от этого правила может быть связано с: i) движение рыбы, и, следовательно, перемещение электродов и / или нос-трубки; ii) загрязнение воды, например, при контакте с руками экспериментатора (особенно если более низкие концентрации данного одоранта дают более крупные реакции, чем более высокие концентрации); или (iii) ухудшение состояния здоровья препарата). В случае i) рыба должна быть проверена на наличие перемещенной; если это так, переместить его, и добавить больше анестезии в воду и / или дать еще одну дозу триэтиодида галламина. Разрешить 5 мин и повторно протестировать стандарт. Если ответ еще меньше, то перепозиционировать электроды и / или нос трубки до тех пор, пока достаточно большой ответ записывается. В случае (ii), просто переделать свежие серии разбавления одоранта, используя чистую стеклянную посуду и воду. В случае (iii), убедитесь, что поток воды над жабры рыбы является адекватным, что вода течет над жабры (т.е., выходя через оперкулу, а не рот), и вода хорошо газированные. Различные виды рыб имеют различные температурные предпочтения; обеспечить, чтобы температура в лаборатории (и воды в контакте с рыбой) как можно ближе к температуре, что рыба хранится на насколько это возможно. Убедитесь также, что рыба не подчеркнул, и избежать перемещения их (даже из одного резервуара в другой) по крайней мере за неделю до записи. Электрический шум, конечно, бич жизни электрофизиолога; однако нынешняя статья не является подходящим средством для обсуждения того, как преодолеть/уменьшить это. Тем не менее, "Axon Guide" (доступно свободно в качестве PDF для скачивания с веб-сайта производителя) является источником практических советов по минимизации шума. После того, как большой, стабильный ответ вызывается стандартным стимулом, и концентрация серии дает концентрациозависимых увеличение амплитуды, с минимальной реакцией на пустой, запись ответов на тест стимулы могут начаться. Некоторые авторы дают тот же стимул три раза, и вычислить арифметическое среднее для последующего анализа данных. Тем не менее, это технические репликации, и этот подход увеличит время записи сессии занимает в три раза. Нынешние авторы предпочитают один раз протестировать данный одорант, но всегда являются частью кривой реакции на концентрацию. Это не только позволяет вычислить порог обнаружения или EC50 (как описано), но и гарантирует, что концентрации, близкие к тем, что рыба будет испытывать в своей природной среде проверяются (это не всегда известно). Кроме того, любые выбросы ответы, в связи с загрязнением, например, легче обнаружить; они могут быть повторены с помощью свежеприготовленного образца, если это необходимо.
Многоразовая запись из обонятельного нерва может быть инвазивной, но она более чувствительна, чем EOG призаписи в морской воде 7, так как она не зависит от внешней солености. Поэтому он может быть использован для оценки обонятельной чувствительности к запахам, таким как кальций и натрий, изменения в концентрациях которых также влияют на проводимость и, следовательно,напряжение, записанное 15. В качестве оценки количества ОРН, реагирующих на данный запах (т.е. потенциалы действия, перемещающиеся по аксонам ORN от обонятельного эпителия до лампочки), он представляет собой необработанный, необработанный сигнал (начальная обработка обонятельного ввода начинается в луковицах). Таким образом, это лучший параметр для оценки прямого воздействия загрязняющих веществ, таких как тяжелые металлы, и изменения окружающей среды, такие как рН, на обонятельную систему, чем EOG илиЭЭГ 24,25. Запись из обонятельной лампы в морской воде с высоким PCO2 (и, следовательно, низкий рН) могут быть затронуты центральным воздействием рН на нейронной обработки; «Теория рецепторовГАМК» подкисления океана 26, в результате чего сокращение рН воды вызывает перераспределение Cl- и HCO3- ион в CSF и последующий сдвиг ГАМК активации от ингибитора (гиперполяризации) к возбуждающей (деполяризации). Кроме того, в таких исследованиях важно оценить воздействие подкисления или загрязняющих веществ с использованием концентраций одорантов, аналогичных тем, с которыми рыба может столкнуться в своей природной среде. Для аминокислот, это в нано до микромолярского диапазона27,28,29; близко к порогу обнаружения этих соединений урыб 1,,18. Оценка порога обнаружения данного запаха может дать некоторое представление о важности и/или биологической роли обонятельной чувствительности. Например, морской минога(Petromyzon marinus) имеет высокую обонятельную чувствительность к специфическим желчным кислотам, высвобождаемым личинками до порога 10-13 M30; эта чувствительность позволяет взрослым найти и определить подходящие нерестилища, и, следовательно, выступать в качестве миграционного феромона на большие расстояния. Аналогичным образом, спелые самки морского минога имеют высокую обонятельную чувствительность к спермину(порог 10 -14 M), полиамин выпущен в милт самцов, который затем привлекает их в гнезда сперматозоидов мужчин31. Другие рыбы также имеют обонятельнуючувствительность к полиаминам 32,,33,,34,,35,но не с достаточно низкими порогами обнаружения для поддержки аналогичной феромональной роли; вместо этого предлагается избегать разлагающейся рыбы. Тем не менее, при такой высокой обонятельной чувствительности, можно себе представить, что небольшое снижение чувствительности (т.е. увеличение порога), даже если амплитуда реакции резко не уменьшается, может вызвать серьезные проблемы длярыбы 24.
При построении полу-logarithmically, концентрация реакции кривых на запахи могут быть экспоненциальными, линейные или сигмоидные18. В случае аминокислот такие полулогаритмические кривые концентрации-реакции являются либо линейными (т.е. логаритмическими), сигмоидными, либо силовымифункциями 7. То, что не наблюдается насыщения реакции (т.е. нет плато в кривой концентрации реакции, даже при над-экологических концентрациях), вероятно, связано с несколькими рецепторами, связывающимися с отдельными аминокислотами, в зависимости от их концентрации, а не каждой аминокислотой, связывающейся с конкретным рецептором; как концентрация данной аминокислоты увеличивается, больше рецепторов способны связать его и, следовательно, реагировать. Тем не менее, рыба может различать смеси аминокислот36,,37,,38,,39; это, вероятно, из-за комбинаторных моделей активности, вызванных в обонятельных луковиц12,40; аксоны всех ORNs, выражают тот же белок рецепторов прекратить в том же glomeruli в обонятельных луковиц41,42, и одна аминокислота может активировать более одного glomerulus.
Тем не менее, высокоспецифические одоранты, такие как феромоны, могут вызывать сигмоидные или квазигимоидные кривыеконцентрации реакции 43,44. Вывод, хотя и не эмпирически протестированы, является то, что эти обонятельные ответы из-за весьма специфических рецепторов, которые связывают молекулы феромона и немного другое. Таким образом, выше данной концентрации, все рецепторы заняты, и дальнейшее увеличение не вызовет никаких дальнейших реакций в других ORNs. Таким образом, эти данные могут быть установлены на трех параметров Хилл участка, и максимальный ответ, EC50 и Хиллсо-эффективных могут быть рассчитаны 15,45,46. Это может дать ценную информацию, такую как кажущееся сродство и явное число рецепторов, которые линейные или экспоненциальные кривые реакции концентрации не могут дать.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Работа в лаборатории авторов поддерживается Funda'o para a Ci'ncia e Tecnologia (FCT), Португалия, проектами PTDC/BIA-BMA/30262/2017 и UID/Multi/04326/2019 и контрактной программой DL57/2016/CP1361/CT0041 к ЗВ.
Материалы
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
Ссылки
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C. Chemoreception. The Physiology of Fishes. Evans, D. H., Claiborne, J. B. , CRC Press. Boca Raton, FL. 471-497 (2006).
- Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. Sorensen, P. W., Wisenden, B. D. , John Wiley & Sons Inc. Ames, IA. 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. Spielman, A. I., Brand, J. G. , CRC Press. Boca Raton, FL. 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, TN. (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor? Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P. Jr, Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633(2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. Schulte, B., Goodwin, T., Ferkin, M. , Springer. Cham, Switzerland. 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731(2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332(2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены