Method Article
Registrazione extracellulare multi-unità dal nervo olfattivo di Teleosts
In questo articolo
Riepilogo
La registrazione extracellulare multi-unità dal nervo olfattivo è un metodo sensibile, robusto e riproducibile per valutare la sensibilità olfattiva nei pesci marini. Registra l'input sensoriale primario ed è indipendente dalla salinità esterna.
Abstract
Recenti studi hanno dimostrato che l'acidificazione degli oceani influisce sul comportamento olfattivo nei pesci. Ciò può essere dovuto in parte ad una riduzione della sensibilità olfattiva nell'acqua ad alto PCO2/low pH. Per valutare gli effetti dell'acidificazione degli oceani, o sensibilità olfattiva nel pesce marino in generale, proponiamo che la registrazione multiunità extracellulare dal nervo olfattivo sia il metodo di scelta. Anche se invasivo, è sensibile, robusto, riproducibile e indipendente dalla salinità esterna (a differenza dell'elettro-olfactogramma [EOG], per esempio). Inoltre, registra un ingresso sensoriale primario nel SNC, prima di qualsiasi elaborazione centrale. Mostriamo che questo metodo può mostrare una riduzione della sensibilità olfattiva che è sia temporanea che dipendente dall'odore, utilizzando una gamma di aminoacidi per costruire curve di concentrazione-risposta e calcolare le soglie di rilevamento.
Introduzione
I pesci si affidano molto all'olfatto per molti aspetti della loro vita, tra cui trovare cibo, evitare i predatori, valutare potenziali compagni e migrazione, tra glialtri 1,2,3. Pertanto, valutando la sensibilità olfattiva nei pesci (che odore hanno? Quanto sono sensibili a questi composti?) è fondamentale comprendere appieno questi processi. Inoltre, gli effetti antropogenici sull'ambiente, come l'acidificazione degli oceani e l'inquinamento, possono avere effetti profondi sul sistema olfattivo, anche a livelli di sublethal, perché è necessariamente in contatto intimo con l'acqua circostante4. L'elettrofisiologia in vivo è l'approccio sperimentale di scelta per valutare la sensibilità olfattiva nei pesci. Sono disponibili tre tecniche principali: l'elettro-olfatogramma (EOG), l'elettroencefalogramma (EEG) registrato dalla lampadina olfattiva e la registrazione multi-unità dal nervo olfattivo5.
L'EOG è il più utilizzato di questi tre6. È un potenziale di campo a corrente diretta (DC) registrato sopra l'epitelio olfattivo e si ritiene che sia il potenziale del generatore sommato di quei neuroni recettori olfattivi (ORN) che rispondono a un dato odore. Tuttavia, come si registra nell'acqua, piuttosto che all'interno del pesce, l'ampiezza della risposta dipende non solo dal segnale generato dal pesce, ma anche dalla conduttività dell'acqua circostante; maggiore è la conduttività (o minore è la resistenza), minore sarà l'ampiezza. Ciò può significare che l'EOG è un metodo meno sensibile nell'acqua di mare rispetto all'acqua dolce7.
L'EEG registrato dal bulbo olfattivo è ampiamente utilizzato anche nello stato di indagine sull'olfatto nei pesci. Tuttavia, la lampadina olfattiva è il centro di elaborazione di primo ordine per l'ingresso sensorialeolfattivo 8; è altamente organizzato in glomeruli, e di conseguenza la risposta registrata dipende fortemente dalla posizione degli elettrodi di registrazione. Ad esempio, l'input da ORN che rileva gli amminoacidi viene elaborato dai glomeruli nella regione laterale dei bulbi olfattivi, mentre quello da sostanze chimiche derivate da conspecifici viene diretto alla regionemediale 9,10,11,12. L'input fenomonale può essere diretto a glomeruli altamente localizzati all'interno della lampadina olfattiva. A seconda anche dell'anatomia della specie in questione, la posizione di registrazione ideale per un dato odore potrebbe non essere facilmente accessibile.
La registrazione multi-unità dal nervo olfattivo aggira i principali problemi con l'EOG e l'EEG sopra descritti. Mentre registra i potenziali azioni che passano gli assoni degli ORN dall'epitelio alla lampadina, è un segnale sensoriale primario. E come è registrato all'interno del pesce, l'ampiezza della risposta è indipendente dalla salinità esterna. Tuttavia, naturalmente, ha alcuni svantaggi. In primo luogo, a seconda dell'anatomia della specie, è necessaria una chirurgia più estesa per esporre il nervo olfattivo rispetto all'EOG. In secondo luogo, poiché il segnale è più piccolo dell'EOG, richiede attrezzature leggermente più sofisticate e quindi costose. Una descrizione generale di altri approcci sperimentali è data da John Caprio5. Lo scopo di questo articolo è quello di delineare come registrare le risposte extracellulari multi-unità dal nervo olfattivo dell'ora del vano (Sparus aurata) in vivo agli odori di amminoacidi come esempio di questa tecnica, e come identificare, e superare, alcuni dei problemi più comuni incontrati in un tale esperimento.
Protocollo
La manutenzione e la sperimentazione degli animali sono state effettuate in impianti sperimentali certificati e hanno seguito la legislazione nazionale portoghese (DL 113/2013) con licenza "gruppo-1" dalla Direzione Generale Veterinaria, dal Ministero dell'Agricoltura, dello Sviluppo Rurale e della Pesca del Portogallo. Poiché questo protocollo prevede la manipolazione degli animali, deve essere approvato dall'organismo locale e/o nazionale che regola il benessere degli animali utilizzati negli esperimenti scientifici, inoltre i ricercatori devono disporre della formazione e delle licenze appropriate per eseguire tali procedure.
1. Preparazione dello stimolo
NOTA: La maggior parte dei pesci ha un sistema olfattivo altamente sensibile, quindi è necessario fare molta attenzione quando si preparano gli stimoli olfattivi da utilizzare nell'esperimento. Il vetro utilizzato per fare gli stimoli deve essere lavato in candeggina del 5% (ipoclorito di sodio), sciacquato accuratamente con acqua del rubinetto e essiccato. Immediatamente prima dell'uso sciacquare accuratamente il vetro con acqua di mare (la stessa acqua utilizzata per effettuare le diluizioni di stimolo). Fare attenzione che nessuna di questa acqua entra in contatto con la pelle nuda.
- Fare 100 mL di 10-2 M L-glutamina, L-leucina e L-serina; conservare 1 aliquots mL di ciascuno a -20 gradi centigradi fino all'uso.
- Il giorno dell'esperimento, preparatevi da questi aliquots, da 10-3 M a 10-7 M (in fasi di diluizione x10) utilizzando sia il controllo che l'acqua di mare ad alta CO2.
NOTA: L-serina (10-3 M) verrà utilizzato come controllo positivo, o standard. L'acqua utilizzata per fare le diluizioni degli stimoli, e trattata esattamente allo stesso modo degli stimoli ma senza aggiunta di alcun odore, sarà utilizzata come controllo negativo o vuoto.
2. Preparazione del controllo e acqua adalta CO 2
- Preparare l'acqua di controllo raccogliendo 1 L di acqua di mare filtrata a carbone.
- Utilizzando una sonda pH, controllare il pH; dovrebbe essere di circa 8.2. In caso contrario, bolla con aria atmosferica fino a raggiungere questo pH.
- Utilizzando un titratore alcalinità misurare l'alcalinità dell'acqua.
- Misurare la temperatura dell'acqua e la salinità.
- Preparare l'acqua ad alta CO2 filtrando 1 L di acqua di mare, quindi bolla CO2 fino a raggiungere il pH desiderato.
- Utilizzando una sonda pH, controllare il pH; dovrebbe essere di circa 7.7.
- Utilizzando un titrator alcalinità, misurare l'alcalinità dell'acqua.
- Misurare la temperatura dell'acqua e la salinità.
- Determinare la pressione di CO2 sia nel controllo che nell'acqua ad alto CO2 utilizzando un software progettato per calcolare i parametri di CO2 in acqua (ad esempio, software CO2Calc13).
- Nella finestra di input aggiungere i valori di pH dell'acqua, temperatura, salinità e alcalinità totale (Figura 1).
- Selezionare le costanti, le unità e le scale (vedere i valori consigliati nella Figura 2).
- Premere il tasto per determinare la pressione di CO2.
NOTA: Figura 3 mostra un esempio di un foglio di risultati.
3. Preparazione del pesce
NOTA: in questo protocollo viene utilizzata un'orata di 200-400 g.
- Anestesizzare il pesce byimmersion in acqua di mare naturale aerato contenente MS222 (sale metanosulfonato etilo-3-aminobenzoato). Quando la risposta a un pizzico di coda si è fermata, iniettare nel muscolo del fianco il neuromuscolare bloccante gallathiodide (10mg-kg -1 in salina fisiologica).
NOTA: La concentrazione di anestetico utilizzato varia a seconda delle specie; per un' allevamento di 200-400 g, utilizzare 200 mg L-1 memorizzato nel buffer con 400 mg L-1 NaHCO3. - Posizionare il pesce anethetizzato su un supporto ammortizzato. La forma e le dimensioni esatte dipendono dalle specie modello; per l'ora di mare (200-400 g), utilizzare un supporto imbottito a forma di V, realizzato in casa.
- Posizionare un tubo di silicio (diametro 10 mm) in bocca, collegare il tubo a una pompa sommergibile in un serbatoio di acqua di mare anestetica, aerata, e pompare l'acqua sopra le branchie a 100 mL-1 -1kg -1.
NOTA: La dimensione del tubo di silicio utilizzato dipenderà dalle dimensioni del pesce. - Inserire il perno di terra nel muscolo del fianco e collegarlo alla fase di testa dell'amplificatore).
- Coprire il pesce con un panno umido (o un asciugamano di carta) solo con la testa esposta, assicurandosi che il rivestimento non impedise l'uscita dell'acqua dalle branchie.
NOTA: Gli occhi possono essere coperti con pezzi di carta/stoffa umida o plastica nera. - Posizionare il tubo del sistema di consegna dello stimolo, cioè il tubo di vetro collegato ad una fornitura di acqua di mare di fondo, nella narice.
NOTA: è possibile utilizzare tubi micro-ematocriti (lunghezza 75 mm, ID 1,15 mm, OD e 1,55 mm); questi possono essere tirati in un punto più fine su un estrattore di elettrodi per l'uso con pesci più piccoli. È importante assicurarsi che l'epitelio olfattivo sia mantenuto bagnato durante l'intervento chirurgico (descritto di seguito). - Esporre i nervi olfattivi rimuovendo la pelle e l'osso del cranio tra gli occhi (i nervi olfattivi di solito corrono insieme tra gli occhi) con l'aiuto di un trapano dentale (idealmente) o hobby (ad esempio, Dremel) o lucidatore di gioielliere (con punte di perforazione dentali) sotto un microscopio sezionante (all'interno di una gabbia di Faraday).
- Nell'orata, rimuovere la parte del cranio immediatamente sopra gli occhi, con una sega circolare, da appena anteriore agli occhi a solo posteriore a loro. Quindi, usando un bit di trapano, rimuovere l'osso tra gli occhi; i nervi olfattivi giacciono tra gli occhi.
- Una volta che l'osso è stato eliminato sufficiente, rimuovere il grasso e il tessuto connettivo sovrastato i nervi utilizzando le forcelle fini; fare attenzione a non danneggiare i nervi o forare i vasi sanguigni.
NOTA: l'esperienza aiuterà a perfezionare la dissezione; più piccola è la dissezione, più stabile sarà la preparazione. Tuttavia, il tessuto sufficiente deve essere eliminato; per gli inesperti, quando i bulbi olfattivi sono appena visibili, chiaro leggermente più anterioremente per esporre la parte dei nervi come si uniscono le lampadine per consentire il corretto posizionamento degli elettrodi. - Pulire gli elettrodi prima dell'uso collegandoli al polo negativo di una sorgente 3V DC (ad esempio, due batterie AA in serie) e posizionando la punta in salina fisiologica (o acqua di mare diluita 1:3 in acqua dolce) per 20-30 s; un flusso costante di piccole bolle dovrebbe essere visto proveniente dalla punta.
- Una volta esposti i nervi olfattivi, inserire gli elettrodi di registrazione (tenuti su micro-manipolatori) in una posizione che dà una risposta massima allo standard (ad esempio, 10-3 M L-serine), e una risposta minima al vuoto. Utilizzare elettrodi di tungsteno rivestiti in parilene (Tabella dei Materiali) collegati alla fase della testa di un preamplificatore a corrente alternata (AC).
NOTA: Nell'ora di 45, le risposte più forti agli aminoacidi sono di solito viste con gli elettrodi posizionati nel lato laterale del nervo, vicino a dove si unisce al bulbo olfattivo. Questo può valere per altre specie, in quanto l'organizzazione glomerare del bulbo è sostanzialmente simile tra le specie. Tuttavia, l'esperienza è sempre il miglior insegnante.
4. Registrazione elettrofisiologica
NOTA: Come per la maggior parte dell'elettrofisiologia, la registrazione multiunità deve avvenire all'interno di una gabbia di Faraday. Tuttavia, la registrazione extracellulare di solito non richiede una tabella anti-vibrazione; la maggior parte dei movimenti verrà dal pesce. Tuttavia, è necessario un tavolo forte e stabile con una superficie metallica per fissare le basi magnetiche degli stand del micro-manipolatore.
- Impostare un sistema di fornitura di stimoli per consentire il rapido passaggio dall'acqua di fondo pulita all'acqua contenente gli stimoli, ad esempio utilizzando una valvola a tre vie azionata da solenoidi. Collegare la presa comune al tubo che trasporta l'acqua alla rosetta olfattiva e posizionare una linea in un serbatoio di acqua di mare e l'altra nella soluzione di prova.
NOTA: Quando la valvola viene commutata (passando la corrente DC), il flusso d'acqua passa dall'acqua di fondo a quella contenente l'odore. Lo stimolo dovrebbe essere dato abbastanza a lungo da vedere un chiaro picco nella risposta integrata, seguito da un periodo di alloggio; il tempo utilizzato nel protocollo attuale è di 4 s, ma può essere necessario un tempo più lungo a seconda della specie. - Collegare il driver della valvola al trigger di un convertitore analogico-digitale (ad esempio, Digidata); quando la valvola passa dallo sfondo alla linea contenente lo stimolo, questa inizierà la registrazione dei dati. Configurare il software per avviare la registrazione in corrispondenza dell'evento trigger e continuare per un periodo predeterminato (ad esempio, 10 s).
NOTA: Dieci secondi dovrebbero essere sufficienti, ma questo può essere accorciato o allungato, a seconda della domanda sperimentale. - Controllare la stabilità della preparazione provando (registrando e misurando l'ampiezza della risposta integrata) ripetutamente con lo standard, 10-3 M L-serine in questo caso, e permettendo 1 min a trascorrere tra stimoli successivi.
NOTA: A seconda in una certa misura delle specie e degli odori, le risposte dovrebbero avere un'ampiezza entro il 10% l'una dall'altra (come regola generale) e dovrebbero avere un rapido insorgenza, salire alla massima attività e tornare alla linea di base dopo l'assenza dellostimolo (Figura 4). - Registrare le risposte nervose olfattive agli amminoacidi nell'acqua di mare di controllo (dalla più bassa alla più alta concentrazione) e consentire 1 min a trascorrere tra stimoli successivi.
NOTA: È possibile che, per alcune specie e/o alcuni odori, sia necessario più tempo. Ma per gli amminoacidi e l'orata, 1 min è sufficiente. - Registrare la risposta a 10-3 M serina e una soluzione di controllo acqua vuota.
- Cambiare l'acqua di fondo da acqua di mare di controllo ad acqua di mare ad alta CO2, inserendo la linea di fondo nella bottiglia con acqua di mare ad alta CO2.
NOTA: Si consiglia di inserire un altro tubo ematocrito (o equivalente) alla fine delle linee di stimolo e di fondo per evitare di toccare l'acqua e garantire che l'estremità del tubo rimanga in acqua. - Prima di testare la risposta del nervo olfattivo agli amminoacidi in acqua di mare ad alta CO2, condizionare l'epitelio olfattivo con acqua alta co2 seguendo l'acqua alta di CO2 sopra l'epitelio olfattivo per alcuni minuti.
NOTA: L'esperienza ha dimostrato che, per l'allevamento, 5 min è sufficiente. - Registrare le risposte nervose olfattive agli aminoacidi nell'acqua di mare ad alta CO2 (dalla più bassa alla più alta concentrazione).
- Registrare la risposta a una soluzione ad alta CO2 acqua vuota.
- Registrare la risposta a 10-3 M serina e una soluzione di controllo acqua vuota.
NOTA: il segnale grezzo (attività nervosa) deve essere filtrato (passaggio basso intorno a 2.000-5.000 Hz, passaggio alto 50-300 Hz) e passato a un convertitore analogico-digitale (Tabella dei materiali). Per facilitare la quantificazione dell'attività nervosa, il segnale grezzo può anche essere integrato utilizzando un integratore che perde ( Tabella deiMateriali) e passato al convertitore analogico-digitale, e da lì, sia segnali grezzi che integrati a un computer che esegue il software appropriato (ad esempio, Axoscope).
5. Analisi dei dati
- Sottrarre l'ampiezza della risposta integrata al vuoto (in mV) dall'ampiezza delle risposte integrate a tutti gli stimoli.
- Normalizzare le risposte agli stimoli dividendo l'ampiezza della risposta precedente allo standard (10-3 M serine); questo riduce la variabilità intra-pesce e intra-pesce.
- Calcolare le soglie di rilevamento per regressione lineare delle curve di concentrazione-risposta (su un grafico semi-logaritmico), in base al log della formula(N - 1,5) - unlog C , doveC è la concentrazione molare, N è l'ampiezza della risposta normalizzata e a e b sono costanti7,14.
NOTA: la soglia di rilevamento è quindi il valore di x dove y è 0,1761 (ad esempio, log 1.5; N - 0); la concentrazione al di sopra della quale si vede una risposta (cioè, il pesce può sentirne l'odore). Alcuni odori evocano curve di concentrazione-risposta sigmoiali quando tracciati semi-logaritmicamente (ad esempio, calcio15,16; in questo caso, i dati normalizzati possono essere adattati a un grafico Hill a tre parametri che darà la massima ampiezza di risposta e la EC50 (cioè, [odore] che dà una risposta semi-massima; anche una misura di sensibilità). - Confrontare le soglie di rilevazione e/o l'ampiezza massima di risposta e la CE50 degli stimoli testati nell'acqua di controllo e quelle testate in acqua ad alta CO2.
Risultati
Una tipica risposta al controllo positivo (10-3 M L-serine; Figura 4A) e controllo negativo (vuoto; Figura 4B) registrata dal nervo olfattivo di un'ora di mare è illustrata nella Figura 4. In presenza dello stimolo (barra orizzontale nera; nella cavità olfattiva, a contatto con l'epitelio olfattivo), si nota il rapido aumento dell'attività (riflessa nella deviazione verso l'alto del segnale integrato) a un picco entro circa un secondo dall'inizio dello stimolo, seguito da un periodo di alloggio (mentre lo stimolo è ancora presente), e da un ritorno all'attività di base una volta terminato lo stimolo. L'ampiezza assoluta della risposta dipende fortemente dalla posizione dell'elettrodo; se viene registrata una risposta di bassa ampiezza, provare a modificare le posizioni degli elettrodi. Un aumento più lento all'attività di picco può essere dovuto al tubo che trasporta l'acqua contenente lo stimolo all'epitelio olfattivo posizionato troppo lontano dall'epitelio; provare a spostare il naso-tubo più vicino (ma non toccare) l'epitelio. Si noti che, al contrario, il vuoto evoca poca o nessuna risposta. Una risposta positiva significativa (cioè l'aumento dell'attività) allo spazio può indicare la contaminazione dell'acqua utilizzata per effettuare le diluizioni degli stimoli; effettuare diluizioni fresche con acqua pulita (e bicchieri) dovrebbe risolvere questo problema. In caso contrario, potrebbe essere necessaria una pulizia più accurata del sistema idrico (compresi i filtri a carbone attivati). Una risposta negativa (cioè una diminuzione dell'attività) può indicare un leggero cambiamento della velocità di flusso quando la valvola viene commutata a causa, ad esempio, di un blocco nella valvola.
Una tipica curva di concentrazione-risposta (tracciata semi-logaritmicamente), in questo caso a L-leucine (da 10-7 M a 10-3 M), è mostrata nella Figura 5A. Si noti che l'aumento delle concentrazioni dell'odore evocano aumenti sempre più grandi dell'attività e, quindi, nell'ampiezza delle risposte integrate. Un grafico dei dati normalizzati e la corrispondente regressione lineare è illustrato nella Figura 5B. La soglia stimata di rilevamento può essere calcolata dal valore di x quando y è 0,1761 (ad esempio, log1.5; dove N è uguale a 0). In questo caso, questo valore è -7,48; vale a essere, la soglia calcolata per L-leucine in questo pesce è 10-7,48 M. L'esponente può essere stimato in modo simile dalla regressione lineare dei dati normalizzati in un grafico log-log; logN : -log[odorante] - costante. Il fattore γ quindi dà l'aumento della concentrazione di odoro necessaria per aumentare l'ampiezza di risposta di un'unità di registro; vale a parte, è una stima della ripidezza della curva di concentrazione-risposta17. In questo esempio, il valore di , è 0,277 e γ 3,61; pertanto, per aumentare di dieci volte l'ampiezza di risposta (cioè un'unità di log; log10 e 1), la concentrazione di stimolo deve essere aumentata di 103,61volte (4.074 volte).
Una tipica curva di concentrazione-risposta sigmoiale (Figura 6A) quando tracciata semi-logaritmicamente, in questo caso a L-glutamina, è illustrata nella Figura 6B. Si osserva un aumento simile dipendente dalla concentrazione nell'ampiezza della risposta; tuttavia, alle concentrazioni più elevate, questo aumento diventa inferiore in modo che l'ampiezza della risposta raggiunga un massimo (Nmax). Ciò consente di montare i dati su un'equazione Hill a tre parametri: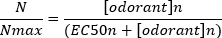
In questo modo, è possibile calcolare la EC50 (la concentrazione odorante alla quale viene evocata una risposta massima del 50%) e la Hill co-efficiente (una misura della ripidezza della pendenza della parte lineare della curva sigmoiale).
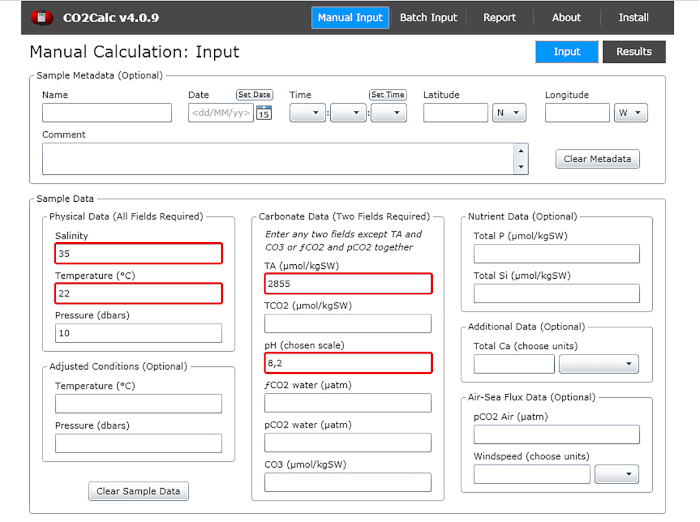
Figura 1: Schermata del software che mostra la finestra di input dal programma CO2Calc. Evidenziati (caselle rosse) sono i campi necessari per il calcolo dei parametri di carbonato. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
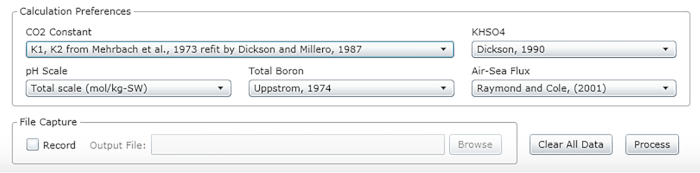
Figura 2: Schermata del software che mostra la finestra di input per le costanti, le unità e le scale appropriate. I valori indicati sono raccomandati per le condizioni in cui sono stati effettuati gli esperimenti descritti; possono cambiare. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
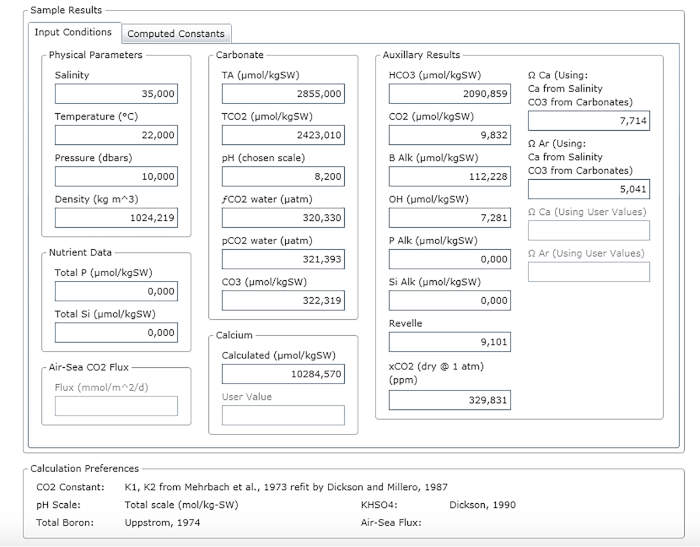
Figura 3: Schermata del software che mostra la finestra dei risultati. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
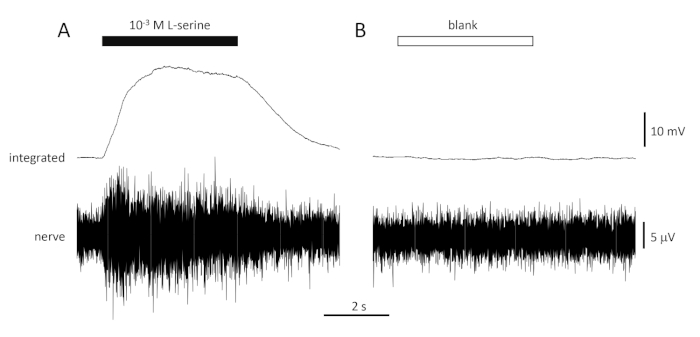
Figura 4: Risposte tipiche multi-unità registrate in modo extracellulare dal nervo olfattivo dell'orata in vivo in risposta a 10-3 M L-serine (A) e vuote (B). Le tracce superiori mostrano le risposte integrate e le tracce inferiori mostrano il segnale grezzo (nervoso). Gli stimoli sono stati applicati all'epitelio olfattivo (barre orizzontali). Si noti il rapido aumento dell'attività durante il 1 s di esposizione, un picco di attività, seguito da un periodo di alloggio (mentre l'odore è stato ancora consegnato all'epitelio) e un ritorno ai livelli di base una volta che la consegna odorante è cessata. Poco o nessun aumento dell'attività è visto dopo la stimolazione con acqua trattata allo stesso modo come diluizioni odoranti, ad eccezione dell'aggiunta di qualsiasi odore (vuoto). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
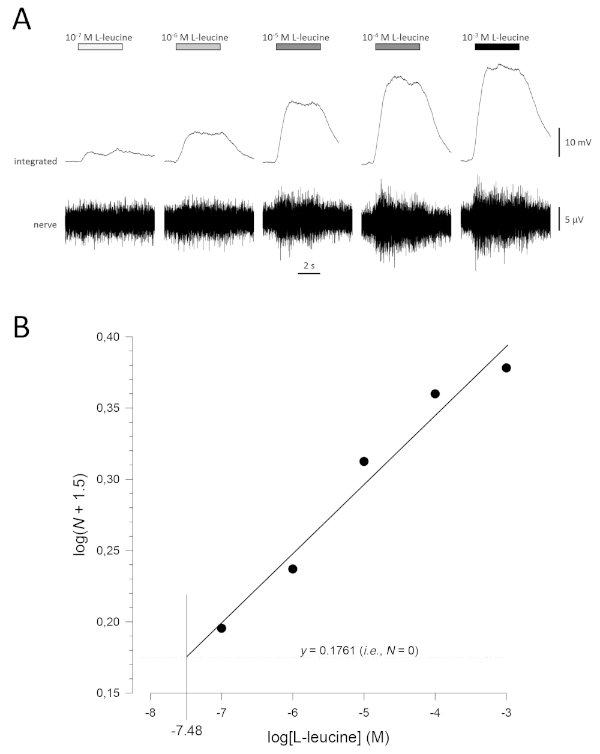
Figura 5: Curva di concentrazione-risposta tipica per L-leucine registrata in modo extracellulare dal nervo olfattivo in vivo. (A) Poiché la concentrazione di L-leucina applicata all'epitelio olfattivo (barre orizzontali) aumenta da 10-7 M a 10-3 M, si osserva un aumento concomitante dell'attività nel nervo. Le tracce superiori mostrano le risposte integrate e le tracce inferiori mostrano il segnale grezzo (nervoso). (B) Regressione lineare (R2 x 0,97) di dati normalizzati tracciati semi-logaritmicamente per calcolare la soglia di rilevamento come valore per log[L-leucine] quando log(N x 1,5) - 0,1761 (cioè, dove N è 0). In questo esempio, questo valore è -7.48; la soglia stimata di rilevamento per L-leucine in questo pesce è quindi 10-7.48 M. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
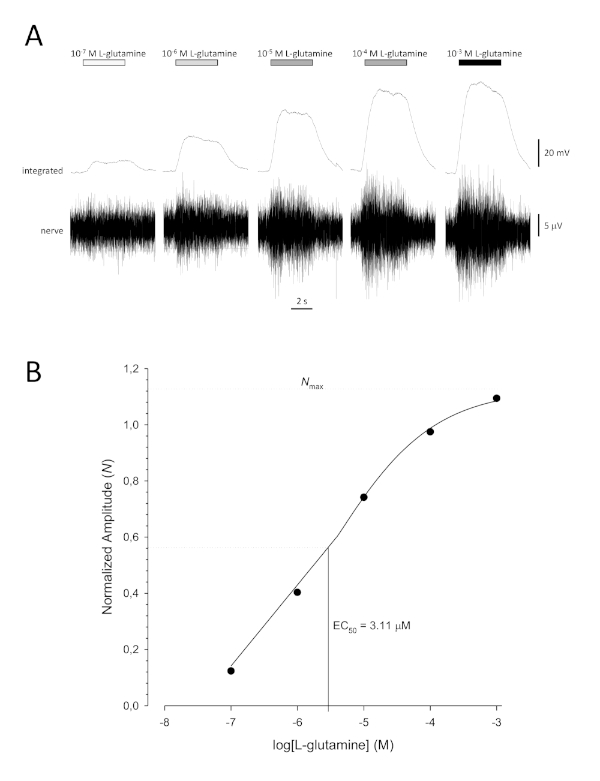
Figura 6: Curva di concentrazione-risposta tipica per L-glutamina registrata extracellulare dal nervo olfattivo in vivo. (A) Poiché la concentrazione di L-glutamina applicata all'epitelio olfattivo (barre orizzontali) aumenta da 10-7 M a 10-3 M, si osserva un aumento concomitante dell'attività nel nervo. Le tracce superiori mostrano le risposte integrate e le tracce inferiori mostrano il segnale grezzo (nervoso). (B) Grafico semi-logaritmico di dati normalizzati adattato a un'equazione Hill a tre parametri (R2 x 0,99). Per questo esempio, il calcolo EC50 è 3,11 M e il co-efficiente Hill è 0,565). Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Lo studio attuale descrive l'uso di registrazione multi-unità (extracellulare) dal nervo olfattivo dell'ora marina (S. aurata), un corpo marino di grande importanza in acquacoltura. Tuttavia, questo approccio sperimentale può essere ampiamente applicato ad altri pesci; l'intervento chirurgico e l'esatto posizionamento degli elettrodi dipenderanno chiaramente dall'anatomia del sistema olfattivo, e la scelta e la concentrazione dell'anestetico possono dipendere dalle specie in esame. Ad esempio, il nervo olfattivo del pesce rosso (Carassius auratus) è breve; in questo caso, registrare l'EEG dalla lampadina olfattiva sarebbe più facile. La scelta dell'odore può anche dipendere, in una certa misura, dalla specie. Lo studio attuale ha usato aminoacidi. Per quanto ne sanno gli autori, tutte le specie ittiche studiate fino ad oggi hanno una sensibilità olfattiva agli amminoacidi1,18. Questa sensibilità è stata implicata è diversi processi come la posizione degli alimenti, comunicazione chimica e il riconoscimento delle acquenatali 19,20,21,22,23. Tuttavia, la sensibilità di specie diverse è, in generale, piuttosto simile e non dipende dallo stile di vita o dall'habitat. Sono anche molecole ben definite e sono a buon mercato e facilmente disponibili. Questi motivi li rendono stimoli di prova ideali per gli studi sull'olfatto nei pesci, in particolare quelli che studiano gli effetti dei disturbi antropogenici (ad esempio, l'acidificazione o l'inquinamento), dove i risultati possono essere facilmente confrontati tra lespecie 24.
A seconda delle specie in questione, i preparati per la registrazione multi-unità possono rimanere stabili per diverse ore; l'ampiezza della risposta allo standard interno (10-3 M L-serine nello studio corrente) non deve variare di oltre il 10% tra i test successivi. Qualsiasi deviazione significativa da questa regola empirica potrebbe essere dovuta a: (i) movimento del pesce, e quindi spostamento degli elettrodi e/o naso-tubo; ii) contaminazione dell'acqua, ad esempio, entrando in contatto con le mani dello sperimentatore (soprattutto se concentrazioni più basse di un dato odore danno risposte maggiori rispetto alle concentrazioni più elevate); o (iii) deterioramento della salute del preparato). Nel caso (i), il pesce deve essere controllato per essere spostato; in tal caso, riposizionarlo e aggiungere più anestetico all'acqua e/o somministrare un'altra dose di triethiodide della gallamina. Lasciare 5 min e ripetere lo standard. Se la risposta è ancora più piccola, riposizionare gli elettrodi e/o il tubo del naso fino a quando non viene registrata una risposta sufficientemente grande. Nel caso (ii), è sufficiente rifare una serie di diluizione fresca dell'odore, utilizzando bicchieri puliti e acqua. Nel caso (iii), verificare che il flusso d'acqua sulle branchie del pesce sia adeguato, che l'acqua flui sia sulle branchie (cioè, uscendo attraverso l'opercula, piuttosto che la bocca), e che l'acqua sia ben aerata. Diverse specie ittiche hanno preferenze di temperatura molto diverse; garantire che la temperatura del laboratorio (e quella dell'acqua a contatto con il pesce) sia il più vicina possibile alla temperatura che i pesci sono mantenuti. Assicurarsi, inoltre, che i pesci non siano stressati ed evitare di spostarli (anche da un serbatoio all'altro) per almeno una settimana prima della registrazione. Il rumore elettrico è, ovviamente, la rovina della vita di un elettrofisiologo; tuttavia, l'articolo attuale non è il mezzo appropriato per discutere come superare / ridurre questo. Tuttavia, 'The Axon Guide' (disponibile gratuitamente in formato pdf per il download dal sito web del produttore) è una fonte di consigli pratici sulla minimizzazione del rumore. Una volta che una risposta grande e stabile viene evocata dallo stimolo standard, e una serie di concentrazioni dà un aumento di ampiezza dipendente dalla concentrazione, con una risposta minima al vuoto, può iniziare la registrazione delle risposte agli stimoli di prova. Alcuni autori danno lo stesso stimolo tre volte e calcolano la media aritmetica per l'analisi dei dati successiva. Tuttavia, si tratta di repliche tecniche e questo approccio aumenterà di tre volte il tempo di registrazione di una sessione di registrazione. Gli autori attuali preferiscono testare un determinato odore una volta, ma sempre parte di una curva di concentrazione-risposta. Ciò non solo consente il calcolo della soglia di rilevazione o EC50 (come descritto), ma assicura anche che le concentrazioni vicine a quelle che il pesce sperimenterebbe nel suo ambiente naturale siano testate (questo non è sempre noto). Inoltre, eventuali risposte ananali, dovute ad esempio alla contaminazione, sono più facili da individuare; questi possono poi essere ripetuti utilizzando un campione appena fatto, se necessario.
La registrazione multi-unità dal nervo olfattivo può essere invasiva, ma è più sensibile rispetto all'EOG quando viene registrata nell'acquadi mare 7, in quanto è indipendente dalla salinità esterna. Può quindi essere utilizzato per valutare la sensibilità olfattiva agli odori, come il calcio e il sodio, i cui cambiamenti nelle concentrazioni inciderebbero anche sulla conduttività e di conseguenza sulle tensioniregistrate 15. Come stima del numero di ORN che rispondono a un determinato odore (cioè, i potenziali d'azione che viaggiano lungo gli assoni ORN dall'epitelio olfattivo alla lampadina), rappresenta un segnale grezzo e non elaborato (l'elaborazione iniziale dell'input olfattivo inizia nelle lampadine). Pertanto, è un parametro migliore per valutare gli effetti diretti degli inquinanti, come i metalli pesanti, e i cambiamenti ambientali, come il pH, sul sistema olfattivo rispetto all'EOG o all'EEG24,25. La registrazione dalla lampadina olfattiva nell'acqua di mare con un elevato PCO2 (e quindi basso pH) può essere influenzata dagli effetti centrali del pH sull'elaborazione neurale; la "teoria del recettore GABAA" dell'acidificazione degli oceani26, per cui la riduzione del pH dell'acqua provoca una ridistribuzione di Cl- e HCO3- ione nel CSF e un conseguente spostamento dell'attivazione GABAergica da inibitorio (iperpolarizzazione) a eccitante (depolarizzazione). Inoltre, in tali studi, è importante valutare gli effetti dell'acidificazione o degli inquinanti utilizzando concentrazioni di odori simili a quelle che il pesce potrebbe incontrare nel suo ambiente naturale. Per gli amminoacidi, questo è nella gamma da nano a micromolare27,28,29; vicino alla soglia di rilevazione di questi composti nei pesci1,18. La stima della soglia di rilevamento per un determinato odore può dare un'idea dell'importanza e/o del ruolo biologico della sensibilità olfattiva. Ad esempio, la lamprede marina (Petromyzon marinus) ha un'elevata sensibilità olfattiva agli acidi biliare specifici rilasciati dalle larve fino a una soglia di 10-13 M30; questa sensibilità consente agli adulti di individuare e identificare i terreni di riproduzione adatti, e quindi agire come un feromone migratorio su lunga distanza. Allo stesso modo, la lampreda di mare femminile matura ha un'alta sensibilità olfattiva allo spermina (soglia10 -14 M), una poliamina rilasciata nel milt dai maschi, che poi li attrae ai nidi dei maschi che lospermaano 31. Altri pesci hanno anche sensibilità olfattiva alle poliamine32,33,34,35, ma non con soglie di rilevamento sufficientemente basse per sostenere un ruolo fenomonre simile; invece, si suggerisce di evitare il pesce in decomposizione. Tuttavia, con una sensibilità olfattiva così elevata, è possibile immaginare che una leggera riduzione della sensibilità (cioè l'aumento della soglia), anche quando l'ampiezza di risposta non è drasticamente ridotta, potrebbe causare gravi problemi per il pesce24.
Se tracciate in semi-logaritmica, le curve di concentrazione-risposta agli odori possono essere esponenziali, lineari o sigmoiali18. Nel caso degli amminoacidi, tali curve di concentrazione-risposta semi-logaritmiche sono sia lineari (cioè logaritmiche), funzioni sigmoimiche o di potenza7. che non si osserva alcuna saturazione della risposta (cioè nessun altopiano nella curva concentrazione-risposta, anche a concentrazioni sovra-ambientali) è probabilmente dovuto a diversi recettori che si legano ai singoli aminoacidi, a seconda della loro concentrazione, piuttosto che di ogni aminoacido che si lega a un recettore specifico; come la concentrazione di un dato aminoacido aumenta, più recettori sono in grado di legarlo e quindi rispondere. Tuttavia, il pesce può distinguere tra miscele di aminoacidi36,37,38,39; ciò è probabilmente dovuto a modelli combinatori di attività evocati nei bulbiolfattivi 12,40; gli assoni di tutte le ORN che esprimono la stessa proteina recettore terminano allo stesso glomeruli nei bulbi olfattivi41,42, e un aminoacido può attivare più di un glomerulo.
Tuttavia, odori altamente specifici, come i feromoni, possono evocare curve sigmoiali o quasi-sigmoiali concentrazione-risposta43,44. L'inferenza, anche se non empiricamente testata, è che queste risposte olfattive sono dovute a recettori altamente specifici che legano la molecola del feromone e poco altro. Pertanto, al di sopra di una determinata concentrazione, tutti i recettori sono occupati, e ulteriori aumenti non evocherà ulteriori risposte in altre ORN. Pertanto, questi dati possono essere adattati a un grafico Hill a tre parametri e la risposta massima, EC50 e Hill co-efficiente può esserecalcolata 15,45,46. Questo può dare informazioni preziose, come l'apparente affinità e il numero apparente del recettore, che le curve di concentrazione-risposta lineari o esponenziali non possono dare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il lavoro nel laboratorio degli autori è supportato da Fundao para a Ciància e a Tecnologia (FCT), Portogallo, progetti PTDC/BIA-BMA/30262/2017 e UID/Multi/04326/2019 e programma di contratto DL57/2016/CP1361/CT0041 a .
Materiali
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
Riferimenti
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C. Chemoreception. The Physiology of Fishes. Evans, D. H., Claiborne, J. B. , CRC Press. Boca Raton, FL. 471-497 (2006).
- Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. Sorensen, P. W., Wisenden, B. D. , John Wiley & Sons Inc. Ames, IA. 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. Spielman, A. I., Brand, J. G. , CRC Press. Boca Raton, FL. 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, TN. (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor? Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P. Jr, Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633(2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. Schulte, B., Goodwin, T., Ferkin, M. , Springer. Cham, Switzerland. 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731(2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332(2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon