Method Article
Enregistrement extracellulaire multi-unités du nerf olfactif des téléosts
Dans cet article
Résumé
L’enregistrement extracellulaire à plusieurs unités du nerf olfactif est une méthode sensible, robuste et reproductible pour évaluer la sensibilité olfactive chez les poissons marins. Il enregistre l’entrée sensorielle primaire et est indépendant de la salinité externe.
Résumé
Des études récentes ont montré que l’acidification des océans affecte le comportement olfactif chez les poissons. Cela peut être dû en partie à une réduction de la sensibilité olfactive dans l’eau à teneurélevée en PCO 2/faiblepH. Pour évaluer les effets de l’acidification des océans, ou de la sensibilité olfactive chez les poissons marins en général, nous proposons que l’enregistrement extracellulaire multi-unités du nerf olfactif soit la méthode de choix. Bien qu’invasif, il est sensible, robuste, reproductible et indépendant de la salinité externe (contrairement à l’électro-olfactogramme [EOG], par exemple). En outre, il enregistre une entrée sensorielle primaire dans le SNC, avant tout traitement central. Nous montrons que cette méthode peut montrer une réduction de la sensibilité olfactive qui est à la fois temporaire et odorant-dépendant, en utilisant une gamme d’acides aminés pour construire des courbes de concentration-réponse et calculer les seuils de détection.
Introduction
Les poissons dépendent fortement de l’olfaction pour de nombreux aspects de leur vie, y compris trouver de la nourriture, éviter les prédateurs, évaluer les partenaires potentiels et la migration, entre autres1,2,3. Par conséquent, l’évaluation de la sensibilité olfactive chez les poissons (Qu’est-ce qu’ils sentent? Quelle est leur sensibilité à ces composés?) est essentiel pour bien comprendre ces processus. En outre, les effets anthropiques sur l’environnement, tels que l’acidification des océans et la pollution, peuvent avoir des effets profonds sur le système olfactif, même aux niveaux sublétaux, car il est nécessairement en contact intime avec l’eau environnante4. L’électrophysiologie in vivo est l’approche expérimentale de choix pour évaluer la sensibilité olfactive chez les poissons. Trois techniques principales sont disponibles : l’électro-olfactogramme (EOG), l’électro-encéphalogramme (EEG) enregistré à partir de l’ampoule olfactive, et l’enregistrement multi-unités du nerf olfactif5.
L’EOG est le plus largement utilisé de ces trois6. Il s’agit d’un potentiel de champ de courant direct (DC) enregistré au-dessus de l’épithélium olfactif et on pense qu’il s’agit des potentiels de générateur résumés de ces neurones récepteurs olfactifs (ORN) répondant à un odorant donné. Cependant, comme il est enregistré dans l’eau, plutôt qu’à l’intérieur du poisson, l’amplitude de la réponse dépend non seulement du signal généré par le poisson, mais aussi de la conductivité de l’eau environnante; plus la conductivité (ou plus la résistance est faible), plus l’amplitude sera faible. Cela peut signifier que l’EOG est une méthode moins sensible dans l’eau de mer que l’eau douce7.
L’EEG enregistré à partir de l’ampoule olfactive est également largement utilisé dans l’étude de l’olfaction chez les poissons. Toutefois, l’ampoule olfactive est le centre de traitement de premier ordre pour l’entrée sensorielle olfactive8; il est fortement organisé en glomeruli, et par conséquent la réponse enregistrée dépend fortement de la position des électrodes d’enregistrement. Par exemple, l’entrée des ORN détectant les acides aminés est traitée par glomeruli dans la région latérale des bulbes olfactifs, alors que celle des produits chimiques dérivés conspécifiques est dirigée vers la région médiale9,10,11,12. L’entrée phéromonale peut être dirigée vers des glomeruli très localisés dans l’ampoule olfactive. Selon également l’anatomie de l’espèce en question, la position d’enregistrement idéale pour un odorant donné peut ne pas être facilement accessible.
L’enregistrement multi-unités du nerf olfactif contourne les principaux problèmes avec l’EOG et l’EEG décrits ci-dessus. Comme il enregistre les actions potentielles passant les axones des ORN de l’épithélium à l’ampoule, il est un signal sensoriel primaire. Et comme il est enregistré à l’intérieur du poisson, l’amplitude de la réponse est indépendante de la salinité externe. Néanmoins, bien sûr, il a quelques inconvénients. Tout d’abord, selon l’anatomie de l’espèce, une chirurgie plus étendue est nécessaire pour exposer le nerf olfactif que pour l’EOG. Deuxièmement, parce que le signal est plus petit que l’EOG, il nécessite un équipement légèrement plus sophistiqué, et donc coûteux. Une description générale d’autres approches expérimentales est donnée par John Caprio5. Le but de cet article est de décrire comment enregistrer les réponses extracellulaires multi-unités du nerf olfactif de la mer (Sparus aurata) in vivo aux odorants acides aminés comme un exemple de cette technique, et comment identifier, et surmonter, certains des problèmes les plus communs rencontrés dans une telle expérience.
Protocole
L’entretien et l’expérimentation des animaux ont été effectués dans des installations expérimentales certifiées et ont suivi la législation nationale portugaise (DL 113/2013) sous licence « roup -1 » par la Direction générale vétérinaire, ministère de l’Agriculture, du Développement rural et de la Pêche du Portugal. Comme ce protocole implique la manipulation des animaux, il doit être approuvé par l’organisme local et/ou national qui réglemente le bien-être des animaux utilisés dans les expériences scientifiques, en outre, les chercheurs doivent avoir la formation et les licences appropriées pour effectuer de telles procédures.
1. Préparation de stimulus
NOTE: La plupart des poissons ont un système olfactif très sensible, donc un grand soin doit être pris lors de la préparation des stimuli olfactifs à utiliser dans l’expérience. La verrerie utilisée pour constituer les stimuli doit être lavée à 5 % d’eau de Javel (hypochlorite de sodium), rincée à fond à l’eau du robinet et séchée. Immédiatement avant l’utilisation rincer la verrerie à fond avec de l’eau de mer (la même eau utilisée pour faire les dilutions de stimulus). Veillez à ce qu’aucune de ces eaux n’entre en contact avec la peau nue.
- Faire 100 mL de 10-2 M L-glutamine, L-leucine et L-serine; conserver 1 mL aliquots de chacun à -20 °C jusqu’à l’utilisation.
- Le jour de l’expérience, préparez-vous à partir de ces aliquots, 10-3 M à 10-7 M solutions (en étapes de dilution x10) en utilisant à la fois le contrôle et l’eau de mer à haute teneur en CO2.
REMARQUE : Le L-serine(10-3 M) sera utilisé comme contrôle positif, ou standard. L’eau utilisée pour compenser les dilutions des stimuli, et traitée exactement de la même manière que les stimuli, mais sans ajout d’un odorant, sera utilisé comme le contrôle négatif ou vide.
2. Préparation du contrôle et de l’eau à haute teneur en CO2
- Préparer l’eau de commande en collectant 1 L d’eau de mer filtrée au charbon de bois.
- À l’aide d’une sonde de pH, vérifiez le pH; il devrait être d’environ 8,2. Sinon, bullez avec l’air atmosphérique jusqu’à ce que ce pH soit atteint.
- À l’aide d’un titrateur alcalin mesurent l’alcalinité de l’eau.
- Mesurer la température de l’eau et la salinité.
- Préparer l’eau à haute teneur en CO2 en filtrant 1 L d’eau de mer, puis faire des bulles de CO2 jusqu’à ce que le pH souhaité soit atteint.
- À l’aide d’une sonde de pH, vérifiez le pH; il devrait être d’environ 7,7.
- À l’aide d’un titrateur alcalin, mesurer l’alcalinité de l’eau.
- Mesurer la température de l’eau et la salinité.
- Déterminer la pression du CO2 dans le contrôle et l’eau à haute teneur en CO2 à l’aide d’un logiciel conçu pour calculer les paramètres de CO2 dans l’eau (p. ex., logiciel CO2Calc13).
- Dans la fenêtre d’entrée ajouter les valeurs du pH de l’eau, la température, la salinité et l’alcalinité totale (figure 1).
- Sélectionnez les constantes, les unités et les échelles (voir les valeurs recommandées à la figure 2).
- Appuyez sur le processus du bouton pour déterminer la pression du CO2.
REMARQUE : La figure 3 montre un exemple de feuille de résultats.
3. Préparation du poisson
REMARQUE : Une dorade de 200 à 400 g est utilisée dans ce protocole.
- Anesthésier le poisson par immersion dans l’eau de mer naturelle aérée contenant du MS222 (sel de méthane de méthane éthyl-3-aminobenzoate). Lorsque la réponse à une pince de queue s’est arrêtée, injectez dans le muscle du flanc le triethiodide de gallamine de blockeur neuromusculaire (10 mg·kg-1 dans la solution saline physiologique).
REMARQUE : La concentration d’anesthésique utilisée varie d’une espèce à l’autre; pour une dorade de 200−400 g, utiliser 200 mg· L-1 tamponné avec 400 mg· L-1 NaHCO3. - Placer le poisson anesthésié sur un support amorti. La forme et la taille exactes dépendent de l’espèce modèle; pour la dorade (200−400 g), utiliser un support rembourré en forme de V, fabriqué à la maison.
- Placez un tube de silicium (diamètre = 10 mm) dans la bouche, connectez le tube à une pompe submersible dans un réservoir d’eau de mer aérée contenant l’anesthésique et pompez de l’eau sur les branchies à ~100 mL·min-1·kg-1.
REMARQUE : La taille du tube de silicium utilisé dépendra de la taille du poisson. - Insérez la goupille de mise à terre dans le muscle du flanc et connectez-la à l’étage de tête de l’amplificateur).
- Couvrir le poisson de tissu humide (ou de papier essuie-tout) avec seulement la tête exposée, en veillant à ce que le revêtement n’empêche pas la sortie de l’eau des branchies.
REMARQUE : Les yeux peuvent être recouverts de morceaux de papier/tissu humide ou de plastique noir. - Placez le tube du système de stimulation-livraison, c’est-à-dire le tube de verre relié à un approvisionnement d’eau de mer de fond, dans la narine.
REMARQUE : Les tubes micro-hématocrites peuvent être utilisés (longueur = 75 mm, ID = 1,15 mm, OD = 1,55 mm); ceux-ci peuvent être tirés à un point plus fin sur un puller d’électrode pour une utilisation avec des poissons plus petits. Il est important de s’assurer que l’épithélium olfactif est maintenu humide pendant la chirurgie (décrit ci-dessous). - Exposer les nerfs olfactifs en enlevant la peau et l’os du crâne entre les yeux (les nerfs olfactifs courent habituellement ensemble entre les yeux) à l’aide d’un exercice dentaire (idéalement) ou d’un passe-temps (p. ex., Dremel) perceuse ou polisseur de bijoutier (avec des forets dentaires) sous un microscope de dissection (à l’intérieur d’une cage faraday).
- Dans la dorade, enlever la partie du crâne immédiatement au-dessus des yeux, avec une scie circulaire, de juste antérieur aux yeux à juste postérieur pour eux. Puis, à l’aide d’un bit de forage, enlever l’os entre les yeux; les nerfs olfactifs se trouvent entre les yeux.
- Une fois que suffisamment d’os a été effacé, enlever la graisse et le tissu conjonctif surseant les nerfs à l’aide de forceps fines; prendre soin de ne pas endommager les nerfs ou percer les vaisseaux sanguins.
REMARQUE : L’expérience aidera à affiner la dissection; plus la dissection est petite, plus la préparation sera stable. Toutefois, suffisamment de tissus doivent être éliminés; pour les non-expérienced, lorsque les ampoules olfactives sont juste visibles, clair légèrement plus antérieurement pour exposer la partie des nerfs comme ils rejoignent les ampoules pour permettre le positionnement correct des électrodes. - Nettoyer les électrodes avant de les utiliser en les reliant à un poteau négatif d’une source de courant d’air 3V (p. ex., deux piles AA en série) et placer la pointe dans une solution saline physiologique (ou eau de mer diluée 1:3 en eau douce) pendant 20−30 s; un flux régulier de petites bulles doit être vu venant de la pointe.
- Une fois que les nerfs olfactifs sont exposés, insérez les électrodes d’enregistrement (maintenues sur les micro-manipulateurs) dans une position qui donne une réponse maximale à la norme (par exemple, 10-3 M L-serine), et une réponse minimale au blanc. Utiliser des électrodes de tungstène enduites de parylène(Tableau des matériaux)reliées au stade de tête d’un préamplificateur de courant alternatif (AC).
REMARQUE : Dans la dorade, les réponses les plus fortes aux acides aminés sont habituellement observées avec les électrodes placées dans le côté latéral du nerf, près de l’endroit où elle rejoint l’ampoule olfactive. Cela peut être vrai pour d’autres espèces, car l’organisation glomerulaire de l’ampoule est largement similaire entre les espèces. Cependant, l’expérience est toujours le meilleur professeur.
4. Enregistrement électrophysiologique
NOTE : Comme pour la plupart des électrophysiologies, l’enregistrement multi-unités doit avoir lieu dans une cage de Faraday. Cependant, l’enregistrement extracellulaire ne nécessite généralement pas une table anti-vibration; la plupart des mouvements viendront du poisson. Néanmoins, une table forte et stable est nécessaire avec une surface métallique pour sécuriser les bases magnétiques des peuplements micro-manipulateurs.
- Mettre en place un système de stimulation pour permettre le passage rapide de l’eau propre de fond à l’eau contenant des stimulus, par exemple, en utilisant une valve à trois voies actionnée par solénoïde. Reliez la prise commune au tube transportant de l’eau à la rosette olfactive et placez une ligne dans un réservoir d’eau de mer et l’autre dans la solution d’essai.
REMARQUE : Lorsque la vanne est commutée (en passant le courant de courant de courant d’eau), le débit d’eau passe de l’eau de fond à celle contenant l’odorant. Le stimulus devrait être donné assez longtemps pour voir un pic clair dans la réponse intégrée, suivie d’une période d’accommodement; le temps utilisé dans le protocole actuel est de 4 s, mais un temps plus long peut être nécessaire selon l’espèce. - Raccorder le conducteur de la vanne au déclencheur d’un convertisseur analogique numérique (p. ex., Digidata); lorsque la vanne passe de l’arrière-plan à la ligne contenant des stimulus, cela commence l’enregistrement des données. Configurez le logiciel pour commencer l’enregistrement à l’événement de déclenchement et continuer pendant une période prédéterminée (p. ex., 10 s).
REMARQUE : Dix secondes devraient suffire, mais cela peut être raccourci ou allongé, selon la question expérimentale. - Vérifiez la stabilité de la préparation en testant (enregistrement et mesure de l’amplitude de la réponse intégrée) à plusieurs reprises avec la norme, 10-3 M L-serine dans ce cas, et en permettant 1 min d’s’écouler entre les stimuli successifs.
REMARQUE : Selon les espèces et les odeurs, les réponses doivent avoir une amplitude à moins de 10 % l’une de l’autre (en règle générale) et devraient avoir un début rapide, une augmentation de l’activité maximale et un retour à la ligne de base après l’absence du stimulus (figure 4). - Enregistrez les réactions nerveuses olfactives aux acides aminés dans l’eau de mer témoin (de la plus faible à la concentration la plus élevée) et laissez 1 min s’écouler entre les stimuli successifs.
REMARQUE : Il est possible que, pour certaines espèces et/ou certains odorants, il soit nécessaire de passer plus de temps. Mais pour les acides aminés et la dorade, 1 min est suffisant. - Enregistrez la réponse à10-3 M de serine et à une solution de commande à vide d’eau.
- Changer l’eau de fond de l’eau de mer de contrôle à l’eau de mer à haute teneur en CO2, en plaçant la ligne de fond dans la bouteille avec une eau de mer à haute teneur en CO2.
REMARQUE : Il est conseillé d’insérer un autre tube hématocrit (ou équivalent) à l’extrémité des lignes de stimulation et de fond pour éviter de toucher l’eau et s’assurer que l’extrémité du tube reste dans l’eau. - Avant de tester la réponse du nerf olfactif aux acides aminés dans l’eau de mer à haute teneur en CO2, conditionner l’épithélium olfactif avec de l’eau à haute teneur en CO2 en suivant l’eau à haute teneur en CO2 sur l’épithélium olfactif pendant quelques minutes.
REMARQUE : L’expérience a montré que, pour la dorade, 5 min est suffisant. - Enregistrez les réactions nerveuses olfactives aux acides aminés dans l’eau de mer à haute teneur en CO2 (de la plus faible à la concentration la plus élevée).
- Enregistrez la réponse à une solution à haute teneur en CO2.
- Enregistrez la réponse à10-3 M de serine et à une solution de commande à vide d’eau.
REMARQUE : Le signal brut (activité nerveuse) doit être filtré (passage faible autour de 2 000−5 000 Hz, passage élevé de 50−300 Hz) et transmis à un convertisseur analogique-numérique (Table des matériaux). Pour une quantification plus facile de l’activité nerveuse, le signal brut peut également être intégré à l’aide d’un intégrateur qui fuit (Table des matériaux)et transmis au convertisseur analogique-numérique, et à partir de là, les signaux bruts et intégrés à un ordinateur exécutant le logiciel approprié (par exemple, Axoscope).
5. Analyse des données
- Soustraire l’amplitude de la réponse intégrée au blanc (en mV) de l’amplitude des réponses intégrées à tous les stimuli.
- Normaliser les réponses aux stimuli en divisant l’amplitude de la réponse précédente à la norme(10-3 M de sérine); cela réduit la variabilité entre et intra-poissons.
- Calculer les seuils de détection par régression linéaire des courbes concentration-réponse (sur une parcelle semi-logarithmique), selon le journal de formule(N + 1,5) = unjournal C + B, où C est la concentration molaire, N est l’amplitude de réponse normalisée, et a et b sont des constantes7,14.
REMARQUE : Le seuil de détection est alors la valeur pour x où y = 0,1761 (c.-à-d. journal 1,5; N = 0); la concentration au-dessus de laquelle une réponse sera vue (c.-à-d. que le poisson peut le sentir). Certains odorants évoquent des courbes sigmoidales de concentration-réponse lorsqu’ils sont tracés semi-logarithmiquement (p. ex., calcium15,16; dans ce cas, les données normalisées peuvent être montées sur une parcelle de colline à trois paramètres qui donnera l’amplitude de réponse maximale et l’EC50 (c.-à-d. [odorant] qui donne une réponse demi-maximale; également une mesure de sensibilité). - Comparez les seuils de détection et/ou l’amplitude maximale de réponse et les EC50 des stimuli testés dans l’eau de contrôle et ceux testés dans l’eau à haute teneur en CO2.
Résultats
Une réponse typique au contrôle positif (10-3 M L-serine; Figure 4A) et contrôle négatif (vide; La figure 4B) enregistrée à partir du nerf olfactif d’une dorade est indiquée à la figure 4. En présence du stimulus (barre horizontale noire; dans la cavité olfactive, en contact avec l’épithélium olfactif), notez l’augmentation rapide de l’activité (reflétée dans la déviation vers le haut du signal intégré) à un pic dans environ une seconde du début de stimulus, suivie d’une période d’accommodement (tandis que le stimulus est toujours présent), et un retour à l’activité de base une fois le stimulus terminé. L’amplitude absolue de la réponse dépend fortement de la position de l’électrode; si une réponse à faible amplitude est enregistrée, essayez de modifier les positions de l’électrode. Une augmentation plus lente de l’activité maximale peut être due au tube transportant l’eau contenant des stimulus à l’épithélium olfactif étant placé trop loin de l’épithélium; essayez de déplacer le tube du nez plus près (mais ne touche pas) l’épithélium. Notez que, en revanche, le blanc évoque peu ou pas de réponse. Une réponse positive significative (c.-à-d. augmentation de l’activité) au blanc peut indiquer la contamination de l’eau utilisée pour faire les dilutions des stimuli; faire des dilutions fraîches avec de l’eau propre (et de la verrerie) devrait résoudre ce problème. Si ce n’est pas le cas, un nettoyage plus complet du système d’eau (y compris les filtres à charbon activé) peut être nécessaire. Une réponse négative (c.-à-d. une diminution de l’activité) peut indiquer un léger changement de débit lorsque la vanne est commutée en raison, par exemple, d’un blocage de la vanne.
Une courbe de concentration-réponse typique (tracée semi-logarithmiquement), en l’occurrence à L-leucine (10-7 M à 10-3 M), est indiquée à la figure 5A. Notez que l’augmentation des concentrations de l’odorant évoque des augmentations de plus en plus importantes de l’activité, et donc, dans l’amplitude des réponses intégrées. Une parcelle des données normalisées et leur régression linéaire correspondante est indiquée à la figure 5B. Le seuil de détection estimé peut être calculé à partir de la valeur de x lorsque y = 0,1761 (c.-à-d. log1.5; où N = 0). Dans ce cas, cette valeur est de -7,48; c’est-à-dire que le seuil calculé pour la l-leucine chez ce poisson est de 10à 7,48 M. L’exposant α peut également être estimé à partir de la régression linéaire des données normalisées sur une parcelle de journal; logN = αlog[odorant] + constante. Le facteur γ donne alors l’augmentation de la concentration d’odorant nécessaire pour augmenter l’amplitude de réponse par une unité de journal; c’est-à-dire qu’il s’agit d’une estimation de la pente de la courbe concentration-réponse17. Dans cet exemple, α = 0,277 et γ = 3,61; par conséquent, pour multiplier par dix l’amplitude de réponse (c.-à-d. une unité de journal; log10 = 1), la concentration de stimulus doit être multipliée par10 3,61(4 074 fois).
Une courbe de concentration-réponse sigmoidale typique ( Figure 6A)lorsqu’elleest tracée semi-logarithmiquement, dans ce cas à L-glutamine, est indiquée à la figure 6B. Une augmentation similaire de l’amplitude de réponse dépendante de la concentration est observée; toutefois, aux concentrations plus élevées, cette augmentation devient moindre de sorte que l’amplitude de réponse atteint un maximum (Nmax). Cela permet d’adapter les données à une équation hill à trois paramètres :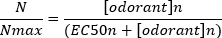
De cette façon, l’EC50 (la concentration odorante à laquelle une réponse maximale de 50% est évoquée) et la colline co-efficace (une mesure de la pente de la partie linéaire de la courbe sigmoidale) peuvent être calculées.
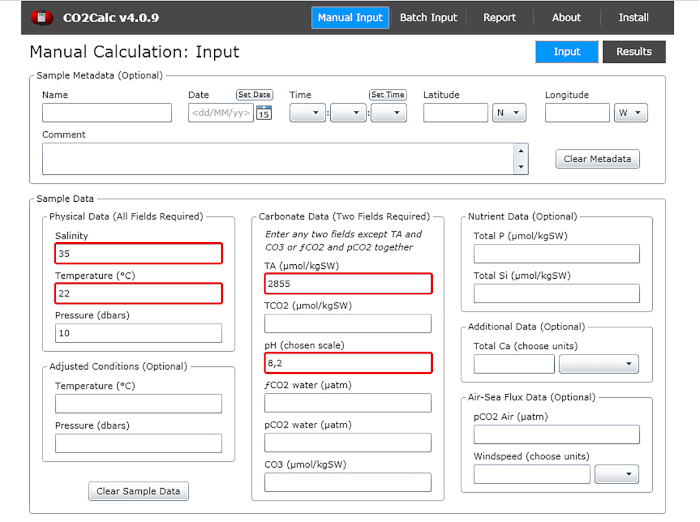
Figure 1 : Capture d’écran logicielle montrant la fenêtre d’entrée du programme CO2Calc. Les champs nécessaires au calcul des paramètres carbonate sont mis en surbrillance (boîtes rouges). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
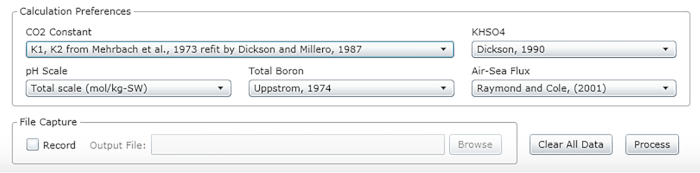
Figure 2 : Capture d’écran logicielle montrant la fenêtre d’entrée pour les constantes, unités et échelles appropriées. Les valeurs indiquées sont recommandées pour les conditions dans lesquelles les expériences décrites ont été effectuées; ils peuvent changer. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
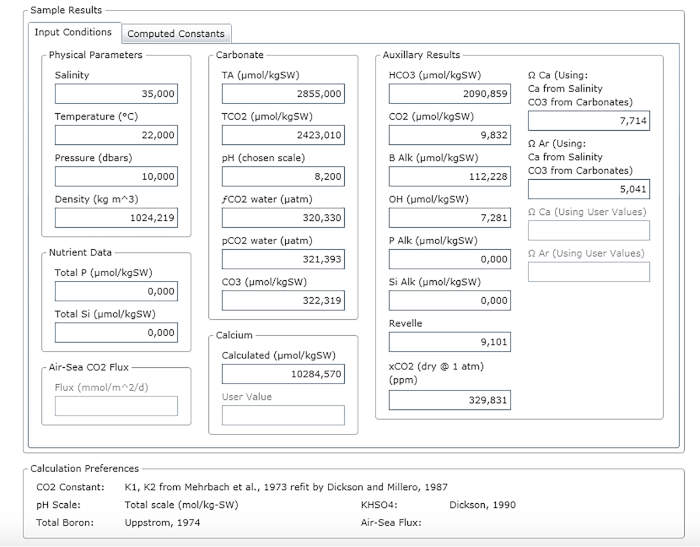
Figure 3 : Capture d’écran logicielle montrant la fenêtre de résultats. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
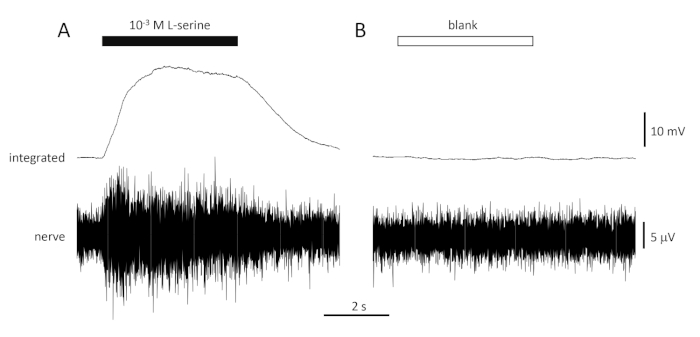
Figure 4 : Réponses multi-unités typiques enregistrées de façon extracellulaire à partir du nerf olfactif de la dorade in vivo en réponse à 10-3 M L-serine (A) et blanc (B). Les traces supérieures montrent les réponses intégrées et les traces inférieures montrent le signal brut (nerf). Des stimuli ont été appliqués à l’épithélium olfactif (barres horizontales). Notez l’augmentation rapide de l’activité pendant le 1 s d’exposition, un pic d’activité, suivie d’une période d’hébergement (alors que l’odorant était encore livré à l’épithélium) et un retour aux niveaux de base une fois que la livraison odorante a cessé. Peu ou pas d’augmentation de l’activité est vu après la stimulation avec de l’eau traitée de la même manière que les dilutions odorantes, à l’exception de l’ajout de tout odorant (blanc). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
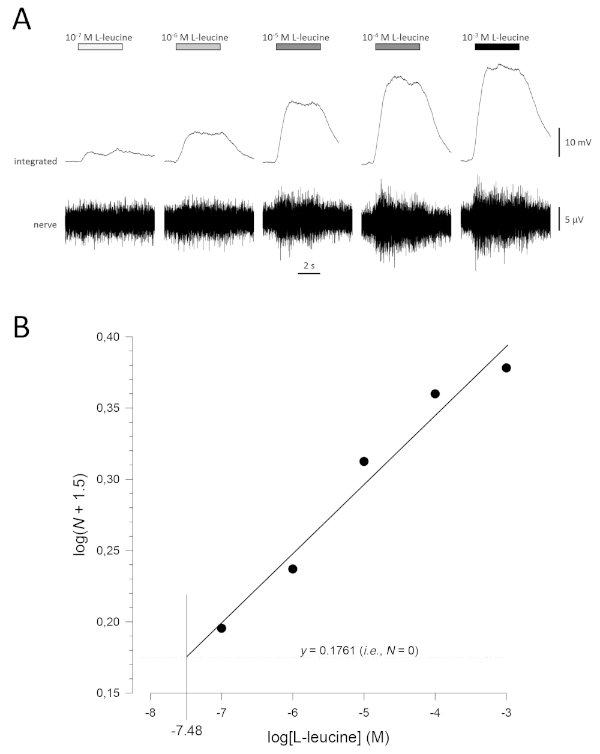
Figure 5 : Courbe de concentration-réponse typique pour la L-leucine enregistrée extracellulairement à partir du nerf olfactif in vivo. (A) Comme la concentration de L-leucine appliquée à l’épithélium olfactif (barres horizontales) augmente de 10-7 M à 10-3 M, une augmentation concomitante de l’activité est observée dans le nerf. Les traces supérieures montrent les réponses intégrées et les traces inférieures montrent le signal brut (nerf). (B) Régression linéaire (R2 = 0,97) des données normalisées tracées semi-logarithmiquement pour calculer le seuil de détection comme valeur pour le journal[L-leucine] lorsque log(N + 1,5) = 0,1761 (c.-à-d. où N = 0). Dans cet exemple, cette valeur est de -7,48; le seuil estimé de détection de L-leucine chez ce poisson est donc de 10à 7,48 M. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
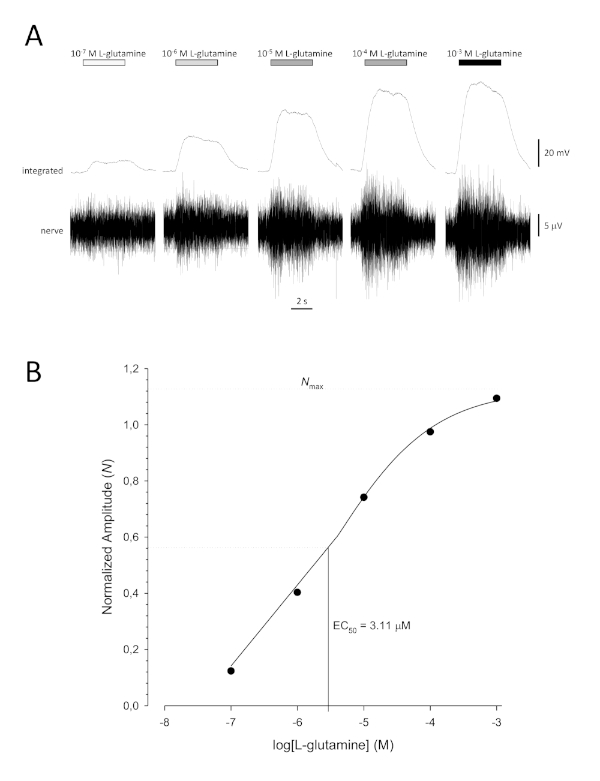
Figure 6 : Courbe de concentration-réponse typique pour la L-glutamine enregistrée extracellulairement à partir du nerf olfactif in vivo. (A) Comme la concentration de L-glutamine appliquée à l’épithélium olfactif (barres horizontales) augmente de 10-7 M à 10-3 M, une augmentation concomitante de l’activité est observée dans le nerf. Les traces supérieures montrent les réponses intégrées et les traces inférieures montrent le signal brut (nerf). (B) Parcelle semi-logarithmique de données normalisées adaptées à une équation hill à trois paramètres (R2 = 0,99). Pour cet exemple, les CE50 calculés = 3,11 μM et la colline co-efficace = 0,565). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
L’étude actuelle décrit l’utilisation d’enregistrements multi-unités (extracellulaires) à partir du nerf olfactif de la dorade (S. aurata), un sparide marin d’une grande importance en aquaculture. Toutefois, cette approche expérimentale peut être largement appliquée à d’autres poissons; la chirurgie et le placement exact des électrodes dépendront clairement de l’anatomie du système olfactif, et le choix et la concentration de l’anesthésique peuvent dépendre de l’espèce à l’étude. Par exemple, le nerf olfactif du poisson rouge (Carassius auratus) est court; dans ce cas, l’enregistrement de l’EEG à partir de l’ampoule olfactive serait plus facile. Le choix de l’odorant peut également dépendre, dans une certaine mesure, de l’espèce. L’étude actuelle a utilisé des acides aminés. À ce que les auteurs savent, toutes les espèces de poissons étudiées à ce jour ont une sensibilité olfactive aux acides aminés1,18. Cette sensibilité a été impliquée est divers processus tels que l’emplacement des aliments, la communication chimique et la reconnaissance des eaux natales19,20,21,22,23. Toutefois, les sensibilités des différentes espèces sont, dans l’ensemble, assez semblables et ne dépendent pas du mode de vie ou de l’habitat. Ils sont également des molécules bien définies et sont à bon marché et facilement disponibles. Ces raisons en font des stimuli d’essai idéaux pour les études sur l’olfaction chez les poissons, en particulier ceux qui étudient les effets des perturbations anthropiques (par exemple, l’acidification ou la pollution), où les résultats peuvent être facilement comparés entre les espèces24.
Selon les espèces en question, les préparatifs pour l’enregistrement à plusieurs unités peuvent rester stables pendant plusieurs heures; l’amplitude de la réponse à la norme interne (10-3 M L-sérine dans la présente étude) ne doit pas varier de plus de 10% entre les tests successifs. Toute déviation significative par rapport à cette règle de base pourrait être due au: (i) au mouvement du poisson, et donc au déplacement des électrodes et/ou du tube nasal; ii) la contamination de l’eau, par exemple, en entrant en contact avec les mains de l’expérimentateur (surtout si des concentrations plus faibles d’un odorant donné donnent des réponses plus importantes que des concentrations plus élevées); iii) détérioration de l’état de santé de la préparation). Dans le cas i, le poisson doit être vérifié pour avoir déménagé; si c’est le cas, repositionnez-le, et ajoutez plus d’anesthésique à l’eau et/ou donnez une autre dose de triethiodide de gallamine. Laisser 5 min et retester la norme. Si la réponse est encore plus faible, repositionnez les électrodes et/ou le tube nasal jusqu’à ce qu’une réponse suffisamment importante soit enregistrée. Dans le cas (ii), il suffit de refaire une série de dilution fraîche de l’odorant, en utilisant de la verrerie propre et de l’eau. Dans le cas (iii), vérifiez que l’écoulement de l’eau sur les branchies du poisson est adéquat, que l’eau coule sur les branchies (c.-à-d. la sortie par l’opercula, plutôt que par la bouche), et que l’eau est bien aérée. Différentes espèces de poissons ont des préférences de température très différentes; s’assurer que la température du laboratoire (et celle de l’eau en contact avec le poisson) est aussi proche de la température à laquelle les poissons sont conservés que possible. Assurez-vous également que les poissons ne sont pas stressés et évitez de les déplacer (même d’un réservoir à l’autre) pendant au moins une semaine avant l’enregistrement. Le bruit électrique est, bien sûr, le fléau de la vie d’un électrophysiologiste; cependant, l’article actuel n’est pas le moyen approprié pour discuter de la façon de surmonter / réduire cela. Néanmoins, le « he Axon Ide » (disponible gratuitement en pdf pour téléchargement sur le site web du fabricant) est une source de conseils pratiques sur la minimisation du bruit. Une fois qu’une réponse importante et stable est évoquée par le stimulus standard, et une série de concentration donne une augmentation dépendante de la concentration de l’amplitude, avec une réponse minimale au blanc, l’enregistrement des réponses aux stimuli de test peut commencer. Certains auteurs donnent le même stimulus trois fois, et calculent la moyenne arithmétique pour l’analyse ultérieure des données. Toutefois, il s’agit de répliques techniques, et cette approche augmentera de trois fois le temps qu’une session d’enregistrement prend. Les auteurs actuels préfèrent tester un odorant donné une fois, mais toujours une partie d’une courbe de concentration-réponse. Cela permet non seulement le calcul du seuil de détection ou EC50 (tel que décrit), mais garantit également que les concentrations proches de celles que le poisson connaîtrait dans son environnement naturel sont testées (ce qui n’est pas toujours connu). En outre, toutes les réponses aberrantes, dues à la contamination par exemple, sont plus faciles à repérer; ceux-ci peuvent ensuite être répétés à l’aide d’un échantillon fraîchement fait si nécessaire.
L’enregistrement multi-unités du nerf olfactif peut être invasif, mais il est plus sensible que l’EOG lorsqu’il est enregistré dans l’eau de mer7, car il est indépendant de la salinité externe. Il peut donc être utilisé pour évaluer la sensibilité olfactive aux odorants, tels que le calcium et le sodium, les changements dans les concentrations de ce qui affecterait également la conductivité et, par conséquent, les tensions enregistrées15. En tant qu’estimation du nombre d’ORN répondant à une odeur donnée (c.-à-d. les potentiels d’action voyageant le long des axones ORN de l’épithélium olfactif à l’ampoule), il représente un signal brut et non transformé (le traitement initial de l’entrée olfactive commence dans les ampoules). Par conséquent, il est préférable d’évaluer les effets directs des polluants, tels que les métaux lourds, et les changements environnementaux, tels que le pH, sur le système olfactif que l’EOG ou EEG24,25. L’enregistrement de l’ampoule olfactive dans l’eau de mer à haute teneuren P CO2 (et donc à faible pH) peut être affecté par les effets centraux du pH sur le traitement neuronal; la « héorie des récepteurs GABA» de l’acidification des océans26, par laquelle la réduction du pH de l’eau provoque une redistribution de Cl- et HCO3- ion dans le CSF et un changement conséquent de l’activation GABAergic de l’inhibiteur (hyperpolarisation) à l’excitateur (dépolarisation). En outre, dans de telles études, il est important d’évaluer les effets de l’acidification ou des polluants en utilisant des concentrations d’odeurs similaires à celles que le poisson est susceptible de rencontrer dans son environnement naturel. Pour les acides aminés, c’est dans la gamme nano à micromolaire27,28,29; près du seuil de détection de ces composés chez les poissons1,18. L’estimation du seuil de détection d’un odorant donné peut donner une idée de l’importance et/ou du rôle biologique de la sensibilité olfactive. Par exemple, la lamproie marine (Petromyzon marinus) a une sensibilité olfactive élevée aux acides biliaires spécifiques libérés par les larves jusqu’à un seuil de 10-13 M30; cette sensibilité permet aux adultes de localiser et d’identifier les frayères appropriées, et donc d’agir comme une phéromone migratrice sur de longues distances. De même, la lamproie femelle mûre a une sensibilité olfactive élevée à la spermine (seuil10-14 M), une polyamine libérée dans le milt par les mâles, qui les attire ensuite vers les nids des mâles sperguants31. D’autres poissons ont également une sensibilité olfactive aux polyamines32,33,34,35, mais pas avec des seuils de détection suffisamment bas pour soutenir un rôle phéromonal similaire; au lieu de cela, l’évitement des poissons en décomposition est suggéré. Néanmoins, avec de telles sensibilités olfactives élevées, il est possible d’imaginer qu’une légère réduction de la sensibilité (c.-à-d. augmentation du seuil), même lorsque l’amplitude de réponse n’est pas considérablement réduite, pourrait causer de graves problèmes pour les poissons24.
Lorsqu’elles sont tracées de façon semi-logarithmique, les courbes de concentration-réponse aux odorants peuvent être exponentielles, linéaires ou sigmoidale18. Dans le cas des acides aminés, ces courbes semi-logarithmiques de concentration-réponse sont soit linéaires (c.-à-d. logarithmiques), sigmoidaux ou fonctions de puissance7. Qu’aucune saturation de la réponse ne soit observée (c.-à-d. qu’aucun plateau dans la courbe concentration-réponse, même à des concentrations supraenvironnementales) est probablement due à plusieurs récepteurs se liant à des acides aminés individuels, en fonction de leur concentration, plutôt que de chaque acide aminé liant à un récepteur spécifique; à mesure que la concentration d’un acide aminé donné augmente, plus de récepteurs sont capables de le lier et donc de réagir. Néanmoins, les poissons peuvent distinguer les mélanges d’acides aminés36,37,38,39; cela est probablement dû aux schémas combinatoires d’activité évoqués dans les ampoules olfactives12,40; les axones de tous les ORN exprimant la même protéine de récepteur se terminent au même glomeruli dans les bulbes olfactifs41,42, et un acide aminé peut activer plus d’un glomerulus.
Cependant, les odorants très spécifiques, tels que les phéromones, peuvent évoquer des courbes sigmoidales ou quasi-sigmoidales concentration-réponse43,44. L’inférence, bien qu’elle ne soit pas testée empiriquement, est que ces réponses olfactives sont dues à des récepteurs très spécifiques qui lient la molécule de phéromone et peu d’autres choses. Par conséquent, au-dessus d’une concentration donnée, tous les récepteurs sont occupés, et d’autres augmentations n’évoqueront aucune autre réponse dans d’autres ORN. Par conséquent, ces données peuvent être montées sur une parcelle hill à trois paramètres, et la réponse maximale, EC50 et Hill co-efficace peut être calculée15,45,46. Cela peut donner des informations précieuses, telles que l’affinité apparente et le nombre apparent de récepteurs, que les courbes linéaires ou exponentielles concentration-réponse ne peuvent pas donner.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Les travaux dans le laboratoire des auteurs sont soutenus par Fundação para a Ciência e a Tecnologia (FCT), Portugal, projets PTDC/BIA-BMA/30262/2017 et UID/Multi/04326/2019 et programme de contrat DL57/2016/CP1361/CT0041 à ZV.
matériels
| Name | Company | Catalog Number | Comments |
| AC pre-amplifier | Digitimer Ltd (Welwyn Garden City, UK) | NL104 | Neurolog pre-amplifier specifically designed for this type of recording. |
| Digidata | Molecular Devices, LLC. (San Jose, CA, USA) | 1440A | Analogue-digital converter. |
| EMG Integrator | Digitimer Ltd (Welwyn Garden City, UK) | NL703 | Leaky' electrical integrator to integrate raw activity of the nerve. |
| Faraday cage | Made in-house | To reduce electrical noise. | |
| Filter | Digitimer Ltd (Welwyn Garden City, UK) | NL125/6 | Filter module for electrophysiological recording. |
| Gallamine triethiodide | Sigma-Aldrich (Portugal) | G8134 | Neuromuscular blocker |
| L-glutamine | Sigma-Aldrich (Portugal) | G3126 | Amino acid used as odorant |
| L-leucine | Sigma-Aldrich (Portugal) | L80000 | Amino acid used as odorant |
| L-serine | Sigma-Aldrich (Portugal) | S4500 | Amino acid used as odorant |
| Metalic base-plate | Any | Provides base for micro-manipulators. | |
| Micro-hematocrit tubes | Any | To position water supply to the olfactory epithelium | |
| Micro-manipulators | Narishige International Ltd (London, UK) | M-152 | Position electrodes |
| MS222 (ethyl-3-aminobenzoate methanesulfonate salt) | Sigma-Aldrich (Portugal) | E10505 | Anesthetic |
| pH probe | Hanna instruments (Póvoa de Varzim, Portugal) | HI12302 | Probe to measure pH of water. |
| Refractometer | Hanna instruments (Póvoa de Varzim, Portugal) | HI96822 | Refractometer to measure water salinity |
| Sodium chloride | Sigma-Aldrich (Portugal) | 746398 | For saline solution |
| Solenoid valves | The Lee Co. (Essex, CT, USA) | LFAA1201618H | For switching between background water and stimuus solutions (no longer available) |
| Stereo-microscope | Zeiss, Leica, Olympus | Any suitable model. | For dissection and placement of electrodes. |
| Titrator | Hanna instruments (Póvoa de Varzim, Portugal) | HI84531 | Titrator to measure water alkalinity, pH and temperature. |
| Tungsten micro-electrodes 0.1 MΩ | World Precision Instruments (Hitchin, UK) | TM31A10 | Extracellular electrodes. |
| Valve Driver | Made in-house | 12 V DC source for operating solenoid valves. | |
| Water pump (submersible) | Any | To supply anesthetic-containing water to the gills of the fish. |
Références
- Kasumyan, A. O. The olfactory system in fish: structure, function, and role in behaviour. Journal of Ichthyology. 44 (Suppl 2), S180-S223 (2004).
- Michel, W. C. Chemoreception. The Physiology of Fishes. Evans, D. H., Claiborne, J. B. , CRC Press. Boca Raton, FL. 471-497 (2006).
- Wisenden, B. D. Chemical cues that indicate risk of predation. Fish Pheromones and Related Cues. Sorensen, P. W., Wisenden, B. D. , John Wiley & Sons Inc. Ames, IA. 131-148 (2015).
- Tierney, K. B., et al. Olfactory toxicity in fishes. Aquatic Toxicology. 96 (1), 2-26 (2010).
- Caprio, J. In vivo olfactory and taste recordings in fish. Experimental Cell Biology of Taste and Olfaction. Current Techniques and Protocols. Spielman, A. I., Brand, J. G. , CRC Press. Boca Raton, FL. 251-261 (1995).
- Scott, J. W., Scott-Johnson, P. E. The electoolfactogram: a review of its history and uses. Microscopy Research and Technique. 58, 152-160 (2002).
- Hubbard, P. C., Barata, E. N., Ozório, R. O. A., Valente, L. M. P., Canário, A. V. M. Olfactory sensitivity to amino acids in the blackspot seabream (Pagellus bogaraveo): a comparison between olfactory receptor recording techniques in seawater. Journal of Comparative Physiology A. 197 (8), 839-849 (2011).
- Hamdani, E. H., Døving, K. B. The functional organization of the fish olfactory system. Progress in Neurobiology. 82 (2), 80-86 (2007).
- Hara, T. J., Zhang, C. Topographic bulbar projections and dual neural pathways of the primary olfactory neurons in salmonid fishes. Neuroscience. 82 (1), 301-313 (1998).
- Thommesen, G. The spatial distribution of odour induced potentials in the olfactory bulb of the char and trout (Salmonidae). Acta Physiologica Scandinavica. 102, 205-217 (1978).
- Nikonov, A. A., Caprio, J. Electrophysiological evidence for a chemotopy of biologically relevant odors in the olfactory bulb of the channel catfish. Journal of Neurophysiology. 86 (4), 1869-1876 (2001).
- Friedrich, R. W., Korsching, S. I. Chemotopic, combinatorial, and noncombinatorial odorant representations in the olfactory bulb revealed using a voltage-sensitive axon tracer. Journal of Neuroscience. 18 (23), 9977-9988 (1998).
- Pierrot, D. E., Lewis, E., Wallace, D. W. R. MS Excel programme developed for CO2 system calculations. ORNL/CDIAC-105a, Carbon Dioxide Information Analysis Center. , Oak Ridge National Laboratory, US Department of Energy, Oak Ridge, TN. (2006).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to catecholamines and their metabolites in the goldfish. Chemical Senses. 28 (3), 207-218 (2003).
- Hubbard, P. C., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the marine teleost Sparus aurata. Journal of Experimental Biology. 203 (24), 3821-3829 (2000).
- Hubbard, P. C., Ingleton, P. M., Bendell, L. A., Barata, E. N., Canário, A. V. M. Olfactory sensitivity to changes in environmental [Ca2+] in the freshwater teleost Carassius auratus: an olfactory role for the Ca2+-sensing receptor? Journal of Experimental Biology. 205, 2755-2764 (2002).
- Byrd, R. P. Jr, Caprio, J. Comparison of olfactory receptor (EOG) and bulbar (EEG) responses to amino acids in the catfish, Ictalurus punctatus. Brain Research. 249 (1), 73-80 (1982).
- Hara, T. J. The diversity of chemical stimulation in fish olfaction and gustation. Reviews in Fish Biology and Fisheries. 4 (1), 1-35 (1994).
- Kawabata, K. Induction of sexual behavior in male fish (Rhodeus ocellatus ocellatus) by amino acids. Amino Acids. 5 (3), 323-327 (1993).
- Shoji, T., Yamamoto, Y., Nishikawa, D., Kurihara, K., Ueda, H. Amino acids in stream water are essential for salmon homing migration. Fish Physiology and Biochemistry. 28 (1-4), 249-251 (2003).
- Yamamoto, Y., Hino, H., Ueda, H. Olfactory imprinting of amino acids in lacustrine sockeye salmon. PLoS ONE. 5 (1), e8633(2010).
- Kutsyna, O., Velez, Z., Canário, A. V. M., Keller-Costa, T., Hubbard, P. C. Variation in urinary amino acids in the Mozambique tilapia: a signal of dominance or individuality?. Chemical Signals in Vertebrates 13. Schulte, B., Goodwin, T., Ferkin, M. , Springer. Cham, Switzerland. 189-204 (2016).
- Velez, Z., Hubbard, P. C., Hardege, J. D., Barata, E. N., Canário, A. V. M. The contribution of amino acids to the odour of a prey species in the Senegalese sole (Solea senegalensis). Aquaculture. 265, 336-342 (2007).
- Porteus, C. S., et al. Near-future CO2 levels impair the olfactory system of a marine fish. Nature Climate Change. 8 (8), 737-743 (2018).
- Velez, Z., Roggatz, C. C., Benoit, D. M., Hardege, J. D., Hubbard, P. C. Short- and medium-term exposure to ocean acidification reduces olfactory sensitivity in gilthead seabream. Frontiers in Physiology. 10, 731(2019).
- Nilsson, G. E., et al. Near-future carbon dioxide levels alter fish behaviour by interfering with neurotransmitter function. Nature Climate Change. 2 (3), 201-204 (2012).
- Fuhrman, J. A., Ferguson, R. L. Nanomolar concentrations and rapid turnover of dissolved free amino acids in seawater: agreement between chemical and microbiological measurements. Marine Ecology - Progress Series. 33 (3), 237-242 (1986).
- Pomeroy, L. R., Macko, S. A., Ostrom, P. H., Dunphy, J. The microbial food web in Arctic seawater: concentration of dissolved free amino acids and bacterial abaundance and activity in the Arctic Ocean and in Resolute Passage. Marine Ecology - Progress Series. 61 (1-2), 31-40 (1990).
- Poulet, S. A., Williams, R., Conway, D. V. P., Videau, C. Co-occurrence of copepods and dissolved free amino acids in shelf sea waters. Marine Biology. 108 (3), 373-385 (1991).
- Sorensen, P. W., et al. Mixture of new sulfated steroids functions as a migratory pheromone in the sea lamprey. Nature Chemical Biology. 1 (6), 324-328 (2005).
- Scott, A. M., et al. Spermine in semen of male sea lamprey acts as a sex pheromone. PLoS Biology. 17 (7), e3000332(2019).
- Da Silva, J. P., et al. Synthetic versus natural receptors: supramolecular control of chemical sensing in fish. ACS Chemical Biology. 9 (7), 1432-1436 (2014).
- Hussain, A., et al. High-affinity olfactory receptor for the death-associated odor cadaverine. Procedings of the National Academy of Sciences of the United States of America. 110 (48), 19579-19584 (2013).
- Michel, W. C., Sanderson, M. J., Olson, J. K., Lipschitz, D. L. Evidence of a novel transduction pathway mediating detection of polyamines by the zebrafish olfactory system. Journal of Experimental Biology. 206 (10), 1697-1706 (2003).
- Rolen, S. H., Sorensen, P. W., Mattson, D., Caprio, J. Polyamines as olfactory stimuli in the goldfish Carassius auratus. Journal of Experimental Biology. 206 (10), 1683-1696 (2003).
- Kang, J., Caprio, J. Electro-olfactogram and multiunit olfactory receptor responses to complex mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of General Physiology. 98 (4), 699-721 (1991).
- Kang, J., Caprio, J. Electrophysiological responses of single olfactory bulb neurons to binary mixtures of amino acids in the channel catfish, Ictalurus punctatus. Journal of Neurophysiology. 74 (4), 1435-1443 (1995).
- Valentincic, T., Kralj, J., Stenovec, M., Koce, A., Caprio, J. The behavioral detection of binary mixtures of amino acids and their individual components by catfish. Journal of Experimental Biology. 203, 3307-3317 (2000).
- Valentincic, T., Wegert, S., Caprio, J. Learned olfactory discrimination versus innate taste responses to amino acids in channel catfish (Ictalurus punctatus). Physiology and Behavior. 55 (5), 865-873 (1994).
- Friedrich, R. W., Korsching, S. I. Combinatorial and chemotopic odorant coding in the zebrafish olfactory bulb visualized by optical imaging. Neuron. 18 (5), 737-752 (1997).
- Vassar, R., et al. Topographic organization of sensory projections to the olfactory bulb. Cell. 79 (6), 981-991 (1994).
- Mombaerts, P., et al. Visualizing an olfactory sensory map. Cell. 87 (4), 675-686 (1996).
- Keller-Costa, T., et al. Identity of a tilapia pheromone released by dominant males that primes females for reproduction. Current Biology. 24 (18), 2130-2135 (2014).
- Sorensen, P. W., Hara, T. J., Stacey, N. E. Extreme olfactory sensitivity of mature and gonadally-regressed goldfish to a potent steroidal pheromone, 17a,20b-dihydroxy-4-pregnen-3-one. Journal of Comparative Physiology A. 160 (3), 305-313 (1987).
- Keller-Costa, T., Canário, A. V. M., Hubbard, P. C. Olfactory sensitivity to steroid glucuronates in Mozambique tilapia suggests two distinct and specific receptors for pheromone detection. Journal of Experimental Biology. 217 (23), 4203-4212 (2014).
- Hubbard, P. C., Mota, V., Keller-Costa, T., da Silva, J. P., Canário, A. V. M. Chemical communication in tilapia: a comparison of Oreochromis mossambicus with O. niloticus. General and Comparative Endocrinology. 207, 13-20 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon