このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
心原性ショックに対する経皮心室補助装置/左心房から大腿動脈バイパスシステムへの使用
要約
次の記事では、経皮的左心室補助装置(pLVAD)である心原性ショック(CS)および左心室から大腿動脈バイパス(LAFAB)システムにデバイス(タンデムハートなど)を配置するステップワイズ手順をCSで説明します。
要約
左心房から大腿動脈バイパス(LAFAB)システムは、左心房(LA)から血液を排出し、大腿動脈を介して全身動脈循環に戻すことによって左心室をバイパスする心原性ショック(CS)に使用される機械的循環支持(MCS)装置である。カニューレの大きさに応じて、2.5~5 L/分の範囲の流れを提供できます。ここでは、LAFABの作用機序、利用可能な臨床データ、心原性ショックにおけるその使用の適応症、移植のステップ、手続き後のケア、およびこの装置とその管理の使用に関連する合併症について議論する。
また、心エコーガイダンスの下での経皮穿刺によるデバイスの配置前準備、経皮穿刺による経皮的配置、デバイスパラメータの術後管理など、デバイス療法の手続きコンポーネントの簡単なビデオを提供します。
概要
心原性ショック(CS)は、心臓が身体の要求を満たすのに十分な血液と酸素を送達することができず、臓器不全をもたらす、付随する低血圧の有無にかかわらず組織低灌流の状態である。これは、心血管造影と介入の協会によってEにステージAに分類されます (SCAI): ステージ A - CS のリスクのある患者;ステージB - 低灌流のない低血圧または頻脈を有するCSの開始段階の患者;ステージC - 灌流を維持するためにイノトロープ/バソプレッサーまたは機械的サポートを必要とする寒さと湿式表現型と古典的なCS。ステージD - より高度なデバイスへのエスカレーションを必要とする現在の医療または機械的サポートで悪化。ステージE - 循環崩壊および継続的な心肺蘇生1で心停止を積極的に経験している難治性不整脈を有する患者が含まれる。CSの最も一般的な原因は、最近報告された分析で症例の81%を表す急性MI(AMI)および急性代償不全心不全(ADHF)である。CSは、混雑および灌流障害によって古典的に特徴付けられ、充填圧力の上昇(肺毛細管内挟み圧力[PCWP]、左心室末端拡張圧[LVEDP]、中央静脈圧[CVP]、および右心室終期拡張圧[RVEDP])、心拍出量の減少(CO)、心臓指数(CI)、心拍出量(CPO)、および臓器機能不全(CPO)、および終了臓器機能不全(CPO)、および終了機能障害.過去には、CSによって複雑化したAMIの唯一の利用可能な治療法は、イトロープおよび/またはバソプレッサー4による早期再生および医療管理であった。最近では、機械的循環サポート(MCS)デバイスの出現と血管圧突機のエスカレーションが死亡率の増加に関連しているという認識により、AMIおよびADHF関連CS5,6の治療にパラダイムシフトがありました。
経皮心室補助装置(pVAD)の現在の時代には、酸素化機能の有無にかかわらず、単心または二心室循環および心室のサポートを提供するMCSデバイスプラットフォーム/構成が数多く用意されています7。AMIとADHF CSの両方を治療するためのpVADの使用が着実に増加しているにもかかわらず、死亡率はほとんど変わっていません5。AMI8の左心室(LV)の早期アンロードおよびAMI CS9でのMCSの早期使用に対する可能な臨床的利益の新たな証拠により、MCSの使用は増加し続けています。
左心房から大腿動脈バイパス(LAFAB)MCS装置は、左心房(LA)から血液を排出し、大腿動脈を介して全身動脈循環に戻すことによってLVをバイパスする(図1)。これは、カンヌラのサイズに応じて、2.5-5.0リットル/分(L/m)の流量(新世代ポンプ、LifeSPARCとして指定され、最大8 L/mの流量が可能)を提供する外部遠心ポンプによって支えられている。血液が経皮静脈カニューレを介してLAから抽出されると、それは大腿動脈に置かれた動脈カニューレを介して患者の体に血液を再循環させる外部遠心ポンプを通過する。

図1:LAFABのセットアップ 画像提供:LivaNova US Inc.の100%子会社であるタンデムライフは、 この図のより大きなバージョンを見るにはここをクリックしてください。
プロトコル
この手順とプロトコルは、機関審査委員会と米国食品医薬品局(FDA)によって承認されています。
1. 患者の基準
- CSステージB以上の患者を含む SCAIコンセンサスステートメント1で定義されている。
- ステージD心不全に移植または耐久性のある左心室補助システムへの橋として含める。
- CSによって複雑なAMIの回復への橋渡しとして含める。
- 全身性抗凝固に対する禁忌を除外する。
- 平均余命<6ヶ月(活性悪性腫瘍)を除外する。
- LA血栓が存在する場合は除外します。
- 患者が大きなカニューレを収容できない小さな動脈を有する末梢血管疾患(PVD)を有する場合は除外する。
- 患者が不可逆的な神経損傷/昏睡状態にある場合は除外する。
- 患者が重度の大動脈不全(AI)を有する場合は除外する。
- 患者が心室中隔欠損(VSD)を有する場合は除外する。
注: LAFAB デバイスの配置には、3 つの個別のプロセスが含まれます: 1) コントローラとポンプを設定します。2)経食道心エコー検査(TEE)または心内心エコー検査(ICE)の下で動脈および静脈カニューレおよび経頭道アクセスの配置;そして3)システムを回路に接続する。
2. 左心房から大腿動脈バイパス装置への配置
- コントローラのセットアップ
注: このステップは、患者がラボに搬送され、テーブルがプロシージャ用に設定されている間に実行できます。通常、デバイス代表および灌流チームは、プロセスを支援するために存在する。- ボックスを開き、次の手順でコントローラのセットアップを開始します。
- コントローラの電源を入れる前に、バッテリドアを開けてコントローラに2個のバッテリを入れます。ロゴをコントローラー画面から離して配置して、各バッテリーを挿入します。バッテリーの溝は、キーバッテリハウジングと一致する必要があります。電池がしっかりと取り付けられていることを確認します。
- 同じプロセスに従って、他の2つの電池をドックに取り付けます。
- コントローラーをドックに接続し、ドックに完全に取り付けられていることを確認し、電源コードを電源コンセントに接続し、AC 電源用の壁ソケットに差し込みます。コントローラは、AC電源に接続されたドックで動作するか、ドックから分離すると、バッテリ電源を使用して動作することができます。
- クランプを使用して、静脈内ポールにドックとコントローラを取り付けます。
- 側面のボタンを使用してコントローラをオンにします。
- ポンプの設定 – システムのプライミング
注:ポンププライミングには2人が必要です - 一次オペレータはスクラブ(滅菌オペレータ)であり、滅菌場にとどまります。二次オペレータ(非無菌オペレータ)は非無菌分野のコントローラーを扱う。 ポンプの空気取り外しは重要なステップ であり、非常に慎重に行う必要があります。- 二次オペレータにパッケージを開けて、プライミングトレイをプライマリオペレータに提示させます。第一オペレータに滅菌ドレープを開け、滅菌テーブルのプライミングトレイのコンポーネントをレイアウトさせます。ポンプ、酸素供給器および緑の酸素の管は皿に含まれている。
- 一次オペレータにポンプドライブラインを二次オペレータに渡し、コントローラに接続してもらいます。
- 滅菌オペレータにチューブの保護キャップを取り外し、端部を洗面器に挿入してもらいます。青いチューブは、青色のポートに入る流入チューブです。赤いチューブは、流域の赤いポートに入る流出管です。
- ベイスンを、青いポートから前後に傾いた充填準備の整った位置に置きます。
- 二次オペレータに4リットルの生理食塩水で洗面器を満たしてもらいます。
- 一次オペレータに流域を持ち上げて、それを素数の準備の整った位置に傾けて、ポンプを引き起こします。
- チューブとポンプからすべての空気が取り除かれていたことを確認します。チューブとポンプを軽くタップして、小さな気泡を取り除きます。 これは重要なステップです。
- その後、非滅菌端からポンプをオンにします。
- 酸素供給器を軽くタップし、気泡が上に上昇して脱出するために、より高いレベル(12時位置)に流出管を配置することによって、酸素供給器の小さな気泡を取り除きます。
- すべての気泡を取り除いたら、ポンプを停止します。
- 流入および流出管をクランプします。流域から流入と流出管を取り除き、酸素供給器のポートのガスに緑色の酸素供給チューブを取り付けます。これで、回路の準備ができました。
- 経皮アクセス10,32
- 患者を無菌の方法で準備し、ドレープする。
- 麻酔チームと一般麻酔下での手順を実行します。
- 患者が十分に挿管され、鎮静されたら、食道にTEEプローブを渡し、基本的な画像を得る。ICEを使用する場合は、静脈アクセス後に画像を取得します。
- TEEまたはICEを使用して、心房間中隔(IAS)上の敗血症の理想的なスポットを特定します。FOSSA楕円形の領域でIASの膜部分を示すTEEの二大視を使用して、IASをより良く露出させます。
- 流入カニューレがTEEまたはICEを使用して配置されるLA内の血栓がないことを確認します。
- 変更されたセルディンガー技術を用いて超音波ガイダンスを介して大腿静脈アクセスを取得し、0.035"ガイドワイヤーを挿入
- ガイドワイヤーを下の静脈カバ(IVC)に進み、右心房接合部に進み、それを蛍光視およびTEEまたはICEの指導の下でIASに向けます。複数の血管造影図(右または左の前斜め)を使用して、経音穿刺に最適な部位を特定する。理想的には、合併症を最小限に抑えるために、卵腔の領域で行われるべきである。 厚いまたは動脈瘤性のセプタまたはIASを有する患者では、以前に外科的または閉鎖的にパッチを適用または測定された場合、針の偏向なしに正確な穿刺を保証するために、通電または無線周波経浄化針の使用を検討することができる。
- 患者を抗凝血剤(ACT250秒以上)。経中隔針を用いて経皮穿刺を行い、LAにガイドワイヤーを挿入する。
- 静脈アクセスとIASを2段階の拡張器で拡張します。経皮カニューレを挿入し、LAに進め、紹介者とガイドワイヤーを取り外し、バックブリードを待ってからクランプします。患者にカニューレをしっかり止める。
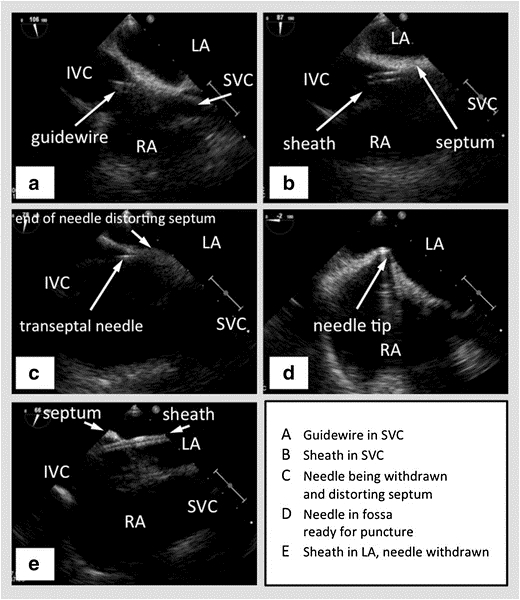
図2:右にSVCを示すビカバルビューで複葉機を有するTEE、左心房を下に左心房と右心房を持つ中央の心房中隔、およびIVCを左方に向けて示す。(A) - SVCに渡すガイドワイヤー。(B) - SVCにワイヤーを通過するシース。(C) - 鞘を通過する経皮針。(D) - 経皮針は、心房中隔をテント.(E) - 針が引き抜かれた後、心房間中隔を通過して左心房に入る鞘。写真提供47
SVC – スーペリア・ヴィーナ・カバ, IVC – 下のヴィーナ・カバ, RA – 右アトリウム, LA – 左アトリウム
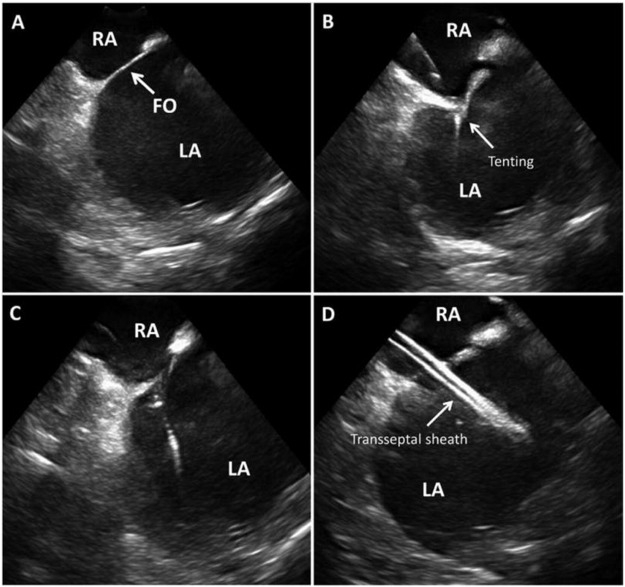
図3:ICEは、心房間中隔およびフォッサ・オバリ(FO)を示すICE誘導性隔管アクセス (A)、針が従事する際の中隔テンティング(B)、針が交差するテントの喪失(C)、D.ピクチャー礼儀48 の左心房における経皮鞘を示す。
RA – 右アトリウム, LA – 左アトリウム, FO – フォアメンオーバル
-
動脈アクセス
- 超音波と大腿骨頭のレベルで血管造影誘導を使用して、改変セルディンガー技術を介して大腿動脈アクセスを取得します。0.035 インチガイドワイヤーを挿入します。
- 動脈アクセスをアップサイジングする前に、市販の様々な血管アクセス閉鎖装置を用いて「事前閉鎖」技術の使用を検討する。
- 選択した動脈カニューレの大きさに適した動脈アクセス部位を連続的に拡張する。動脈カニューレを挿入し、導入者とガイドワイヤーを取り外し、バックブリードを待ってからクランプします。ホルダーを使用して患者にカニューレを固定します。
-
コンポーネントの接続
- 回路内の気泡の導入を避けるために、カニューレに ウェットからウェット 接続を行います。 これは重要なステップです。
- 生理食音または生理食音の一定の注入を、カニューレの両端に接続する場合に使用します。
- 経浄化カニューレ(静脈)を青色でマークされたポンプ入口に、動脈カニューレを赤でマークされたポンプ出口に接続します。
- まず、静脈クランプを取り外し、ポンプを(コントローラボックスから)起動します。その後、他のクランプを順次に解放し、常に空気をチェックし、動脈クランプを最後に離します。
- ポンプ速度を調整(RPMを調整)して、流れを最適化します。蛍光検査とTEEまたはICEの下でカニューレの位置を確認し、患者に回路を固定します。
- ポンプが設置されている限り、ポンプが設置されている限り、治療用抗凝固(活性化凝固時間ACT(180-220sで活性化凝固時間ACTまたは65〜80sで活性化部分トロンボプラスチン時間aPTT)を維持します。 これは重要なステップです。
3. 肺動脈バイパス(RAPAB)システム配置への右アトリウム
- コントローラを開始し、ポンプの下のチャンバーをプライムし、任意の気泡をチェック - 上記のように説明したのと同じステップ。
- ポンプの上部チャンバーをプライムし、任意の空気をチェックし、それをクランプ - 上記のように説明したのと同じステップ。
- 患者の処置
- 超音波指導の下で修正されたセルディンガー技術を介して右の内部司法(RIJ)静脈の静脈アクセスを得る。
- 肺動脈(PA)カテーテルを0.035インチの内腔で挿入し、分岐の直前にメインPAに進めます。硬いボディ0.035"ガイドワイヤーを挿入し、PAカテーテルを取り外します。
- 患者を抗凝血剤(ACT>250 s)。
- 必要なサイズ(29フランス語または31フランス語)に達するまで、パッケージに用意されている段階的な拡張器を使用して静脈アクセスサイトを順次拡張します。
- 静脈カニューレ(例えば、ProtekDuo)をガイドワイヤーの上に挿入します。
- ガイドワイヤを取り外し、バックブリードを待ってから、「遠位」とマークされている遠位ポートをクランプします。
- 止血キャップを取り外し、バックブリードを待ち、「近位」とマークされている近位ポートをクランプします。縫合糸を介して患者にカニューレを固定します。
- カニューラを確認し、ポンプからカニューレに濡れた接続を行います。
- 近位カニューレを青色でマークされたポンプ入口に接続し、遠位カニューレを赤でマークされたポンプ出口に接続します。ポンプの電源を入れます(コントローラーから)。
- リリースクランプは連続して、常に任意の気泡をチェックします。ポンプ速度を調整(RPMを制御)して、流れを最適化します。
- 蛍光法下でカニューレの位置を確認し(主要なPA内の位置を確認するためにTEEガイダンスを使用し得る)、患者に回路を固定する。治療抗凝固(ACTは180-220 s;aPTTは65-80 s)維持する。
4. デバイスの削除
注意:患者の末端臓器機能が改善され、血行力学がLV回復または耐久性のあるLVAD配置/移植などの高度な治療法のいずれかで安定した状態を維持したら、デバイスを取り除くことができます。
- 装置を取り外す前に、段階的に0.5 L/分の速度をゆっくりと下げ、保担度の低い十分なCOと正常な充填圧力があることを注意深く観察します(ランプダウンまたは断り断りスタディとも呼ばれます)。
- ターンダウンスタディが成功したら、ポンプの電源を切ります。
- 動脈カニューレを取り外す前に、ACTが150秒<されていることを確認してください。以前に配置された血管内縫合糸を締めて動脈開管部位を閉塞するか、または手動圧力を少なくとも40分間保持して止血を確実にすることができる。
- 経皮カニューレをIVCに引き出し、大腿静脈からゆっくりと取り除きます。静脈部位に8縫合糸の図を適用し、さらに、止まり止めを達成するためにサイト上の手動圧力を保持します。
注意:心房中隔欠損(ASD)は通常小さく、日常的に閉じられていない。 - 後処理は、患者の血行力学と終了臓器機能の継続的なモニタリングを行い、安定性を確保します。
- ラパブの除去。
- LAFAB除去と同様に、患者のエンドオルガン機能が回復または高度な治療法で安定した場合、ポンプを0.5 L/minでゆっくりと下げ、血行力学を注意深く観察する。
- ターンダウンスタディが成功したら、ポンプの電源を切ります。
- ACTが150秒<されたら、頸部から静脈カニューレを取り出し、8縫合糸の図を置いて穿刺部位を固定します。完全な止止めを達成するために縫合糸に加えて手動圧力を保持する。
- 除去後、患者の血行力学とエンド臓器機能を注意深く監視し、安定性を確保します。
| 錯綜 | リスク要因 | 発生のタイミング | 予防策 | 管理 |
| 心臓穿穿とタンポンネード | 左心房の後部自由壁に沿って針または拡張器または鞘の不注意な進行。 | 経中穿刺中、流入カニューレの配置 | TEEまたはICE上の心房間中隔の正確な評価と、血管造影とエコーによる経皮穿刺の部位と角度の最適化。 | タンポンネードを緩和するための即時心穿刺。外科的介入が必要な場合があります。 |
| 急性四肢虚血は動脈カンヌリンに遠位 | 大きなカニューレ、既存の末梢動脈疾患を収容する小口径血管 | 直ちに手続を投稿する | カヌレーション前の周辺血管造影。 | 遠位灌流カテーテルの配置、重症例における血管外科補助。 |
| 血化、後腹膜出血、偽動脈瘤形成などの血管合併症。 | より高いポンプ速度、ポンプ血栓症、DIC、抗凝固 | ポンプ上のいつでも | 各患者に対してポンプ速度を個別に最適化します。上薬療法抗凝固を避ける. | ポンプ速度を低下させ、抗凝固の治療範囲を維持する。 |
| 一般的な大腿動脈における大腿骨頭における動脈アクセスの最適部位。 | ||||
| 残留心房中隔欠損 | 経皮アクセスのための複数の試み | デアヌレーション後 | 浸透力学的に重要な欠陥は、経皮的に閉じることができます。 |
表1:LAFABデバイス33の合併症。
結果
LAFABデバイスの臨床応用
経皮的な心房横断左心室バイパスシステムの技術と実現可能性は、1960年代にDennisらららによって最初に記述された。しかし、中隔切除術の合併症のために、最初は半透明穿刺が広く採用されなかった。過去10年間、経皮的介入の分野で進歩したオペレータは、心房中隔切れの経験を蓄積し、経皮心室補助装置...
ディスカッション
LAFABデバイスのヘモダイナミクス:
LAFABデバイスの血行性プロファイルは、他のpVADとは異なります。LAから直接血液を排出し、大腿動脈に戻すことによって、装置はLVを完全にバイパスする。その際、LV末端の拡張期容積と圧力を低減し、LV形状の改善に寄与し、LVストローク作業の低下に寄与します。しかし、腸骨動脈/下降大動脈に血液を戻すことで、後負荷が増加...
開示事項
サンディープ・ネイサン - ディスクロージャーズ:コンサルタント、アビオメッド、ゲティング、CSI、Inc.
アレクサンダー・トゥルースデル - 開示:コンサルタント、アビオメド株式会社
プーナム・ベラガプディ - 開示:女性の健康イニシアチブ諮問委員会、アビオメッド
謝辞
ライフスパルクのタンデムハートチームへ。
資料
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
参考文献
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved