JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
경피 심실 보조 장치 /심장 유발 쇼크를위한 대퇴 동맥 우회 시스템에 왼쪽 아트리움의 사용
요약
다음 기사에서는 경피좌 심실 보조 장치(pLVAD)와 CS의 좌심실 바이패스(LAFAB) 시스템을 우회하고 지원하는 대퇴동맥 우회(LAFAB) 시스템에 대한 좌심방인 심근 쇼크(CS)에 장치(예를 들어 탠덤하트)의 배치를 위한 단계별 절차를 설명합니다.
초록
대퇴동맥 우회(LAFAB) 계통에 대한 좌심방은 좌심방(LA)에서 혈액을 배출하여 좌심실을 우회하는 심장발생 쇼크(CS)에 사용되는 기계적 순환유지(MCS) 장치이며, 대퇴동맥을 통해 전신 동맥 순환으로 반납한다. 캐뉼라의 크기에 따라 2.5-5 L/min에 이르는 흐름을 제공할 수 있습니다. 여기에서는 LAFAB의 작용 메커니즘, 사용 가능한 임상 데이터, 심장 유발 쇼크에 대한 사용 표시, 이식 단계, 절차 후 치료 및 이 장치 사용 및 관리와 관련된 합병증에 대해 논의합니다.
또한 전배치 준비, 심초음파 지침 에 따른 경막 포심을 통한 장치의 경피 배치 및 장치 파라미터의 수술 후 관리를 포함한 장치 치료의 절차 적 구성 요소에 대한 간략한 비디오를 제공합니다.
서문
심장 유발 충격 (CS)은 심장이 신체의 요구를 충족시키기에 충분한 혈액과 산소를 전달할 수없는 수반되는 저혈압의 유무에 관계없이 조직 저구주입 상태이며 장기 부전의 결과로 발생합니다. 그것은 심혈관 혈관 조영술 및 내정간섭의 사회에 의해 단계 A로 E로 분류됩니다 (SCAI): 단계 A - CS를 위한 위험한 상태에 환자; 단계 B - 저혈압이나 빈맥이있는 CS의 시작 단계에서 환자는 저혈압이없는; 단계 C - 관류를 유지하기 위해 이노트로프 / 혈관 제기 또는 기계적 지원을 필요로하는 차갑고 습식 표현형의 고전적인 CS; 단계 D - 현재 의료 또는 기계적 지원에서 악화되어 고급 장치에 에스컬레이션이 필요합니다. 및 단계 E - 순환 붕괴와 진행 중인 심폐 소생술로 심장 마비를 적극적으로 경험하는 불응성 부정맥 환자를 포함한다1. CS의 가장 흔한 원인은 급성 MI (AMI)가 최근 보고된 분석2에서 케이스의 81%를 나타내고, 급성 보상심부전 (ADHF)입니다. CS는 고전적으로 혼잡과 관류 장애를 특징으로하며, 높은 충진 압력(폐 모세관 쐐기 압력[PCWP], 좌심실 단측 이연수 압력 [LVEDP], 중앙 정맥 압력 [CVP], 오른쪽 심실 단측 측압 [RVEDP]), 심장 출력 감소(CO), 심장 지수(CI-구성), 심장 지수(CI3) 감소 . 과거에, CS에 의해 복잡 AMI에 대 한 유일한 사용 가능한 치료는 초기 revascularization 및 의료 관리 이노트로프 및/또는 vasopresss4. 최근에는 기계순환지원(MCS) 장치의 출현과 혈관제의 에스컬레이션이 사망률 증가와 관련이 있다는 인식과 함께 AMI 및 ADHF 관련 CS5,6의 치료에 패러다임 변화가 있었습니다.
경피 심실 보조 장치(pVAD)의 현재 시대에는 산소 공급 기능 의 유무에 관계없이 원심또는 쌍실 순환 및 심실 지원을 제공하는 MCS 장치 플랫폼/구성이 많이 있습니다. AMI와 ADHF CS를 모두 치료하기 위해 pVAD를 꾸준히 증가했음에도 불구하고 사망률은 크게 변하지 않았습니다5. AMI8에서 좌심실(LV)의 조기 하역과 AMI CS9에서 MCS의 조기 사용에 대한 임상 적 이점에 대한 새로운 증거로 MCS의 사용이 계속 증가하고 있습니다.
대퇴동맥 바이패스(LAFAB) MCS 디바이스에 대한 좌심방은 왼쪽 아트리움(LA)에서 혈액을 배출하고 대퇴동맥을 통해 전신 동맥 순환으로 되돌리기 함으로써 LV를 우회한다(도 1). 그것은 캐뉼러의 크기에 따라 분당 2.5-5.0 리터 (L / m) 흐름 (LifeSPARC로 지정된 생명SPARC로 지정된 차세대 펌프)를 제공하는 외부 원심 펌프에 의해 지원됩니다. 혈액이 경부 정맥 캐뉼라를 통해 LA에서 추출되면, 대퇴 동맥에 배치 된 동맥 캐뉼라를 통해 환자의 몸으로 혈액을 다시 순환외부 원심 펌프를 통과합니다.

그림 1: LAFAB 설정. 이미지 제공 TandemLife, LivaNova US Inc.의 전액 출자 자회사 이 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
이 절차와 프로토콜은 기관 검토 위원회와 미국 식품 의약국 (FDA)에 의해 승인되었습니다.
1. 환자 기준
- SCAI 합의 문1에 의해 정의된 바와 같이 CS 단계 B 이상을 가진 환자를 포함하십시오.
- D 단계 심부전에서 이식하거나 내구성이 뛰어난 좌심실 보조 시스템을 이식하는 다리로 포함하십시오.
- CS가 복잡하게 하는 AMI에서 복구할 수 있는 브리지로 포함합니다.
- 전신 항응고에 대한 콘트라 표시를 제외하십시오.
- 평균 수명 <6개월(활성 악성)을 제외합니다.
- LA 혈전의 존재가 있는 경우 제외합니다.
- 환자가 큰 캐뉼러를 수용할 수 없는 작은 동맥을 가진 말초 혈관 질병 (PVD)이 있는 경우에 제외합니다.
- 환자가 돌이킬 수없는 신경 상해 / 혼수 상태에 있는 경우에 제외하십시오.
- 환자가 심각한 대동맥 부전 (AI)이있는 경우 제외하십시오.
- 환자가 심실 중격 결손 (VSD)이있는 경우 제외하십시오.
참고: LAFAB 장치의 배치에는 세 가지 프로세스가 포함됩니다: 1) 컨트롤러 및 펌프 설정; 2) 경도 심초음파(TEE) 또는 심장 내 심초음파(ICE) 하에서 동맥 및 정맥 캐뉼라 및 경외 접근의 배치; 및 3) 회로에 시스템을 연결합니다.
2. 대퇴동맥 우회 장치에 왼쪽 아트리움 배치
- 컨트롤러 설정
참고: 이 단계는 환자가 실험실로 이송되고 있으며 절차를 위해 테이블이 설정됨에 따라 수행될 수 있습니다. 일반적으로 장치 담당자 및 관혈 팀은 프로세스를 지원하기 위해 존재합니다.- 상자를 열고 다음 단계로 컨트롤러 설정을 시작합니다.
- 컨트롤러에 전원을 공급하기 전에 배터리 도어를 열어 컨트롤러에 배터리 2개씩 배치합니다. 로고를 컨트롤러 화면에서 멀리 향하여 각 배터리를 삽입합니다. 배터리의 홈은 주요 배터리 하우징과 정렬되어야 합니다. 배터리가 잘 장착되어 있는지 확인하십시오.
- 동일한 프로세스에 따라 다른 2개의 배터리를 도크에 설치합니다.
- 컨트롤러를 도크에 부착하고, 도크에 완전히 고정되어 있는지 확인하고 전원 코드를 전원 콘센트에 연결하고 AC 전원을 위해 벽 소켓에 연결합니다. 컨트롤러는 AC 전원에 연결된 도크에서 작동할 수 있거나 도크에서 분리될 때 배터리 전원을 사용하여 작동할 수 있습니다.
- 클램프를 사용하여 정맥 극에 도크와 컨트롤러를 장착합니다.
- 측면의 버튼을 사용하여 컨트롤러를 켭니다.
- 펌프 설정 - 시스템 프라이밍
참고: 펌프 프라이밍에는 두 사람이 필요합니다- 기본 작업자는 스크러빙(멸균 작업자)이며 멸균 필드에 유지됩니다. 보조 연산자(비멸균 연산자)는 비멸 환경에서 컨트롤러를 처리합니다. 펌프 드에어링은 중요한 단계이며 매우 신중하게 수행해야 합니다.- 보조 연산자가 패키지를 열고 프라이밍 트레이를 기본 연산자에게 제시하도록 합니다. 1차 작업자가 멸균 드레이프를 열고 멸균 테이블에 프라이밍 트레이의 구성 요소를 배치하십시오. 펌프, 산소 공급및 녹색 산소 튜브가 트레이에 포함되어 있습니다.
- 주 연산자가 펌프 드라이브라인을 보조 연산자에게 건네준 다음 컨트롤러에 연결하도록 합니다.
- 멸균 작업자가 튜브의 보호 캡을 제거하고 끝을 분지에 삽입하도록 합니다. 파란색 튜브는 파란색 포트로 들어가는 유입 튜브입니다. 빨간 튜브는 분지의 붉은 항구로 들어가는 유출 튜브입니다.
- 파란색 포트에서 앞뒤로 기울어진 채우기 준비 위치에 분지를 놓습니다.
- 보조 작업자가 4리터의 식염수로 분지를 채우게 하십시오.
- 기본 연산자가 분지를 들어 올리고 펌프를 중력프라임에 배치할 수 있는 주요 준비 위치로 다시 기울이게 한다.
- 모든 공기가 튜브와 펌프에서 제거되었는지 확인합니다. 튜브와 펌프를 부드럽게 탭하여 작은 기포를 제거합니다. 이것은 중요한 단계입니다.
- 그런 다음 비멸 성 끝에서 펌프를 켭니다.
- 산소를 부드럽게 두드리고 기포가 위로 올라가 탈출할 수 있도록 더 높은 수준(12시 위치)에 유출 튜브를 배치하여 산소에 있는 작은 기포를 제거합니다.
- 모든 기포가 제거되면 펌프를 중지합니다.
- 유입 및 유출 튜브를 고정합니다. 분지에서 유입 및 유출 튜브를 제거한 다음 산소공급기의 항구에 있는 가스에 녹색 산소 공급 튜브를 부착합니다. 이제 회로가 준비되었습니다.
- 환무 액세스10,32
- 멸균 방식으로 환자를 준비하고 드레이프하십시오.
- 마취 팀과 전신 마취하에 절차를 수행하십시오.
- 환자가 삽관되고 적절하게 진정되면 TEE 프로브를 식도로 전달하고 기본 이미지를 얻습니다. ICE를 사용하는 경우 정맥 액세스 후 이미지를 가져옵니다.
- TEE 또는 ICE를 사용하여 심방 간 격막 중격 (IAS)에 중격 절제술을위한 이상적인 지점을 식별합니다. 포스사 타원 영역에서 IAS의 빈약한 부분을 보여주는 TEE의 이카발 뷰를 사용하여 IAS를 더 잘 노출시하십시오.
- 유입 캐뉼라가 TEE 또는 ICE를 사용하여 배치될 LA에 혈전이 없는지 확인합니다.
- 수정 된 셀딩거 기술로 초음파 지침을 통해 대퇴 정맥 액세스를 얻고 0.035 "가이드 와이어를 삽입하십시오.
- 가이드와이어를 열등한 베나 카바(IVC)로 전진한 다음, 오른쪽 심방 접합부로 이동한 다음 불소 및 TEE 또는 ICE 지침에 따라 IAS로 안내합니다. 여러 혈관 조강(오른쪽 또는 왼쪽 전방 경사)을 사용하여 경전 천자에 대한 최적의 부위를 식별합니다. 이상적으로, 그것은 합병증을 최소화하기 위해 포맨 타원형의 영역에서 수행해야합니다. 이전에 외과 또는 폐막 수술을 하거나 폐쇄된 두껍거나 동맥류 격막 또는 IAS를 가진 환자에서는 바늘 편향 없이 정밀한 구멍을 보장하기 위해 활력 또는 무선 주파수 환무 바늘을 사용하는 것을 고려할 수 있습니다.
- 환자를 항응성 (ACT 250 초 이상). LA에 가이드와이어를 삽입하여 경부 바늘을 사용하여 경부 천자를 수행합니다.
- 정맥 접근과 IAS를 2단 확장기로 확장합니다. 경부 캐뉼라를 삽입하고 LA로 진출하고, 소개자와 가이드와이어를 제거하고, 백 블리드를 기다렸다가 클램프를 기다립니다. 환자에게 캐뉼라를 고정하십시오.
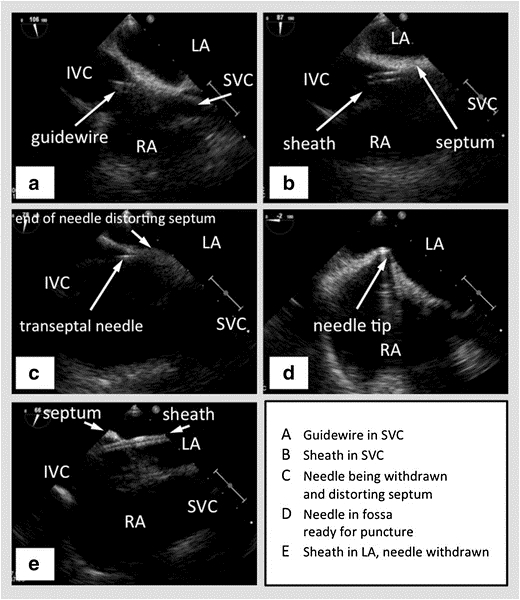
도 2: 오른쪽SVC를 보여주는 바이플레인, 중앙의 중간 심격막 수평, 아래 왼쪽 아트리움, 그리고 IVC가 왼쪽으로 향하는 비카발 뷰에 있는 TEE. (A) - SVC로 전달되는 가이드와이어. (B) - SVC로 와이어를 전달하는 시스. (C) - 칼집을 통과하는 환무 바늘. (D) - 간심 중격을 텐트하는 환무 바늘. (E) - 바늘이 철회 된 후 좌심관으로 간심 중격을 통과하는 시스. 사진 제공47
SVC – 슈페리어 베나 카바, IVC – 열등한 베나 카바, RA – 오른쪽 아트리움, LA – 왼쪽 아트리움
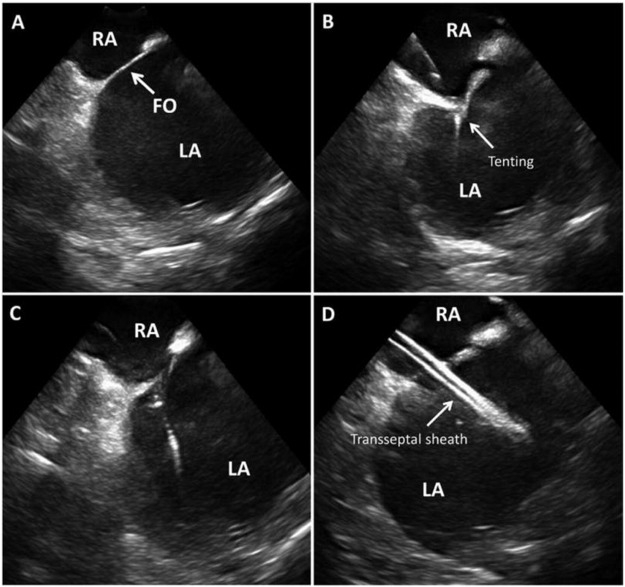
도 3: ICE 경막 간 중격 및 포사 타원(FO)을 보여주는 트랜스 중격 접근을 유도한 ICE(A), 바늘이 (B)에 관여하는 중격 텐트, 바늘이 교차하는 동안 텐트의 손실(C), D. Picture 호의 왼쪽 아트리움의 환무 칼집.
RA – 오른쪽 아트리움, LA – 왼쪽 아트리움, FO – 포라멘 오벌
-
동맥 액세스
- 대퇴골 머리의 수준에서 초음파 및 혈관 지도를 사용하여 수정 된 셀딩거 기술을 통해 대퇴 동맥 액세스를 얻을 수 있습니다. 0.035" 가이드와이어를 삽입합니다.
- 동맥 액세스를 강화하기 전에 다양한 시판되는 혈관 액세스 폐쇄 장치를 사용하여 "사전 폐쇄"기술을 사용하는 것이 좋습니다.
- 선택한 동맥 캐뉼라의 크기에 적합한 동맥 액세스 사이트를 직렬로 팽창시다. 동맥 캐뉼라를 삽입하고, 소개자와 가이드와이어를 제거하고, 백 블리드를 기다린 다음, 클램프합니다. 홀더를 사용하여 환자에게 캐뉼라를 고정하십시오.
-
구성 요소 연결
- 회로에 기포가 도입되지 않도록 캐뉼라에 젖은 연결을 만듭니다. 이것은 중요한 단계입니다.
- 식염수 침수 또는 식염수 ("폭포")를 카누라의 두 쪽 끝에 걸쳐 식염수 침수 또는 일정한 주입을 사용합니다.
- 투명 캐뉼러(정맥)를 파란색으로 표시된 펌프 입구에 연결하고 동맥 캐뉼라를 빨간색으로 표시된 펌프 콘센트에 연결합니다.
- 먼저 정맥 클램프를 제거하고 펌프를 시작합니다(컨트롤러 상자에서). 그런 다음 다른 클램프를 순차적으로 방출하여 지속적으로 공기를 확인하고 동맥 클램프를 마지막으로 방출합니다.
- 흐름을 최적화하기 위해 펌프 속도를 조정합니다(RPm을 조정하여). 불소 검사 및 TEE 또는 ICE 하에서 캐뉼라의 위치를 확인하고 환자에게 회로를 고정하십시오.
- 펌프가 펌프 혈전증 및 뇌졸중을 예방하는 한 치료 적 항응고(180-220s에서 활성화된 응고 시간 ACT 또는 65-80s에서 활성 부분 혈전라스틴 시간 aPTT)을 유지하십시오. 이것은 중요한 단계입니다.
3. 폐 동맥 바이 패스 (RAPAB) 시스템 배치에 오른쪽 아트리움
- 위와 같이 설명된 동일한 단계 - 컨트롤러, 펌프의 하부 챔버를 프라임하고 기포를 확인하십시오.
- 펌프의 상부 챔버를 프라임, 공기를 확인하고 그것을 고정 - 위와 같은 단계.
- 환자 절차
- 초음파 지침에 따라 변형 된 셀딩거 기술을 통해 오른쪽 내부 경마 (RIJ) 정맥에서 정맥 액세스를 얻을 수 있습니다.
- 0.035"루멘과 폐 동맥 (PA) 카테터를 삽입하고 분기 직전에 주요 PA로 진행합니다. 딱딱한 몸체 0.035" 가이드와이어를 삽입하고 PA 카테터를 제거합니다.
- 환자를 항응성 (ACT > 250 s).
- 원하는 크기에 도달할 때까지 패키지에 제공된 단계별 확장기를 사용하여 정맥 액세스 사이트를 순차적으로 분리합니다(프랑스어 29 개 또는 31 프랑스어).
- 가이드와이어 위에 정맥 캐뉼라(예: ProtekDuo)를 삽입합니다.
- 가이드 와이어를 제거하고 백 블리드를 기다린 다음 "Distal"으로 표시된 탈반 포트를 고정합니다.
- hemostasis 캡을 제거하고 백 블리드를 기다린 다음 "동축"으로 표시된 근접 포트를 고정합니다. 봉합사를 통해 환자에게 캐뉼라를 고정하십시오.
- 캐뉼라를 확인하고 펌프에서 캐뉼라까지 젖은 연결장치를 만듭니다.
- 파란색으로 표시된 펌프 입구와 빨간색으로 표시된 펌프 콘센트에 근위 캐뉼라를 연결합니다. 펌프를 켜십시오(컨트롤러에서).
- 클램프를 순차적으로 방출하여 기포를 지속적으로 확인합니다. 펌프 속도를 조정하여(RPm을 제어하여) 흐름을 최적화합니다.
- 형광술 하에서 캐뉼라 위치를 확인(TEE 지침을 사용하여 메인 PA의 위치를 확인할 수 있음) 환자에게 회로를 고정할 수 있습니다. 치료 적 응고를 유지 (ACT 에서 180-220 s; aPTT 에서 65-80 s).
4. 장치 제거
참고: 환자의 최종 장기 기능이 개선되고 혈역학이 LV 회복 또는 내구성있는 LVAD 배치 / 이식과 같은 고급 치료법으로 안정적으로 유지되면 장치를 제거 할 수 있습니다.
- 장치를 제거하기 전에 속도를 단계별로 0.5 L/min으로 천천히 거절하고 혈역학을 주의 깊게 관찰하여 적절한 CO 및 정상 충전 압력이 적은 지지체(경사로 를 끄거나 거절하는 연구라고도 함).
- 턴다운 스터디가 성공하면 펌프를 끕니다.
- 동맥 캐뉼러를 제거하기 전에 ACT가 150초 < 있는지 확인하십시오. 이전에 배치된 인트라바스내 봉합사를 조여 동맥 절제술 부위 또는 수동 압력을 최소 40분 동안 유지하여 hemostasis를 보장할 수 있습니다.
- IVC로 환부식 캐뉼라를 철회하고 대퇴 정맥에서 천천히 제거하십시오. 정맥 사이트에 8 봉합사의 그림을 적용하고 또한, hemostasis을 달성하기 위해 사이트에 수동 압력을 유지합니다.
참고: 심방 중격 결함 (ASD)은 일반적으로 작고 일상적으로 닫히지 않습니다. - 수술 후 환자의 혈역학을 지속적으로 모니터링하고 안정성을 보장하기 위해 장기 기능을 종료합니다.
- 라파브의 제거.
- LAFAB 제거와 마찬가지로 환자의 최종 장기 기능이 회복 또는 고급 치료법으로 안정화되면 펌프를 0.5 L/min으로 천천히 끄고 혈역학을 주의 깊게 관찰합니다.
- 턴다운 스터디가 성공할 때 펌프를 끕니다.
- ACT가 150초 < 되면 목에서 정맥 캐뉼라를 제거하고 8봉합사의 그림을 배치하여 천자 부위를 확보하십시오. 완합사 이외에 수동 압력을 유지하여 완전한 hemostasis를 달성하십시오.
- 제거 후 환자의 혈역학 및 최종 장기 기능을 면밀히 모니터링하여 안정성을 보장합니다.
| 복잡 | 위험 요소 | 발생 시기 | 예방법 | 경영 |
| 심장 천공 및 탐포나데 | 왼쪽 아트리움의 후방 무료 벽을 따라 바늘이나 팽창기 또는 칼집의 의도하지 않은 발전. | 경부 천자 동안, 유입 캐뉼라의 배치 | TEE 또는 ICE의 심방 간 중격을 정확하게 평가하고 혈관 조영술 및 에코를 통해 경부 천자의 사이트와 각도를 최적화합니다. | 탐폰을 완화하기 위한 즉각적인 흡기. 외과 적 개입이 필요할 수 있습니다. |
| 급성 사지 허혈 경하 성 동맥 수 분 | 대형 캐뉼러, 기존 말초 동맥 질환을 수용하는 소형 구경 선박 | 즉시 사후 절차 | 수분 전에 주변 혈관. | 심한 경우에 황반 관류 카테터, 혈관 수술 지원의 배치. |
| 혈류, 레트로 복막 출혈, 의사 혈관 형성과 같은 혈관 합병증. | 더 높은 펌프 속도, 펌프 혈전증, DIC, 항응고 | 펌프에 언제든지 | 모든 환자에게 개별적으로 펌프 속도를 최적화합니다. 수근 치료 항응고를 피하십시오. | 펌프 속도를 줄이고 치료 범위를 유지합니다. |
| 일반적인 대퇴동맥에서 대퇴머리에 동맥 접근의 최적의 사이트. | ||||
| 잔류 심방 격막 결함 | 상무 액세스를 위한 여러 시도 | 감소 후 | 혈역학적으로 중요한 결함은 경피적으로 닫을 수 있습니다. |
표 1: LAFAB 장치의 합병증33.
결과
LAFAB 장치의 임상 응용 프로그램
경피성 심방 좌심실 우회 시스템의 기술과 타당성은 데니스 외 11,12에 의해 1960 년대에 처음 설명되었다. 그러나 경부 천자는 처음에 septostomy 기술로 합병증 때문에 널리 채택되지 않았습니다. 지난 10 년 동안, 경피 적 개입 분야의 발전과 함께, 운영자는 심방 중격 절제술에 대한 경험을 축적하여 경부 심?...
토론
LAFAB 장치의 혈역학:
LAFAB 장치의 혈역학 프로파일은 다른 pVAD와 구별됩니다. LA에서 직접 혈액을 배출하고 대퇴 동맥에 반환함으로써 장치는 LV를 완전히 우회합니다. 이 과정에서 LV 엔드 확장기 부피와 압력을 감소시켜 LV 형상개선에 기여하여 LV 스트로크 작업의 감소를 이에 이수합니다. 그러나 혈액을 다시 일악 동맥/내림차순 대동맥으로 돌려보내면 후하량이 증가합...
공개
산딥 네이선 - 공개: 컨설턴트, 아비오메드, 게팅, CSI, Inc.
알렉산더 트루델 - 공개: 컨설턴트, Abiomed Inc.
푸남 벨라가푸디 - 공개: 여성 건강 이니셔티브자문위원회, 아비오메드
감사의 말
LifeSparc의 탠덤하트 팀에게.
자료
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
참고문헌
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유