Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование чрескожного желудочкового вспомогательного устройства / левого предсердия до системы шунтирования бедренной артерии для кардиогенного шока
В этой статье
Резюме
В следующей статье описывается пошаговая процедура размещения устройства (например, Tandemheart) при кардиогенном шоке (CS), которое представляет собой чрескожное вспомогательное устройство левого желудочка (pLVAD) и систему шунтирования левого предсердия в бедренную артерию (LAFAB), которая обходит и поддерживает левый желудочек (LV) в CS.
Аннотация
Система шунтирования левого предсердия в бедренную артерию (LAFAB) представляет собой механическое устройство поддержки кровообращения (MCS), используемое при кардиогенном шоке (CS), которое обходит левый желудочек путем дренирования крови из левого предсердия (LA) и возвращения ее в системное артериальное кровообращение через бедренную артерию. Он может обеспечивать потоки в диапазоне от 2,5-5 л/мин в зависимости от размера канюли. Здесь мы обсудим механизм действия LAFAB, имеющиеся клинические данные, показания к его применению при кардиогенном шоке, этапы имплантации, постпроцедурный уход, а также осложнения, связанные с использованием данного аппарата и управлением ими.
Мы также предоставляем краткое видео процедурной составляющей аппаратной терапии, включая подготовку перед размещением, чрескожное размещение устройства с помощью транссептической пункции под эхокардиографическим руководством и послеоперационное управление параметрами устройства.
Введение
Кардиогенный шок (КС) — это состояние гипоперфузии тканей с сопутствующей гипотензией или без нее, при котором сердце не в состоянии доставить достаточное количество крови и кислорода для удовлетворения потребностей организма, что приводит к органной недостаточности. Он классифицируется на стадии от А до Е Обществом сердечно-сосудистой ангиографии и вмешательств (SCAI): стадия А - пациенты с риском КС; стадия В – пациенты на начальной стадии КС с гипотензией или тахикардией без гипоперфузии; стадия С - классическая КС с холодным и влажным фенотипом, требующим инотропов/вазопрессоров или механической поддержки для поддержания перфузии; стадия D - ухудшение текущего медицинского или механического обеспечения, требующего перехода на более совершенные устройства; и стадия Е – включает пациентов с коллапсом кровообращения и рефрактерными аритмиями, которые активно испытывают остановку сердца при продолжающейся сердечно-легочной реанимации1. Наиболее распространенными причинами КС являются острый ИМ (ОИМ), составляющий 81% случаев в недавно опубликованном анализе2, и острая декомпенсированная сердечная недостаточность (АДГФ). CS классически характеризуется застойными явлениями и нарушением перфузии, проявляющимся повышенным давлением наполнения (давление легочного капиллярного клина [PCWP], левожелудочковое конечное диастолическое давление [LVEDP], центральное венозное давление [CVP] и правожелудочковое конечное диастолическое давление [RVEDP]), снижение сердечного выброса (CO), сердечного индекса (CI), сердечного выброса (CPO) и сбоя в работе конечного органа3 . В прошлом единственными доступными методами лечения ОИМ, осложненными КС, были ранняя реваскуляризация и медицинское лечение инотропами и /или вазопрессорами4. Совсем недавно, с появлением механических устройств поддержки кровообращения (MCS) и признанием того, что эскалация вазопрессоров связана с увеличением смертности, произошел сдвиг парадигмы в лечении как AMI, так и ADHF, связанных с CS5,6.
В нынешнюю эпоху чрескожных желудочковых вспомогательных устройств (pVAD) существует ряд платформ / конфигураций устройств MCS, которые обеспечивают одновентрикулярную или бивентрикулярную поддержку кровообращения и желудочков с возможностью оксигенации и без нее7. Несмотря на устойчивый рост использования пВАД для лечения как ОИМ, так и АДГФ КС, показатели смертности остались в основном неизменными5. С появлением доказательств возможных клинических преимуществ ранней разгрузки левого желудочка (LV) в AMI8 и раннего использования MCS в AMI CS9, использование MCS продолжает расти.
Устройство MCS для шунтирования левой предсердной и бедренной артерии (LAFAB) обходит ЛЖ, дренируя кровь из левого предсердия (LA) и возвращая ее в системное артериальное кровообращение через бедренную артерию (рисунок 1). Он поддерживается внешним центробежным насосом, который обеспечивает поток 2,5-5,0 литров в минуту (л / м) (насос нового поколения, обозначенный как LifeSPARC, способный к потоку до 8 л / м) в зависимости от размера канюль. Как только кровь извлекается из ЛА через транссептальную венозную канюлю, она проходит через внешний центробежный насос, который рециркулирует кровь обратно в тело пациента через артериальную канюлю, помещенную в бедренную артерию.

Рисунок 1: Настройка LAFAB. Изображение любезно предоставлено TandemLife, дочерней компанией LivaNova US Inc. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Эта процедура и протокол были одобрены институциональным наблюдательным советом и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
1. Критерии пациента
- Включите пациентов со стадией CS B и выше, как определено в консенсусном заявлении SCAI1.
- Включают в качестве моста для трансплантации или прочную систему помощи левому желудочку при стадии D сердечной недостаточности.
- Включить в качестве моста к восстановлению в AMI, осложненном CS.
- Исключить противопоказание к системным антикоагуляциям.
- Исключить продолжительность жизни <6 месяцев (активная злокачественность).
- Исключить, если есть наличие ТРОМБА ЛА.
- Исключите, если у пациентов есть заболевания периферических сосудов (PVD) с мелкими артериями, которые не могут вместить большие канюли.
- Исключить, если у пациентов есть необратимая неврологическая травма/кома.
- Исключить, если пациенты имеют тяжелую аортальную недостаточность (ИИ).
- Исключить, если у пациентов есть дефект межжелудочковой перегородки (ВСД).
ПРИМЕЧАНИЕ: Размещение устройства LAFAB включает в себя три отдельных процесса: 1) настройка контроллера и насоса; 2) размещение артериальных и венозных канюл и трансэптального доступа под чреспищеводную эхокардиограмму (ТЭЭ) или внутрисердечную эхокардиограмму (ДВС); и 3) подключение системы к цепи.
2. Расположение левого предсердия к устройству шунтирования бедренной артерии
- Настройка контроллера
ПРИМЕЧАНИЕ: Этот шаг может быть выполнен, когда пациент транспортируется в лабораторию и устанавливается стол для процедуры. Обычно представитель устройства и команда перфузиологов присутствуют, чтобы помочь с процессом.- Откройте окно и запустите настройку контроллера, выполнив следующие действия.
- Перед включением питания контроллера поместите 2 батареи в геймпад, открыв дверцу аккумулятора. Вставьте каждую батарею, поместив логотип в сторону от экрана контроллера. Паз на батарее должен совпадать с корпусом батареи ключа. Убедитесь, что батарейки хорошо сидят.
- Установите остальные 2 батареи в док-станцию, следуя тому же процессу.
- Подключите контроллер к док-станции, убедитесь, что он полностью установлен на док-станции, подключите кабель питания к розетке и подключите его к розетке для подключения к розетке переменного тока. Контроллер может работать в док-станции, подключенной к сети переменного тока, или при отделении от док-станции он может работать с использованием батарейного питания.
- Установите док-станцию и контроллер на столб внутривенного введения с помощью зажима.
- Включите геймпад с помощью кнопок сбоку.
- Настройка насоса – Подкормка системы
ПРИМЕЧАНИЕ: Для заправки насоса требуется два человека — первичный оператор очищается (стерильный оператор) и остается в стерильном поле. Вторичный оператор (нестерильный оператор) обрабатывает контроллер в нестерильном поле. Обезвоживание насоса является важным этапом и должно выполняться очень осторожно.- Попросите вторичного оператора открыть пакет и предъявить лоток для грунтовки основному оператору. Затем попросите основного оператора открыть стерильную драпировку и выложить компоненты грунтовочного лотка на стерильный стол. Насос, оксигенатор и зеленая кислородная трубка включены в лоток.
- Попросите основного оператора передать трансмиссию насоса вторичному оператору, который затем подключит ее к контроллеру.
- Попросите стерильного оператора снять защитные колпачки на трубке и вставить концы в раковину. Синяя трубка - это приточная трубка, которая входит в синий порт. Красная трубка - это отводная трубка, которая входит в красный порт бассейна.
- Поместите таз в готовое к заполнению положение, наклоненное назад и в сторону от синего порта.
- Попросите вторичного оператора заполнить емкость 4 литрами физиологического раствора.
- Попросите основного оператора поднять бассейн и наклонить его обратно в исходное положение, чтобы гравитировать насос.
- Убедитесь, что весь воздух удален из трубки и насоса. Осторожно постучите по трубке и насосу, чтобы удалить мелкие пузырьки воздуха. Это важнейший шаг.
- Затем включите насос с нестерильного конца.
- Удалите все крошечные пузырьки воздуха в оксигенаторе, осторожно постукивая по кислородатору и позиционируя трубку оттока на более высоком уровне (положение 12 часов), чтобы пузырьки воздуха поднялись выше и вырвались наружу.
- Остановите насос, как только все пузырьки воздуха будут удалены.
- Зажмите приточную и выходную трубку. Снимите трубку притока и оттока из бассейна, а затем присоедините зеленую трубку подачи кислорода к газу в порту на оксигенаторе. Теперь схема готова.
- Транссептальный доступ10,32
- Подготовьте и задрапируйте пациента стерильным способом.
- Выполните процедуру под общим наркозом с анестезиологической бригадой.
- После того, как пациент будет интубирован и адекватно седатив, проведите зонд TEE в пищевод и получите основные изображения. Если используется ДВС, то получают снимки после венозного доступа.
- Определите идеальное место для септостомии на межпредсердной перегородке (IAS) с помощью TEE или ICE. Используйте двустворчатый вид на TEE, показывающий мембранную часть IAS в области fossa ovalis, чтобы лучше экспонировать IAS.
- Подтвердите отсутствие тромба в Лос-Анджелесе, где приточная канюля будет позиционироваться с помощью TEE или ICE.
- Получите доступ к бедренной венозной артерии с помощью ультразвукового наведения с модифицированной техникой Селдингера и вставьте 0,035-дюймовый направляющий провод
- Продвиньте направляющую проволоку к нижней полой вене (IVC) - правому предсердному соединению, а затем направьте ее к IAS под флюороскопическим и TEE или ICE руководством. Используя несколько ангиографических проекций (правая или левая передняя косая), определите оптимальное место для трансэптальной пункции. В идеале это должно быть сделано в области овального отверстия, чтобы свести к минимуму осложнения. У пациентов с толстой или аневризмальной перегородкой или IAS, которая ранее была нанесена или инструментирована хирургическим путем или закрыта чрескожно, можно рассмотреть возможность использования под напряжением или радиочастотной транссептической иглы для обеспечения точной пункции без отклонения иглы.
- Антикоагулянт пациента (АКТ более 250 секунд). Выполните транссептальную пункцию с помощью транссептической иглы, вставьте направляющую проволоку в ЛА.
- Расширьте венозный доступ и ИАС с помощью 2-ступенчатого расширителя. Вставьте транссептальную канюлю и переместите ее в Лос-Анджелес, удалите интродьюсер и направляющую проволоку, дождитесь обратного кровотечения и зажмите. Закрепите канюлю для пациента.
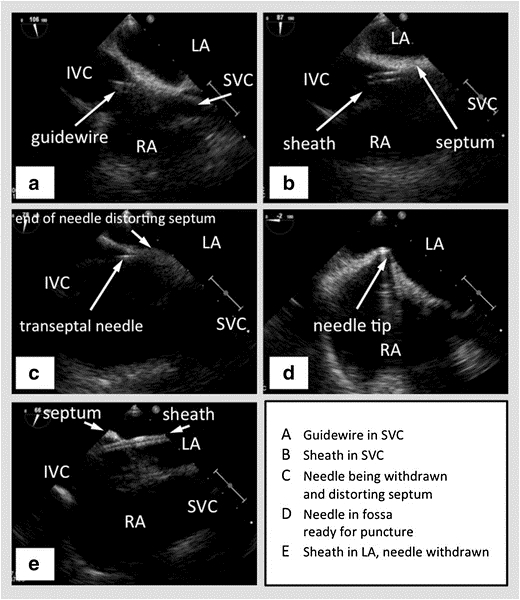
Рисунок 2: TEE с бипланом в бикавальном виде, показывающим SVC справа, межпредсердную перегородку горизонтальную посередине с левым предсердием выше и правым предсердием внизу, и IVC слева. (A) - Направляющая проволока, проходящая в SVC. (B) - Оболочка, проходящая через провод в SVC. (C) - Транссептальная игла, проходящая через оболочку. (D) - Транссептальная игла, укладывающая межпредсердную перегородку. (E) - Оболочка, проходящая через межпредсердную перегородку в левое предсердие, после того, как игла была извлечена. Фото любезно предоставлено47
SVC – верхняя полая вена, IVC – нижняя полая вена, РА – правое предсердие, LA – левое предсердие
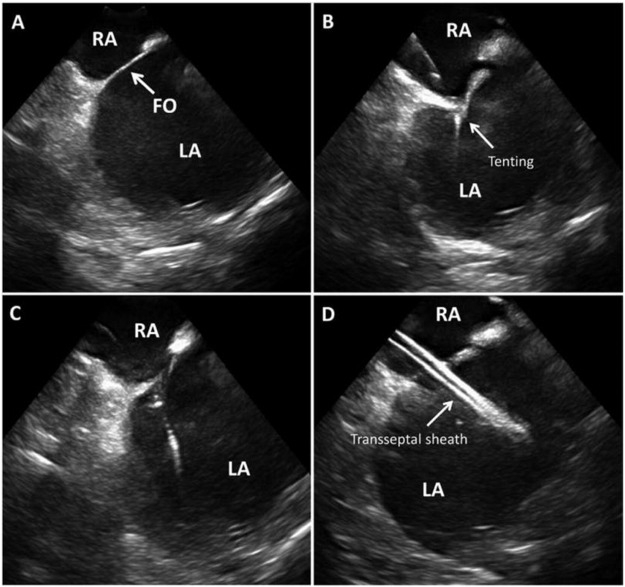
Рисунок 3: ДВС для трансэптального доступа ICE управляемый трансперегородный доступ, показывающий межпредсердную перегородку и овальную яму (FO) в (A), перегородку по мере вовлечения иглы (B), потерю палатки при пересечении иглы в (C), транссептальную оболочку в левом предсердии в D. Рисунок любезно предоставлен48 .
RA – Правое предсердие, LA – Левое предсердие, FO – Foramen Ovale
-
Артериальный доступ
- Получить доступ к бедренной артерии с помощью модифицированной методики Зельдингера с помощью ультразвука и ангиографического наведения на уровне головки бедренной кости. Вставьте 0,035-дюймовый направляющий провод.
- Рассмотрите возможность использования метода «предварительного закрытия» с использованием различных коммерчески доступных устройств закрытия сосудистого доступа до увеличения артериального доступа.
- Последовательно расширяют участок артериального доступа, соответствующий размеру выбранной артериальной канюли. Вставьте артериальную канюлю, удалите интродьюсер и направляющую проволоку, дождитесь обратного кровотечения, а затем зажмите. Закрепите канюлю на пациенте с помощью держателей.
-
Подключение компонентов
- Сделайте влажные и влажные соединения с канюлями , чтобы избежать введения каких-либо пузырьков воздуха в контур. Это важнейший шаг.
- Используйте соленое погружение или постоянную инфузию физиологического раствора («водопад») над двумя концами канюль по мере их соединения.
- Подключите транссептальную канюлю (венозную) к входному отверстию насоса, которое отмечено синим цветом, а артериальную канюлю к выходному отверстию насоса, которое отмечено красным цветом.
- Сначала снимите венозные зажимы и запустите насос (из блока контроллера). Затем отпустите другие зажимы последовательно, постоянно проверяя наличие воздуха, выпуская артериальный зажим последним.
- Отрегулируйте скорость насоса (регулируя обороты) для оптимизации потока. Подтвердите положение канюли под рентгеноскопией и TEE или ICE и закрепите схему для пациента.
- Поддерживайте терапевтическую антикоагуляцию (активированное время свертывания ACT в 180-220 с или активированное частичное тромбопластиновое время aPTT в 65-80 с) до тех пор, пока насос находится на месте, чтобы предотвратить тромбоз насоса и инсульт. Это важнейший шаг.
3. Установка системы шунтирования правого предсердия в легочную артерию (RAPAB)
- Запустите контроллер, загрунтуйте нижнюю камеру насоса и проверьте наличие пузырьков воздуха - те же шаги, что описано выше.
- Загрунтуйте верхнюю камеру насоса, проверьте наличие воздуха и зажмите его – те же шаги, что описано выше.
- Процедура для пациентов
- Получить венозный доступ к правой внутренней яремной (RIJ) вене с помощью модифицированной методики Зельдингера под ультразвуковым контролем.
- Вставьте катетер легочной артерии (ПА) с просветом 0,035 дюйма и переместите его к главному ПА непосредственно перед бифуркацией. Вставьте жесткую направляющую проволоку 0,035" и извлеките катетер PA.
- Антикоагулянт пациента (ACT > 250 с).
- Расширяйте венозный участок доступа последовательно, используя ступенчатые расширители, поставляемые в упаковке, до тех пор, пока не будет достигнут желаемый размер (29 французских или 31 французский).
- Вставьте венозную канюлю (например, ProtekDuo) на направляющую проволоку.
- Извлеките направляющий провод, дождитесь обратного кровотечения, а затем зажмите дистальный порт, который помечен как «Дистальный».
- Снимите колпачок гемостаза, дождитесь обратного кровотечения и зажмите проксимальный порт, который помечен как «Проксимальный». Закрепите канюлю для пациента с помощью швов.
- Проверьте канюли и сделайте соединения между насосом и канюлей.
- Подключите проксимальную канюлю к входному отверстию насоса, которое отмечено синим цветом, а дистальную канюлю к выходу насоса, которое отмечено красным цветом. Включите насос (от контроллера).
- Отпускайте зажимы последовательно, постоянно проверяя наличие пузырьков воздуха. Отрегулируйте скорость насоса (управляя оборотами) для оптимизации потока.
- Подтвердить положение канюли при рентгеноскопии (может использовать руководство TEE для подтверждения положения в главном ПА) и закрепить схему для пациента. Поддерживать терапевтическую антикоагуляцию (АКТ на 180-220 с; аПТТ на 65-80 с).
4. Удаление устройства
ПРИМЕЧАНИЕ: После того, как функция конечного органа пациента улучшилась, а гемодинамика оставалась стабильной либо при восстановлении ЛЖ, либо при передовых методах лечения, таких как длительное размещение / трансплантация LVAD, устройство может быть удалено.
- Перед извлечением устройства медленно повышайте скорость на 0,5 л / мин шагом, тщательно наблюдая за гемодинамикой, чтобы убедиться, что есть достаточный CO и нормальное давление наполнения с меньшей поддержкой (также известное как исследование спуска или поворота вниз).
- Выключите насос, как только исследование подготовки номера будет успешным.
- Убедитесь, что ACT < 150 секунд, прежде чем удалить артериальную канюлю. Подтянуть ранее поставленный внутрисосудистый шов для закупорки места артериотомии или ручное давление можно удерживать не менее 40 минут, чтобы обеспечить гемостаз.
- Выведите транссептальную канюлю в IVC и медленно удалите ее из бедренной вены. Нанесите рисунок 8 швов на венозный участок и дополнительно удерживайте ручное давление над участком для достижения гемостаза.
ПРИМЕЧАНИЕ: Дефект межпредсердной перегородки (ASD) обычно небольшой и не закрывается регулярно. - После процедуры выполнять непрерывный мониторинг гемодинамики пациента и функции конечного органа для обеспечения стабильности.
- Удаление РАПАБ.
- Подобно удалению LAFAB, когда функция конечного органа пациента стабилизировалась с восстановлением или расширенной терапией, медленно отключите насос на 0,5 л / мин, внимательно наблюдая за гемодинамикой.
- Выключите насос, когда исследование откатится успешно.
- После того, как ACT < 150 секунд, удалите венозную канюлю с шеи и поместите фигуру из 8 швов, чтобы закрепить место прокола. Удерживайте ручное давление в дополнение к шву для достижения полного гемостаза.
- После удаления внимательно следите за гемодинамикой пациента и функцией конечного органа для обеспечения стабильности.
| Сложность | Факторы риска | Сроки возникновения | Предосторожность | Управление |
| Перфорация сердца и тампонада | Непреднамеренное продвижение иглы или расширителя или оболочки вдоль задней свободной стенки левого предсердия. | Во время транссептической пункции, размещения приточной канюли | Точная оценка межпредсердной перегородки на TEE или ICE и оптимизация места и угла транссептической пункции с помощью ангиографии и эхо. | Немедленный перикардиоцентез для снятия тампонады. Может потребоваться хирургическое вмешательство. |
| Острая ишемия конечностей дистальнее артериальной канюляции | Сосуды малого калибра, в которых находятся крупные канюли, ранее существовавшие заболевания периферических артерий | Немедленно после процедуры | Периферическая ангиограмма перед канюляцией. | Установка дистального перфузионного катетера, помощь в сосудистой хирургии в тяжелых случаях. |
| Гемолиз, забрюшинное кровотечение, сосудистые осложнения, такие как образование псевдоаневризмы. | Более высокие скорости насоса, тромбоз насоса, ДВС-синдром, антикоагуляция | В любое время на насосе | Оптимизируйте скорость насоса для каждого пациента в отдельности. Избегайте супратерапевтических антикоагулянтов. | Снижение скорости насоса, поддержание терапевтического диапазона антикоагуляции. |
| Оптимальное место артериального доступа в головке бедренной кости в общей бедренной артерии. | ||||
| Остаточный дефект межпредсердной перегородки | Несколько попыток транссептального доступа | После деканнуляции | Гемодинамически значимые дефекты могут быть закрыты чрескожно. |
Таблица 1: Осложнения применения устройства LAFAB33.
Результаты
Клиническое применение устройства LAFAB
Техника и осуществимость чрескожной транспредсердной системы шунтирования левого желудочка были впервые описаны в 1960-х годах Dennis et al.11,12. Однако транссептальная пункция изначально не получила широкого р?...
Обсуждение
Гемодинамика аппарата LAFAB:
Гемодинамический профиль устройства LAFAB отличается от других пВАД. Дренируя кровь непосредственно из ЛОС и возвращая ее в бедренную артерию, устройство полностью обходит ЛЖ. При этом он уменьшает диастолический объем и давление на конце Р?...
Раскрытие информации
Сандип Натан - Раскрытие информации: Консультант, Abiomed, Getinge, CSI, Inc.
Александр Трусделл - Раскрытие информации: Консультант, Abiomed Inc.
Пунам Велагапуди - Раскрытие информации: Консультативный совет по Инициативе по охране здоровья женщин, Abiomed
Благодарности
Команде TandemHeart в LifeSparc.
Материалы
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Ссылки
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены