Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kardiyojenik Şok için Perkütan Ventrikül Yardımcı Cihazının/Sol Atriyumdan Femoral Arter Bypass Sistemine Kullanımı
Bu Makalede
Özet
Aşağıdaki makalede, CS'de sol ventrikülü (LV) atlayan ve destekleyen perkütan bir sol ventrikül destek cihazı (pLVAD) ve sol atriyal to femoral arter bypass (LAFAB) sistemi olan kardiyojenik şoka (CS) bir cihazın (örneğin Tandemheart) yerleştirilmesi için adım adım prosedür açıklanmaktadır.
Özet
Sol atriyal to femoral arter bypass (LAFAB) sistemi, kardiyojenik şokta (CS) kullanılan ve sol kulakçıktan (LA) kan boşaltıp femoral arter yoluyla sistemik arter dolaşımına geri döndürerek sol ventrikülü atlayan mekanik dolaşım destek (MCS) cihazıdır. Çanül büyüklüğüne bağlı olarak 2,5-5 L/dk arasında değişen akışlar sağlayabilir. Burada LAFAB'ın etki mekanizmasını, mevcut klinik verileri, kardiyojenik şokta kullanımına ilişkin endikasyonları, implantasyon adımlarını, prosedür sonrası bakımı ve bu cihazın kullanımı ve yönetimi ile ilişkili komplikasyonları tartışıyoruz.
Ayrıca, ekolofiyografik rehberlik altında transseptal delinme yoluyla cihazın yerleştirme öncesi hazırlanması, perkütan yerleştirilmesi ve cihaz parametrelerinin ameliyat sonrası yönetimi de dahil olmak üzere cihaz tedavisinin prosedürel bileşeninin kısa bir videosunu sunuyoruz.
Giriş
Kardiyojenik şok (CS), kalbin vücudun taleplerini karşılamak için yeterli kan ve oksijeni sağlayamadığı ve organ yetmezliğine neden olduğu eşlik eden hipotansiyonlu veya eşliksiz bir doku hipopripfüzyonu durumudur. Kardiyovasküler Anjiyografi ve Müdahaleler Derneği (SCAI) tarafından A'dan E'ye aşamalar halinde sınıflandırılır: A evresi - CS riski altındaki hastalar; B evresi - hipoperfüzyon olmadan hipotansiyon veya taşikardi ile CS'nin başlangıç aşamasındaki hastalar; aşama C - perfüzyonu korumak için inotroplar / vazopresörler veya mekanik destek gerektiren soğuk ve ıslak fenotipli klasik CS; aşama D - daha gelişmiş cihazlara yükseltme gerektiren mevcut tıbbi veya mekanik destekte bozulma; ve E evresi - dolaşım çökmesi ve refrakter aritmileri olan ve devam eden kardiyopulmoner resüsitasyon ile aktif olarak kalp durması yaşayan hastaları içerir1. CS'nin en sık nedenleri, yakın zamanda bildirilen bir analizde olguların% 81'ini temsil eden akut MI (AMI) ve akut dekomse edilmiş kalp yetmezliğidir (ADHF). CS klasik olarak tıkanıklık ve bozulmuş perfüzyon ile karakterizedir, yüksek dolum basınçları (pulmoner kılcal kama basıncı [PCWP], sol ventrikül uç-diyastolik basınç [LVEDP], merkezi venöz basınç [CVP] ve sağ ventrikül end-diyastolik basıncı [RVEDP]), azalmış kardiyak çıkış (CO), kardiyak indeks (CI), kardiyak güç çıkışı (CPO) ve son organ arızası3 ile kendini gösterir3 . Geçmişte, CS tarafından komplike olan AMI için mevcut tek tedaviler erken revaskülarizasyon ve inotroplar ve / veya vazopresörler ile tıbbi yönetimdi4. Daha yakın zamanda, mekanik dolaşım desteği (MCS) cihazlarının ortaya çıkması ve vazopresörlerin artmasının artan mortalite ile ilişkili olduğunun tanınmasıyla, hem AMI hem de ADHF ile ilgili CS5,6 tedavisinde bir paradigma değişikliği olmuştur.
Perkütan ventrikül destek cihazlarının (pVAD) mevcut çağında, oksijenasyon yeteneği olan ve olmayan, spor dışı veya biventriküler dolaşım ve ventrikül desteği sağlayan bir dizi MCS cihaz platformu / konfigürasyonu mevcuttur7. Hem AMI hem de ADHF CS'yi tedavi etmek için pVAD'lerin kullanımındaki istikrarlı artışlara rağmen, ölüm oranları büyük ölçüde değişmeden kalmıştır5. AMI8'de sol ventrikülün (LV) erken boşaltılmasına ve AMI CS9'da MCS'nin erken kullanımına olası klinik faydalar için ortaya çıkan kanıtlarla, MCS kullanımı artmaya devam ediyor.
Sol Atriyal to Femoral Arter Bypass (LAFAB) MCS cihazı sol kulakçıktan (LA) kan boşaltarak ve femoral arter yoluyla sistemik arter dolaşımına geri döndürerek LV'yi atlar (Şekil 1). Canüllerin büyüklüğüne bağlı olarak dakikada 2,5-5,0 litre (L/m) akış (LifeSPARC olarak belirlenen ve 8 L/m akışa kadarabilen yeni nesil pompa) sunan harici bir santrifüj pompa ile desteklenir. Kan, transseptal venöz kanül yoluyla LA'den çıkarıldıktan sonra, kanı femoral artere yerleştirilen arteriyel kanül yoluyla hastanın vücuduna geri döndüren dış santrifüj pompadan geçer.

Şekil 1: LAFAB kurulumu. Görüntü, LivaNova US Inc.'in tamamına sahip olduğu bir yan kuruluşu olan TandemLife'ın izniyle, bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Bu prosedür ve protokol kurumsal inceleme kurulu ve Amerika Birleşik Devletleri Gıda ve İlaç İdaresi (FDA) tarafından onaylanmıştır.
1. Hasta kriterleri
- SCAI konsensüs beyanında tanımlandığı gibi CS evresi B ve üzeri olan hastaları dahil edin1.
- D evre kalp yetmezliğinde nakil köprüsü veya dayanıklı sol ventrikül destek sistemi olarak dahil edin.
- CS tarafından karmaşık hale gelen AMI'de kurtarma köprüsü olarak dahil edin.
- Kontra-endikasyonu sistemik antikoagülasyona hariç tutun.
- Yaşam beklentisi <6 ay (aktif malignite) hariç tutun.
- LA trombüs varlığı varsa hariç tutun.
- Hastalarda büyük kanülleri barındıramayan küçük arterlere sahip periferik vasküler hastalık (PVD) varsa hariç tutun.
- Hastaların geri dönüşü olmayan nörolojik yaralanması/komaları varsa hariç tutun.
- Hastalarda ciddi aort yetersizliği (AI) varsa hariç tutun.
- Hastaların ventrikül septal defektleri (VSD) varsa hariç tutun.
NOT: LAFAB cihazının yerleştirilmesi üç ayrı işlem içerir: 1) kontrol cihazının ve pompanın kurulması; 2) transözofageal ekokardiyogram (TEE) veya intrakardiyak ekokardiyogram (ICE) altında arteriyel ve venöz kanüllerin ve transeptal erişimin yerleştirilmesi; ve 3) sistemi devreye bağlamak.
2. Sol atriyumun femoral arter bypass cihazına yerleştirilmesi
- Denetleyiciyi ayarlama
NOT: Hasta laboratuvara nakledilirken ve işlem için masa kurulurken bu adım gerçekleştirilebilir. Genellikle, cihaz temsilcisi ve perfüzyonist ekibi sürece yardımcı olmak için hazır bulunur.- Kutuyu açın ve aşağıdaki adımlarla denetleyici kurulumunu başlatın.
- Kumandayı açmadan önce, pil kapısını açarak kontrol cihazına 2 pil yerleştirin. Logoyu denetleyici ekranından uzağa bakacak şekilde yerleştirerek her pili takın. Pil üzerindeki oluk, anahtar pil muhafazasıyla hizalanmalıdır. Pillerin iyi oturduğundan emin olun.
- Diğer 2 pili de aynı işlemin ardından yuvaya takın.
- Kumandayı yuvaya takın, yuvaya tam olarak oturduğundan doğrulayın ve güç kablosunu elektrik prizine bağlayın ve AC gücü için duvar prizine takın. Denetleyici, AC gücüne bağlı yuvada çalışabilir veya yuvadan ayrıldığında pil gücü kullanarak çalışabilir.
- Kenetleyi ve kontrol cihazını kelepçeyi kullanarak intravenöz bir direğe monte edin.
- Yan taraftaki düğmeleri kullanarak kumandayı açın.
- Pompanın ayarlanması – Sistemin astarlanması
NOT: Pompa astarı iki kişi gerektirir - birincil operatör ovulmuş (steril operatör) ve steril alanda kalır. İkincil operatör (steril olmayan operatör), denetleyiciyi steril olmayan alanda işler. Pompa havalandırma çok önemli bir adımdır ve çok dikkatli bir şekilde yapılması gerekir.- İkincil operatörün paketi açmasını ve astar tepsisini birincil operatöre sunmasını sağlamak. Birincil operatörün steril örtünün açılmasını ve astar tepsisinin bileşenlerini steril tablaya koymasını sunun. Pompa, oksijenatör ve yeşil oksijen tüpü tepsiye dahildir.
- Birincil operatörün pompa tahrik hattını denetleyiciye takacak ikincil operatöre vermesini sağla.
- Steril operatörün boru üzerindeki koruyucu kapakları çıkarmasını ve uçlarını havzaya yerleştirmesini sasın. Mavi boru, mavi bağlantı noktasına giren giriş tüpüdür. Kırmızı boru, havzanın kırmızı limanına giren çıkış tüpüdür.
- Havzayı mavi bağlantı noktasından geriye ve uzağa eğik olarak doldurmaya hazır konuma yerleştirin.
- İkincil operatörün havzayı 4 litre salinle doldurmasını sasın.
- Birincil operatörün havzayı kaldırmasını ve pompayı yerçekimine hazır konuma geri eğmesini sağla.
- Tüm havanın borudan ve pompadan çıkarıldığından emin olun. Küçük hava kabarcıklarını çıkarmak için boruya ve pompaya hafifçe dokunun. Bu çok önemli bir adım.
- Daha sonra pompayı steril olmayan uçtan açın.
- Oksijenatöre hafifçe dokunarak ve hava kabarcıklarının yükselmesi ve dışarı kaçması için çıkış borularını daha yüksek bir seviyeye (saat 12 pozisyonunda) konumlandırarak oksijenatördeki küçük hava kabarcıklarını çıkarın.
- Tüm hava kabarcıkları çıkarıldıktan sonra pompayı durdurun.
- Giriş ve çıkış borularını kelepçeleyin. Giriş ve çıkış borusunu havzadan çıkarın ve ardından yeşil oksijen kaynağı borusunu oksijenatördeki bağlantı noktasındaki gaza takın. Devre hazır.
- Transseptal erişim10,32
- Hastayı steril bir şekilde hazırlayın ve örtün.
- Anestezi ekibi ile genel anestezi altında işlemi gerçekleştirin.
- Hasta yeterince entübe edilip yatıştırıldıktan sonra TEE probini yemek borusuna geçirin ve temel görüntüleri elde edin. ICE kullanıyorsanız, venöz erişimden sonra görüntüleri elde edin.
- TEE veya ICE kullanarak atriyal septum (IAS) üzerinde septostomi için ideal noktayı belirleyin. IAS'yi daha iyi göstermek için TEE'de IAS'nin fossa ovalis bölgesindeki membranöz kısmını gösteren iki eşli görünümü kullanın.
- GIRIŞ kanülünün TEE veya ICE kullanılarak konumlandırılacağı LA'de herhangi bir trombüs olmadığını onaylayın.
- Modifiye Seldinger tekniği ile ultrason rehberliği ile femoral venöz erişim elde edin ve 0.035" kılavuz tel takın
- Kılavuz telini alt vena kavasına (IVC) ilerletin - sağ atriyal kavşak ve ardından floroskopik ve TEE veya ICE rehberliğinde IAS'ye doğru yönlendirin. Birden fazla anjiyografik projeksiyon (Sağ veya Sol Ön Eğik) kullanarak transeptal delinme için en uygun bölgeyi tanımlayın. İdeal olarak, komplikasyonları en aza indirmek için foramen ovale bölgesinde yapılmalıdır. Kalın veya anevrizmal septa veya daha önce cerrahi olarak yamalı veya alet edilmiş veya perkütan olarak kapatılmış bir IAS'li hastalarda, iğne sapması olmadan hassas delinmeyi sigortalamak için enerjik veya radyofrekans transseptal iğne kullanmayı düşünebilir.
- Hastayı antikoagülat (250 saniyeden fazla ACT). Transseptal iğne kullanarak transseptal delinme gerçekleştirin, LA'ye kılavuz tel yerleştirin.
- Venöz erişimi ve IAS'yi 2 aşamalı bir dilatörle genişletin. Transseptal kanülleri yerleştirin ve LA'ye ilerletin, indeksleyiciyi ve kılavuz telini çıkarın, geri kanamayı bekleyin ve kelepçeleyin. Hastaya güvenli bir şekilde canül.
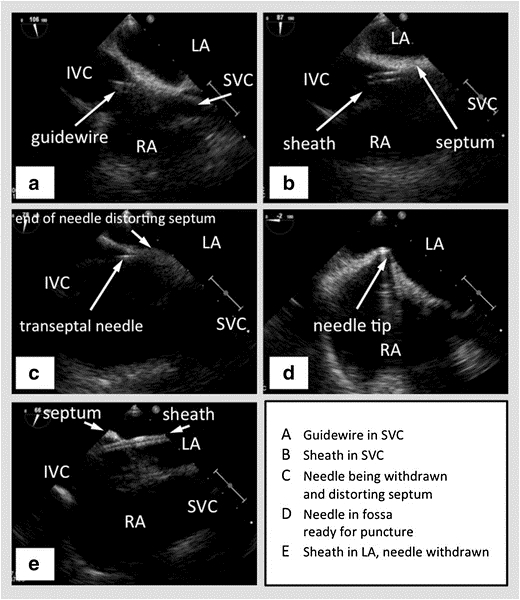
Şekil 2: SVC'yi sağa, ortası sol atriyum yukarıda ve sağ kulakçık aşağıda ve IVC'yi sola doğru gösteren iki taraflı görünümde çift kanatlı TEE. (A) - SVC'ye geçen kılavuz tel. (B) - SVC'ye telin üzerinden geçen kılıt. (C) - Kılıktan geçen transseptal iğne. (D) - Transseptal iğne interatrial septum çadır. (E) - İğne çekildikten sonra interatrial septumdan sol kulakçığa geçen kılıt. Resim nezaket47
SVC – Superior Vena Cava, IVC – Alt Vena Cava, RA – Sağ Atriyum, LA – Sol Atriyum
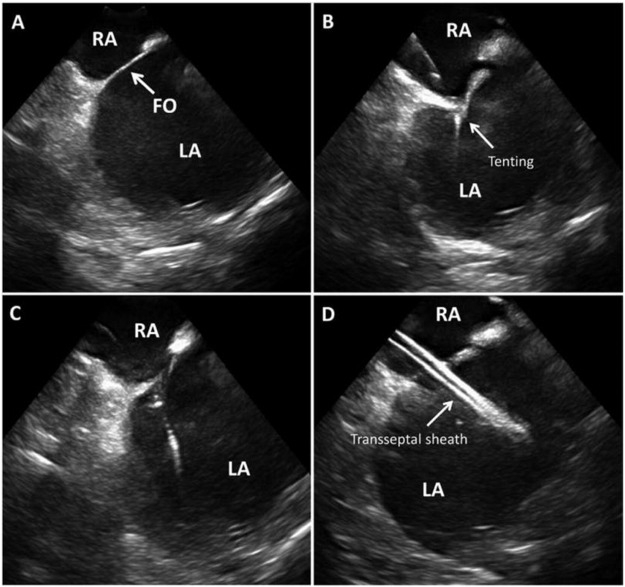
Şekil 3: Transeptal erişim için ICE güdümlü trans septal erişim (A) içinde atriyal septum ve fossa ovalis (FO), iğne (B) ile meşgul olarak septal çadırlaşma, iğne (C) ile geçerken çadır kaybı, D. Picture courtesy48'de sol kulakçıkta transseptal kılım.
RA – Sağ Atriyum, LA – Sol Atriyum, FO – Foramen Ovale
-
Arteriyel erişim
- Femoral kafa düzeyinde ultrason ve anjiyografik rehberlik kullanarak modifiye Seldinger tekniği ile femoral arteriyel erişim elde edin. 0,035" kılavuz tel takın.
- Arteriyel erişimi yükseltmeden önce piyasada bulunan çeşitli vasküler erişim kapatma cihazlarını kullanarak "ön kapama" tekniğini kullanmayı düşünün.
- Seçilen arteriyel kanül boyutuna uygun arteriyel erişim bölgesini seri olarak genişletin. Arteriyel kanülleri yerleştirin, indeksi ve kılavuz telini çıkarın, geri kanamayı bekleyin ve sonra kelepçeleyin. El tutucuları kullanarak hastaya canülleri sabitleyin.
-
Bileşenleri bağlama
- Devrede herhangi bir hava kabarcığı girmesini önlemek için canüllere ıslaktan ıslaka bağlantılar kurun. Bu çok önemli bir adım.
- Bağlı oldukları için kanüllerin iki ucu üzerinde salin daldırma veya sürekli salin ("şelale") infüzyonu kullanın.
- Transseptal kanülü (venöz) mavi ile işaretlenmiş pompa girişine ve arteriyel kanülü kırmızı ile işaretlenmiş pompa çıkışına bağlayın.
- İlk olarak, venöz kelepçeleri çıkarın ve pompayı başlatın (kontrol kutusundan). Daha sonra diğer kelepçeleri sırayla serbest bırakın, sürekli olarak herhangi bir hava olup olmadığını kontrol edin, arteriyel kelepçeyi en son serbest bırakın.
- Akışı optimize etmek için pompa hızını (RPM'leri ayarlayarak) ayarlayın. Kanülün floroskopi ve TEE veya ICE altındaki konumunu onaylayın ve devreyi hastaya sabitleyin.
- Pompa trombozu ve inmeyi önlemek için pompa yerinde olduğu sürece terapötik antikoagülasyonu (aktif pıhtılaşma süresi ACT 180-220'lerde ACT veya 65-80'lerde aktif kısmi tromboplastin süresi aPTT) sürdürmektedir. Bu çok önemli bir adım.
3. Pulmoner Arter Bypass (RAPAB) sistem yerleşimine sağ atriyum
- Kontrol cihazını başlatın, pompanın alt odasını astarın ve hava kabarcıklarını kontrol edin - yukarıda açıklanan adımlarla aynı.
- Pompanın üst haznesini astarla, herhangi bir hava olup olmadığını kontrol edin ve kelepçeleyin - yukarıda açıklandığı gibi aynı adımlar.
- Hasta prosedürü
- Ultrason rehberliğinde modifiye Seldinger tekniği ile sağ iç juguler (RIJ) damarda venöz erişim elde edin.
- 0,035" lümenli bir Pulmoner Arter (PA) Kateteri yerleştirin ve çatallanmadan hemen önce ana PA'ya ilerletin. Sert gövdeli 0,035" kılavuz tel takın ve PA Kateteri çıkarın.
- Hastayı antikoagülat (ACT > 250 s).
- İstenilen boyuta (29 Fransızca veya 31 Fransızca) ulaşılana kadar pakette sağlanan adım adım dilatörleri kullanarak venöz erişim sitesini sırayla genişletin.
- Venöz kavunu (örneğin ProtekDuo) kılavuz telin üzerine yerleştirin.
- Kılavuz telini çıkarın, geri kanamayı bekleyin ve ardından "Distal" olarak işaretlenmiş distal bağlantı noktasını sıkıştırın.
- Hemostaz kapağını çıkarın, geri kanamayı bekleyin ve "Proksimal" olarak işaretlenmiş proksimal bağlantı noktasını sıkıştırın. Tedavi yoluyla hastaya kavunları sabitleyin.
- Canülleri doğrulayın ve pompadan canüle ıslaktan ıslaka bağlantılar yapın.
- Proksimal canül mavi ile işaretlenmiş pompa girişine ve distal canül kırmızı ile işaretlenmiş pompa çıkışına bağlayın. Pompayı açın (kontrol ünitesinden).
- Kelepçeleri ardışık olarak serbest bırakın, sürekli olarak hava kabarcıklarını kontrol edin. Akışı optimize etmek için pompa hızını (RPM'leri kontrol ederek) ayarlayın.
- Floroskopi altında kanonula pozisyonunu onaylayın (ana PA'daki pozisyonu onaylamak için TEE kılavuzunu kullanabilir) ve devreyi hastaya sabitleyin. Terapötik antikoagülasyonu koruyun (180-220 s'de ACT; 65-80 s'de aPTT).
4. Cihazın çıkarılması
NOT: Hastanın son organ fonksiyonu düzeldikten ve hemodinamik LV iyileşmesi veya dayanıklı LVAD yerleştirme/nakil gibi ileri tedavilerle sabit kaldıktan sonra cihaz çıkarılabilir.
- Cihazı çıkarmadan önce, hızı adım adım 0,5 L / dk yavaşça kısın, daha az destekle yeterli CO ve normal dolum basınçları olduğundan emin olmak için hemodinamikleri dikkatlice gözlemleyin (rampa aşağı veya çalışmayı kısma olarak da bilinir).
- Geri dönüş çalışması başarılı olduktan sonra pompayı kapatın.
- Arteriyel kanülleri çıkarmadan önce ACT'nin 150 saniye < emin olun. Arteriyotomi bölgesini tıkamak için önceden yerleştirilen intravasküler sütürleri sıkın veya hemostazdan emin olmak için manuel basınç en az 40 dakika tutulabilir.
- Transseptal kanülleri IVC'ye çekin ve femoral damardan yavaşça çıkarın. Venöz bölgeye 8 dikişli bir şekil uygulayın ve ayrıca hemostaz elde etmek için site üzerinde manuel basınç tutun.
NOT: Atriyal septal defekt (ASD) genellikle küçüktür ve rutin olarak kapatılmaz. - İşlem sonrası, hastanın hemodinamik sürekli izlenmesini ve stabiliteyi sağlamak için organ fonksiyonunun sona ermesini sağlayın.
- RAPAB'ın kaldırılması.
- LAFAB çıkarılmasına benzer şekilde, hastanın son organ fonksiyonu iyileşme veya ileri tedavilerle stabilize olduğunda, pompayı yavaşça 0,5 L / dk kısın ve hemodinamikleri dikkatlice gözlemleyin.
- Geri çevirme çalışması başarılı olduğunda pompayı kapatın.
- ACT 150 saniye < sonra, venöz damarı boyundan çıkarın ve delinme bölgesini sabitlemek için 8 dikiş gibi bir rakam yerleştirin. Tam hemostaz elde etmek için dikişe ek olarak manuel basınç tutun.
- Post-çıkarma, hastanın hemodinamik ve son organ fonksiyonlarını yakından izleyerek stabiliteyi sağlayın.
| Komplikasyon | Risk faktörleri | Oluşumun zamanlaması | Önlem | Yönetim |
| Kardiyak perforasyon ve tamponalat | Sol atriyumun arka serbest duvarı boyunca iğne veya dilatör veya kılıfın yanlışlıkla ilerlemesi. | Transseptal delinme sırasında, giriş kanülünün yerleştirilmesi | TEE veya ICE'de atriyal septumun doğru değerlendirilmesi ve anjiyografi ve eko yoluyla transseptal delinmenin bölgesinin ve açısının optimize edilmesi. | Tamponatı hafifletmek için acil perikardiyosentez. Cerrahi müdahale gerekebilir. |
| Akut uzuv iskemi distal arteriyel kanülasyon | Büyük kanülleri barındıran küçük kalibreli kaplar, önceden var olan periferik arteriyel hastalık | Prosedürü hemen deftere naklet | Canülasyondan önce periferik anjiyogram. | Distal perfüzyon kateterinin yerleştirilmesi, ağır vakalarda damar cerrahisi yardımı. |
| Hemoliz, retroperitoneal kanama, psödoanevrizma oluşumu gibi damar komplikasyonları. | Daha yüksek pompa hızları, pompa trombozu, DIC, antikoagülasyon | Pompada her zaman | Pompa hızını her hasta için ayrı ayrı optimize edin. Supratherapeutic antikoagülasyondan kaçının. | Pompa hızını azaltmak, terapötik antikoagülasyon aralığını korumak. |
| Ortak femoral arterde femoral kafada arteriyel erişimin optimal yeri. | ||||
| Artık atriyal septal defekt | Transseptal erişim için birden fazla deneme | Dekannülasyondan sonra | Hemodinamik olarak önemli kusurlar perkütan olarak kapatılabilir. |
Tablo 1: LAFAB cihazının komplikasyonları33.
Sonuçlar
LAFAB cihazının klinik uygulamaları
Perkütan trans-atriyal sol ventrikül bypass sisteminin tekniği ve fizibilitesi ilk olarak 1960'larda Dennis ve ark.11,12 tarafından tanımlanmıştır. Ancak transseptal delinme, septostomi tekniği ile komplikasyonlar nedeniyle başlangıçta yaygın olarak benimsenmemiştir. Son on yılda, perkütan müdahaleler alanındaki gelişmelerle, operatörler transseptal ventrikül destek cihazının veya L...
Tartışmalar
LAFAB cihazının hemodinamikleri:
LAFAB cihazının hemodinamik profili diğer pVAD'lardan farklıdır. Kanı doğrudan LA'den boşaltarak ve uyluk atardamarlarına geri döndürerek, cihaz LV'yi tamamen atlar. Bunu yaparken, LV uç diyastolik hacmini ve basıncını azaltarak gelişmiş LV geometrisine katkıda bulunur ve böylece LV strok çalışmalarında bir azalmayı etkiler. Bununla birlikte, kanı iliak artere geri döndürerek / alçalan aort, artçı yük artar. Bu, LV'nin ...
Açıklamalar
Sandeep Nathan - Açıklamalar: Danışman, Abiomed, Getinge, CSI, Inc.
Alexander Truesdell - Açıklamalar: Danışman, Abiomed Inc.
Poonam Velagapudi - Açıklamalar: Kadın Sağlığı girişimi danışma kurulu, Abiomed
Teşekkürler
LifeSparc'taki TandemHeart ekibine.
Malzemeler
| Name | Company | Catalog Number | Comments |
| For LAFAB (TandemHeart) | |||
| Factory Supplied Equipment for circuit connections. | TandemLife | ||
| ProtekSolo 15 Fr or 17 Fr Arterial Cannula | TandemLife | ||
| ProtekSolo 62 cm or 72 cm Transseptal Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump | |
| For RAPAB (ProtekDuo) | |||
| Factory Supplied Equipment to complete the circuit. | TandemLife | ||
| ProtekDuo 29 Fr or 31 Fr Dual Lumen Cannula | TandemLife | ||
| TandemHeart Controller | TandemLife | For adjusting flows/RPM | |
| TandemHeart Pump | LifeSPARC | Centrifugal pump |
Referanslar
- Baran, D. A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Harjola, V. -. P., et al. Clinical picture and risk prediction of short-term mortality in cardiogenic shock. European Journal of Heart Failure. 17 (5), 501-509 (2015).
- Furer, A., Wessler, J., Burkhoff, D. Hemodynamics of Cardiogenic Shock. Interventional Cardiology Clinics. 6 (3), 359-371 (2017).
- Hochman, J. S., et al. Cardiogenic shock complicating acute myocardial infarction--etiologies, management and outcome: a report from the SHOCK Trial Registry. SHould we emergently revascularize Occluded Coronaries for cardiogenic shocK. Journal of the American College of Cardiology. 36 (3), 1063-1070 (2000).
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Alkhouli, M., et al. Mechanical Circulatory Support in Patients with Cardiogenic Shock. Current Treatment Options in Cardiovascular Medicine. 22 (2), 4 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Alkhouli, M., Rihal, C. S., Holmes, D. R. Transseptal Techniques for Emerging Structural Heart Interventions. JACC: Cardiovascular Interventions. 9 (24), 2465-2480 (2016).
- Dennis, C., et al. Clinical use of a cannula for left heart bypass without thoracotomy: experimental protection against fibrillation by left heart bypass. Annals of Surgery. 156 (4), 623-637 (1962).
- Dennis, C., et al. Left atrial cannulation without thoracotomy for total left heart bypass. Acta Chirurgica Scandinavica. 123, 267-279 (1962).
- Fonger, J. D., et al. Enhanced preservation of acutely ischemic myocardium with transseptal left ventricular assist. Annals of Thoracic Surgery. 57 (3), 570-575 (1994).
- Thiele, H., et al. Reversal of cardiogenic shock by percutaneous left atrial-to-femoral arterial bypass assistance. Circulation. 104 (24), 2917-2922 (2001).
- Burkhoff, D., et al. A randomized multicenter clinical study to evaluate the safety and efficacy of the TandemHeart percutaneous ventricular assist device versus conventional therapy with intraaortic balloon pumping for treatment of cardiogenic shock. American Heart Journal. 152 (3), 469 (2006).
- Thiele, H., et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. European Heart Journal. 26 (13), 1276-1283 (2005).
- Gregoric, I. D., et al. TandemHeart as a rescue therapy for patients with critical aortic valve stenosis. Annals of Thoracic Surgery. 88 (6), 1822-1826 (2009).
- Kar, B., et al. The percutaneous ventricular assist device in severe refractory cardiogenic shock. Journal of the American College of Cardiology. 57 (6), 688-696 (2011).
- Patel, C. B., Alexander, K. M., Rogers, J. G. Mechanical Circulatory Support for Advanced Heart Failure. Current Treatment Options in Cardiovascular Medicine. 12 (6), 549-565 (2010).
- Tempelhof, M. W., et al. Clinical experience and patient outcomes associated with the TandemHeart percutaneous transseptal assist device among a heterogeneous patient population. Asaio Journal. 57 (4), 254-261 (2011).
- Gregoric, I. D., et al. The TandemHeart as a bridge to a long-term axial-flow left ventricular assist device (bridge to bridge). Texas Heart Institute Journal. 35 (2), 125-129 (2008).
- Bruckner, B. A., et al. Clinical experience with the TandemHeart percutaneous ventricular assist device as a bridge to cardiac transplantation. Texas Heart Institute Journal. 35 (4), 447-450 (2008).
- Agarwal, R., et al. Successful treatment of acute left ventricular assist device thrombosis and cardiogenic shock with intraventricular thrombolysis and a tandem heart. Asaio Journal. 61 (1), 98-101 (2015).
- Vetrovec, G. W. Hemodynamic Support Devices for Shock and High-Risk PCI: When and Which One. Current Cardiology Reports. 19 (10), 100 (2017).
- Al-Husami, W., et al. Single-center experience with the TandemHeart percutaneous ventricular assist device to support patients undergoing high-risk percutaneous coronary intervention. Journal of Invasive Cardiology. 20 (6), 319-322 (2008).
- Vranckx, P., et al. Clinical introduction of the Tandemheart, a percutaneous left ventricular assist device, for circulatory support during high-risk percutaneous coronary intervention. International Journal of Cardiovascular Interventions. 5 (1), 35-39 (2003).
- Vranckx, P., et al. The TandemHeart, percutaneous transseptal left ventricular assist device: a safeguard in high-risk percutaneous coronary interventions. The six-year Rotterdam experience. Euro Intervention. 4 (3), 331-337 (2008).
- Vranckx, P., et al. Assisted circulation using the TandemHeart during very high-risk PCI of the unprotected left main coronary artery in patients declined for CABG. Catheterization and Cardiovascular Interventions. 74 (2), 302-310 (2009).
- Thomas, J. L., et al. Use of a percutaneous left ventricular assist device for high-risk cardiac interventions and cardiogenic shock. Journal of Invasive Cardiology. 22 (8), 360 (2010).
- Vranckx, P., et al. Assisted circulation using the Tandemhear , percutaneous transseptal left ventricular assist device, during percutaneous aortic valve implantation: the Rotterdam experience. Euro Intervention. 5 (4), 465-469 (2009).
- Pitsis, A. A., et al. Temporary assist device for postcardiotomy cardiac failure. The Annals of Thoracic Surgery. 77 (4), 1431-1433 (2004).
- Singh, G. D., Smith, T. W., Rogers, J. H. Targeted Transseptal Access for MitraClip Percutaneous Mitral Valve Repair. Interventional Cardiology Clinics. 5 (1), 55-69 (2016).
- Subramaniam, A. V., et al. Complications of Temporary Percutaneous Mechanical Circulatory Support for Cardiogenic Shock: An Appraisal of Contemporary Literature. Cardiology and Therapy. 8 (2), 211-228 (2019).
- Morley, D., et al. Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data. The Journal of Thoracic and Cardiovascular Surgery. 133 (1), 21-28 (2007).
- Naidu, S. S. Novel Percutaneous Cardiac Assist Devices. Circulation. 123 (5), 533-543 (2011).
- Kapur, N. K., et al. Hemodynamic Effects of Left Atrial or Left Ventricular Cannulation for Acute Circulatory Support in a Bovine Model of Left Heart Injury. ASAIO Journal. 61 (3), 301-306 (2015).
- Smith, L., et al. Outcomes of patients with cardiogenic shock treated with TandemHeart percutaneous ventricular assist device: Importance of support indication and definitive therapies as determinants of prognosis. Catheterization and Cardiovascular Interventions. 92 (6), 1173-1181 (2018).
- Ergle, K., Parto, P., Krim, S. R. Percutaneous Ventricular Assist Devices: A Novel Approach in the Management of Patients With Acute Cardiogenic Shock. The Ochsner Journal. 16 (3), 243-249 (2016).
- Sultan, I., Kilic, A., Kilic, A.Short-Term Circulatory and Right Ventricle Support in Cardiogenic Shock: Extracorporeal Membrane Oxygenation, Tandem Heart, CentriMag, and Impella. Heart Failure Clinics. 14 (4), 579-583 (2018).
- Bermudez, C., et al. . Percutaneous right ventricular support: Initial experience from the tandemheart experiences and methods (THEME) registry. , (2018).
- Aggarwal, V., Einhorn, B. N., Cohen, H. A. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheterization and Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Kapur, N. K., et al. Mechanical Circulatory Support for Right Ventricular Failure. JACC: Heart Failure. 1 (2), 127-134 (2013).
- Geller, B. J., Morrow, D. A., Sobieszczyk, P. Percutaneous Right Ventricular Assist Device for Massive Pulmonary Embolism. Circulation: Cardiovascular Interventions. 5 (6), 74-75 (2013).
- Bhama, J., et al. Initial Experience with a Percutaneous Dual Lumen Single Cannula Strategy for Temporary Right Ventricular Assist Device Support Following Durable LVAD Therapy. The Journal of Heart and Lung Transplantation. 35 (4), 323 (2013).
- O'Neill, B., et al. Right ventricular hemodynamic support with the PROTEKDuo Cannula. Initial experience from the tandemheart experiences and methods (THEME) registry category. Miscellaneous. , (2018).
- O’Brien, B., et al. Fluoroscopy-free AF ablation using transesophageal echocardiography and electroanatomical mapping technology. Journal of Interventional Cardiac Electrophysiology. 50 (3), 235-244 (2017).
- O’Brien, B., et al. Transseptal puncture — Review of anatomy, techniques, complications and challenges. International Journal of Cardiology. 233, 12-22 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır