このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
冠動脈動脈硬化の光コヘレンス断層撮影法による生体力学的流体構造相互作用解析
要約
心筋梗塞が起こる前に介入を導くために冠状血管系でどのアテローム硬化性病変が進行するかを決定する必要がある。この記事では、この進行を予測するのに役立つ市販の有限要素ソルバーで流体構造相互作用技術を使用した光コヘレンス断層撮影による動脈の生体力学的モデリングについて概説します。
要約
本論文では冠状血管系におけるアテローム硬化性プラークの生体力学的解析のための完全なワークフローを提示する。アテローム性動脈硬化症は、世界的な死、罹患率、経済的負担の主要な原因の1つとして、その進行を分析し予測する新しい方法が必要です。このような計算方法の1つは、血流と動脈/プラークドメインの相互作用を分析するための流体構造相互作用(FSI)の使用である。 インビボ イメージングと組み合わせることで、このアプローチは各患者に合わせて調整することができ、安定したプラークと不安定なプラークの区別を助けることができます。血管内の光コヘレンス断層撮影(OCT)と侵襲性冠動脈血管造影(ICA)を用いた3次元再構成プロセスの概要を説明します。動脈の立体的な動きを複製することを含むシミュレーションの境界条件の抽出は、セットアップと分析が商業的有限要素ソルバーで行われる前に議論される。動脈壁の超弾性特性と脈動性の血液速度/圧力を記述する手順を、2つのドメイン間のシステム結合を設定するとともに概説する。心筋梗塞後の患者における非犯人、軽度のステノーチン性、脂質が豊富なプラークを分析することによって、この手順を実証する。壁せん断応力や局所的な正常化されたヘリシティなどのアテローム硬化性プラーク進行に関連する確立および新興マーカーがそれぞれ議論され、動脈壁およびプラークの構造的応答に関連する。最後に、結果を潜在的な臨床的関連性に変換し、限界について議論し、さらなる発展のための領域を概説します。本論文に記載された方法は、アテローム硬化性進行のリスクがある部位の決定を支援するための約束を示しており、したがって、アテローム性動脈硬化症の重大な死亡、罹患率および経済的負担の管理に役立つ可能性がある。
概要
冠動脈疾患(CAD)は、心臓病の最も一般的なタイプであり、世界的に死亡および経済的負担の主要な原因の1つである1,2。米国では、およそ8人に1人がCAD3、4に起因し、CADによる世界的な死亡者のほとんどが低所得国と中所得国5で見られる。アテローム性動脈硬化症はこれらの死亡の主な原動力であり、冠状動脈閉塞および急性心筋梗塞(AMI)6につながるプラーク破裂または浸食を伴う。冠動脈病変の再血管化後も、患者はAMI後に再発性主要有害心血管イベント(MACE)の実質的なリスクを有し、主に破裂に対しても脆弱である他の非犯系プラークの存在に起因する7。冠動脈内イメージングは、これらの高リスクプラーク8を検出する機会を提供する。血管内超音波(IVUS)は、プラークの体積を評価するためのゴールドスタンダードであるが、光学コヘレンス断層撮影(OCT)の高解像度(10〜20 μm)とは対照的に、脆弱なプラークの微細構造特徴を同定する分解能が限られている。大きな脂質プールを覆う薄く炎症を起こした繊維状のキャップは、脆弱なプラーク9の最も重要な署名であることが実証されており、現在利用可能な冠動脈内画像化モダリティ10の中でOCTによって最もよく同定され、測定される。重要なことに、OCTは、脂質アークを含む他の高リスクプラークの特徴を評価することもできる。マクロファージ浸潤;薄いキャップ線維症(TCFA)の存在は、過部の薄い線維性キャップ(<65 μm)を有する脂質が豊富なコアとして定義される。汚い石灰化;とプラークマイクロチャネル。非犯系プラークポストAMIにおけるこれらの高リスク機能のOCT検出は、将来のMACE11の最大6倍のリスク増加リスクに関連している。しかし、それにもかかわらず、血管造影とOCTイメージングの能力は、どの冠動脈プラークが進行し、最終的には破裂または浸食を予測する能力が限られており、陽性の予測値はわずか20%〜30%8である。この限られた予測能力は、非犯人のプラークを治療する(例えば、ステントで)7,12の周りの臨床的意思決定を妨げる。
患者の要因およびプラークの生物学的特徴に加えて、冠動脈における生体力もまた、プラーク進行および不安定性13の重要な決定要因である。これらの力を総合的に評価する上での約束を示す一つの手法は、流体構造相互作用(FSI)14シミュレーションである。壁せん断応力(WSS)は、内皮剪断応力とも呼ばれ、冠動脈バイオメカニクス研究15の伝統的な焦点であり、WSSがアテローム性動脈硬化症形成16において病因的役割を果たしていることを一般的に理解している。主に計算流体力学(CFD)技術を用いてシミュレートされ、低WSS領域は、内肉肥厚17と関連付けられており、血管再モデリング18および病変進行19および将来のMACE20の予測とが関連している。これらの分析の最近の進歩は、WSSの大きさ単独よりもアテローム性動脈硬化症リスクのより良い予測因子として、基礎となるWSSベクトルフィールドトポロジー21とその多方向特性22を示唆している。しかし、WSSは内腔壁の全体的な生体力学的システムを垣間見るだけで、イメージングモダリティと同様に、1つの生体メカニカルメトリックは高リスクのアテローム硬化性特徴を確実に識別することはできません。
さらなる指標は、アテローム性動脈硬化症形成において潜在的に重要なものとして浮上している。このような例の一つである内流動特性23は、らせん流れを用いて、種々の指標24を通じて定量化し、乱れた流れパターン25,26を抑制してアテローム保護役割を果たすように示唆される。CFD技術はこれらの流れの特徴を分析し、有用な結果の広い範囲を提示することができるが、彼らは血流、動脈構造および一般的な心臓運動間の根本的な相互作用を考慮しない。この動的システムを硬直壁に単純化すると、繊維状のキャップ応力などの潜在的に重要な結果が見逃されます。CFDに対するFSIの必要性に対する議論は27、28、29を続けていますが、多くの比較は心室機能の影響を含むのを無視しています。この制限は、心室機能の影響を通じて動脈に及ぶ動的な曲げおよび圧迫が、WSS30、31、32などの流量メトリックと同様にプラークおよび動脈構造ストレスに大きな影響を与えることができることを示したFSIで克服することができる。これは、構造応力がプラーク破裂33,34を分析および予測するための重要な指標であり、プラーク増加14,35の領域と共に位置付けることを示唆しているので重要である。これらの相互作用を捉えるので、冠状動脈環境の表現と疾患進行の潜在的なメカニズムが可能になります。
これに対処し、ここでは、OCTイメージング36 から患者固有の幾何学を開発するプロセスと、市販の有限要素ソルバーを用いた動脈FSIシミュレーションの設定と実行について概説する。ルーメン、脂質および外動脈壁を手動で抽出するプロセスは、患者の動脈の三次元計算再構成の前に詳述される。我々は、シミュレーションのセットアップ、カップリング、ベースラインの比較のプロセス、および病変進行を決定するためのフォローアップOCTイメージングパラメータの概要を説明する。最後に、数値結果の後処理と、これらのデータが病変進行/回帰と生体力学的結果を比較することによって、どのように臨床的関連性を持つ可能性があるかについて議論する。全体的な方法は、非犯人に実証されています, 高血圧、2型糖尿病、肥満(BMI32.6)および早期CADの家族歴において急性非ST上昇心筋梗塞を呈した58歳の白人男性患者の右冠動脈(RCA)における軽度のステノニック、脂質豊富なプラークを最初に行った。 そして12ヶ月後に進行中の臨床試験の一環として(COCOMO-ACS試験ACTRN126180008009235)。この技術は、進行のリスクが高い冠状動脈プラークを同定するために、さらに洗練され、使用できることを期待しています。
プロトコル
以下の非同定データは、進行中のCOCOMO-ACS無作為化比較試験(ACTRN12618000809235;;)に採用された患者から分析された。ロイヤルアデレード病院HREC参照番号:HREC/17/RAH/366)、中央アデレード地域保健ネットワーク(CALHN)研究サービスが生体機械シミュレーションを目的として付与した追加の倫理承認(CALHN参照番号14179)。 図 1 は、FSI 対応のソフトウェアまたはコードに適用できる、次のプロトコルで概説されているワークフロー全体を示しています。
1. 画像評価
- 分岐などの解剖学的ランドマークを使用してベースラインとOCTのフォローアップ画像を一致させ、遠位分岐に直ちに近位画像を使用し、最も近位の分岐に遠位します。これらのランドマーク間の一致した画像は、 図 2Aで説明するように分析される必要があります。
- OCT ルーメン断面
- 各 OCT イメージをイメージ デジタイザにロードし、カテーテルの中心点とスケールの限界をマークするをクリックします(図 2B)。これらのポイントをエクスポートして、後で使用します。
- 手動で、すべての画像の同じ位置から始めて、ルーメンの曲線をできるだけ正確にキャプチャするように、ルーメンのエッジをマークします。再構築プロセスが後の段階でこの領域を補間するので、カテーテルのアーティファクトにギャップを残します。これらのファイル.dat形式でエクスポートし、すべての画像に対してこれを繰り返します。
- OCT 外壁と脂質
- DICOMソフトウェアでは、 外壁の可視部分を使用して外壁を高減衰領域に抽出し、手動で楕円をフィットさせ、外壁の位置を推定する。マウスの左ボタンをクリックしてドラッグし、楕円を定義し、適切な位置に合わせて配置します。
- 図3に示すように、図3に示すように、脂質アークを手動で定義し、角度と距離の測定をクリックおよびドラッグすることによって、厚さ。これらは、ルーメン領域と共に病変の進行を分析するために使用されます。
- これらのオーバーレイされた画像をイメージデジタイザにインポートし、外弾性膜が見えない高減衰領域のガイドとしてフィット楕円を使用して、外壁点を手動で選択します。ステップ 1.2.2 を繰り返して、点を選択し、.dat形式に書き出します。
- 脂質に対しても同様に、手動で脂質表面を選択し、いずれの場合も脂質の同一端から始まる。一貫した裏側の円弧を作成するには、外壁の楕円体ガイド(ステップ 1.3.1)を使用します。エクスポートポイントは.datファイルに、脂質が存在するすべての画像に対して繰り返し、ステップ1.2.2で説明したようにガイドワイヤーアーティファクト全体にギャップを残します。
注:病変の進行は、DICOMビューアから直接評価することができる3つのメトリック、すなわち、ルーメン領域、脂質アークおよび繊維状キャップ厚さを比較することによって分析される。外壁と脂質裏面を抽出する技術は、OCTの限られた浸透深さのために必要とされます。OCTは、プラーク組成と生体力との関係に焦点を当てたため、この調査で使用されました。
- 造影をベースにした中心線
- 画像デジタイザー37に最初の血管画像をロードする。カテーテルのエッジを選択して後の手順で画像を拡大縮小し、 図4Aに示すように、近位マーカーで始まり、遠ずれて遠く移動するカテーテルの中心線を手動でマークします。データを.dat形式にエクスポートし、2 番目の血管造影平面に対して繰り返します。
注: 一般に、その間の角度が 20° 以上の平面は、3 次元の中心線の復元の堅牢性を向上させます。カテーテルおよびOCTガイドワイヤーは、各画像に表示される必要があります。
- 画像デジタイザー37に最初の血管画像をロードする。カテーテルのエッジを選択して後の手順で画像を拡大縮小し、 図4Aに示すように、近位マーカーで始まり、遠ずれて遠く移動するカテーテルの中心線を手動でマークします。データを.dat形式にエクスポートし、2 番目の血管造影平面に対して繰り返します。
2. 立体的再構築
- 血管造影図
- ステップ 1.4 でエクスポートされたデータ ファイルを読み込みます。最初の 2 つのポイントを使用して、データをミリメートルにスケールします (最初の 2 つのポイントは、既知のカテーテルの仕様で使用されます(この場合は 6F)。各データセットの残りのポイントから近位データポイントを引いて、カーブが座標系の原点から始まるようにします。
- 各血管造影図ビューに対して回転行列を生成し 、θ とΦ はそれぞれ RAO/LAO 角度と CAU/CRA 角度を表します。LAO と CRA の角度を負の角度として使用します。 x (Rotx) および y (Roty) の 2 つの回転行列は、それぞれ次のとおりです。
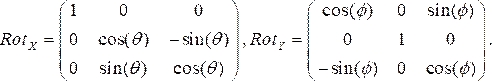 (1)
(1) - 回転行列を乗算し、ステップ 2.1.1 の各点の座標を乗算します。結果の方程式:
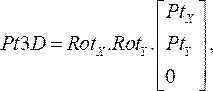 (2)
(2)
それぞれの血管造影画像から指定された 2 次元点を回転させることによって、それぞれの血管造影平面上のカテーテル点の 3 次元位置を示します。 - xおよびy回転行列にz方向の単位ベクトルを掛けることで、各血管造影平面に対する法線ベクトルを計算します。近位から遠位位置まで、各点をそれぞれの平面に対して垂直に投影し、投影間の最短距離の中点を計算します。これにより、空間内の OCT ガイドワイヤの 3 次元ポイントになります。
- MATLAB中央ファイル交換38から利用できる「インターパルク」機能を使用して、3次元の中心線を等間隔の点に分割する。ポイント間の間隔は、引き戻し速度によって決定される OCT イメージ間の間隔と等しくする必要があります。OCT の断面が配置される場所です。
- OCT 断面回転
- カテーテルの中心とスケールを含むデータ ファイルを使用して、スケーリング ファイルの 2 番目と 3 番目のポイントを使用して、各断面をピクセルから mm に変換します。カテーテルの位置を中心に断面を配置するには、すべての断面点からスケーリングファイルの最初の点(カテーテルの中心)を引きます。カテーテル曲線に沿った次の遠位点から3次元の中心線点を引いて、断面(動脈のカテーテルに平行)に垂直ベクトルを計算します。
- スケールされたデータポイントに回転行列を掛けることで、OCT 断面を回転させてカテーテルの中心線に垂直に整列させます。
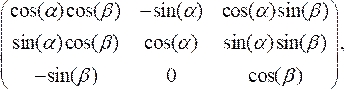 (3)
(3)
どこ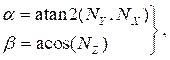 (4)
(4)
NX、N Y、および NZは、それぞれセクション 2.1 で計算された法線ベクトルの x、y、z の成分です。 3 次元の中心線を、断面内のすべての回転点に追加し、その結果、3 次元空間の断面位置を作成します (図 4B)。 - 各断面(ルーメン、動脈、脂質)について、ステップ2.2.1~2.2.2を繰り返します。断面をテキスト ファイルにエクスポートし、最終的なソリッド ボディ作成のためにコンピュータ支援設計 (CAD) ソフトウェアにインポートできます。
- 3D ソリッド モデルの作成
- 3D モデリング ソフトウェアでは、クロス セクションを一度に 1 つのファイルずつインポートして生成します。断面を含むテキスト ファイルを 3D モデリング ソフトウェアにインポートするには、コンセプト ドロップダウン ボックス (図 5A-1)をクリックし、3D カーブを選択します (図 5A-2)。[ 生成] をクリックします。
- ソリッドコンポーネントを作成するには、すべてのカーブを順番に選択し、それらを一緒にロフトします(図5A-3)、新しいソリッドを生成するために フリーズを追加 するが選択されていることを確認します。ルーメン、脂質、外壁に対してこれらの手順を実行して、別々の固体を作成し、マージトポロジを可能にします。
注: 問題のあるジオメトリが発生した場合は、カーブをスキップする必要があります。この再構成では、そのサイズと、その包含に関連する計算コストおよび数値の複雑さの追加による小さな中間部脂質を省略する。 - 動脈壁から内腔と脂質を差し引くには、作成ドロップダウンリストからブール演算を作成し、ターゲットボディを壁として、脂質/ルーメンをツールボディとして選択して、動脈壁から内腔と脂質を差し引く(図5A-4)。
- 壁と脂質の間でトポロジを共有し、メッシュ ノードが将来のステップで共有されるようにします。これを行うには、壁と脂質を手動でハイライト表示し、右クリックして新しい部品を形成します(図5A-5)。
注: この手順により、メッシュ ノードがサーフェス間で共有され、2 つのレイヤ間で不適切な接触領域やメッシュの侵入が防止され、解析フェーズの大幅な支援が行われます。カテーテル中心線の最終的な幾何学的形状は、脂質、内腔および動脈壁を 図5Bで視覚化する。
- 前処理: 境界条件
注: シミュレーションを設定する前に、患者固有の境界条件(BC)が必要です。ここで血管造影から抽出した変位を用いて、ヒト患者から測定したシミュレーション及び血流速度/圧力の流入口及び出口に適用されるものであり、文献39に記載されている。- 排水量
- ステップ 1.4 と 2.1 を繰り返しますが、末端拡張期の直前にある血管造影画像から始めて、遠位マーカーと近位マーカーのみを選択します。1つの心臓周期上のすべての血管造影画像のためにこれを行います。
- 2 つのポイントセットのx、y、z座標にスムージング スプラインをフィットします。 これにより、流入口領域と出口領域の変位が生じます。患者の変位の代表的な結果は、図6Aに示されている。
注: 末端の期に先行する画像で変位解析が開始され、抽出された変位と、シストリックフェーズが0.1 s(血管造影画像間の間隔に対応)から始まるセクション3.1.2で見つかった適用された圧力および速度プロファイルとの間の最適な一致フェーズが得られました。モーションを抽出する場合は、イメージセット全体にテーブルのパン/イメージの動きがないことを確認します。
- 血液速度/圧力
- ユーザー定義関数 (UDF) をコンパイルして、脈動血速と圧力を記述するプロファイルを作成します。ここでは、文献中のヒト患者から測定された一過性プロファイルを 適用し、フーリエシリーズとしてモデル化し、数学的に次のように記述した。
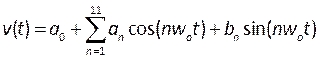 , (5)
, (5)
ここで、tは時間、w0は周波数、Tは信号周期、nは項の数、0-11、b1-11は文献に記載されたプロファイルに適合する係数である。 この場合、最初の 11 の用語を使用しています。 - 注 : これらのプロファイルは 図 6B で説明されており、Microsoft Visual Studio などの統合開発環境で C 形式のファイルに書き込む必要があります。出口圧力は、フラットプロファイルであり、流入速度は、完全に発達した放物線プロファイルとして適用され、現実的な条件40を再現するのに十分であると説明される。この手順のさらなる開発には、患者の血液速度(ドップラー心エコー検査41など)および圧力(圧力線を使用)をより現実的な境界条件として測定が含まれる可能性がある。さらに、同時に変位、血液速度および圧力を測定することは、それらの段階が正確に一致することを保障する。
- ユーザー定義関数 (UDF) をコンパイルして、脈動血速と圧力を記述するプロファイルを作成します。ここでは、文献中のヒト患者から測定された一過性プロファイルを 適用し、フーリエシリーズとしてモデル化し、数学的に次のように記述した。
- 排水量
3. 動脈/構造
- 動脈と脂質の材料特性を設定するには、工学データを入力し、動脈と呼ばれる新しい材料を追加します。密度と 5 パラメータの Mooney-Rivlin モデルを新しい材料にドラッグし、パラメータを設定します。文献中のインティマ42および脂質43特性に基づいて、1,000kg/m3の密度と表1に記載されている超弾性係数を入力します。脂質についてこれを繰り返します。
注:ムーニー·リブリンモデルは44によって記述されています: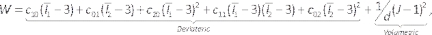 (6)
(6)
ここで、c10、c 01、c 20、c 11、および c02は材料定数、dは非圧縮性パラメータ(この場合は非圧縮性材料の場合はゼロ)です。ここでI xはひずみテンソルのx番目の不変量であり、Jは弾性変形勾配決定基である。 - モデルコンポーネントを入力し、ルーメン/流体を右クリックして[抑制](図7A)を選択して、ルーメン/流体コンポーネントを抑制します。あらかじめ定義した材料を、材料のドロップダウンリストから選択して、その単位が適切かどうかを確認して、動脈および脂質固形分に割り当てます。
- ジオメトリをメッシュ化する必要があります。メッシュをクリックし (図 7B)、物理の優先順位を非線形機械的に設定し、メッシュのサイズを指定します。ここでは、0.14mmの目標サイズを持つアダプティブメッシュを使用した。必要に応じてメッシュの基本設定を調整して、適切なメッシュ歪度値を取得し、繊維キャップなどのギャップにわたって少なくとも 2 ~ 3 個のメッシュ要素を目指します。メッシュの生成には、複雑なジオメトリが原因で時間がかかる場合があります。
注: メッシュの特性に影響を受けないように、メッシュ独立性スタディを実施する必要があります。メッシュ サイズを徐々に小さくし、変動が設定された制限より小さくなるまで結果を比較します。この場合、我々は2%45( 第3プラークの繊維状キャップで測定)を使用する。さらに、メッシュの品質を確保するために、メッシュの歪度を確認します。メッシュの歪度が高いと、収束中の数値的な問題や不正確な結果が生じます。歪度を下げるには、メッシュサイズを小さくするか、成長率、最大サイズ、曲率角度を調整します。メッシュ独立性検定の結果は、この分析全体で使用された中型メッシュサイズと比較して結果の変動割合を示す 表2に概要を示しています。 - [解析設定]をクリックします (図 7C)。FSIシミュレーションの場合、自動ステップステップオフをオンにし、サブステップの数を1に設定し(システムカップリングはサブステップを制御します)、シミュレーション終了時間(この場合は0.8 s)を設定します(患者の心拍数は75 bpm)。システム結合は、時間とサブステップを制御します。
- ソルバー コントロール のドロップダウン リストで、直接または反復的な方法を使用するようにソルバーの種類をプログラム制御に設定します。直接的な方法はより堅牢ですが、かなりの量のメモリを使用します。ニュートン・ラフソン法をフルに設定します。(シミュレーションではジオメトリの複雑さと非線形性が複雑になるため、直接法と完全なニュートン・ラフソン反復法が必要になる場合があります。
- 流体・固体界面を挿入して、動脈の内壁としてシステム結合ドメインを指定する。これを行うには、[ 過渡] タブ(図7D)の下で流体ソリッドインタフェースを右クリックしてインセットします。インターフェースの動脈壁の内側を選択します。これにより、この位置の構造と流体の間でデータが渡されます。
- 変位境界条件は、入口と出口に適用される x、y、z方向に変位関数として入力できます。 これを行うには、[過渡]タブの下を右クリックし、変位を挿入します(図7E)。x、y、z方向の変位を複製します。 方向ドロップダウン リストで、[関数]を選択し、ステップ 2.4.1 で抽出した変位をコピーします。
注: 変位は、基本設定に応じて、関数として、または点のテーブルとして入力することができます。 - エラーのトラブルシューティングを支援するには、[ ソリューション ]タブでニュートン ラフソン残差を 4 つ挿入します。これらは、問題のあるジオメトリやメッシュの位置を見つけるためにエラーが発生した場合に表示できます。
注: 最大主応力などの後処理オプションを挿入するには、[ソリューション]タブを右クリックし、適切な結果を挿入します(図 7F)。
4. 血液/液体
- 「モデル」タブを入力し、単位を確認し、動脈と脂質部分を抑制し、流体領域を離れ、ステップ3.2と同様の方法で残します。
- メッシュメトリクスを指定してメッシュを生成し、必要に応じて歪度をチェックし、調整します(最大壁サイズ0.12mmの0.14 mmメッシュサイズを適用しました)。構造部品で行われているように、流体と固体の相互作用が発生している領域で同様のメッシュ サイズと形状を使用することをお勧めします。
注: 手順 3.3 と同様に、メッシュの独立性テストを実施して、結果がメッシュ プロパティから独立していることを確認する必要があります ( 表 2を参照)。メッシュの品質を確認し、歪度が低く、メッシュの独立性に達していることを確認するために、必要に応じて要素のサイズ、成長速度、改良または曲率を調整します。 - 流体設定に入る前に、各サーフェスを右クリックして[名前付き選択を挿入]を選択して、流入口、出口、および壁の名前付き選択を作成します。
- [セットアップ] タブを入力し、倍精度が有効になっていることを確認します。ソルバータイプを圧力ベースに設定し、それぞれのチェックボックスをオンにして時間が過渡に設定されていることを確認します(図8A)。
- k-ω粘性乱流モデルを有効にし、粘性モデルタブ(図8B)を入力し、それぞれのチェックボックスをオンにして、せん断応力伝達と低レイノルズ補正を有効にします。
- 乱気流を持つ非線形粘度モデルを有効にするには、コマンドコンソールにコマンド'/定義/モデル/粘性/乱流エキスパート/ターブ非ニュートン?' を入力し、プロンプトが表示されたら「yes」と入力します。
- 材料(図8D)で、密度を入力し、粘度ドロップダウンリストで非ニュートン力則を選択して血液特性を定義します。これを行うには、流体の名前を血液に変更し、密度を1,050 kg/m3に設定し、パワーロー非ニュートン一貫性指数kを0.035、電力法則指数n、0.6に設定します。
注:力則非ニュートン粘度モデルは、非線形血液粘度46、η、流体ひずみ率の観点から、次のように記述する文献に基づいて選択されました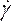 。
。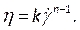 (7)
(7)
血液のせん断性を取り込むために、さまざまな非ニュートン血液粘度モデルが存在します。いくつかの出版物46、47、48、49は、様々な粘度モデルとその係数の有効性を調査しており、適切なモデルを選択する際に詳細を調べる必要があります。 - ステップ 2.4.2 で説明したユーザー定義関数をコンパイルし、一過性の血速と圧力を含み、コマンド ラインにエラーがないかチェックします (図 8C)。ここで 、UDF を読み込み、ユーザー定義タブ (図 8E) を入力し、 [ コンパイル済み ] を選択して UDF のディレクトリに移動してからインポートし、[ ビルド] をクリックし、 [ 読み込み] をクリックします。
メモ: コンソールにテキストが表示されます (図 8C)。この点を慎重に確認して、エラーや警告が表示されないようにします。UDF が正しくロードされると、UDF 名がコンソールに表示されます ( 図 8Cで強調表示されています)。 - これらは、入口および出口に適用することができる。これを行うには、[ 境界条件] タブを選択します。 [インレット ] (図 8F) をダブルクリックし、プロファイルドロップダウン リストから入口 UDF を選択します。このステップを繰り返して、出口圧力も定義します。
- (図 8Gに示す[動的メッシュ]タブのチェック ボックス)、スムージング、再メッシュ、6°の自由ソルバー チェック ボックスを含むダイナミック メッシュを有効にし、拡散パラメータを 1.5 に設定し、メッシュの最大スケールと最小スケールを適切に設定します。
- 最大および最小のメッシュスケールがメッシュゾーンの範囲内にあり、ターゲットの歪みが 0.7 に設定されていることを確認します。メッシュ プロパティは、[ メッシュ プロパティ] タブをクリックして表示できます。
- [作成]ボタンをクリックして新しいダイナミック メッシュ ゾーンを 作成 し、[ 領域 ]ドロップダウンリストでルーメンの壁を指定し、[ システムカップリング]を選択します。これは、シミュレーションの動脈コンポーネントにデータを渡すインタフェースです。
- 入口、出口、および内部ルーメンのメッシュスケールに適切な値を持つ変形メッシュゾーンを作成します。これを行うには、[動的メッシュ]タブで[作成]をクリックし、[変形]を選択します。再メッシュとスムージングを有効にし、各ゾーンの制限に基づいてメッシュスケールを設定します。多くの場合、負のセル体積エラーはこの動的メッシュに関連付けられるため、各領域に必要な場合は慎重にチェックしてメッシュスケールを調整します。
- 圧力速度の結合が結合に設定されていることを確認し、[ 方法 ] タブ (図 8H)を入力し、それぞれのドロップダウン リストから選択を行うことで、過渡式および空間離散化スキームを 2 番目の順序に設定します。
- コントロール (図 8H)に 2 のクーラント番号を入力し、[モニタ] タブ (図 8I)で残余収束条件を設定します。連続性には 1e-5、残りの部分には 1e-6 という値を使用しました。
注: クーラント数は、メッシュサイズ 、dx、時間ステップサイズ 、dt、血液の速度 、vに基づいて推定できます。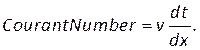 (8)
(8)
この番号を[ コントロール] タブの[クーラント番号]セクションに入力します(図8H)。ここでは、2のクーラント番号を適用します。クーラント数は一般的に1未満です。ただし、暗黙の解法を使用した結合された圧力速度ソルバーが使用されると、結果は本質的により安定し、この値に対する感度が低下します。したがって、2 つは許容可能と見なされます。 - ローカルの正規化されたヘリシティ (LNH) などの結果に対してカスタム関数を定義するには、[パラメータとカスタマイズ] タブ (図 8J)でカスタム フィールド関数を選択し、右クリックして[新規] を選択して新しい関数を挿入します。ポップアップウィンドウを使用して、必要に応じて定義します。ソルバー変数のドロップダウン リストを使用して、数式を入力します。代表的な結果として、LNH50、51、速度、
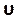 および渦度、ω、ベクトルの間の位置合わせの尺度を使用します。
および渦度、ω、ベクトルの間の位置合わせの尺度を使用します。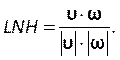 (9)
(9)
注: 他のカスタム変数は、このステップで定義する必要があります(振動せん断インデックス(OSI)52、53、流れの反転の尺度など。 - [ 計算の実行 ] タブ (図 8K)では、タイムステップの数を 160 (ステップ サイズ 0.005 秒、終了時間 0.8 秒)、時間ステップ サイズ 5 ms、反復回数を 300 に設定し、結果が時間に依存しないようにします。
注: シミュレーションの複雑さによっては、ステップごとにより多くの反復が必要になる場合があります。複数の心周期は、完全な数値収束のために必要とされるかもしれないが、我々は限界として注意する。しかし、このシミュレーションは、これらのシミュレーションに関連する計算コストのために、冠状のバイオメカニクスシミュレーションに適用されることがよくあります。 - [ 時間統計のデータ サンプリング ] チェック ボックスが有効になっているかどうかを確認し、 壁の統計 と 流れせん断応力 、および定義済みのカスタム関数が選択されていることを確認します。
- 後処理のCFD ポスト互換オプションを選択して、計算アクティビティと自動保存タブ (図 8L)でデータエクスポートを作成します。別のソフトウェアで結果を処理したい場合は、必要に応じてエクスポートタイプを調整します。すべての領域(壁、内部メッシュ、流入口、出口)とエクスポートする結果を選択します。
- 最後に、ハイブリッドスキームでシミュレーションを初期化するには、「 初期化 」タブ (図8M)を入力し、 ハイブリッド スキームを選択し、「 設定」をクリックして、反復回数を20に増やします。[ 初期化] をクリックします。
5. システム結合
- 構造と流体の両方の設定がシステムのカップリングに接続され、更新されていることを確認します。これを行うには、図 9Aに示すように、構造および流体の設定をクリックしてシステム結合にドラッグしてリンクします。
- システム カップリングで終了時間を 0.8 s に設定し、タイムステップを 0.005 s に設定します。この操作を行うには 、[解析設定] (図 9B-1) を選択し、終了時間と時間ステップ サイズを入力します。最大反復回数を 10 に設定します。
注: 通常、構造コンポーネントと流体コンポーネントの両方がうまく収束している場合は、10 ~ 15 回の反復で十分です。 - 流体コンポーネントと構造コンポーネントから壁面とソリッドインタフェースをそれぞれ選択し、Ctrl キーを押しながら 2 つの流体構造インタフェースを選択してデータ転送を追加します(図 9B-2)。右クリックして、流体コンポーネントと構造コンポーネント間のデータ転送を作成します (図 9B-3)。収束を支援するために、流体から構造物に移動する力の下緩和または傾斜を調整します。
注: モデルの複雑さ、境界条件、材料特性によっては、数値収束にデータ転送の傾斜または過少緩和が必要になる場合があります。これらは、流体データ転送(すなわち、流体成分から動脈壁に伝達される力)に適用することができる。これらのオプションは、作成されたデータ転送内で使用できます (図 9B-2)。 - 実行の準備ができたら、[ 更新] をクリックします。構造収束と流体収束、およびそれぞれのデータ転送収束などのシミュレーション データがコンソールに出力されます。
注: FSI シミュレーションは計算負荷が高く、このシミュレーションは 16 コアのマシン (180 Gb の物理メモリ (RAM) を使用する 2.6 GHz の Intel Xeon Gold) で 11 日を費やしており、ハードウェアのセットアップとモデルの複雑さに応じてシミュレーション時間がさらに変化します。代表的なデータ転送残差は図 (図 9B-4)に示され、ソリューションデータはコンソールに出力されます (図 9B-5)。最初の数回の繰り返しで、平衡状態になるまでデータ転送残差の収束が完全に得られないことがあります。この詳細については、 図 9Bのキャプションで説明します。 - シミュレーションが完了すると、ステップ 4.19 で説明したデータエクスポートタイプに応じて、結果を商用ソフトウェア内または別のソフトウェアで後処理できます。
結果
アテローム性動脈硬化症の進行の確立されたバイオメカニカルマーカーと新生生物力学的マーカーの両方に対する代表的な結果が提示される。WSS および WSS 派生結果 (時間平均壁せん断応力 (TAWSS) および振動せん断指数 (OSI)を含む) などの確立されたメトリックは、 図 10に示します。心周期に対する壁せん断応力は、主に血液速度によって駆動されるが、動脈幾何学的?...
ディスカッション
冠状動脈バイオメカニクスを分析するFSI法の使用は、数値モデリングと臨床結果の両方の側面から発展途上の分野です。ここでは、OCTおよび血管造影を利用した有限要素/有限体積法に基づいて、患者固有のFSI分析を設定する概要を説明しました。ここで説明する方法は商用有限要素ソルバーを利用しますが、この手順はFSI対応ソフトウェアに適用できます。方法論にはまだいくつかの制限が...
開示事項
著者は、この記事の準備に関して宣言する競合はありません。S.J.N.は、アストラゼネカ、アムジェン、アンセラ、イーライリリー、エスペリオン、ノバルティス、 セレニス、医薬品会社、レスベロリックス、インフラReDx、ロシュ、サノフィ・レジェネロン、リポサイエンスは、アストラゼネカ、アクセア、イーライ・リリー、アンテラ、コワ、オムセラ、メルク、タケダ、レスベロリックス、サノフィ・レジーン、CSLベーリング、エスペルン、ボエル・インゲリンゲルのコンサルタントです。P.J.P.はアボット・パスリンスから研究支援を受けており、アムジェンとエスペリオンからコンサルティング料を受け取り、アストラゼネカ、バイエル、ベーリンガー・インゲルハイム、メルク・シェリング・プラウ、ファイザーから講演者の名誉を受けています。
謝辞
著者らは、アデレード大学、ロイヤルアデレード病院(RAH)、南オーストラリア保健医療研究所(SAHMRI)の支援を認めたい。COCOMO-ACS試験は、オーストラリアの国家保健医療研究評議会(NHMRC)とオーストラリア国立心臓財団(ID101370)からのプロジェクト助成金によって資金提供された研究者主導の研究です。H.J.Cは、ウェストパック・スカラーズ・トラスト(フューチャー・リーダーズ・スカラシップ)の奨学金の支援を受けており、アデレード大学、機械工学部、教育・技能・雇用研究研修プログラム(RTP)奨学金からの支援を認めています。S.J.N.はNHMRC(ID1111630)から主任研究フェローシップを受け取ります。P.J.P.は、オーストラリア国立心臓財団(FLF102056)からレベル2未来リーダーフェローシップを受け、NHMRC(CDF1161506)からレベル2キャリア開発フェローシップを受け取ります。
資料
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
参考文献
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved