Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Koroner Ateroskleroz İlerlemesinin Optik Koherens Tomografi Tabanlı Biyomekanik Akışkan-Yapı Etkileşim Analizi
Bu Makalede
Özet
Miyokard enfarktüsü oluşmadan önce müdahaleye rehberlik etmek için koroner vaskültürde hangi aterosklerotik lezyonların ilerleyeceğini belirlemeye ihtiyaç vardır. Bu makalede, bu ilerlemeyi tahmin etmeye yardımcı olmak için ticari bir sonlu eleman çözücüsünde akışkan yapısı etkileşim teknikleri kullanılarak Optik Koherens Tomografisinden arterlerin biyomekanik modellemesi özetilmektedir.
Özet
Bu yazıda koroner vaskültürdeki aterosklerotik plağın biyomekanik analizi için eksiksiz bir iş akışı sunuyoruz. Küresel ölüm, morbidite ve ekonomik yükün önde gelen nedenlerinden biri olarak ateroskleroz ile ilerlemesini analiz etmenin ve tahmin etmenin yeni yollarına ihtiyaç vardır. Bu hesaplama yöntemlerinden biri, kan akışı ile arter/plak etki alanları arasındaki etkileşimi analiz etmek için sıvı yapısı etkileşiminin (FSI) kullanılmasıdır. In vivo görüntüleme ile birleştiğinde, bu yaklaşım her hastaya uyarlanabilir ve kararlı ve kararsız plaklar arasında ayrım yapılmasına yardımcı olabilir. İntravasküler Optik Koherens Tomografi (OCT) ve invaziv koroner anjiyografiden (ICA) yararlanarak üç boyutlu rekonstrüksiyon sürecini özetliyoruz. Arterin üç boyutlu hareketini çoğaltmak da dahil olmak üzere simülasyon için sınır koşullarının çıkarılması, kurulum ve analiz ticari bir sonlu eleman çözücüde yapılmadan önce tartışılır. Arter duvarının ve pulsatil kan hızının/basıncının son derece doğrusal olmayan hiperelastik özelliklerini tanımlama prosedürü, iki alan adı arasındaki sistem bağlantının kurulmasıyla birlikte özetlenmiştir. Miyokard enfarktüsü takip eden bir hastada suçlu olmayan, hafif stenotik, lipit bakımından zengin bir plağını analiz ederek işlemi gösteriyoruz. Sırasıyla duvar kesme stresi ve lokal normalleştirilmiş heliklik gibi aterosklerotik plak ilerlemesi ile ilgili kurulan ve ortaya çıkan belirteçler tartışılır ve arter duvarı ve plaktaki yapısal yanıtla ilgilidir. Son olarak, sonuçları potansiyel klinik alaka düzeyine çeviriyor, sınırlamaları tartışıyor ve daha fazla gelişme için alanları özetliyoruz. Bu makalede açıklanan yöntem, aterosklerotik ilerleme riski altındaki bölgelerin belirlenmesine yardımcı olmak için umut vaat ettiğini ve bu nedenle aterosklerozun önemli ölüm, morbidite ve ekonomik yükünün yönetilmesinde yardımcı olabileceğini göstermektedir.
Giriş
Koroner arter hastalığı (CAD) en sık görülen kalp hastalığı türüdür ve küresel olarak önde gelen ölüm ve ekonomik yük nedenlerinden biridir1,2. Amerika Birleşik Devletleri'nde, kabaca her sekiz ölümden biri CAD3,4'e atfedilirken, CAD'den kaynaklanan küresel ölümlerin çoğu şimdi düşük ve orta gelirli ülkelerde görülmektedir5. Ateroskleroz, koroner arter tıkanıklığı ve akut miyokard enfarktüsüne (AMI) yol açan plak yırtılması veya erozyonu ile bu ölümlerin baskın sürücüsüdür6. Suçlu koroner lezyonların revaskülarizasyonundan sonra bile, hastalar AMI'den sonra tekrarlayan majör majör ad kardiyovasküler olaylar (MACE) riskine sahiptir, büyük ölçüde yırtılmaya karşı savunmasız olan diğer suçlu olmayan plakların eşlik etmesi nedeniyle7. İç görüntüleme, bu yüksek riskli plakları tespit etme fırsatı sağlar8. İntravasküler ultrason (IVUS) plak hacmini değerlendirmek için altın standart olmasına rağmen, optik koherens tomografisinin (OCT) yüksek çözünürlüğünün (10-20 μm) aksine savunmasız plasın mikroyapısal özelliklerini tanımlamak için sınırlı çözünürlüğe sahiptir. Büyük bir lipit havuzunun üzerinde bulunan ince ve iltihaplı lifli bir kapağın savunmasız bir plak9'un en önemli imzası olduğu gösterilmiştir ve şu anda mevcut intrakoroner görüntüleme yöntemleri arasında OCT tarafından en iyi şekilde tanımlanır ve ölçülür10. Daha da önemlisi, OCT ayrıca lipid arkı da dahil olmak üzere diğer yüksek riskli plak özelliklerini de değerlendirebilir; makrofaj infiltrasyon; aşırı ince lifli kapaklı lipit bakımından zengin çekirdek (<65 μm) olarak tanımlanan ince kapak fibroteromunun (TCFA) varlığı; sivilceli kireçlenme; ve plak mikrokanelleri. AMI sonrası suçlu olmayan plaklarda bu yüksek riskli özelliklerin OCT tespiti, gelecekteki MACE11riskinin 6 kata kadar artmasıyla ilişkilendirilmiştir. Bununla birlikte, buna rağmen, anjiyografi ve OCT görüntülemenin hangi koroner plakların ilerleyeceğini ve sonuçta yırtılma veya aşındırılacağını tahmin etme yeteneği sınırlıdır, pozitif tahmin değerleri sadece% 20-% 308. Bu sınırlı tahmin yeteneği, hangi suçlu olmayan plakların tedavi etmek için klinik karar vermeyi engeller (örneğin, stenting ile)7,12.
Hasta faktörlerine ve plakların biyolojik özelliklerine ek olarak, koroner arterlerdeki biyomekanik kuvvetler de plak ilerlemesi ve instabilitesinin önemli belirleyicileridir13. Bu kuvvetlerin kapsamlı bir şekilde değerlendirilmesine yardımcı olma sözünü gösteren bir teknik, akışkan yapısı etkileşimi (FSI)14 simülasyondur. Endotel kesme stresi olarak da adlandırılan duvar kesme stresi (WSS), koroner biyomekanik araştırması15için geleneksel bir odak noktası olmuştur WSS'nin ateroskleroz oluşumunda etiyolojik bir rol oynadığı genel bir anlayışla16. Ağırlıklı olarak hesaplamalı akışkan dinamiği (CFD) teknikleri kullanılarak simüle edilen düşük WSS bölgeleri, intimal kalınlaşma17, vasküler remodeling18 ve lezyon ilerlemesi tahmini19 ve gelecekteki MACE20ile ilişkilendirilmiştir. Bu analizlerdeki son gelişmeler, alttaki WSS vektör alanı topolojisi21ve çok yönlü özellikleri22, ateroskleroz riskinin sadece WSS büyüklüğüne göre daha iyi bir tahmincisi olduğunu göstermektedir. Bununla birlikte, WSS sadece lümen duvarındaki genel biyomekanik sisteme bir bakış yakalar ve görüntüleme yöntemleri gibi, hiç kimse biyomekanik metrik yüksek riskli aterosklerotik özellikleri güvenilir bir şekilde ayırt edilemez.
Ateroskleroz oluşumunda potansiyel olarak önemli olan diğer metrikler ortaya çıkıyor. İntralüminal akış özellikleri23, çeşitli endeksler24ile ölçülen sarmal akış ile, rahatsız akış desenlerini bastırarak ateroprotektif bir rol oynadığı önerilen25,26. CFD teknikleri bu akış özelliklerini analiz edebilir ve çok çeşitli yararlı sonuçlar sunabilirken, kan akışı, arter yapısı ve genel kalp hareketi arasındaki altta kalan etkileşimleri dikkate almaz. Dinamik sistemin sert bir duvara doğru basitleştirilmesi, lifli kapak stresi gibi potansiyel olarak kritik sonuçları kaçırır. CFD üzerinden FSI ihtiyacına karşı hem tartışma devam ederken27,28,29, birçok karşılaştırma ventrikül fonksiyonunun etkisini dahil etmeyi ihmal ediyor. Bu sınırlama, ventrikül fonksiyonunun etkisiyle artere uygulanan dinamik bükülme ve sıkıştırmanın plak ve arter yapısal stresinin yanı sıra WSS30 , 31,32gibi akış metriklerini önemli ölçüde etkileyebileceğini gösteren FSI ile aşılabilir. Yapısal gerilmeler ayrıca plak yırtığı33,34'ü analiz etmek ve tahmin etmek için önemli bir metrik olduğundan ve plak artışı14,35bölgeleriyle birlikte bulunması önerildi. Bu etkileşimleri yakalamak, koroner ortamın ve hastalığın ilerlemesinin potansiyel mekanizmalarının daha gerçekçi bir şekilde temsilini sağlar.
Bunu ele alarak, burada OCT görüntüleme36'dan hastaya özgü bir geometri geliştirme ve ticari bir sonlu eleman çözücü kullanarak bir arter FSI simülasyonunun kurulması ve çalıştırlanması sürecini özetliyoruz. Lümen, lipit ve dış arter duvarını manuel olarak çıkarma işlemi, hastanın atardamarının üç boyutlu hesaplamalı rekonstrüksiyonundan önce ayrıntılı olarak detaylandırıldır. Lezyon ilerlemesini belirlemek için simülasyon kurulumunu, kavramayı ve taban çizgisini karşılaştırma sürecini ve OCT görüntüleme parametrelerini takip ediyoruz. Son olarak, biyomekanik sonuçları lezyon ilerlemesi/gerilemesi ile karşılaştırarak sayısal sonuçların işlenme sonrası işlenmesini ve bu verilerin klinik açıdan nasıl bir ilgisi olabileceğini tartışıyoruz. Genel yöntem suçlu olmayan, hafif stenotik, Hipertansiyon, tip 2 diabetes mellitus, obezite (VKİ 32.6) ve ailesinde prematüre CAD öyküsü olan akut non-ST yüksekliği miyokard infarktüsü ile başvuran 58 yaşındaki Kafkas erkek hastanın sağ koroner arterinde (RCA) lipid bakımından zengin plaklar ilk kabulü sırasında yapıldı, ve 12 ay sonra devam eden bir klinik çalışmanın bir parçası olarak (COCOMO-ACS denemesi ACTRN12618000809235). Bu tekniğin daha da rafine edilebileceğini ve ilerleme riski yüksek olan koroner plakların tanımlanmasında kullanılabileceğini öngörüyoruz.
Protokol
Aşağıdaki kodlanmış veriler, devam eden COCOMO-ACS randomize kontrollü denemeye (ACTRN12618000809235) alınan bir hastadan analiz edildi; Royal Adelaide Hastanesi HREC referans numarası: HREC/17/RAH/366), Merkezi Adelaide Yerel Sağlık Ağı (CALHN) Araştırma Hizmetleri tarafından biyomekanik simülasyon amacıyla verilen ek etik onayı ile (CALHN Referans Numarası 14179). Şekil 1, aşağıdaki protokolde özetlenen ve FSI özellikli herhangi bir yazılıma veya koda uygulanabilen iş akışının tamamını özetler.
1. Görüntü değerlendirmesi
- Bifurkasyonlar gibi anatomik yer işaretlerini kullanarak ve görüntüleri distal çatallanma ile hemen proksimal ve distal olarak en proksimal çatallanma ile eşleştirin. Şekil 2A'daaçıklandığı gibi, bu yer işaretleri arasındaki eşleşen görüntüler analiz edilecektir.
- OCT lümen kesiti
- Her OCT görüntüsünü görüntü sayısallaştırıcısına yükleyin ve kateter merkezi noktasındaki noktaları ve ölçeğin sınırlarını işaretlemek için tıklatın (Şekil 2B). Bu noktaları daha sonra kullanılmak üzere dışarı aktarın.
- Lümenin kenarını, her görüntüde aynı konumdan başlayarak, lümenin eğrilerini mümkün olduğunca doğru bir şekilde yakaladığından emin olarak manuel olarak işaretleyin. Yeniden inşa süreci daha sonraki bir aşamada bu bölgeye enterpolasyon yapacağından kateter eserinde bir boşluk bırakın. Bu dosyaları .dat biçimde dışa aktarın ve her görüntü için bunu tekrarlayın.
- OCT dış duvar ve lipitler
- DICOM yazılımında, Şekil 3'teaçıklandığı gibi, dış duvarın konumunu tahmin etmek için bir elips takmak için dış elastik zarın görünür kısımlarını kullanarak dış duvarı yüksek zayıflama bölgelerindeki ayıklayın. Elips ve konumu uygun şekilde tanımlamak için sol fare düğmesini tıklatıp sürükleyin.
- Şekil 3'teaçıklandığı gibi lümen merkezkoidine hesaplanan lipid arkını ve lifli kapak kalınlığını sırasıyla açı ve mesafe ölçülerini tıklatıp sürükleyerek manuel olarak tanımlayın. Bunlar lümen bölgesi ile birlikte lezyon ilerlemesini analiz etmek için kullanılacaktır.
- Bu kaplanmış görüntüleri görüntü sayısallaştırıcısına içe aktarın ve dış elastik zarın görünmediği yüksek zayıflama bölgelerinde kılavuz olarak takılan elipsleri kullanarak dış duvar noktalarını manuel olarak seçin. Noktaları seçmek ve .dat bir biçime vermek için 1.2.2 adımını yineleyin.
- Benzer şekilde lipitler için, her durumda lipitin aynı ucundan başlayarak lipit yüzeyini manuel olarak seçin. Tutarlı bir arka yay için dış duvar elipsoidal kılavuzunu (adım 1.3.1) kullanın. .dat bir dosyaya işaret eder ve lipitlerin bulunduğu tüm görüntüler için tekrarlayın ve 1.2.2 adımında açıklandığı gibi kılavuz tel objesinde bir boşluk bırakın.
NOT: Lezyon ilerlemesi, doğrudan DICOM görüntüleyiciden değerlendirilebilen lümen alanı, lipit arkı ve lifli kapak kalınlığı olmak üzere üç metrik karşılaştırılarak analiz edilir. Oct'un sınırlı penetrasyon derinliği nedeniyle dış duvarı ve lipid arka tarafını çıkarma tekniği gereklidir. OCT bu araştırmada plak bileşimi ve biyomekanik kuvvetler arasındaki ilişkiye odaklanılması nedeniyle kullanılmıştır.
- Anjiyografi tabanlı merkez çizgisi
- İlk anjiyografik görüntüyü görüntü sayısallaştırıcısına yükleyin37. Görüntüyü sonraki adımlarda ölçeklemek için kateterin kenarlarını seçin ve ardından kateter merkez çizgisini proksimal işaretleyiciden başlayarak ve Şekil 4A'dagösterildiği gibi eşit aralıklı noktalarla düzensiz bir şekilde hareket ederek manuel olarak işaretleyin. Verileri .dat biçime dışa aktarın ve ikinci anjiyografik düzlem için yineleyin.
NOT: Genellikle, aralarında 20° daha büyük bir açıya sahip düzlemler üç boyutlu merkez çizgisi rekonstrüksiyon sağlamlığını artırır. Kateter ve OCT kılavuz tel her görüntüde görünür olmalıdır.
- İlk anjiyografik görüntüyü görüntü sayısallaştırıcısına yükleyin37. Görüntüyü sonraki adımlarda ölçeklemek için kateterin kenarlarını seçin ve ardından kateter merkez çizgisini proksimal işaretleyiciden başlayarak ve Şekil 4A'dagösterildiği gibi eşit aralıklı noktalarla düzensiz bir şekilde hareket ederek manuel olarak işaretleyin. Verileri .dat biçime dışa aktarın ve ikinci anjiyografik düzlem için yineleyin.
2. Üç boyutlu rekonstrüksiyon
- Anjiyografi projeksiyonları
- 1.4. adımda verilen veri dosyalarını yükleyin. Verileri milimetreye ölçeklemek için ilk iki noktayı kullanın (ilk iki nokta bilinen kateter özellikleriyle kullanılır, bu durumda 6F). Eğrinin koordinat sisteminin kaynağından başlaması için her veri kümesindeki kalan noktalardan proksimal veri noktasını çıkarın.
- Her anjiyografik görünüm için dönüş matrisleri oluşturun; LAO ve CRA açılarını negatif olarak kullanıyoruz. Sırasıyla x ( Rotx) ve y (Roty) yönlerindeki iki dönüş matrisleri şunlardır:
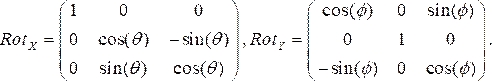 (1)
(1) - Döndürme matrislerini birlikte çarpın ve sonra 2.1.1 adımından her noktanın koordinatlarıyla çarpın. Sonuç denklemi:
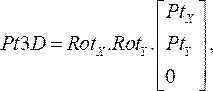 (2)
(2)
kateter noktasının üç boyutlu konumunu, her anjiyografik görüntüden belirtilen iki boyutlu noktaları döndürerek ilgili anjiyogram düzleminde(Pt3D)verir. - X ve y dönüş matrislerini z yönünde birim vektörüyle çarparak her anjiyografik düzleme normal vektörü hesaplayın. Proksimalden distal konuma kadar, her noktayı normal olarak kendi düzlemine yansıtın ve projeksiyonlar arasındaki en kısa mesafenin orta noktasını hesaplayın. Bu, uzaydaki OCT kılavuz telinde üç boyutlu nokta ile sonuçlanır.
- MATLAB merkezi dosya değişimi38'denkullanılabilen 'interparc' işlevini kullanarak, üç boyutlu merkez çizgisini eşit aralıklı noktalara bölün. Noktalar arasındaki aralık, geri çekme hızı tarafından belirlenen OCT görüntüleri arasındaki boş boşluklara eşit olmalıdır. Bunlar OCT kesitlerinin yerleştirileceği konumlardır.
- OCT kesit dönüşü
- Kateter merkezini ve ölçeğini içeren veri dosyasını kullanarak, ölçekleme dosyasındaki ikinci ve üçüncü noktaları kullanarak her kesiti piksellerden mm'ye dönüştürün. Kateter konumuyla ilgili kesiti ortalamak için, ölçekleme dosyasındaki ilk noktayı (kateter merkezi) tüm kesit noktalarından çıkarın. Üç boyutlu merkez çizgisi noktasını kateter eğrisi boyunca bir sonraki distal noktadan çıkararak kesite normal vektörü (arterdeki katetere paralel) hesaplayın.
- Ölçeklenmiş veri noktalarını döndürme matrisi ile çarparak kateter merkez çizgisine dik hizalamak için OCT kesitini döndürün:
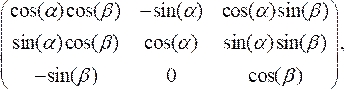 (3)
(3)
nerede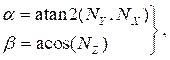 (4)
(4)
ve NX, N Yve N Z, bölüm 2.1'de hesaplanan normal vektörün sırasıyla x, y ve z bileşenleridir. Üç boyutlu merkez çizgisi noktasını kesitteki tüm döndürülmüş noktalara ekleyin, bu da kesit konumunu üç boyutlu boşlukta elde edin (Şekil 4B). - Her kesit (lümen, arter ve lipid) için 2.2.1-2.2.2 adımlarını yineleyin. Kesitleri, son katı gövde oluşturma için bilgisayar destekli tasarım (CAD) yazılımına alınabilen bir metin dosyasına dışa aktarın.
- 3D katı model oluşturma
- 3B modelleme yazılımında, kesitleri birer birer içe aktarın ve oluşturun. Kavram açılan kutusuna(Şekil 5A-1)tıklayıp 3B eğriyi ( Şekil 5A-2)seçerek kesitleri içeren metin dosyalarını 3B modelleme yazılımına içeaktarın. Oluştur 'utıklatın.
- Katı bir bileşen oluşturmak için, tüm eğrileri sırayla seçin ve birlikte çatı katın (Şekil 5A-3), yeni bir katı oluşturmak için dondurulmuş eklemenin seçilmesini sağlayın. Lümen, lipitler ve dış duvarın ayrı katılar oluşturması için bu adımları gerçekleştirin ve birleştirme topolojisini etkinleştirin.
NOT: Sorunlu geometri ortaya çıkarsa eğriyi atlamak gerekebilir. Bu rekonstrüksiyonda, boyutu ve dahil edilmesiyle ilişkili ek hesaplama maliyeti ve sayısal karmaşıklık nedeniyle küçük bir orta bölüm lipidini atlar. - Lümen ve lipitleri arter duvarından çıkarmak için, oluşturma açılan listesinden bir Boole işlemi oluşturun ve arter duvarından lümen ve lipitleri çıkarmak için hedef gövdeyi duvar ve lipitleri / lümeni takım gövdesi olarak seçin (Şekil 5A-4).
- Mesh düğümlerinin gelecekteki adımlarda paylaşılmasını sağlamak için topolojiyi duvar ve lipitler arasında paylaşın. Bunu yapmak için, duvarı ve lipitleri manuel olarak vurgulayın ve yeni bir parça oluşturmak için sağ tıklayın (Şekil 5A-5).
NOT: Bu adım, mesh düğümlerinin yüzeyler arasında paylaşılmasını sağlayarak yanlış temas bölgelerini veya iki katman arasındaki kafes penetrasyonunu önler ve çözüm aşamasında büyük ölçüde yardımcı olmasını sağlar. Kateter merkez çizgisi, lipitler, lümen ve arter duvarının son geometrisi Şekil 5B'degörselleştirilmiştir.
- Ön işleme: Sınır koşulları
NOT: Simülasyonun kurulmasından önce hastaya özel Sınır Koşullarına (BC'ler) ihtiyaç vardır. Burada insan hastalardan ölçülen simülasyon ve kan akış hızı/basıncının giriş ve çıkışına uygulanan ve literatürde açıklanan anjiyografiden çıkarılan yer değiştirmekullanılmıştır 39.- Yer değiştirme
- 1.4 ve 2.1. Bunu bir kalp döngüsü boyunca tüm anjiyografik görüntüler için yapın.
- Yumuşatma spline'larını iki nokta kümesinin x, yve z koordinatlarına sığdırın. Bu, giriş ve çıkış bölgelerinin yer değiştirmesiyle sonuçlanır. Hasta yer değiştirmeleri için temsili sonuçlar Şekil 6A'dagösterilmiştir.
NOT: Deplasman analizi, son diastole'den önceki görüntüde, çıkarılan yer değiştirme ile sistolik fazı 0,1 sn'de başlayan bölüm 3.1.2'de bulunan uygulanan basınç ve hız profilleri arasındaki en iyi eşleşme aşamalarına (anjiyografik görüntüler arasındaki boşluğe karşılık gelir) başladı. Hareketi ayıklarken, görüntü kümesi boyunca tablo kaydırma/görüntü hareketi olmadığından emin olun.
- Kan hızı/basıncı
- Kullanıcı Tanımlı İşlevleri (UDF) derleyerek pulsatil kan hızını ve basıncını tanımlayan profiller oluşturun. Burada literatürdeki insan hastalardan ölçülen geçici profiller uygulandı 39, Bir Fourier serisi olarak modellendi, matematiksel olarak şöyle tanımlandı:
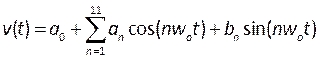 , (5)
, (5)
burada t zaman, w0 frekanstır, T sinyal periyodudur, n terim sayısıdır ve0-11, b1-11 literatürde açıklanan profillere takılan katsayılardır. Bu durumda, ilk 11 terimini kullanıyoruz. - NOT: Bu profiller Şekil 6B'de açıklanmıştır ve Microsoft Visual Studio gibi tümleşik bir geliştirme ortamında C biçimli bir dosyaya yazılmalıdır. Çıkış basıncı düz bir profildir ve giriş hızı, gerçekçi koşulları yeniden üretmek için yeterli olarak tanımlanan tamamen gelişmiş, parabolik bir profil olarak uygulanır40. Bu prosedürün daha da geliştirilmesi, hasta kan hızının (doppler ekokardiyografi41gibi) ve basıncın (basınç telleri kullanılarak) daha gerçekçi sınır koşulları olarak ölçülmesini içerebilir. Ayrıca, aynı anda yer değiştirme, kan hızı ve basıncın ölçülmesi, fazlarının doğru bir şekilde eşleşmesini sağlayacaktır.
- Kullanıcı Tanımlı İşlevleri (UDF) derleyerek pulsatil kan hızını ve basıncını tanımlayan profiller oluşturun. Burada literatürdeki insan hastalardan ölçülen geçici profiller uygulandı 39, Bir Fourier serisi olarak modellendi, matematiksel olarak şöyle tanımlandı:
- Yer değiştirme
3. Arter/yapısal
- Arter ve lipit için malzeme özelliklerini ayarlamak için mühendislik verilerini girin ve arter adı verilen yeni bir malzeme ekleyin. Yoğunluğu ve 5 parametreli Mooney-Rivlin modelini yeni malzemeye sürükleyin ve parametrelerini ayarlayın. Literatürdeki intima 42 ve lipid43 özelliklerine dayanarak Tablo 1'de açıklanan1.000 kg/m3 yoğunluk ve hiperelastik katsayıları girin. Lipit için bunu tekrarlayın.
NOT: Mooney-Rivlin modeli44ile açıklanmıştır: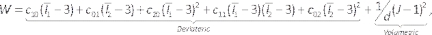 (6)
(6)
Burada c10, c01, c20, c11ve c02 malzeme sabitleridir ve d sıkıştırılamazlık parametresidir (bu durumda sıkıştırılamaz malzeme için sıfır). Burada X, gerinim tensörünün x. - Model bileşenini girin, Lümen/Akışkan'a sağ tıklayarak ve Bastır 'ı (Şekil 7A) seçerek lümen/akışkan bileşenini bastırın. Daha önce tanımlanmış malzemeleri, malzeme açılan listesinden seçerek, ünitelerin uygun olup olmadığını kontrol ederek arter ve lipid katılarına atayın.
- Geometrinin artık meshlenmesi gerekiyor. Mesh ' e tıklayın (Şekil 7B), fizik tercihini doğrusal olmayan mekanik olarak ayarlayın ve mesh boyutlandırmasını belirtin. Burada 0,14 mm hedef boyutu ile adaptif meshleme kullanılmıştır. Makul mesh eğriliği değerleri elde etmek için mesh tercihlerini gerektiği gibi ayarlayın ve lifli kapak gibi boşluklarda en az iki ila üç kafes elemanı hedefleyin. Karmaşık geometri nedeniyle ağın oluşturulması biraz zaman alabilir.
NOT: Sonuçların mesh özellikleri tarafından etkilenmemesini sağlamak için bir mesh bağımsızlığı çalışması yapılmalıdır. Mesh boyutunu kademeli olarak azaltın ve varyasyon belirlenen sınırdan az olana kadar sonuçları karşılaştırın; Bu durumda% 245 kullanıyoruz (üçüncü plağın lifli kapağında ölçülür). Ayrıca, mesh kalitesini sağlamak için mesh eğriliğini kontrol edin; yüksek mesh eğriliği yakınsama veya yanlış sonuçlar sırasında sayısal zorluklara neden olur. Eğriliği azaltmak için kafes boyutunu küçültmeyi deneyin veya büyüme hızını, maksimum boyutu ve/veya eğrilik açısını ayarlayın. Mesh bağımsızlık testimizin sonuçları Tablo 2'de özetlenmiştir Bu analiz boyunca kullanılan orta ağ boyutlandırmasına kıyasla sonuçlarda yüzde değişim. - Analiz ayarlarına tıklayın (Şekil 7C). FSI simülasyonları için, otomatik zaman adımlarını kapatın ve alt adım sayısını bire ayarlayın (sistem bağlantısı alt adımları kontrol eder), simülasyon bitiş saatini ayarlayın, bu durumda 0,8 s (hasta kalp hızı 75 bpm). Sistem bağlantısı zamanı ve alt seviyeleri kontrol eder.
- Çözücü denetimleri açılan listesinde, çözücü türünü doğrudan veya yinelemeli yöntemi kullanmak üzere program kontrollü olarak ayarlayın. Doğrudan yöntemler daha sağlamdır, ancak önemli miktarda daha fazla bellek kullanır. Newton-Raphson yöntemini tam olarak ayarlayın. (Simülasyondaki geometrinin karmaşıklığı ve doğrusal olmayanlığı nedeniyle, doğrudan yönteme ve tam Newton-Raphson yineleme yöntemine ihtiyaç duyulabilir; ancak bunlar hesaplama maliyetini önemli ölçüde artırır.)
- Akışkan-katı bir arabirim ekleyerek sistem bağlantı etki alanını arterin iç duvarı olarak belirtin. Bunu sağ tıklayarak yapın ve Geçici sekmesi (Şekil 7D) altında akışkan-katı bir arayüziçine yumun. Arayüz için arter duvarının içini seçin. Bu, bu konumdaki yapı ve akışkan arasında veri geçirir.
- Yer değiştirme sınır koşulları, giriş ve çıkışlara uygulanan x, yve z yönüne bir yer değiştirme işlevi olarak girilebilir. Bunu, Geçici sekmesinin altına sağ tıklayarak ve yer değiştirmeleri ekleyerek yapın (Şekil 7E). x, yve z yönleri için yer değiştirmeyi çoğaltın. Yön açılan listesinde, işlevi seçin ve 2.4.1 adımında ayıklanan yer değiştirmeleri kopyalayın.
NOT: Yer değiştirme, tercihlere bağlı olarak bir işlev veya puan tablosu olarak girilebilir. - Hataların giderilmesine yardımcı olmak için, Çözüm sekmesinin altına dört Newton-Raphson kalıntısı ekleyin. Bunlar, sorunlu geometriyi veya kafes konumlarını bulmak için hatalar ortaya çıkarsa görüntülenebilir.
NOT: Maksimum ana gerilim gibi işlem sonrası seçenekler eklemek için, Çözüm sekmesine sağ tıklayın ve uygun sonuçları ekleyin (Şekil 7F).
4. Kan/sıvı
- Model sekmesine girin, birimleri kontrol edin ve arter ve lipit kısmını bastırın, sıvı etki alanını 3.2 adımına benzer şekilde bırakın.
- Mesh metriklerini belirtin ve gerekirse eğriliği kontrol ederek ve ayarlayarak ağı oluşturun (maksimum duvar boyutu 0,12 mm olan 0,14 mm örgü boyutu uyguladık). Sıvı-katı etkileşimin meydana geldiği alanlarda yapısal kısımda olduğu gibi benzer ağ boyutu ve şekli kullanmak iyi bir uygulamadır.
NOT: Adım 3.3'te olduğu gibi, sonuçların Tablo 2'de gösterildiği gibi mesh özelliklerinden bağımsız olduğundan emin olmak için bir kafes bağımsızlığı testi yapılmalıdır. Mesh'in kalitesini kontrol edin ve eğriliğin düşük kalmasını ve mesh bağımsızlığına ulaşılabilmesini sağlamak için eleman boyutunu, büyüme hızını, inceltmeyi veya eğriliği gerektiği gibi ayarlayın. - Akışkan kurulumuna girmeden önce, ilgili yüzeye sağ tıklayarak ve seçim adlı kesici ucu seçerek giriş, çıkış ve duvar için adlandırılmış seçimler oluşturun.
- Kur sekmesini girin ve çift duyarlılığın etkinleştirildiğinden emin olun. Çözücü türünü Basınç Tabanlı olarak ayarlayın ve ilgili onay kutularını işaretleyerek Sürenin Geçici olarak ayarlanıp ayarlanmamasını sağlayın (Şekil 8A).
- Vikoz Modeller sekmesine(Şekil 8B)girerek ve ilgili onay kutularını kontrol ederek k-omega Viskoz Türbülans modelini etkinleştirin ve Kesme Stres Taşıma ve Düşük Reynolds Düzeltmeleri'ni etkinleştirin.
- Türbülanslı doğrusal olmayan viskozite modellerini etkinleştirmek için, komut konsoluna(Şekil 8C)'/define/models/viscous/turbulence-expert/turb-non-newtonian?' komutunu girin ve istendiğinde 'evet' girin.
- Malzemeler (Şekil 8D) altında, viskozite açılır listesinde yoğunluk girerek ve Newton olmayan güç yasasını seçerek kan özelliklerini tanımlayın. Sıvıyı kan olarak yeniden adlandırarak bunu yapın, 1.050 kg/m3yoğunluk ayarlayın ve Newton olmayan Güç Kanunu tutarlılık indeksini, k, 0,035'e, güç yasası dizinini, n , 0,6'ya ayarlayın.
NOT: Newton olmayan Güç Kanunu viskozite modeli, doğrusal olmayan kan viskozitesi46, ηsıvı gerinim oranı açısından, olarak tanımlamak için literatüre göre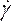 seçilmiştir:
seçilmiştir: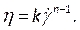 (7)
(7)
Kanın kesme inceltici doğasını yakalamak için Newton dışı çeşitli kan viskozite modelleri mevcuttur. Çeşitli yayınlar46,47,48,49, uygun modeli seçerken daha fazla bilgi için danışılması gereken çeşitli viskozite modellerinin etkinliğini ve katsayılarını araştırmıştır. - Daha önce adım 2.4.2'de açıklanan, geçici kan hızını ve basıncını içeren, komut satırlarında herhangi bir hata meydana gelen herhangi bir hata meydana gelenleri kontrol eden kullanıcı tanımlı işlevimizi derleyin (Şekil 8C). Şimdi Kullanıcı Tanımlı sekmesine girerek UDF'yi yükleyin (Şekil 8E), Derlenmiş'i seçip ADF'yi almadan önce dizinine gidin ve Oluştur 'uve ardından Yükle 'yitıklatın.
NOT: Metin konsolda görünecektir (Şekil 8C). Hata veya uyarı görünmemesi için bunu dikkatlice kontrol edin. UDF doğru yüklenirse, UDF adları konsolda görünür (Şekil 8C'devurgulanır). - Bunlar giriş ve çıkışa uygulanabilir. Bunu yapmak için Sınır Koşulları sekmesini seçin. Giriş ( Şekil8F) üzerine çift tıklayın ve profil açılan listesinden UDF girişini seçin. Çıkış basıncını da tanımlamak için bu adımı yineleyin.
- Dinamik ağı etkinleştirin (Şekil 8G'degösterilen Dinamik Mesh sekmesinin altındaki onay kutusunu işaretleyerek), yumuşatma, yeniden bağlama ve 6° serbestlik çözücü onay kutuları, difüzyon parametresini 1,5'e ve ağınız için uygun maksimum ve minimum ölçeklere ayarlama dahil.
- Maksimum ve minimum mesh ölçeklerinin mesh bölgesinin sınırları içinde olduğundan ve hedef eğriliğin 0,7 olarak ayarlı olduğundan emin olun. Kafes özellikleri, Kafes Özellikleri sekmesine tıklayarak gösterilebilir.
- Oluştur düğmesine tıklayarak yeni bir dinamik ağ bölgesi oluşturun, Bölge açılan listesinde lümenin duvarını belirtin ve Sistem Bağlantısı 'nıseçin. Bu, simülasyonun arter bileşenine veri aktarmak için arayüzdür.
- Kafes ölçeği için uygun değerlere sahip giriş, çıkış ve iç lümen için deforme edici kafes bölgeleri oluşturun. Bunu, Dinamik Ağ sekmesinde Oluştur 'u tıklatıp Deformasyon 'useçerek yapın. Yeniden işlemeyi ve yumuşatmayı etkinleştirin ve her bölgenin sınırlarına göre kafes ölçeklerini ayarlayın. Genellikle, negatif hücre hacmi hataları bu dinamik ağ ile ilişkilidir, bu nedenle dikkatlice kontrol edin ve her bölge için gerekirse kafes ölçeklerini ayarlayın.
- Basınç hızı bağlantılarının birleştiğinden emin olun ve Yöntemler sekmesine (Şekil 8H)girerek ve ilgili açılan listelerden seçimler yaparak geçici formülasyon ve uzamsal ayrışma düzenlerini ikinci sıraya ayarlayın.
- Kontrollerde (Şekil 8H), iki numaralı bir courant girin ve Monitörler sekmesinde artık yakınsama ölçütlerini ayarlayın (Şekil 8I). Süreklilik için 1e-5, geri kalanı için 1e-6 değerini kullandık.
NOT: Courant sayısı mesh boyutuna, dx, zaman adımı boyutuna, dtve kanın hızına göre tahmin edilebilir, v, kullanarak: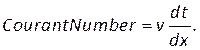 (8)
(8)
Bu numarayı Kontroller sekmesindeki(Şekil 8H)kabadayı numarası bölümünün altına girin. Burada iki numaralı bir Courant uyguluyoruz. Courant sayısı genellikle birden azdır; ancak, örtük çözelti yöntemleri ile bağlantılı basınç hızı çözücü kullanıldığından, sonuç doğası gereği daha kararlı ve bu değere daha az duyarlıdır; bu nedenle, iki kabul edilebilir olarak kabul edilir. - Yerel normalleştirilmiş sarmalık (LNH) gibi sonuçlar için özel bir işlev tanımlamak üzere Parametreler ve Özelleştirme sekmesi(Şekil 8J)altında özel alan işlevlerini seçin ve sağ tıklatıp Yeni 'yi seçerek yenibir işlev ekleyin. Gerektiği gibi tanımlamak için açılır pencereyi kullanın. Çözücü değişkenlerinin açılan listesini kullanarak formülü girin. Temsili bir sonuç olarak, aşağıdakiler tarafından açıklanan özel bir işlev olarak LNH50,51, hız ve
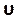 vorticity, ω, vektörler arasındaki hizalamanın bir ölçüsünü kullanıyoruz:
vorticity, ω, vektörler arasındaki hizalamanın bir ölçüsünü kullanıyoruz: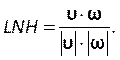 (9)
(9)
NOT: Osilatör kesme indeksi (OSI)52 , 53, akış ters çevrilmesinin bir ölçüsü gibi diğer özel değişkenler bu adımda tanımlanmalıdır. - Hesaplamayı Çalıştır sekmesinde (Şekil 8K), sonucun zamandan bağımsız olmasını sağlamak için zaman adımlarının sayısını 160 'a (0,005 sn adım boyutu ve 0,8 sn bitiş süresi), 5 ms zaman adım boyutunu ve yineleme sayısını 300 olarak ayarlayın.
NOT: Simülasyonun karmaşıklığına bağlı olarak, adım başına daha fazla yineleme gerekebilir. Tam sayısal yakınsama için çoklu kardiyak döngüler gerekebilir, bu bir sınırlama olarak not ettiğimiz bir şey; bununla birlikte, bu simülasyonlarla ilişkili hesaplama maliyeti nedeniyle koroner biyomekanik simülasyonlarında sıklıkla uygulanır. - Zaman İstatistikleri için Veri Örneklemesi onay kutusunun etkin olup olmadığını denetleyin ve Duvar İstatistikleri ve Akış Kesme Gerilmelerinin yanı sıra önceden tanımlanmış özel işlevin seçili olduğundan emin olun.
- İşlem sonrası için CFD-Post Uyumlu seçeneğini seçerek Hesaplama Aktiviteleri ve Otomatik Kaydetme sekmesinde ( Şekil8L)veri dışa aktarmayı oluşturun. Sonuçları ayrı bir yazılımla işlemek istiyorsanız, dışa aktarma türünü gerektiği gibi ayarlayın. Tüm bölgeleri (duvar, iç ağ, giriş, çıkış) ve dışa aktarılacak sonuçları seçin.
- Son olarak, Başlatma sekmesine girerek (Şekil 8M), Karma düzeni seçerek, Ayarlar'ı tıklatarak ve yineleme sayısını 20'ye artırarak simülasyonu karma şemayla başlatın. Başlat'ı tıklatın.
5. Sistem bağlantısı
- Hem yapısal hem de akışkan kurulumların sistem bağlantısına bağlı olduğundan ve güncel olduğundan emin olun. Şekil 9A'dagösterildiği gibi, yapısal ve akışkan kurulumu tıklatıp sistem bağlantısına sürükleyerek, her iki kurulumun da sağ tıklatıp Güncelleştir'i seçerek güncelleştirilmesini sağlayarak bunu yapın.
- Sistem Bağlantısı'nda, bitiş saatini 0,8 sn ve zaman dilimini 0,005 s olarak ayarlayın. Bunu, Analiz Ayarları 'nı (Şekil 9B-1) seçip bitiş saati ve zaman adım boyutunu girerek yapın. En fazla yinelemeyi 10 olarak ayarlayın.
NOT: Genellikle, hem yapısal hem de akışkan bileşenler iyi birleşiyorsa 10 ila 15 yineleme yeterlidir. - Sırasıyla akışkan ve yapısal bileşenlerden duvar ve katı arayüzü seçin ve Ctrl tuşunu basılı tutarak ve iki akışkan yapı arayüzünü seçerek bir veri aktarımı ekleyin (Şekil 9B-2); sağ tıklatın ve akışkan ve yapısal bileşenler arasında bir veri aktarımı oluşturun (Şekil 9B-3). Yakınsama yardımcı olmak için sıvıdan yapıya aktarılan kuvvetin az gevşemesini veya rampalanmasını ayarlayın.
NOT: Modelin karmaşıklığına, sınır koşullarına ve malzeme özelliklerine bağlı olarak, sayısal yakınsama için veri aktarımı rampası veya az gevşeme gerekebilir. Bunlar sıvı veri aktarımı için uygulanabilir (yani, sıvı bileşeninden arter duvarına aktarılan kuvvet). Bu seçenekler oluşturulan veri aktarımları içinde mevcuttur (Şekil 9B-2). - Çalışmaya hazır olduğunuzda Güncelleştir'i tıklatın. Yapısal ve akışkan yakınsama ve ilgili veri aktarımı yakınsaması gibi simülasyon verileri konsola yazdırılır.
NOT: FSI simülasyonlarının hesaplama açısından pahalı olduğunu ve bu simülasyonun 16 çekirdekli bir makinede (180 Gb fiziksel bellek (RAM) kullanarak 2,6 GHz Intel Xeon Gold) 11 gün süre aldığını ve donanım kurulumuna ve model karmaşıklığına bağlı olarak simülasyon sürelerinde daha fazla değişiklik olduğunu unutmayın. Temsili veri aktarımı artıkları grafikte gösterilmiştir (Şekil 9B-4) ve çözüm verileri konsola yazdırılır (Şekil 9B-5). İlk birkaç yinelemede, bir denge durumuna ulaşılana kadar veri aktarımı artıklarının yakınsaması tamamen elde edilemeyebilir. Bu, Şekil 9Biçin resim yazısının daha ayrıntılı olarak açıklanmıştır. - Simülasyon tamamlandığında, sonuçlar, 4.19 adımında açıklanan veri dışa aktarma türünüze bağlı olarak ticari yazılım içinde veya ayrı bir yazılımda işlenebilir.
Sonuçlar
Ateroskleroz ilerlemesinin hem yerleşik hem de gelişmekte olan biyomekanik belirteçleri için temsili sonuçlar sunulmuştur. WSS ve WSS türevi sonuçlar (zaman ortalamalı duvar kesme gerildirim (TAWSS) ve salınımlı kesme indeksi (OSI) dahil) gibi yerleşik ölçümler Şekil 10'dagörselleştirilmiştir. Kardiyak döngü üzerindeki duvar kesme stresi büyük ölçüde kan hızı tarafından yönlendirilir, ancak arter geometrisi ve hareketi / kasılması mekansal dağılımında ö...
Tartışmalar
Koroner biyomekaniği analiz etmek için FSI yöntemlerinin kullanılması, hem sayısal modelleme hem de klinik sonuç açısından hala gelişmekte olan bir alandır. Burada, OCT ve anjiyografik görüntülemeden yararlanarak, sonlu eleman/ sonlu hacim yöntemlerine dayalı olarak hastaya özgü bir FSI analizi oluşturmanın ana hatlarını açıkladık. Burada tarif ettiğimiz yöntem ticari bir sonlu eleman çözücü kullanırken, prosedür herhangi bir FSI özellikli yazılıma uygulanabilir. Metodolojide hala iyi...
Açıklamalar
Yazarların bu makalenin hazırlanması ile ilgili beyan edecekleri herhangi bir ihtilafı bulunmamaktadır. S.J.N. AstraZeneca, Amgen, Anthera, Eli Lilly, Esperion, Novartis,. Cerenis, The Medicines Company, Resverlogix, InfraReDx, Roche, Sanofi-Regeneron ve Liposcience ve AstraZeneca, Akcea, Eli Lilly, Anthera, Kowa, Omthera, Merck, Takeda, Resverlogix, Sanofi-Regeneron, CSL Behring, Esperion ve Boehringer Ingelheim'ın danışmanıdır. P.J.P., Abbott Vascular'dan araştırma desteği, Amgen ve Esperion'dan danışmanlık ücretleri ve AstraZeneca, Bayer, Boehringer Ingelheim, Merck Schering-Plough ve Pfizer'dan konuşmacı honoraria aldı.
Teşekkürler
Yazarlar, Adelaide Üniversitesi, Royal Adelaide Hastanesi (RAH) ve Güney Avustralya Sağlık ve Tıbbi Araştırma Enstitüsü (SAHMRI) tarafından sağlanan desteği kabul etmek istiyor. COCOMO-ACS denemesi, Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) (ID1127159) ve Avustralya Ulusal Kalp Vakfı'nın (ID101370) proje hibeleri ile finanse edilen araştırmacı tarafından başlatılan bir çalışmadır. H.J.C. Westpac Scholars Trust (Geleceğin Liderleri Bursu) bursu ile desteklenmektedir ve Adelaide Üniversitesi, Makine Mühendisliği Fakültesi ve Eğitim, Beceri ve İstihdam Araştırma Eğitim Programı (RTP) bursundan destek kabul eder. S.J.N., NHMRC'den (ID1111630) Başlıca Araştırma Bursu alır. P.J.P., Avustralya Ulusal Kalp Vakfı'ndan (FLF102056) Seviye 2 Gelecekteki Lider Bursu ve NHMRC'den (CDF1161506) Seviye 2 Kariyer Geliştirme Bursu alır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
Referanslar
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır