A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טומוגרפיה קוהרנטית אופטית מבוסס ביומכנית נוזל מבנה ניתוח של טרשת עורקים כלילית התקדמות
In This Article
Summary
יש צורך לקבוע אילו נגעים טרכו-עורקים יתקדמו vasculature כלילית כדי להנחות התערבות לפני אוטם שריר הלב מתרחשת. מאמר זה מתאר את המודל הביומכני של העורקים מטומוגרפיה קוהרנטית אופטית באמצעות טכניקות אינטראקציה של מבנה נוזלים בפותל אלמנטים סופי מסחרי כדי לעזור לחזות התקדמות זו.
Abstract
במאמר זה, אנו מציגים זרימת עבודה מלאה לניתוח ביומכני של פלאק תרמית באזור כלילית. עם טרשת עורקים כאחד הגורמים המובילים למוות עולמי, תחלואה ונטל כלכלי, יש צורך בדרכים חדשניות לניתוח וחיזוי התקדמותה. שיטה חישובית אחת כזו היא השימוש באינטראקציה בין מבנה נוזלים (FSI) כדי לנתח את האינטראקציה בין זרימת הדם לבין תחומי העורק/פלאק. יחד עם הדמיית in vivo, גישה זו יכולה להיות מותאמת לכל מטופל, ומסייעת להבדיל בין לוחות יציבים ולא יציבים. אנו מתארים את תהליך השיקום התלת מימדי, תוך שימוש בטומוגרפיה של קוהרנטיות אופטית תוך-וסקולרית (OCT) ובאנגיוגרפיה כלילית פולשנית (ICA). הפקת תנאי הגבול לסימולציה, כולל שכפול התנועה התלת ממדית של העורק, נדונה לפני ההתקנה והניתוח מתבצעים בפותל אלמנטים סופי מסחרי. ההליך לתיאור המאפיינים ההיפר-אלסטיים הלא ליניאריים ביותר של דופן העורק ומהירות הדם הפועמת / לחץ מתואר יחד עם הגדרת צימוד המערכת בין שני התחומים. אנו מדגימים את ההליך על ידי ניתוח פלאק שאינו אשם, סטנוטי מעט, עשיר בשומן בחולה בעקבות אוטם שריר הלב. סמנים מבוססים ומתעוררים הקשורים להתקדמות פלאק תרמית, כגון מתח הטיה קיר ו helicity מנורמל מקומי, בהתאמה, נדונים הקשורים לתגובה המבנית בקיר העורק ובפלאק. לבסוף, אנו מתרגמים את התוצאות לרזיונום קליני פוטנציאלי, דנים במגבלות ומתווים תחומים לפיתוח נוסף. השיטה המתוארת במאמר זה מראה הבטחה לסיוע בקביעת אתרים בסיכון להתקדמות טרשת עורקים, ולכן יכולה לסייע בניהול הנטל המשמעותי של מוות, תחלואה ונטל כלכלי של טרשת עורקים.
Introduction
מחלת לב כלילית (CAD) היא הסוג הנפוץ ביותר של מחלות לב ואחד הגורמים המובילים למוות ונטל כלכלי ברחבי העולם1,2. בארצות הברית, בערך אחד מכל שמונה מקרי מוות מיוחס ל- CAD3,4, בעוד שרוב מקרי המוות העולמיים מ- CAD נראים כיום במדינות בעלות הכנסה נמוכה ובינוניות5. טרשת עורקים היא המניע השולט של מקרי מוות אלה, עם קרע פלאק או שחיקה המובילה לאוטם עורקים כליליים אוטם שריר הלב חריף (AMI)6. גם לאחר revascularization של נגעים כלייליים אשמים, חולים יש סיכון משמעותי של אירועים קרדיווסקולריים שליליים גדולים חוזרים ונשנים (MACE) לאחר AMI, בעיקר בשל נוכחות בו זמנית של לוחות אחרים שאינם אשמים כי הם גם פגיעים לקרע7. הדמיה תוך-קורונית מספקת הזדמנות לזהות את הלוחות בסיכון גבוה8. למרות אולטרסאונד תוך וסקולרי (IVUS) הוא תקן הזהב להערכת נפח פלאק, יש לו רזולוציה מוגבלת לזהות תכונות מיקרו מובנות של פלאק פגיע בניגוד לרזולוציה גבוהה (10-20 מיקרומטר) של טומוגרפיה קוהרנטית אופטית (OCT). כובע סיבי דק ודלקתי מעל בריכת שומנים גדולה הוכח להיות החתימה החשובה ביותר של לוח פגיע9 והוא מזוהה ונמדד בצורה הטובה ביותר על ידי OCT בין שיטות הדמיה תוך-קורוניאלי זמין כרגע10. חשוב לציין, OCT הוא גם מסוגל להעריך תכונות פלאק בסיכון גבוה אחרות, כולל: קשת שומנים בדם; חדירת מקרופאגים; נוכחות של פיברות'ומה כובע דק (TCFA), אשר מוגדר כמו ליבה עשירה בשומנים עם כובע סיבי דק overlying (<65 מיקרומטר); הסתיידות מנומרת; ומיקרוכנלים פלאק. זיהוי OCT של תכונות בסיכון גבוה אלה בלוחות שאינם אשמים לאחר AMI קושר לסיכון מוגבר של עד פי 6 ל- MACE11עתידי . עם זאת, למרות זאת, היכולת של אנגיוגרפיה הדמיה OCT לחזות אילו לוחות כלילית יתקדמו ובסופו של דבר קרע או לשחוק מוגבלת, עם ערכי חיזוי חיוביים של רק 20%-30%8. יכולת חיזוי מוגבלת זו מעכבת קבלת החלטות קליניות שסביבן לוחות שאינם אשמים לטיפול (למשל, על ידי סטנטינג)7,12.
בנוסף לגורמי המטופל והמאפיינים הביולוגיים של פלאק, כוחות ביומכניים בעורקים הכליליים הם גם דטרמיננטים חשובים של התקדמות פלאק וחוסר יציבות13. טכניקה אחת המציגה הבטחה לסיוע בהערכה מקיפה של כוחות אלה היא סימולציה של אינטראקציה עם מבנה נוזלים (FSI)14. מתח גזוז קיר (WSS), המכונה גם מתח גזוז אנדותל, היה מוקד מסורתי למחקר ביומכניקה כלילית15, עם הבנה כללית כי WSS ממלא תפקיד אטיולוגי היווצרות טרשת עורקים16. בעיקר מדומה באמצעות דינמיקת נוזל חישובי (CFD) טכניקות, אזורי WSS נמוך קושרו עם עיבוי intimal17, שיפוץ כלי דם18 ואת התחזית של התקדמות נגע19 ו- MACEבעתיד 20. ההתקדמות האחרונה ניתוחים אלה מצביעה על טופולוגיית שדה וקטור WSSהבסיסית 21, ואת המאפיינים הרב-כיווניים שלה22, כמנבא טוב יותר של סיכון טרשת עורקים מאשר גודל WSS בלבד. עם זאת, WSS רק לוכד הצצה של המערכת הביומכנית הכוללת בקיר לומן, ובדומה לאופני הדמיה, אף מדד ביומכני אחד לא יכול להבחין באופן אמין בתכונות מיזוג עורקים בסיכון גבוה.
מדדים נוספים מתגלים כחשובים פוטנציאליים בהיווצרות טרשת עורקים. מאפייני זרימה תוך-אלומינלית23 הם דוגמה אחת כזו, עם זרימה הללית, המכונה דרך מדדים שונים24, הציע לשחק תפקיד atheroprotective על ידי דיכוי דפוסי זרימה מופרעים25,26. בעוד טכניקות CFD יכול לנתח את מאפייני הזרימה ולהציג מגוון רחב של תוצאות שימושיות, הם אינם רואים את האינטראקציות הבסיסיות בין זרימת הדם, מבנה העורק ותנועת הלב הכללית. פישוט זה של המערכת הדינמית לקיר נוקשה מפספס תוצאות שעלולות להיות קריטיות כגון מתח כובע סיבי. בעוד הדיון בעד ונגד הצורך ב- FSI על פני CFD נמשך27,28,29, השוואות רבות מזניחות לכלול את ההשפעה של תפקוד החדר. מגבלה זו ניתן להתגבר עם FSI, אשר הראה כי כיפוף דינמי ודחיסה המופעלים על העורק באמצעות ההשפעה של תפקוד החדר יכול להשפיע באופן משמעותי על פלאק ומתח מבני עורק, כמו גם מדדי זרימה כגון WSS30,31,32. זה חשוב כמו לחצים מבניים הם גם מדד מפתח לניתוח וחיזוי קרע פלאק33,34, הוצעו לאתר במשותף עם אזורים של גידול פלאק14,35. לכידת אינטראקציות אלה מאפשרת ייצוג מציאותי יותר של הסביבה הכלילית והמנגנונים הפוטנציאליים של התקדמות המחלה.
בהמשך לכך, אנו מתארים כאן את תהליך פיתוח הגיאומטריה הספציפית למטופל מ- OCT Imaging36 וההקמת והפעלה של סימולציית FSI עורקית באמצעות פותר אלמנטים סופי מסחרי. התהליך לחילוץ ידני של הלומן, השומנים וקיר העורק החיצוני מפורט לפני השחזור החישובי התלת מימדי של עורק המטופל. אנו מתארים את הגדרת הסימולציה, צימוד ותהליך ההשוואה בין פרמטרי הדמיית OCT בסיסיים ומעקב כדי לקבוע את התקדמות הנגע. לבסוף, אנו דנים לאחר עיבוד של תוצאות מספריות וכיצד נתונים אלה עשויים להיות רלוונטיים קליניים על ידי השוואת התוצאות הביומכניות עם התקדמות/רגרסיה של נגעים. השיטה הכוללת מודגמת על לוחות שריר הלב שאינם אשמים, סטנוטיים מעט, עשירים בשומנים בעורק הכלילי הימני (RCA) של גבר לבן בן 58 שהציג אוטם שריר הלב חריף שאינו ST בהגדרת יתר לחץ דם, סוכרת מסוג 2, השמנת יתר (BMI 32.6) והיסטוריה משפחתית של CAD מוקדם. אנגיוגרפיה כלילית והדמיה OCT בוצעו במהלך האשפוז הראשוני שלו, ולאחר מכן 12 חודשים מאוחר יותר כחלק מניסוי קליני מתמשך (ניסוי COCOMO-ACS ACTRN12618000809235). אנו צופים כי טכניקה זו יכולה להיות מעודנת יותר ומשמשת לזיהוי לוחות כלילית הנמצאים בסיכון גבוה להתקדמות.
Protocol
הנתונים המנוקדים הבאים נותחו ממטופל שגויס לניסוי המתמשך של COCOMO-ACS מבוקר אקראי (ACTRN12618000809235; רויאל אדלייד בית החולים HREC מספר התייחסות: HREC / 17/RAH /366), עם אישור אתי נוסף שניתן על ידי מרכז אדלייד רשת הבריאות המקומית (CALHN) שירותי מחקר לצורך סימולציה ביומכנית (CALHN מספר 14179). איור 1 מסכם את זרימת העבודה המלאה המתוארת בפרוטוקול הבא, שניתן להחיל על כל תוכנה או קודים התומכים ב- FSI.
1. הערכת תמונה
- התאם תמונות מעקב בסיסיות ו- OCT באמצעות ציוני דרך אנטומיים כגון bifurcations ושימוש בתמונות מיד קרוב ל bifurcation דיסטלי דיסטלי ואת דיסטליה לביפורציה הפרוקסימלית ביותר. יש לנתח את התמונות התואמות בין ציוני הדרך הללו, כמתואר באיור 2A.
- חתך רוחב של לומן OCT
- טענו כל תמונת OCT לדיגיטציה של התמונה ולחצו כדי לסמן נקודות בנקודת המרכז ובמגבלות של קנה המידה(איור 2B). יצא נקודות אלה לשימוש מאוחר יותר.
- סמן ידנית את קצה הלומן, החל מאותו מיקום בכל תמונה, הקפד ללכוד את הקימורים של הלומן בצורה מדויקת ככל האפשר. השאירו פער בחתח הקטטר מכיוון שתהליך השחזור יתפשט ברחבי האזור בשלב מאוחר יותר. יצא קבצים אלה בתבנית .dat וחזור על כך עבור כל תמונה.
- קיר החיצוני של OCT ושומנים
- בתוכנת DICOM, חלצו את הקיר החיצוני באזורי החלה גבוהים באמצעות חלקים גלויים של הממברנה האלסטית החיצונית כדי להתאים באופן ידני אליפסה כדי להעריך את מיקום הקיר החיצוני, כמתואר באיור 3. לחץ וגרור את לחצן העכבר השמאלי כדי להגדיר את האליפסה ואת המיקום בהתאם.
- הגדר ידנית את קשת השומנים, המחושבת לעובי הלומן סנטרואיד והכובע הסיבי, כמתואר באיור 3, על-ידי לחיצה וגרירה של מידות זווית ומרחק, בהתאמה. אלה ישמשו לניתוח התקדמות הנגע יחד עם אזור לומן.
- יש לייבא תמונות אלה עם שכבות-על לתוך הדיגיטציה של התמונה ולבחור באופן ידני את נקודות הקיר החיצוניות, תוך שימוש באליפסה המותאמת כמדריך באזורים של הפחתה גבוהה שבהם הממברנה האלסטית החיצונית אינה נראית לעין. חזור על שלב 1.2.2 כדי לבחור ולייצא את הנקודות לתבנית .dat.
- באופן דומה עבור השומנים, באופן ידני לבחור את משטח השומנים, החל מאותו קצה של השומנים בכל מקרה. השתמש במדריך האליפסואידי בקיר החיצוני (שלב 1.3.1) לקשת אחורית עקבית. ייצוא מצביע על קובץ .dat וחוזר על עצמו עבור כל התמונות עם שומנים נוכחים, משאיר רווח על פני החפץ guidewire כמתואר בשלב 1.2.2.
הערה: התקדמות הנגע מנותחת על ידי השוואת שלושה מדדים, כלומר, אזור לומן, קשת השומנים ועובי מכסה סיבי, אשר ניתן להעריך ישירות מן הצופה DICOM. הטכניקה לחילוץ הקיר החיצוני ואת הישבן השומנים נדרשת בשל עומק החדירה המוגבל של OCT. OCT שימש בחקירה זו בשל ההתמקדות בקשר בין הרכב פלאק וכוחות ביומכניים.
- קו האמצע מבוסס אנגיוגרפיה
- טען את התמונה האנגיוגרפית הראשונה בדיגיטציה שלהתמונה 37. בחרו בשולי הקטטר כדי לשנות את קנה המידה של התמונה בשלבים מאוחרים יותר, ולאחר מכן סמנו ידנית את קו האמצע של הצנתר החל מהסמן הפרוקסימלי ונעים בצורה שווה, עם נקודות מרווחות באופן שווה, כפי שמוצג באיור 4A. יצא את הנתונים לתבנית .dat וחזר על הפעולה עבור המישור האנגיוגרפי השני.
הערה: בדרך כלל, מישורים עם זווית גדולה יותר כי 20° ביניהם משפר את חוסן שחזור קו האמצע תלת ממדי. הקטטר ו- OCT guidewire צריכים להיות גלויים בכל תמונה.
- טען את התמונה האנגיוגרפית הראשונה בדיגיטציה שלהתמונה 37. בחרו בשולי הקטטר כדי לשנות את קנה המידה של התמונה בשלבים מאוחרים יותר, ולאחר מכן סמנו ידנית את קו האמצע של הצנתר החל מהסמן הפרוקסימלי ונעים בצורה שווה, עם נקודות מרווחות באופן שווה, כפי שמוצג באיור 4A. יצא את הנתונים לתבנית .dat וחזר על הפעולה עבור המישור האנגיוגרפי השני.
2. שחזור תלת מימדי
- תחזיות אנגיוגרפיה
- טען את קבצי הנתונים שיוצאו בשלב 1.4. השתמש בשתי הנקודות הראשונות כדי לשנות את קנה המידה של הנתונים למילימטרים (שתי הנקודות הראשונות משמשות עם מפרטי הצנתר הידועים, 6F במקרה זה). הפחת את נקודת הנתונים הפרוקסימלית מהנקודות הנותרות בכל ערכת נתונים כך שהעקומה תתחיל במקור מערכת הקואורדינטות.
- צור מטריצות סיבוב עבור כל תצוגה אנגיוגרפית, שבה θ ו- Φ מייצגים את זוויות RAO / LAO ו- CAU / CRA, בהתאמה. אנו משתמשים בזוויות LAO ו- CRA כשליליות. שתי מטריצות הסיבוב בכיווני x (Rotx) ו- y (Roty), בהתאמה, הן:
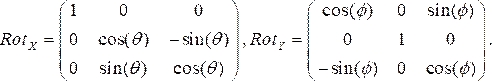 (1)
(1) - הכפילו את מטריצות הסיבוב יחד, ולאחר מכן הכפילו אותן בקואורדינטות של כל נקודה בשלב 2.1.1. המשוואה המתקבלת:
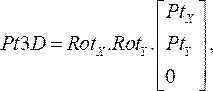 (2)
(2)
מעניק את המיקום התלת-ממדי של נקודת הצנתר במישור אנגיוגרמה (Pt3D) על-ידי סיבוב הנקודות הדו-ממדיות שצוינו מכל תמונה אנגיוגרפית. - חשב את הווקטור הנורמלי לכל מישור אנגיוגרפי על-ידי הכפלת מטריצות הסיבוב x ו- y על-ידי וקטור היחידה בכיוון z. ממיקום פרוקסימלי למיקום דיסטלי, הקרן כל נקודה נורמלית למישור שלה וחשב את נקודת האמצע של המרחק הקצר ביותר בין התחזיות. התוצאה היא הנקודה התלת-ממדית במדריך OCT בחלל.
- באמצעות הפונקציה 'interparc', הזמינה מחילופי הקבצים המרכזיים של MATLAB38, חלק את קו האמצע התלת-ממדי לנקודות מרווחות באותה מידה. המרווח בין נקודות צריך להיות שווה למרווח בין תמונות OCT, שנקבע על-ידי מהירות הנסיגה. אלה המיקומים שבהם יוצבו חתך הרוחב של OCT.
- סיבוב חתך רוחב של OCT
- באמצעות קובץ הנתונים המכיל את מרכז הקטטר ואת קנה המידה, המר כל חתך מהפיקסלים ל- mm באמצעות הנקודות השני והשלישי בקובץ קנה המידה. כדי למרכז את החתך על מיקום הצנתר, הפחת את הנקודה הראשונה בקובץ קנה המידה (מרכז הצנתר) מכל נקודות החתך. חשב את הווקטור הרגיל לחתך (במקביל לצנתר בעורק) על-ידי חיסור נקודת קו האמצע התלת-ממדית מנקודת הדיסטל הבאה לאורך עקומת הצנתר.
- סובב את חתך OCT כדי ליישר בניצב לקו האמצע של הצנתר על-ידי הכפלת נקודות הנתונים שקנה המידה שלהן משתנה במטריצה הסיבוב:
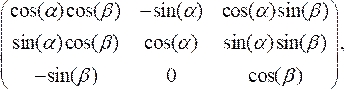 (3)
(3)
איפה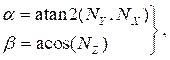 (4)
(4)
ו- NX, NYו- NZ הם רכיבי x , Y ו- z, בהתאמה, של הווקטור הנורמלי המחושב בסעיף 2.1. הוסף את נקודת קו האמצע התלת-ממדית לכל הנקודות המסובבות בחתך, וכתוצאה מכך המיקום החוצה-חתך במרחב תלת-ממדי (איור 4B). - חזור על שלבים 2.2.1-2.2.2 עבור כל חתך רוחב (לומן, עורק ושומנים). יצא את המקטעים הצולבים לקובץ טקסט, שניתן לייבא לתוכנת העיצוב בסיוע המחשב (CAD) ליצירת גוף מלא סופי.
- יצירת דגם מלא תלת-ממדי
- בתוכנת מידול תלת-ממדית, יבא וצור את החלקים הצולבים של קובץ אחד בכל פעם. יבא את קבצי הטקסט המכילים את החלקים הצולבים לתוך תוכנת המידול תלת-ממדי על-ידי לחיצה על התיבה הנפתחת של הרעיון (איור 5A-1) ובחירת עקומת תלת-ממד (איור 5A-2). לחץ על צור.
- כדי ליצור רכיב מוצק, בחר את כל העקומות לפי הסדר ורכיב אותן יחד (איור 5A-3), והבטח שנבחר להוסיף קפוא כדי ליצור מוצק חדש. בצע את השלבים הבאים עבור לומן, שומנים, וקיר החיצוני כדי ליצור מוצקים נפרדים, להבטיח לאפשר טופולוגיית מיזוג.
הערה: ייתכן שיהיה צורך לדלג על עקומה אם מתעוררת גיאומטריה בעייתית. בשחזור זה, להשמיט שומנים קטנים באמצע החלק בשל גודלו ואת העלות החישובית הנוספת ומורכבות מספרית הקשורים להכללתו. - כדי להחסיר את הלומן והשומנים מקיר העורק, צרו מבצע בוליאני מהרשימה הנפתחת של יצירתם ובחרו את גוף היעד כקיר ואת השומנים/לומן כגופי הכלים כדי להחסיר את הלומן והשומנים מקיר העורק (איור 5A-4).
- שתף טופולוגיה בין הקיר לבין השומנים כדי להבטיח צמתי רשת משותפים בשלבים עתידיים. כדי לעשות זאת, הדגישו ידנית את הקיר והשומנים ולחצו לחיצה ימנית כדי ליצור חלק חדש(איור 5A-5).
הערה: שלב זה מבטיח שצמתי רשת משותף בין המשטחים המונעים אזורי מגע לא תקינים או חדירת רשת בין שתי השכבות, ומסייעים מאוד בשלב הפתרון. הגיאומטריה הסופית של קו האמצע של הצנתר, השומנים, הלומן וקיר העורק מוצגת באיור 5B.
- טרום עיבוד: תנאי גבול
הערה: לפני הגדרת הסימולציה, יש צורך בתנאי גבול ספציפיים למטופל (BC) . כאן נעשה שימוש בתזוזה שחולצה מהאנגיוגרפיה, המיושמת על המפרצון והשקע של הסימולציה ומהירות זרימת הדם / לחץ שנמדדו מחולים אנושיים ומתוארים בספרות39.- הזחה
- חזור על שלבים 1.4 ו- 2.1, אך בחירת הסמנים הדיסטליים והפרוזומים בלבד, החל מהתמונה האנגיוגרפית שקודמה לסיום דיאסטולה. לעשות זאת עבור כל תמונות אנגיוגרפיות על מחזור לב אחד.
- התאם את קווי ההחלקה לקואורדינטות x, y ו- z של שתי קבוצות הנקודות. התוצאה היא עקירה של אזורי המפרצון והשקע. תוצאות מייצגות של תזוזות החולה מוצגות באיור 6A.
הערה: ניתוח תזוזה החל בתמונה שקדמה לסיום-דיאסטולה כדי להתאים בצורה הטובה ביותר את שלבי ההעתקה שחולצו לבין פרופילי הלחץ והמהירות המוחלים שנמצאו בסעיף 3.1.2, שהשלב הסיסטולי שלו מתחיל ב- 0.1 s (מתאים למרווח בין תמונות אנגיוגרפיות). בעת חילוץ תנועה, ודא שאין תנועת גלילה רציפה/תמונה של טבלה לאורך כל ערכת התמונה.
- מהירות דם/לחץ
- צור פרופילים המתארים את מהירות הדם הפועם והלחץ על-ידי הידור פונקציות המוגדרות על-ידי המשתמש (UDF). כאן פרופילים ארעיים שנמדדו מחולים אנושיים בספרות יושמו 39, מודל כסדרת פורייה, המתוארת מתמטית על ידי:
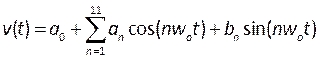 , (5)
, (5)
כאשר t הוא הזמן, w0 הוא התדירות, T הוא תקופת האות, n הוא מספר המונחים, ו0-11, b1-11 הם מקדמים המותאמים לפרופילים המתוארים בספרות. במקרה זה, אנו משתמשים ב- 11 המונחים הראשונים. - הערה: פרופילים אלה מתוארים באיור 6B ויש לכתוב אותם בקובץ בתבנית C בסביבת פיתוח משולבת כגון Microsoft Visual Studio. לחץ שקע הוא פרופיל שטוח ומהירות המפרצון מוחלת כפרופיל פרבולי מפותח במלואו, המתואר כמספיק כדי לשחזר תנאים מציאותיים40. התפתחות נוספת של הליך זה יכולה לכלול מדידת מהירות הדם של המטופל (כגון על ידי אקוקרדיוגרפיה דופלר41) ולחץ (באמצעות חוטי לחץ) כתנאי גבול מציאותיים יותר. יתר על כן, מדידת עקירה, מהירות דם ולחץ בו זמנית תבטיח שהשלבים שלהם יתאימו במדויק.
- צור פרופילים המתארים את מהירות הדם הפועם והלחץ על-ידי הידור פונקציות המוגדרות על-ידי המשתמש (UDF). כאן פרופילים ארעיים שנמדדו מחולים אנושיים בספרות יושמו 39, מודל כסדרת פורייה, המתוארת מתמטית על ידי:
- הזחה
3. עורק/מבני
- כדי להגדיר את תכונות החומר עבור העורק והשומנים, הזן נתונים הנדסיים ולהוסיף חומר חדש הנקרא עורק. גרור צפיפות ואת מודל מוני-ריבלין 5 פרמטרים לחומר החדש ולהגדיר את הפרמטרים שלהם. הזן צפיפות של 1,000 ק"ג / מ'3 ואת מקדמי hyperelastic המתואר בטבלה 1, המבוסס על אינתימה42 ו43 שומנים בספרות. חזור על זה עבור השומנים.
הערה: מודל מוני-ריבלין מתואר על ידי44: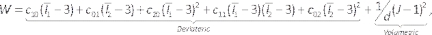 (6)
(6)
כאשר c10, c01, c20, c11 ו- c02 הם קבועים חומריים ו- d הוא פרמטר חוסר הדיכוי (אפס עבור חומר בלתי ניתן לריסון במקרה זה). כאן אניx הוא xinvariant של טנסור המתח ו J הוא דטרמיננט שיפוע עיוות עיוות אלסטי. - הזן את רכיב הדגם, דכא את רכיב הלומן/נוזל על-ידי לחיצה ימנית על הלומן/נוזל ובחירה באפשרות דיכוי (איור 7A). הקצה את החומרים שהוגדרו בעבר לעורק ולמוצקי השומנים על-ידי בחירתם מהרשימה הנפתחת של החומר, ובדוק אם היחידות מתאימות.
- הגיאומטריה עכשיו צריכה להיות רשת. לחץ על רשת שינוי(איור 7B),הגדר את העדפת הפיזיקה למכנית לא ליניארית וציין את שינוי גודל הרשת. כאן נעשה שימוש במיזוג אדפטיבי עם גודל יעד של 0.14 מ"מ. התאם את העדפות הרשת לפי הצורך כדי להשיג ערכי היתדות רשת סבירים ולכוון לפחות לשניים עד שלושה רכיבי רשת על פני פערים כגון המכסה הסיבי. יצירת הרשת עשויה להימשך זמן מה עקב הגיאומטריה המורכבת.
הערה: יש לערוך מחקר עצמאות רשת כדי להבטיח שהתוצאות לא יושפעו מאפייני רשת. להקטין בהדרגה את גודל רשת השינוי ולהשוות תוצאות עד שהווריאציה קטנה ממגבלה מוגדרת; במקרה זה, אנו משתמשים 2%45 (נמדד על מכסה סיבית של הלוח השלישי). יתר על כן, כדי להבטיח את איכות הרשת, לבדוק את ההטיה רשת; הטיות רשת גבוהה תגרום לקשיים מספריים במהלך התכנסות או תוצאות לא מדויקות. כדי להקטין את ההאטה, נסה להקטין את גודל הרשת או להתאים את קצב הצמיחה, הגודל המרבי ו/או זווית העקמומיות. התוצאות עבור בדיקת עצמאות הרשת שלנו מפורטות בטבלה 2, עם שונות באחוזים בתוצאות בהשוואה לשינוי גודל רשת בינונית, אשר שימש לאורך ניתוח זה. - לחץ על הגדרות ניתוח (איור 7C). עבור סימולציות FSI, כבה את הזמן האוטומטי והגדר את מספר תת-הteps לאחד (צימוד המערכת ישלוט בteps משנה), הגדר את זמן הסיום של הסימולציה, במקרה זה 0.8 s (קצב לב המטופל של 75 bpm). צימוד המערכת ישלוט בזמן ובצעדי המשנה.
- ברשימה הנפתחת פקדי Solver, הגדר את סוג Solver לתוכנית הנשלטת לשימוש בשיטה הישירה או האיטרטיבית. שיטות ישירות חזקות יותר אך משתמשות בכמות משמעותית יותר זיכרון. תמלא את שיטת ניוטון-רפסון. (בשל המורכבות של הגיאומטריה והלא ליניאריות בסימולציה, ייתכן שיהיה צורך בשיטה הישירה ובשיטת האיטרטיבית המלאה של ניוטון-רפסון; עם זאת, אלה מגדילים באופן משמעותי את עלות החישוב.)
- ציין את תחום צימוד המערכת כקיר הפנימי של העורק על-ידי החדרת ממשק מלא נוזלים. עשה זאת על-ידי לחיצה באמצעות לחצן העכבר הימני והטמעת ממשק מלא נוזלים תחת הכרטיסיה ארעי (איור 7D). בחר את החלק הפנימי של דופן העורק עבור הממשק. פעולה זו תעביר נתונים בין המבנה לנוזל במיקום זה.
- ניתן להזין את תנאי גבול ההעתק כפונקציית תזוזה בכיוון x, y ו- z המוחלים בכניסה ובשקעים. עשה זאת על-ידי לחיצה באמצעות לחצן העכבר הימני תחת הכרטיסיה ארעית והוספת תזוזות(איור 7E). שכפל את ההעתקה לכיווני x, y ו- z. ברשימה הנפתחת כיוון, בחר פונקציה והעתק את ההעתקות שחולצו בשלב 2.4.1.
הערה: ניתן להזין תזוזה כפונקציה או כטבלת נקודות בהתאם להעדפות. - כדי לסייע בפתרון שגיאות, תחת הכרטיסיה פתרון, הוסף ארבעה שיורית של ניוטון-רפסון. ניתן להציג אותם אם מתעוררות שגיאות כדי למצוא את הגיאומטריה הבעייתית או מיקומי רשת.
הערה: כדי להוסיף אפשרויות לאחר עיבוד, כגון מתח עיקרי מרבי, לחץ באמצעות לחצן העכבר הימני על הכרטיסיה פתרון והוסף את התוצאות המתאימות (איור 7F).
4. דם/נוזל
- הזן את הכרטיסיה מודל, בדוק את היחידות והעלים את החלק של העורק והשומנים, והשאר את תחום הנוזלים, באופן דומה לשלב 3.2.
- ציין את מדדי הרשת וצור את רשת שינוי, בדיקת ההטיה והתאמת במידת הצורך (החלנו גודל רשת 0.14 מ"מ עם גודל קיר מרבי של 0.12 מ"מ). זה תרגול טוב להשתמש בגודל רשת דומה וצורה, כפי שנעשה בחלק המבני, על האזורים שבהם מתרחשת אינטראקציה מוצקה נוזל.
הערה: כמו בשלב 3.3, יש לבצע בדיקת עצמאות רשת כדי להבטיח שהתוצאות אינן תלויות במאפייני רשת, כפי שמוצג בטבלה 2. בדוק את איכות הרשת ולהתאים את גודל היסוד, קצב הצמיחה, עידון או עקמומיות לפי הצורך כדי להבטיח ההטיה נשארת נמוכה וכי עצמאות רשת הוא הגיע. - צור בחירות בשם עבור הכניסה, השקע והקיר לפני הכניסה להגדרת הנוזל, על-ידי לחיצה באמצעות לחצן העכבר הימני על המשטח המתאים ובחירה באפשרות הוסף בחירה בעלת שם.
- הזן את הכרטיסיה התקנה והבטח דיוק כפול זמין. הגדר את סוג Solver ל'מבוסס לחץ' וודא שהזמן מוגדר כ'ארעי' על-ידי סימון תיבות הסימון המתאימות(איור 8A).
- הפעל את דגם המערבולת הצמיגית k-omega ואפשר הובלת מתח גמירה ותיקונים נמוכים ריינולדס על ידי הזנת הכרטיסייה מודלים צמיגים (איור 8B) וסימון תיבות הסימון שלהם בהתאמה.
- כדי לאפשר מודלים של צמיגות לא ליניארית עם מערבולת, הזן את הפקודה '/להגדיר/מודלים/צמיג/צמיג/מערבולת-מומחה/טורב-לא-ניוטון?' במסוף הפקודה (איור 8C) והזן 'כן' כאשר תתבקש.
- תחת חומרים (איור 8D), הגדר את תכונות הדם על-ידי הזנת צפיפות ובחירת חוק הכוח הלא-ניוטוני ברשימה הנפתחת של הצמיגות. עשה זאת על-ידי שינוי שם הנוזל כדם, קבע צפיפות של 1,050 ק"ג/מ"ר3, והגדר את מדד עקביות לא-ניוטונית של חוק החשמל, k, ל- 0.035, את מדד חוק החשמל, n, ל- 0.6.
הערה: מודל הצמיגות הלא-ניוטון של חוק החשמל נבחר על סמך ספרות כדי לתאר את צמיגות הדם הלא ליניארית46, η, במונחים של קצב זן הנוזלים,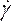 כמו:
כמו: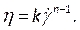 (7)
(7)
קיימים מודלים שונים של צמיגות דם לא-ניוטון כדי ללכוד את טבעו הדליל של הדם. מספר פרסומים46,47,48,49 חקרו את היעילות של מודלים צמיגות שונים ואת מקדמיהם, אשר יש להתייעץ לקבלת מידע נוסף בעת בחירת המודל המתאים. - קומפיית הפונקציה המוגדרת על-ידי המשתמש שלנו, שתוארה בעבר בשלב 2.4.2, המכילה את מהירות הדם והלחץ הארעיים, ובדק את שורות הפקודה עבור שגיאות כלשהן (איור 8C). כעת טען את ה- UDF על-ידי הזנת הכרטיסיה הגדרת משתמש (איור 8E), בחירת הידור וניווט לספריה של UDF לפני ייבואו ולחיצה על בנהולאחר מכן על טען.
הערה: טקסט יופיע בקונסולה(איור 8C). בדוק זאת בקפידה כדי לוודא שלא יופיעו שגיאות או אזהרות. אם ה-UDF נטען כהלכה, שמות ה-UDF יופיעו בקונסולה (מסומן באיור 8C). - אלה יכולים להיות מוחלים על המפרצון והשקע. כדי לעשות זאת, בחר בכרטיסיה תנאי גבול. לחץ פעמיים על מפרצון (איור 8F) ובחר את UDF נכנס מהרשימה הנפתחת פרופיל. חזור על שלב זה כדי להגדיר גם את לחץ השקע.
- הפוך את רשת הרשת הדינאמית לזמינה (על-ידי סימון תיבת הסימון תחת הכרטיסיה רשת שינוי דינאמית המוצגת באיור 8G), כולל החלקה, remeshing ו- 6° של תיבות סימון של פותר החופש, הגדרת פרמטר הדיפוזיה ל- 1.5 ואת קנה המידה המרבי והמינימלי המתאים עבור רשת המערכת שלך.
- ודא שקשקשי רשת שינוי מרביים ומינימליים נמצאים בגבולות אזור הרשת ושהיית היעד מוגדרת ל- 0.7. ניתן להציג את מאפייני רשת הרשת על-ידי לחיצה על הכרטיסיה מאפייני רשת משנית.
- צור אזור רשת דינמי חדש על-ידי לחיצה על לחצן צור, ציין את קיר הלומן ברשימה הנפתחת אזור ובחר צימוד מערכת. זהו הממשק להעברת נתונים לרכיב העורק של הסימולציה.
- צור אזורי רשת שינוי מעוותים עבור הלומן של המפרצון, השקע והפנים עם ערכים מתאימים לקנה המידה של רשת שינוי. בצע פעולה זו על-ידי לחיצה על צור בכרטיסיה רשת משנה דינאמית ובחירה באפשרות עיוות. אפשר שינוי והחלבה והגדר את סולמות הרשת בהתבסס על הגבולות של כל אזור. לעתים קרובות, שגיאות שליליות של עוצמת תאים משויכות לרשת שינוי דינאמית זו, לכן בדוק היטב והתאם את סולמות רשת שינוי במידת הצורך עבור כל אזור.
- ודא שצימוד מהירות הלחץ מוגדר לצמד והגדר את ערכות הניסוח וההדי-דיסקרטיות המרחביות החולפות לסדר השני על-ידי הזנת הכרטיסיה שיטות (איור 8H)וביצוע בחירות מהרשימות הנפתחות המתאימות.
- בפקדים (איור 8H), הזן מספר זורם של שניים והגדר את קריטריוני ההתכנסות השיורית בכרטיסיה צגים (איור 8I). השתמשנו בערך של 1e-5 להמשכיות ו-1e-6 עבור השאר.
הערה: ניתן להעריך את מספר Courant בהתבסס על גודל הרשת, dx, גודל שלב הזמן, dt, ומהירות הדם, v, באמצעות: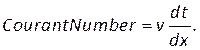 (8)
(8)
הזן מספר זה תחת המקטע מספר זורם בכרטיסיה פקדים (איור 8H). כאן אנו מיישמים מספר קורנט של שניים. מספר הקורנט הוא בדרך כלל פחות מאחד; עם זאת, כמו פותר מהירות לחץ בשילוב עם שיטות פתרון משתמע משמש, התוצאה היא מטבעה יציבה יותר ופחות רגיש לערך זה; לפיכך, שניים נחשבים מקובלים. - כדי להגדיר פונקציה מותאמת אישית עבור תוצאות כגון helicity מנורמלת מקומית (LNH), בחר פונקציות שדה מותאמות אישית תחת הכרטיסיה פרמטרים והתאמה אישית (איור 8J) והוסף פונקציה חדשה על-ידי לחיצה באמצעות לחצן העכבר הימני ובחירה ב' חדש. השתמש בחלון המוקפץ כדי להגדיר לפי הצורך. הזן את הנוסחה באמצעות הרשימה הנפתחת של משתני Solver. כתוצאה מייצגת, אנו משתמשים LNH50,51, מדד של היישור בין
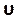 המהירות, , מערבולות, ω, וקטורים, כפונקציה מותאמת אישית המתוארת על ידי:
המהירות, , מערבולות, ω, וקטורים, כפונקציה מותאמת אישית המתוארת על ידי: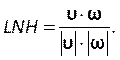 (9)
(9)
הערה: יש להגדיר משתנים מותאמים אישית אחרים בשלב זה, כגון אינדקס הטיה מתנדנדת (OSI)52,53, מדד של היפוך זרימה. - בכרטיסיה חישוב הפעלה (איור 8K),הגדר את מספר צעדי הזמן ל- 160 (גודל שלב של 0.005 s ושעת סיום של 0.8 s), גודל שלב הזמן של 5 אלפיות שני ומספר האיטרציות ל- 300 כדי להבטיח שהתוצאה היא בלתי תלויה בזמן.
הערה: בהתאם למורכבות הסימולציה, ייתכן שיידרשו איטרציות גדולות יותר לכל שלב. מחזורי לב מרובים עשויים להידרש להתכנסות מספרית מלאה, משהו שאנו מציינים כמגבלה; עם זאת, זה מיושם לעתים קרובות בסימולציות ביומכניקה כלילית בשל העלות החישובית הקשורה סימולציות אלה. - בדוק אם תיבת הסימון דגימת נתונים עבור סטטיסטיקת זמן מופעלת וודא שנבחרו סטטיסטיקת קיר ולחצי הטיית זרימה, כמו גם את הפונקציה המותאמת אישית שהוגדרה בעבר.
- צור את ייצוא הנתונים בכרטיסיה פעילויות חישוב ושמירה אוטומטית (איור 8L), ובחר באפשרות תואם CFD-Post לעיבוד לאחר. אם ברצונך לעבד תוצאות בתוכנה נפרדת, התאם את סוג הייצוא לפי הצורך. בחר את כל האזורים (קיר, רשת פנימית, מפרצון, שקע) ואת התוצאות שיש לייצא.
- לבסוף, אתחל את הסימולציה עם התוכנית ההיברידית על-ידי הזנת הכרטיסיה אתחול (איור 8M), בחירת הערכה ההיברידית, לחיצה על הגדרותוהגדלת מספר האיטרציות ל- 20. לחץ על אתחל.
5. צימוד מערכת
- ודא שהמערך המבני והנוזל מחובר לצימוד המערכת ומתעדכן. עשה זאת על-ידי לחיצה וגרירה של ההתקנה המבנית והנוזלית לצימוד המערכת כדי לקשר ביניהם, כפי שמוצג באיור 9A, להבטיח ששתי ההגדרות יעודכנו על-ידי לחיצה באמצעות לחצן העכבר הימני ובחירה באפשרות Update.
- בצימוד מערכת, הגדר את שעת הסיום ל- 0.8 s ואת סף הזמן ל- 0.005 s. בצע זאת על-ידי בחירת הגדרות ניתוח (איור 9B-1) והזנת גודל שלב הסיום והזמן. הגדר את האיטרציות המרביות ל- 10.
הערה: בדרך כלל, בין 10 ל 15 איטרציות מספיק אם הן המרכיבים המבניים והן הרכיבים הנוזליים מתכנסים היטב. - בחר את הקיר ואת הממשק המוצק מהרכיבים הנוזליים והמבניים, בהתאמה, והוסף העברת נתונים על-ידי החזקת Ctrl ובחירת שני הממשקים של מבנה הנוזלים (איור 9B-2); לחץ באמצעות לחצן העכבר הימני וצור העברת נתונים בין הרכיבים הנוזליים והמבניים (איור 9B-3). התאימו את תת-ההרפיה או ההשתוללות של הכוח המועבר מנוזל למבנה כדי לסייע בהתכנסות.
הערה: בהתאם למורכבות של המודל, תנאי הגבול ומאפייני החומר, ייתכן שיידרשו השתוללות העברת נתונים או תת-הרפיה להתכנסות מספרית. אלה יכולים להיות מיושמים על העברת נתוני נוזל (כלומר, הכוח המועבר מרכיב הנוזל לקיר העורק). אפשרויות אלה זמינות במסגרת העברות הנתונים שנוצרו(איור 9B-2). - כאשר אתה מוכן להפעלה, לחץ על עדכן. נתוני סימולציה כגון התכנסות מבנית וזורמת והתכנסות העברת הנתונים המתאימה שלהם מודפסים בקונסולה.
הערה: שים לב כי סימולציות FSI הן יקרות מבחינה חישובית, עם סימולציה זו שלוקחת 11 ימים על מכונה של 16 ליבות (2.6 GHz Intel Xeon Gold באמצעות זיכרון פיזי (RAM) של 180 ג'יגה-בתים), עם שונות נוספת בזמני הסימולציה בהתאם להגדרת החומרה ומורכבות הדגם. שאריות העברת נתונים מייצגות מוצגות בתרשים (איור 9B-4) ונתוני הפתרון מודפסים בקונסולה (איור 9B-5). במהלך האיטרציות הראשונות, לא ניתן להשיג לחלוטין את ההתכנסות של שאריות העברת הנתונים עד להגעה למצב שיווי משקל. הדבר מתואר ביתר פירוט בכיתוב של איור 9B. - לאחר השלמת הסימולציה, ניתן להגביר את עיבוד התוצאות בתוך התוכנה המסחרית או בתוכנה נפרדת, בהתאם לסוג ייצוא הנתונים המתואר בשלב 4.19.
תוצאות
תוצאות מייצגות מוצגות עבור סמנים ביומכניים מבוססים ומתפתחים של התקדמות טרשת עורקים. מדדים מבוססים כגון תוצאות WSS ו- WSS (כולל מתח הגהה קיר ממוצע זמן (TAWSS) ומדד הגהה מתנד (OSI)) מוצגים באיור 10. הלחץ הגניסוי בקיר על מחזור הלב מונע במידה רבה על ידי מהירות הדם, עם זאת, גיאומטריית העורק...
Discussion
השימוש בשיטות FSI לניתוח ביומכניקה כלילית הוא עדיין תחום מתפתח הן מהיבטי מידול מספרי והן מהיבטי תוצאות קליניות. כאן תיארנו את קווי המתאר של הגדרת ניתוח FSI ספציפי למטופל, המבוסס על האלמנט הסופי / שיטות נפח סופיות, תוך שימוש ב- OCT והדמיה אנגיוגרפית. בעוד שהשיטה שאנו מתארים כאן משתמשת בפותל רכיב?...
Disclosures
למחברים אין קונפליקטים להצהיר לגבי הכנת מאמר זה. ס.ג.נ. קיבל תמיכה מחקרית מ אסטרהזנקה, אמגן, אנתרה, אלי לילי, אספריון, נוברטיס, סרניס, חברת התרופות, רזברלוג'יקס, InfraReDx, רוש, סאנופי-רגנרון, ליפוסיאנס והוא יועץ לאסטרהזנקה, אקסיה, אלי לילי, אנתרה, קובה, אומתרה, מרק, טקדה, רסברלוג'יקס, סאנופי-רגנרון, CSL Behring, Esperion, ו Boehringer Ingelheim. P.J.P. קיבלה תמיכה מחקרית מאבוט ווסקולר, דמי ייעוץ מ-Amgen and Esperion ומנורת דוברים מאסטרהזנקה, באייר, בוהרינג'ר אינגלהיים, מרק שרינג-פלו ופייזר.
Acknowledgements
המחברים רוצים להכיר בתמיכה הניתנת על ידי אוניברסיטת אדלייד, בית החולים רויאל אדלייד (RAH) ומכון הבריאות והמחקר הרפואי של דרום אוסטרליה (SAHMRI). ניסוי COCOMO-ACS הוא מחקר ביוזמת החוקר הממומן על ידי מענקי פרויקטים של המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) של אוסטרליה (ID1127159) וקרן הלב הלאומית של אוסטרליה (ID101370). H.J.C. נתמך על ידי מלגה מקרן החוקרים Westpac (מלגת מנהיגים עתידיים) ומכיר בתמיכה מאוניברסיטת אדלייד, בית הספר להנדסת מכונות ומלגת המחלקה לחינוך, מיומנויות והכשרה למחקר תעסוקתי (RTP). S.J.N. מקבל מלגת מחקר ראשית מ- NHMRC (ID1111630). P.J.P. מקבל מלגת מנהיג עתידי ברמה 2 מקרן הלב הלאומית של אוסטרליה (FLF102056) ומלגת פיתוח קריירה ברמה 2 מ- NHMRC (CDF1161506).
Materials
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
References
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved