Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптическая когерентная томография На основе биомеханического анализа взаимодействия жидкости и структуры коронарного атеросклероза прогрессирования
В этой статье
Резюме
Необходимо определить, какие атеросклеротические поражения будут прогрессировать в коронарной сосудистой системе, чтобы направлять вмешательство до того, как произойдет инфаркт миокарда. В этой статье описывается биомеханическое моделирование артерий с помощью оптической когерентной томографии с использованием методов взаимодействия жидкости и структуры в коммерческом решателе конечных элементов, чтобы помочь предсказать эту прогрессию.
Аннотация
В этой статье мы представляем полный рабочий процесс биомеханического анализа атеросклеротической бляшки в коронарной сосудистой системе. Поскольку атеросклероз является одной из ведущих причин глобальной смертности, заболеваемости и экономического бремени, необходимы новые способы анализа и прогнозирования его прогрессирования. Одним из таких вычислительных методов является использование взаимодействия жидкости и структуры (FSI) для анализа взаимодействия между кровотоком и доменами артерий / бляшек. В сочетании с визуализацией in vivo этот подход может быть адаптирован к каждому пациенту, помогая различать стабильные и нестабильные бляшки. Мы описываем процесс трехмерной реконструкции с использованием внутрисосудистой оптической когерентной томографии (OCT) и инвазивной коронарной ангиографии (ICA). Извлечение граничных условий для моделирования, включая репликацию трехмерного движения артерии, обсуждается до того, как установка и анализ проводятся в коммерческом решателе конечных элементов. Описана процедура описания высоконелинейных гиперупругих свойств стенки артерии и пульсирующей скорости/давления крови, а также настройка системной связи между двумя доменами. Мы демонстрируем процедуру, анализируя невиновную, слегка стенотическую, богатую липидами бляшку у пациента после инфаркта миокарда. Известные и возникающие маркеры, связанные с прогрессированием атеросклеротических бляшек, такие как напряжение сдвига стенки и местная нормализованная спиральность, соответственно, обсуждаются и связаны со структурной реакцией в стенке артерии и бляшке. Наконец, мы переводим результаты в потенциальную клиническую значимость, обсуждаем ограничения и намечаем области для дальнейшего развития. Метод, описанный в этой статье, показывает перспективность для помощи в определении участков, подверженных риску атеросклеротического прогрессирования, и, следовательно, может помочь в управлении значительной смертностью, заболеваемостью и экономическим бременем атеросклероза.
Введение
Ишемическая болезнь сердца (ИБС) является наиболее распространенным типом сердечных заболеваний и одной из ведущих причин смерти и экономического бремени во всем мире1,2. В Соединенных Штатах примерно одна из каждых восьми смертей приписываетсяCAD 3,4,в то время как большинство глобальных смертей от ИБС в настоящее время наблюдаются в странах с низким и средним уровнем дохода5. Атеросклероз является преобладающим фактором этих смертей, с разрывом бляшек или эрозией, приводящей к окклюзии коронарной артерии и острому инфаркту миокарда (ОИМ)6. Даже после реваскуляризации виновных коронарных поражений пациенты имеют значительный риск рецидива серьезных неблагоприятных сердечно-сосудистых событий (MACE) после ОИМ, в основном из-за сопутствующего присутствия других невиновных бляшек, которые также уязвимы к разрыву7. Интракоронарная визуализация дает возможность обнаружить эти бляшки высокого риска8. Хотя внутрисосудистое ультразвуковое исследование (IVUS) является золотым стандартом для оценки объема бляшек, оно имеет ограниченное разрешение для выявления микроструктурных особенностей уязвимой бляшки в отличие от высокого разрешения (10-20 мкм) оптической когерентной томографии (ОКТ). Было продемонстрировано, что тонкий и воспаленный волокнистый колпачок, покрывающий большой липидный пул, является наиболее важной сигнатурой уязвимой бляшки9 и лучше всего идентифицируется и измеряется ОКТ среди доступных в настоящее время методов внутрикоронарной визуализации10. Важно отметить, что OCT также способен оценивать другие особенности бляшек высокого риска, в том числе: липидную дугу; инфильтрация макрофагов; наличие фиброатеромы тонкой шляпки (TCFA), которая определяется как богатое липидами ядро с вышележащим тонким волокнистым колпачком (<65 мкм); пятнистая кальцификация; и микроканалы бляшек. Oct-обнаружение этих признаков высокого риска в невиновных бляшках после ОИМ было связано с увеличением риска будущего MACE11в 6 раз. Однако, несмотря на это, способность ангиографии и ОКТ-визуализации предсказывать, какие коронарные бляшки будут прогрессировать и в конечном итоге разрываться или разрушаться, ограничена, с положительными прогностическими значениями только 20%-30%8. Эта ограниченная прогностическая способность препятствует принятию клинических решений вокруг того, какие невиновные бляшки лечить (например, стентированием)7,12.
В дополнение к факторам пациента и биологическим характеристикам бляшек, биомеханические силы в коронарных артериях также являются важными детерминантами прогрессирования бляшек и нестабильности13. Одним из методов, который обещает помочь всесторонне оценить эти силы, является моделирование взаимодействия жидкости и структуры (FSI)14. Напряжение сдвига стенки (WSS), также называемое эндотелиальным напряжением сдвига, было традиционным фокусом для исследований коронарной биомеханики15,с общим пониманием того, что WSS играет этиологическую роль в формировании атеросклероза16. Преимущественно смоделированные с использованием методов вычислительной гидродинамики (CFD), области с низким уровнем WSS были связаны с интимальным утолщением17,ремоделированием сосудов18 и прогнозированием прогрессирования поражения19 и будущего MACE20. Последние достижения в этом анализе предполагают, что лежащая в основе топология векторного поляWSS 21и ее разнонаправленные характеристики22являются лучшим предиктором риска атеросклероза, чем только величина WSS. Тем не менее, WSS фиксирует только проблеск общей биомеханической системы на стенке просвета, и, как и методы визуализации, ни одна биомеханическая метрика не может надежно различить атеросклеротические особенности высокого риска.
Дальнейшие показатели становятся потенциально важными в формировании атеросклероза. Характеристики внутрипросветного потока23 являются одним из таких примеров, с спиральным потоком, количественно оцененным с помощью различных индексов24,которые, как предполагается, играют атеропротекторную роль путем подавления нарушенных моделей потока25,26. Хотя методы CFD могут анализировать эти характеристики потока и представлять широкий спектр полезных результатов, они не учитывают основные взаимодействия между кровотоком, структурой артерий и общим движением сердца. Это упрощение динамической системы до жесткой стенки упускает потенциально критические результаты, такие как напряжение волокнистого колпачка. В то время как дебаты как за, так и против необходимости FSI над CFD продолжаются27,28,29,многие сравнения пренебрегают включением влияния функции желудочков. Это ограничение может быть преодолено с помощью FSI, который показал, что динамическое изгиб и сжатие, оказываемые на артерию под влиянием функции желудочка, могут значительно влиять на структурное напряжение бляшек и артерий, а также на показателипотока,такие как WSS30,31,32. Это важно, поскольку структурные напряжения также являются ключевым показателем для анализа и прогнозирования разрыва бляшек33,34 и были предложены для совместного размещения с областями увеличения бляшек14,35. Захват этих взаимодействий позволяет более реалистично представить коронарную среду и потенциальные механизмы прогрессирования заболевания.
Обращаясь к этому, здесь мы описываем процесс разработки геометрии для конкретного пациента из визуализации OCT36 и настройку и запуск моделирования FSI артерии с использованием коммерческого решателя конечных элементов. Процесс ручного извлечения просвета, липидной и наружной стенки артерии детализируется перед трехмерной вычислительной реконструкцией артерии пациента. Мы описываем настройку моделирования, связь и процесс сравнения исходных условий, а также последующие параметры визуализации OCT для определения прогрессирования поражения. Наконец, мы обсуждаем постобработку численных результатов и то, как эти данные могут иметь клиническое значение, сравнивая биомеханические результаты с прогрессированием / регрессией поражения. Общий метод продемонстрирован на невиновных, слегка стенотических, богатых липидами бляшках в правой коронарной артерии (РКА) 58-летнего кавказского пациента мужского пола, у которого наблюдался острый инфаркт миокарда без повышения ST в условиях гипертонии, сахарного диабета 2 типа, ожирения (ИМТ 32,6) и семейной истории преждевременной ИБС. Коронарография и ОКТ-визуализация были выполнены во время его первоначальной госпитализации; а затем 12 месяцев спустя в рамках продолжающегося клинического исследования (исследование COCOMO-ACS ACTRN12618000809235). Мы ожидаем, что этот метод может быть дополнительно усовершенствован и использован для выявления коронарных бляшек, которые подвергаются высокому риску прогрессирования.
протокол
Следующие деидентифицированные данные были проанализированы у пациента, набранного в продолжающееся рандомизированное контролируемое исследование COCOMO-ACS (ACTRN12618000809235; Регистрационный номер HREC Королевской больницы Аделаиды: HREC/17/RAH/366), с дополнительным этическим одобрением, предоставленным Исследовательской службой Центральной сети местного здравоохранения Аделаиды (CALHN) для целей биомеханического моделирования (справочный номер CALHN 14179). На рисунке 1 показан полный рабочий процесс, описанный в следующем протоколе, который может быть применен к любому программному обеспечению или кодам, поддерживающим FSI.
1. Оценка изображения
- Сопоставьте исходные и ОКТ последующие изображения с использованием анатомических ориентиров, таких как бифуркации, и используя изображения непосредственно проксимально к дистальной бифуркации и дистальнее к наиболее проксимальной бифуркации. Соответствующие изображения между этими ориентирами должны быть проанализированы, как описано на рисунке 2A.
- Поперечное сечение просвета ОКТ
- Загрузите каждое изображение OCT в дигитайзер изображения и щелкните, чтобы отметить точки в центральной точке катетера и пределах шкалы(рисунок 2B). Экспортируйте эти точки для последующего использования.
- Вручную отметьте край просвета, начиная с одного и того же места на каждом изображении, обязательно захватив кривые просвета как можно точнее. Оставьте пробел в артефакте катетера, так как процесс реконструкции будет интерполироваться по всему региону на более позднем этапе. Экспортируйте эти файлы в формате .dat и повторите это для каждого изображения.
- Наружная стенка OCT и липиды
- В программном обеспечении DICOM извлеките внешнюю стенку в областях высокого затухания, используя видимые части внешней упругой мембраны, чтобы вручную установить эллипс для оценки местоположения внешней стенки, как описано на рисунке 3. Щелкните и перетащите левую кнопку мыши, чтобы правильно определить эллипс и положение.
- Вручную определите липидную дугу, рассчитанную на центроидный просвет, и толщину волокнистого колпачка, как описано на рисунке 3,путем щелчка и перетаскивания углов и измерений расстояния соответственно. Они будут использоваться для анализа прогрессирования поражения вместе с областью просвета.
- Импортируйте эти наложенные изображения в дигитайзер изображений и вручную выберите точки внешней стенки, используя установленный эллипс в качестве ориентира в областях высокого затухания, где внешняя упругая мембрана не видна. Повторите шаг 1.2.2, чтобы выбрать и экспортировать точки в формат .dat.
- Аналогично для липидов, вручную выберите липидную поверхность, начиная с одного и того же конца липида в каждом случае. Используйте эллипсоидальную направляющую наружной стенки (шаг 1.3.1) для последовательной дуги задней стороны. Экспорт указывает на .dat файл и повторяется для всех изображений с присутствующими липидами, оставляя зазор по всему артефакту направляющей проволоки, как описано в шаге 1.2.2.
ПРИМЕЧАНИЕ: Прогрессия поражения анализируется путем сравнения трех показателей, а именно области просвета, липидной дуги и толщины волокнистого колпачка, которые можно оценить непосредственно из средства просмотра DICOM. Техника извлечения наружной стенки и липидной задней стороны требуется из-за ограниченной глубины проникновения OCT. OCT был использован в этом исследовании из-за акцента на взаимосвязи между составом бляшек и биомеханическими силами.
- Центральная линия на основе ангиографии
- Загрузите первое ангиографическое изображение в дигитайзер изображения37. Выберите края катетера, чтобы масштабировать изображение на последующих этапах, а затем вручную отметьте осевую линию катетера, начинающуюся с проксимального маркера и движущуюся дистально, с равномерно расположенными точками, как показано на рисунке 4A. Экспортируйте данные в .dat формат и повторите для второй ангиографической плоскости.
ПРИМЕЧАНИЕ: Как правило, плоскости с углом более 20° между ними улучшают надежность трехмерной реконструкции осевой линии. Катетер и направляющая проволока OCT должны быть видны на каждом изображении.
- Загрузите первое ангиографическое изображение в дигитайзер изображения37. Выберите края катетера, чтобы масштабировать изображение на последующих этапах, а затем вручную отметьте осевую линию катетера, начинающуюся с проксимального маркера и движущуюся дистально, с равномерно расположенными точками, как показано на рисунке 4A. Экспортируйте данные в .dat формат и повторите для второй ангиографической плоскости.
2. Трехмерная реконструкция
- Ангиографические проекции
- Загрузите файлы данных, экспортированные на шаге 1.4. Используйте первые две точки для масштабирования данных до миллиметров (первые две точки используются с известными спецификациями катетера, 6F в данном случае). Вычтите проксимальную точку данных из оставшихся точек в каждом наборе данных, чтобы кривая начиналась в начале системы координат.
- Генерируйте матрицы вращения для каждого ангиографического представления, где θ и Φ представляют углы RAO/LAO и CAU/CRA соответственно. Мы используем углы LAO и CRA как отрицательные. Две матрицы вращения в направлениях x (Rotx) и y (Roty) соответственно:
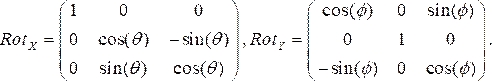 (1)
(1) - Умножьте матрицы вращения вместе, а затем умножьте их на координаты каждой точки с шага 2.1.1. Результирующее уравнение:
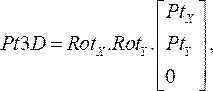 (2)
(2)
дает трехмерное расположение точки катетера на соответствующей плоскости ангиограммы(Pt3D)путем вращения двумерных точек, которые были указаны из каждого ангиографического изображения. - Вычислите нормальный вектор к каждой ангиографической плоскости, умножив матрицы вращения x и y на единичный вектор в направлении z. От проксимального до дистального местоположения проецируйте каждую точку, нормальную на соответствующую плоскость, и вычисляйте среднюю точку кратчайшего расстояния между проекциями. Это приводит к трехмерной точке на направляющей проволоке oct в пространстве.
- Используя функцию 'interparc', доступную из центрального файлового обмена MATLAB38,разделите трехмерную центральную линию на равно расположенные точки. Интервал между точками должен быть равен интервалу между изображениями центра развертывания Office, который определяется скоростью отката. Это места, где будут размещены поперечные сечения центра развертывания Office.
- Вращение поперечного сечения центра развертывания Office
- Используя файл данных, содержащий центр катетера и масштаб, преобразуйте каждое поперечное сечение из пикселей в мм, используя вторую и третью точки в файле масштабирования. Чтобы отцентрировать поперечное сечение относительно расположения катетера, вычтите первую точку в файле масштабирования (центр катетера) из всех точек поперечного сечения. Рассчитайте нормальный вектор к поперечному сечению (параллельно катетеру в артерии) путем вычитания трехмерной осевой точки из следующей дистальной точки по кривой катетера.
- Поверните поперечное сечение центра развертывания Office, чтобы выровнять перпендикулярно осевой линии катетера, умножив масштабированные точки данных на матрицу вращения:
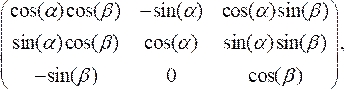 (3)
(3)
где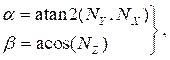 (4)
(4)
и NX, NYи NZ являются компонентами x, y и z соответственно нормального вектора, рассчитанного в разделе 2.1. Добавьте трехмерную точку осевой линии ко всем повернутым точкам в поперечном сечении, в результате чего расположение поперечного сечения в трехмерном пространстве(рисунок 4B). - Повторите шаги 2.2.1-2.2.2 для каждого поперечного сечения (просвет, артерия и липиды). Экспортируйте поперечные сечения в текстовый файл, который может быть импортирован в программное обеспечение автоматизированного проектирования (CAD) для окончательного создания твердого тела.
- Создание 3D твердотельной модели
- В программном обеспечении для 3D-моделирования импортируйте и генерируйте поперечные сечения по одному файлу за раз. Импортируйте текстовые файлы, содержащие поперечные сечения, в программное обеспечение для 3D-моделирования, щелкнув раскрывающийся список концепции(рисунок 5A-1)и выбрав 3D-кривую(рисунок 5A-2). Нажмите На Кнопка Создать.
- Чтобы создать твердый компонент, выберите все кривые по порядку и поместите их вместе(рисунок 5A-3),гарантируя, что для создания нового твердого тела выбрано добавление замороженного. Выполните эти шаги для просвета, липидов и внешней стенки, чтобы создать отдельные твердые тела, обеспечивая возможность объединения топологии.
ПРИМЕЧАНИЕ: Может потребоваться пропустить кривую, если возникает проблема с геометрией. В этой реконструкции опустить небольшой липид среднего сечения из-за его размера и дополнительных вычислительных затрат и численной сложности, связанных с его включением. - Чтобы вычесть просвет и липиды из стенки артерии, создайте логическую операцию из выпадающего списка создания и выберите целевое тело в качестве стенки и липиды / просвет в качестве органов инструмента для вычитания просвета и липидов из стенки артерии(рисунок 5A-4).
- Совместное использование топологии между стеной и липидами, чтобы обеспечить совместное использование узлов сетки на будущих этапах. Для этого вручную выделите стенку и липиды и щелкните правой кнопкой мыши, чтобы сформировать новую деталь(рисунок 5А-5).
ПРИМЕЧАНИЕ: Этот этап обеспечивает разделение узлов сетки между поверхностями, предотвращая неправильные области контакта или проникновение сетки между двумя слоями, что значительно помогает на этапе раствора. Окончательная геометрия осевой линии катетера, липидов, просвета и стенки артерии визуализирована на рисунке 5B.
- Предварительная обработка: Граничные условия
ПРИМЕЧАНИЕ: Перед настройкой моделирования необходимы граничные условия пациента (BC). Здесь использовалось смещение, извлеченное из ангиографии, которое применяется к входу и выходу моделирования и скорости кровотока/давления, измеренного у пациентов человека и описанного в литературе39.- Смещение
- Повторите шаги 1.4 и 2.1, но выбирая только дистальные и проксимальные маркеры, начиная с ангиографического изображения, непосредственно предшествующего конечной диастоле. Делайте это для всех ангиографических изображений в течение одного сердечного цикла.
- Подгоняйте сглаживающие сплайны к координатам x, yи z двух наборов точек. Это приводит к смещению входных и выходных областей. Репрезентативные результаты для перемещений пациентов показаны на рисунке 6А.
ПРИМЕЧАНИЕ: Анализ смещения был начат на изображении, предшествующем конечной диастоле, для наилучшего соответствия фаз между извлеченным смещением и применяемыми профилями давления и скорости, обнаруженными в разделе 3.1.2, систолическая фаза которого начинается с 0,1 с (что соответствует интервалу между ангиографическими изображениями). При извлечении движения убедитесь, что по всему набору изображений нет сдвига таблицы или перемещения изображения.
- Скорость крови/давление
- Создайте профили, описывающие пульсирующую скорость и давление крови, скомпилировав определяемые пользователем функции (UDF). Здесь были применены переходные профили, измеренные у пациентов-людей в литературе 39,смоделированные как ряд Фурье, математически описанный:
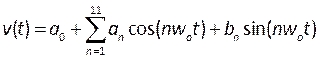 , (5)
, (5)
где t — время, w0 — частота, T — период сигнала, n — число слагаемых, а a0-11, b1-11 — коэффициенты, соответствующие профилям, описанным в литературе. В этом случае мы используем первые 11 терминов. - ПРИМЕЧАНИЕ: Эти профили описаны на рисунке 6B и должны быть записаны в файл в формате C в интегрированной среде разработки, такой как Microsoft Visual Studio. Давление на выходе представляет собой плоский профиль, а скорость на входе применяется как полностью развитый, параболический профиль, описанный как достаточный для воспроизведения реалистичных условий40. Дальнейшее развитие этой процедуры может включать измерение скорости крови пациента (например, с помощью доплеровской эхокардиографии41)и давления (с использованием напорных проводов) в качестве более реалистичных граничных условий. Кроме того, одновременное измерение смещения, скорости крови и давления обеспечит точное соответствие их фаз.
- Создайте профили, описывающие пульсирующую скорость и давление крови, скомпилировав определяемые пользователем функции (UDF). Здесь были применены переходные профили, измеренные у пациентов-людей в литературе 39,смоделированные как ряд Фурье, математически описанный:
- Смещение
3. Артерия/структура
- Чтобы задать свойства материала для артерии и липида, введите инженерные данные и добавьте новый материал, называемый артерией. Перетащите плотность и 5-параметрную модель Муни-Ривлина на новый материал и задайте их параметры. Вводят плотность 1000кг/м3 и коэффициенты гиперупругости, описанные в таблице 1,исходя из свойств интима42 и липида43 в литературе. Повторите это для липидов.
ПРИМЕЧАНИЕ: Модель Муни-Ривлина описана44: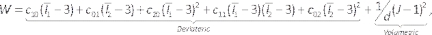 (6)
(6)
Где c10, c01, c20, c11и c02 — константы материала, а d — параметр несжимаемости (ноль для несжимаемого материала в данном случае). Здесь Ix —x-й инвариант тензора деформации, а J — определитель градиента упругой деформации. - Введите компонент модели, подавите компонент люмен/жидкость, щелкнув правой кнопкой мыши на Lumen/Fluid и выбрав Подавить (рисунок 7A). Назначьте ранее определенные материалы артерии и липидным твердым веществам, выбрав их из выпадающего списка материалов, проверив, являются ли единицы подходящими.
- Геометрия теперь должна быть сшита. Нажмите на сетку(рисунок 7B),установите физические предпочтения на нелинейные механические и укажите размер сетки. Здесь использовалась адаптивная сетка с размером мишени 0,14 мм. Отрегулируйте предпочтения сетки по мере необходимости для получения разумных значений асимметрии сетки и стремитесь к тому, чтобы по крайней мере два-три элемента сетки пересекали зазоры, такие как волокнистый колпачок. Генерация сетки может занять некоторое время из-за сложной геометрии.
ПРИМЕЧАНИЕ: Необходимо провести исследование независимости сетки, чтобы гарантировать, что на результаты не влияют характеристики сетки. Постепенно уменьшайте размер сетки и сравнивайте результаты до тех пор, пока отклонение не станет меньше установленного предела; в этом случае мы используем 2%45 (измеряется на фиброзном колпачке третьей бляшки). Кроме того, чтобы обеспечить качество сетки, проверьте перекос сетки; высокий перекос сетки приведет к численным трудностям во время сходимости или неточным результатам. Чтобы уменьшить асимметрию, попробуйте уменьшить размер сетки или отрегулируйте скорость роста, максимальный размер и/или угол кривизны. Результаты нашего теста на независимость сетки приведены в таблице 2с процентным отклонением результатов по сравнению со средним размером сетки, который использовался в этом анализе. - Нажмите на Настройки анализа (рисунок 7C). Для моделирования FSI включите автоматическое отключение времени и установите количество подшагов на единицу (системная связь будет контролировать подшагии), установите время окончания моделирования, в данном случае 0,8 с (частота сердечных сокращений пациента 75 уд/мин). Системная связь будет контролировать время и подшаги.
- В раскрывающемся списке элементов управления решателя задайте для типа решателя значение Программа, управляемая для использования прямого или итеративного метода. Прямые методы более надежны, но используют значительно больше памяти. Установите метод Ньютона-Рафсона на полный. (Из-за сложности геометрии и нелинейности в моделировании может потребоваться прямой метод и полный итерационный метод Ньютона-Рафсона; однако они значительно увеличивают стоимость вычислений.)
- Укажите область связи системы в качестве внутренней стенки артерии, вставив интерфейс жидкость-твердое вещество. Сделайте это, щелкнув правой кнопкой мыши и вставив интерфейс жидкость-твердое вещество под вкладкой Переходные процессы(рисунок 7D). Выберите внутреннюю часть стенки артерии для интерфейса. Это будет передавать данные между структурой и жидкостью в этом месте.
- Граничные условия смещения могут быть введены как функция смещения в направлении x, yи z, применяемом на входе и выходах. Для этого щелкните правой кнопкой мыши под вкладкой Переходные процессы и вставьте смещения(рисунок 7E). Дублируйте смещение для направлений x, yи z. В раскрывающемся списке направления выберите функцию и скопируйте смещения, извлеченные на шаге 2.4.1.
ПРИМЕЧАНИЕ: Смещение может быть введено как функция или как таблица точек в зависимости от предпочтений. - Чтобы помочь в устранении ошибок, на вкладке Решение вставьте четыре остатка Ньютона-Рафсона. Их можно просмотреть, если возникают ошибки, чтобы найти проблемную геометрию или места сетки.
ПРИМЕЧАНИЕ: Чтобы вставить параметры постобработки, такие как максимальное основное напряжение, щелкните правой кнопкой мыши на вкладке Решение и вставьте соответствующие результаты(рисунок 7F).
4. Кровь/жидкость
- Войдите на вкладку Модель, проверьте единицы измерения и подавите артерию и липидную часть, покинув область жидкости, аналогично шагу 3.2.
- Укажите метрики сетки и сгенерируйте сетку, проверяя перекос и регулируя при необходимости (мы применили размер сетки 0,14 мм с максимальным размером стенки 0,12 мм). Хорошей практикой является использование аналогичного размера и формы сетки, как это сделано в структурной части, на участках, где происходит взаимодействие жидкости и твердого тела.
ПРИМЕЧАНИЕ: Как и на этапе 3.3, следует провести испытание на независимость сетки для обеспечения того, чтобы результаты не зависели от свойств сетки, как показано в таблице 2. Проверьте качество сетки и отрегулируйте размер элемента, скорость роста, уточнение или кривизну по мере необходимости, чтобы убедиться, что асимметрия остается низкой и достигается независимость сетки. - Создайте именованные выделения для входного отверстия, розетки и стены перед входом в установку жидкости, щелкнув правой кнопкой мыши на соответствующей поверхности и выбрав вставить именованную выделенную область.
- Перейдите на вкладку Настройка и убедитесь, что включена двойная точность. Установите для типа Solver значение Pressure Based и убедитесь, что для параметра Time установлено значение Transient, установив соответствующие флажки(рисунок 8A).
- Включите модель вязкой турбулентности k-омега и включите перенос напряжения сдвига и коррекцию низкого Рейнольдса, войдя на вкладку «Вязкие модели»(рисунок 8B)и установив соответствующие флажки.
- Чтобы включить нелинейные модели вязкости с турбулентностью, введите команду '/define/models/viscous/turbulence-expert/turb-non-newtonian? ' в командной консоли(рисунок 8C)и введите 'yes' при появлении запроса.
- В разделе Материалы (рисунок 8D)определите свойства крови, введя плотность и выбрав неньютоновский степенной закон в выпадающем списке вязкости. Сделайте это, переименовав жидкость в кровь, установите плотность 1050кг/м3и установите индекс неньютоновской согласованности Степенного закона, k,равный 0,035, индекс степенного закона, n,0,6.
ПРИМЕЧАНИЕ: Неньютоновская модель вязкости степенного закона была выбрана на основе литературы для описания нелинейной вязкости крови46, η,с точки зрения скорости деформации жидкости,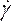 как:
как: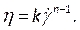 (7)
(7)
Существуют различные неньютоновские модели вязкости крови, чтобы уловить разжижающую сдвиг природу крови. В нескольких публикациях46,47,48,49 исследовалась эффективность различных моделей вязкости и их коэффициенты, с которыми следует ознакомиться для получения дополнительной информации при выборе соответствующей модели. - Скомпилируйте нашу пользовательскую функцию, ранее описанную в шаге 2.4.2, содержащую переходную скорость крови и давление, проверяя командные строки на наличие ошибок(рисунок 8C). Теперь загрузите UDF, войдя на вкладку User Defined (рисунок 8E),выбрав Compiled и перейдя в каталог UDF перед его импортом и щелкнув Build, а затем Load.
ПРИМЕЧАНИЕ: Текст появится в консоли(рисунок 8C). Тщательно проверьте это, чтобы убедиться, что не появляются ошибки или предупреждения. Если UDF загружается правильно, имена UDF появятся в консоли (выделено на рисунке 8C). - Они могут быть применены к входу и выходу. Для этого выберите вкладку Граничные условия. Дважды щелкните на входе (рисунок 8F)и выберите вход UDF из раскрывающегося списка профиля. Повторите этот шаг, чтобы также определить давление на выходе.
- Включите динамическую сетку (установив флажок на вкладке Dynamic Mesh, показанную на рисунке 8G),включая сглаживание, ремеширование и 6° решателя свободы, установив параметр диффузии равным 1,5 и соответствующие максимальные и минимальные шкалы для вашей сетки.
- Убедитесь, что максимальная и минимальная шкалы сетки находятся в пределах зоны сетки и что целевой наклон установлен равным 0,7. Свойства сетки можно отобразить, щелкнув вкладку Свойства сетки.
- Создайте новую динамическую зону сетки, нажав на кнопку Создать, укажите стенку люмена в раскрывающемся списке Регион и выберите Системная связь. Это интерфейс для передачи данных в артериальный компонент моделирования.
- Создайте деформирующие зоны сетки для входного, выходного и внутреннего просвета с соответствующими значениями для шкалы сетки. Для этого нажмите «Создать» на вкладке «Динамическая сетка» и выберите «Деформация». Включите ремешинг и сглаживание и установите шкалы сетки на основе ограничений каждой зоны. Часто ошибки отрицательного объема ячейки связаны с этой динамической сеткой, поэтому тщательно проверяйте и корректируйте шкалы сетки, если это необходимо для каждой области.
- Убедитесь, что связь между давлением и скоростью установлена на сопряжение, и установите переходную формулировку и схемы пространственной дискретизации на второй порядок, войдя во вкладку Методы (рисунок 8H)и сделав выбор из соответствующих раскрывающихся списков.
- В элементах управления(рисунок 8H)введите курантное число два и задайте критерии остаточной сходимости на вкладке Мониторы (рисунок 8I). Мы использовали значение 1e-5 для непрерывности и 1e-6 для остатка.
ПРИМЕЧАНИЕ: Число Куранта может быть оценено на основе размера сетки, dx,размера временного шага, dtи скорости крови, v, используя: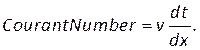 (8)
(8)
Введите это число в разделе курантного номера на вкладке Controls (рисунок 8H). Здесь мы применяем курантное число два. Число Куранта, как правило, меньше единицы; однако, поскольку используется сопряженный решатель давления-скорости с неявными методами решения, результат по своей природе более стабилен и менее чувствителен к этому значению; следовательно, два из них считаются приемлемыми. - Чтобы определить пользовательскую функцию для таких результатов, как локальная нормализованная спиральность (LNH), выберите пользовательские функции полей на вкладке Параметры и настройка (рисунок 8J)и вставьте новую функцию, щелкнув правой кнопкой мыши и выбрав New. Используйте всплывающее окно, чтобы определить, как необходимо. Введите формулу, используя раскрывающийся список переменных решателя. В качестве репрезентативного результата мы используем LNH50,51, меру выравнивания между скоростью , и
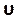 вихревостью, ω, векторами, в качестве пользовательской функции, описываемой следующим образом:
вихревостью, ω, векторами, в качестве пользовательской функции, описываемой следующим образом: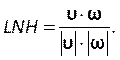 (9)
(9)
ПРИМЕЧАНИЕ: На этом шаге должны быть определены другие пользовательские переменные, такие как индекс колебательного сдвига (OSI)52,53,мера разворота потока. - На вкладке Run Calculation (рисунок 8K)задайте количество временных шагов равным 160 (размер шага 0,005 с и время окончания 0,8 с), размер шага времени 5 мс и количество итераций 300, чтобы убедиться, что результат не зависит от времени.
ПРИМЕЧАНИЕ: В зависимости от сложности моделирования может потребоваться больше итераций на шаг. Для полной численной сходимости может потребоваться несколько сердечных циклов, что мы отмечаем как ограничение; однако это часто применяется в моделировании коронарной биомеханики из-за вычислительных затрат, связанных с этими симуляциями. - Проверьте, включен ли флажок Выборка данных для статистики времени, и убедитесь, что выбраны Параметры Статистика стен и Напряжения сдвига потока, а также ранее определенная пользовательская функция.
- Создайте экспорт данных на вкладке Расчетные действия и автосохранение (рисунок 8L),выбрав опцию CFD-Post Compatible для постобработки. Если кто-то хочет обработать результаты в отдельном программном обеспечении, при необходимости настройте тип экспорта. Выберите все регионы (стена, внутренняя сетка, входное отверстие, розетка) и результаты для экспорта.
- Наконец, инициализируйте моделирование гибридной схемой, войдя на вкладку Инициализация (рисунок 8M),выбрав гибридную схему, щелкнув Настройкии увеличив количество итераций до 20. Нажмите инициализировать.
5. Системная муфта
- Убедитесь, что как конструкционные, так и жидкостные установки подключены к системной муфте и обновлены. Сделайте это, щелкнув и перетащив структурную и текучую настройку на системную связь, чтобы связать их, как показано на рисунке 9A,гарантируя, что обе настройки обновлены, щелкнув правой кнопкой мыши и выбрав Обновить.
- В разделе Системная связьустановите время окончания равным 0,8 с, а временной шаг — 0,005 с. Для этого выберите Параметры анализа (рисунок 9B-1)и введите время окончания и размер шага времени. Установите максимальное число итераций равным 10.
ПРИМЕЧАНИЕ: Как правило, от 10 до 15 итераций достаточно, если структурные и жидкие компоненты хорошо сходятся. - Выберите настенный и сплошной интерфейс из жидкого и структурного компонентов соответственно и добавьте передачу данных, удерживая Ctrl и выбирая два интерфейса жидкостной структуры(рисунок 9B-2); щелкните правой кнопкой мыши и создайте передачу данных между флюидом и структурными компонентами(рисунок 9B-3). Отрегулируйте недостаточную релаксацию или нарастание силы, передаваемой от жидкости к структуре, чтобы помочь в конвергенции.
ПРИМЕЧАНИЕ: В зависимости от сложности модели, граничных условий и свойств материала для численной сходимости может потребоваться ускорение передачи данных или недостаточная релаксация. Они могут быть применены к передаче данных жидкости (т. е. силе, передаваемой от компонента жидкости к стенке артерии). Эти опции доступны в рамках созданных передач данных(рисунок 9B-2). - Когда все будет готово к запуску, нажмите Обновить. Данные моделирования, такие как структурная и флюидная конвергенция и их соответствующая конвергенция передачи данных, печатаются в консоли.
ПРИМЕЧАНИЕ: Обратите внимание, что моделирование FSI является вычислительно дорогостоящим, причем это моделирование занимает 11 дней на 16-ядерной машине (2,6 ГГц Intel Xeon Gold с использованием 180 Гб физической памяти (ОЗУ)), с дальнейшим изменением времени моделирования в зависимости от настройки оборудования и сложности модели. Репрезентативные остатки передачи данных показаны на диаграмме(рисунок 9B-4),а данные решения печатаются в консоли(рисунок 9B-5). В течение первых нескольких итераций сходимость остатков передачи данных может быть получена не полностью до тех пор, пока не будет достигнуто равновесное состояние. Это более подробно описано в подписи к рисунку 9B. - После завершения моделирования результаты могут быть обработаны в коммерческом программном обеспечении или в отдельном программном обеспечении, в зависимости от типа экспорта данных, описанного в шаге 4.19.
Результаты
Представлены репрезентативные результаты как для установленных, так и для новых биомеханических маркеров прогрессирования атеросклероза. Установленные метрики, такие как результаты WSS и WSS (включая усредненное по времени напряжение сдвига стенки (TAWSS) и индекс колебательного сдвига (OS...
Обсуждение
Использование методов FSI для анализа коронарной биомеханики по-прежнему является развивающейся областью как с точки зрения численного моделирования, так и аспектов клинических результатов. Здесь мы описали схему создания специфического для пациента анализа FSI, основанного на методах...
Раскрытие информации
Авторы не могут заявить о каких-либо конфликтах относительно подготовки данной статьи. S.J.N. получила исследовательскую поддержку от AstraZeneca, Amgen, Anthera, Eli Lilly, Esperion, Novartis, Cerenis, The Medicines Company, Resverlogix, InfraReDx, Roche, Sanofi-Regeneron и Liposcience и является консультантом AstraZeneca, Akcea, Eli Lilly, Anthera, Kowa, Omthera, Merck, Takeda, Resverlogix, Sanofi-Regeneron, CSL Behring, Esperion и Boehringer Ingelheim. P.J.P. получил исследовательскую поддержку от Abbott Vascular, консультационные сборы от Amgen и Esperion и гонорары спикеров от AstraZeneca, Bayer, Boehringer Ingelheim, Merck Schering-Plough и Pfizer.
Благодарности
Авторы хотели бы отметить поддержку, оказанную Университетом Аделаиды, Королевской больницей Аделаиды (RAH) и Южно-Австралийским институтом здравоохранения и медицинских исследований (SAHMRI). Исследование COCOMO-ACS является исследованием, инициированным исследователем, финансируемым грантами проекта от Национального совета по здравоохранению и медицинским исследованиям (NHMRC) Австралии (ID1127159) и Национального фонда сердца Австралии (ID101370). H.J.C. поддерживается стипендией Westpac Scholars Trust (Future Leaders Scholarship) и признает поддержку со стороны Университета Аделаиды, Школы машиностроения и стипендии Департамента образования, навыков и трудоустройства Research Training Program (RTP). S.J.N. получает главную исследовательскую стипендию от NHMRC (ID1111630). P.J.P. получает стипендию для будущих лидеров уровня 2 от Национального фонда сердца Австралии (FLF102056) и стипендию для развития карьеры уровня 2 от NHMRC (CDF1161506).
Материалы
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
Ссылки
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены