Method Article
PD-1/PD-L1相互作用のPDL1-Vaxxペプチドワクチン誘導抗体遮断の磁気蛍光ビーズベースのデュアルレポーターフロー分析
要約
チェックポイント阻害剤は、がんとの闘いのための治療法を開発する上で重要な標的です。本稿では、PD-1/PDL1複合体の形成を阻害する中和ポリクローナル抗体産生を誘導する新規PDL1ペプチドベースのがんワクチンPDL1-Vaxxについて紹介する。この研究では、この活性を分析するための蛍光ビーズベースのアッセイの開発と試験についても詳しく説明しています。
要約
チェックポイント受容体(PD-1、PD-L1、CTLA-4)をモノクローナル抗体で阻害することは、がん患者を治療するための臨床試験で大きな利益を示しており、現代のがん免疫療法の主力アプローチとなっています。しかし、チェックポイントモノクローナル抗体免疫療法に反応する患者はごく一部である。したがって、がんに対する新しい治療戦略の開発が急務です。アミノ酸130-147がGPSLリンカー を介して MVFペプチド(「無差別」T細胞麻疹ウイルス融合タンパク質)に結合した新しいB細胞ペプチドエピトープPDL1(プログラム死リガンド1)癌ワクチンが開発されました。前臨床試験では、このPDL1ワクチン(PDL1-Vaxx)が動物の免疫原性が高い抗体を効果的に刺激することが示されています。PDL1-Vaxxで免疫された動物は、さまざまな動物がんモデルにおいて腫瘍負荷の軽減と生存率の延長を示しています。作用機序は、ワクチンによって誘発される抗体が腫瘍細胞の増殖を阻害し、アポトーシスを誘導し、PD-1/PD-L1相互作用を阻害することを示しています。この論文では、デュアルレポーターフロー解析システムを使用して、PD-1/PD-L1相互作用と、PDL1-Vaxxに対して産生された抗PDL1抗体によるその遮断を評価する磁気ビーズベースのアッセイを紹介します。
概要
免疫系のT細胞、B細胞、および細胞内チェックポイントでは、シグナル伝達経路が免疫活性を調節します。一部のがん細胞は、免疫機能を阻害し、腫瘍性の生存と増殖を促進するチェックポイント標的を刺激することにより、免疫攻撃から身を守ります。チェックポイント阻害による腫瘍免疫療法は、抗体を使用してシグナル伝達チェックポイントを標的にしてブロックし、免疫系の抗腫瘍性機能を回復させます1,2,3。現在、非常に効果的な抗がん剤として、プログラム死タンパク質1(PD-1)4を標的とするモノクローナル抗体ニボルマブと、プログラム死リガンド1(PD-L1)5を標的とするアテゾリズマブがあります。このアプローチは、がん患者の治療において大きな臨床的成功を示しています。しかし、現在のチェックポイント阻害戦略の臨床的有用性は、特に単剤療法において、有害事象および治療抵抗性によって軽減される6。がん治療では、免疫療法とより毒性の低いより効果的な治療戦略の組み合わせが緊急に必要とされています1,3,6。
過去30年以上にわたり、カウマヤ博士の研究室では、がん治療のためのペプチドがんワクチンとペプチド模倣関連剤を開発しており、その一部は現在進行中の臨床試験中です1,2,7,8,9,10,11,12,13,14.例えば、B-VaxxとHER-2併用免疫療法は、臨床試験で転移性および/または再発性固形腫瘍に対する患者の有益性を示しています12。同研究所の最新のがんワクチンはPD1-Vaxx 2,13とPDL1-Vaxx14で、前臨床試験、特に併用療法で大きな利点が示されています。PD1-Vaxxは、米国とオーストラリアで用量漸増臨床試験を完了しています。PD1-Vaxxは、2023年5月に開始予定の第1b相試験でアテゾリズマブと併用されます。このレポートでは、PD-1-Vaxx誘導抗体がPD-1/PD-L1相互作用を阻害する能力の評価に焦点を当てています。
PDL1-Vaxxがんワクチンは、PD-L1アミノ酸130-147がGPSLペプチドリンカー を介して 無差別T細胞麻疹ウイルス融合(MVF)ペプチドに結合した新規B細胞ペプチドエピトープワクチンです。前臨床試験では、PDL1-Vaxxがさまざまな動物モデルで抗がん抗体産生を刺激する上で高い免疫原性を示しており、生存期間を延長し、腫瘍の負担を軽減します14。PD-L1ペプチドに対して産生されたこれらの抗体は、PD1/PD-L1相互作用をうまくブロックし、抗腫瘍活性をもたらします。本報告では、PDL1-Vaxx誘導抗体によるPD1/PD-L1複合体形成の遮断を、フローサイトメトリー装置でデュアルレポーター読み出しを備えた磁気ビーズベースのフォーマットを用いて解析するアッセイを紹介する。
プロトコル
1. 実験準備
注:このステップに記載されているすべての試薬/機器の詳細は、 材料表に記載されています。
- 組換えヒトPD-1(rhPD-1;ポリヒスチジンタグ)を入手します。凍結乾燥したrhPD1は、使用前に滅菌ろ過したリン酸緩衝生理食塩水(PBS)、pH 7.4で再溶解してください。
- ビオチン化組換えヒトPD-L1(rhPD-L1)を入手します。使用前に凍結乾燥したrhPD-L1を滅菌脱イオン水で再構成してください。
- ストレプトアビジン標識R-フィコエリトリン検出試薬(SAPE)を入手します。光から保護されたすべてのSAPE溶液は、冷蔵庫の温度(つまり、2〜8°C)で保管してください。
- 蛍光染色した磁性微小球(直径6.5 μm、マグネタイトが埋め込まれたポリスチレン)とビーズカップリングキット15 (使用する場合は、 材料表を参照)を入手します。ミクロスフェアへの共有結合には、スルホ-NHS(スルホ-N-ヒドロコハク酸イミド)とEDC(N-[3-ジメチルアミノプロピル]-N'-エチルカルボジイミド塩酸塩)が必要です。
注:磁気ビーズセットは、500個の固有の蛍光タグのいずれかで利用可能であり、異なるビーズセット16からの識別と区別を可能にします。ビーズは、2.5 × 106 ビーズ/mL および 12.5 × 106 ビーズ/mL のストック濃度で提供されます。ビーズは冷蔵庫の温度(つまり、2〜8°C)で光から保護して保管してください。ビード懸濁液を凍結しないでください。 - ポジティブコントロール抗体とネガティブコントロール抗体、およびBrilliant Violet 421(BV421)標識二次検出抗体を入手します。すべての蛍光標識分子を光から保護して保管してください。
- すべてのカップリング反応は低タンパク質結合チューブで、すべてのアッセイ反応は低タンパク質結合の丸底 96 ウェルマイクロタイタープレートで行います。アッセイのインキュベーションステップ用に、使い捨ての粘着ホイルまたはプラスチック製の96ウェルマイクロプレートカバーでプレートを密封します。磁気プレートセパレーターを使用して、アッセイ洗浄ステップ中にビーズを固定化します。
注:デュアルレポーターフロー分析システムには、3つのレーザーがあります:(1)ビーズセット特異的な蛍光を同定および定量するレーザー(分類チャンネル)。(2)標的特異的フィコエリトリン(PE)蛍光を検出および定量するもの(レポーターチャンネル1;532 nm励起、「オレンジ色」565〜585 nm発光);(3)第2のターゲット分析種(レポーターチャンネル2;405 nm励起、「青色」421-441 nm発光)のターゲット特異的BV421蛍光を検出して定量するもの。
2. rhPD-1と磁気ビーズの結合
注:結合するタンパク質は、ウシ血清アルブミン(BSA)、アジ化ナトリウム、グリシン、グリセロール、トリス(ヒドロキシメチル)アミノメタン(トリス)、またはアミン含有添加剤を含まず、pH 7.4のPBSに懸濁している必要があります。市販のカップリングキットには、本明細書に記載されている必要な試薬および緩衝液がすべて含まれています( 材料表を参照)。
- すべてのカップリング試薬を冷蔵庫から取り出し、室温(室温、18〜22°C)で20〜30分間平衡化させます。
- 製品情報シートに従って、短時間のボルテックス、超音波処理、または回転(15〜30 rpmで15分)して、ストックミクロスフェアを再懸濁します。
- 1×106 個の磁気ビーズを1.5 mLの低タンパク質結合微量遠心チューブに移します( 材料表を参照)。
- ビーズを100μLの活性化バッファー15:0.1 M NaH2PO4 (一塩基性)、pH 6.2で洗浄します。
注:カップリングは、0.1 M 2-モルホリノエタンスルホン酸(MES)、pH 6.0)を含む事前設定済みのカップリングキットを使用して、代替の活性化およびカップリングバッファーとして使用することもできます( 材料表を参照)。- ビーズの入ったチューブを磁気セパレーターに1〜2分間入れます。
注:あるいは、ビーズを≥8,000 × g で1〜2分間微量遠心分離して分離することもできます。 - チューブを磁気セパレーターにセットしたまま、磁石で固定またはペレット化されたビーズからピペットで上清を吸引します。
- 微量遠心チューブを磁石から取り外し、80 μLのカップリングバッファーを加えます( 材料表を参照)。
- 反応チューブを静かにボルテックスし、20秒間超音波処理してビーズを分散させます。
- ビーズの入ったチューブを磁気セパレーターに1〜2分間入れます。
- スルホ-NHSとEDCでビーズを活性化します。
注:スルホ-NHSのストック溶液は、活性化バッファーに溶解した50 mg/mLです。EDCの原液も50 mg/mLを活性化バッファーに溶解しています。活性化バッファーと大気中の水分の両方がEDCの分解を引き起こします。保存されたEDCソリューションを使用することはお勧めできません。ステップの前に十分な量の新鮮なEDC溶液を作り、溶液の準備ができたらすぐに使用してください。余分なEDC溶液を廃棄します。
注意: EDCは重度の眼刺激を引き起こし、気道および皮膚を刺激します。- 洗浄して活性化したビーズを入れたマイクロチューブに10 μLのスルホ-NHSを加えます。
- ビーズとスルホ-NHSを入れたマイクロチューブに10 μLのEDCストック溶液を加えます。
- 感光性微小球を光から保護し、回転子上で15〜30rpmで20分間、室温(18〜22°C)で回転させます。あるいは、10分間隔でビーズを再分配するために穏やかにボルテックスすると、活性化ステップ中にチューブを静止したままにすることができます。
- ビーズから余分なカップリング試薬を洗い流します。
- 活性化ビーズの入ったチューブを磁気セパレーターに1〜2分間入れます。
- チューブを磁気セパレーターにセットしたまま、磁石で固定またはペレット化したビーズからピペットで上清を吸引します。
- 微量遠心チューブを磁石から取り外し、100 μLの活性化バッファーを加えます。
- 反応チューブを静かにボルテックスしてビーズを分散させます。
- 手順2.6.1〜2.6.4をさらに2回繰り返して、合計3回洗浄します。洗浄終了時に、ビーズは100 μLの活性化バッファーに約10〜10 6ビーズ/mLの濃度で懸濁×されます。
- rhPD-1ペプチドを活性化ビーズに結合させます。
- 活性化ビーズの入ったチューブに390 μLの活性化バッファーを添加し、ビーズ懸濁液の総量を490 μLにします。
- 活性化ビーズの入ったチューブに10 μLのPD-1ペプチド溶液(PBSに溶解した1 mg/mL)を添加し、活性化ビーズ懸濁液にPD-1ペプチド1 μgを添加します。
- 微量遠心チューブを短時間ボルテックスして、PD-1と活性化ビーズを均一に分散させます。
- ビーズをPD-1とともに暗所で室温(18-22°C)で回転(15-30rpm)しながら2時間インキュベートします。
- アッセイ/ウォッシュバッファー(PBS-TBN:1x PBS、pH 7.4 + 0.1% BSA + 0.05% Tween-20 + 0.05% NaN315)を使用してビーズを2回(2回)洗浄します。
- 活性化ビーズの入ったチューブを磁気セパレーターに1〜2分間入れます。
- チューブを磁気セパレーターにセットしたまま、磁石で固定またはペレット化されたビーズからピペットで上清を吸引します。
- 微量遠心チューブを磁石から取り外し、100 μLの活性化バッファーを加えます。
- 反応チューブを静かにボルテックスしてビーズを分散させます。
- 手順2.8.1〜2.8.4をさらに1回繰り返して、合計2回の洗浄を行います。洗浄終了時に、ビーズは100 μLの活性化バッファーに10〜106ビーズ /mLの濃度で懸濁×されます。
注:アッセイ/洗浄バッファーは、バッファーを保存媒体としても使用しない場合、アジ化ナトリウム(防腐剤)を使用せずに作成できます。 - rhPD-1結合ビーズをすぐに使用しない場合は、2〜8°Cの冷蔵庫で暗所で保管してください。タンパク質共役ビーズは、最大18ヶ月間安定です。
3. rhPD-1のビーズへの結合成功の評価
注:rhPD-1結合ミクロスフェアは、ビオチン化rhPD-L1と反応し、後者はSAPEとのインキュベーションとそれに続くフローサイトメーターでの評価によって検出されます。これにより、PD-1と磁気ビーズとの結合が成功し、rhPD-1とrhPD-L1タンパク質間の機能的相互作用が検証されました。
- PBS-TBN 溶液中のビオチン化 rhPD-L1 の 2 倍段階希釈シリーズを作成します(標準の rhPD-L1 溶液は 1 mg/mL です)。試験する最終的なrhPD-L1濃度範囲は、8 μg/mL溶液から313 pg/mL溶液までです。各rhPD-L1希釈液を150 μLの容量で作成します:各反応で50 μL、および条件ごとに2回の反応に加えて、ピペッティングの損失に対応するのに十分な余剰量。
- rhPD-L1希釈マイクロチューブを8 μg/mL、4 μg/mL、2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL、0.125 μg/mL、0.063 μg/mL、0.031 μg/mLとラベル付けします。0 μg/mL チューブ(PBS-TBN のみ)は、no-PD-L1 コントロールとして機能します。
- 150 μL の PBS-TBN をすべての標識 rhPD-L1 希釈チューブにプレロードします。
注:試験するrhPD-L1の最終濃度は8 μg/mLであり、rhPD-L1は反応混合物に添加すると1:1に希釈されるため、「8 μg/mL」と表示されている希釈チューブは最終濃度を指し、実際には16 μg/mLのrhPD-L1が含まれています。すべての希釈チューブのラベルは、反応物に添加した後の最終的なrhPD-L1濃度を示しています。 - 最高濃度のrhPD-L1希釈液(実量16 μg/mL)を作成します。これは、1 mg/mL rhPD-L1 ストック溶液 (1,000 μg/16 μg = 62.5) を 2 段階、62.5 倍に希釈したものです。
- 84 μLのPBS-TBNと16 μLのrhPD-L1ストック溶液(1 mg/mL、すなわち1,000 μL)を微量遠心チューブに入れます。これは6.25倍希釈液で、得られた濃度は160μg/mLのrhPD-L1です。
- 「8 μg/mL」とラベル付けされたチューブに、270 μLのPBS-TBNと、前のステップで作成したrhPD-L1希釈液30 μL(160 μg/mL)を混ぜ合わせます。これは 10 倍希釈液で、得られる濃度は実際には 16 μg/mL です。「8 μg/mL」チューブラベルは、反応に添加した後の最終濃度を示しています。
- ステップ3.1.3で作成したrhPD-L1希釈液150μL(「8μg/mL」)を「4μg/mL」チューブに移し、微量遠心チューブキャップを閉じ、短時間ボルテックスして溶液を混合します。
- rhPD-L1希釈系列が完了するまで、手順3.1.4を順次繰り返します。作成後、「8 μg/mL」から「0.063 μg/mL」までのすべてのチューブ、および0 μg/mLのコントロールには150 μLの溶液が含まれ、最後のチューブ「0.031 μg/mL」には300 μLの溶液が含まれている必要があります。これにより、各希釈液 50 μL のビオチン化 rhPD-L1 希釈液を二重反応で試験するのに十分な量が得られ、ピペッティングの損失に対応するのに十分な余剰量が残ります。
- 血球計算盤17を用いてrhPD-1結合ビーズをカウントする。
- ストックrhPD-1結合ビーズを5 × 104 ビーズ/mLに希釈し、2,500ビーズ/50 μL/反応に十分な容量にします。
- 5 × 10 4ビーズ/mL rhPD-1結合ビーズ懸濁液をボルテックスし、懸濁液50 μLを96ウェル丸底マイクロタイタープレートの各標識/マッピングウェルにピペットで移動させ、試験中のrhPD-L1希釈液ごとに複製ウェルが作成されるようにします。
- ステップ 3.1 で作成した各ビオチン化 rhPD-L1 希釈チューブ 50 μL を、マイクロタイタープレート上の適切なウェルに加えます。
- マイクロタイタープレートを使い捨てホイルまたはプラスチック粘着プレートシーラーで覆い、オービタルシェーカー(600rpm)で室温(18〜22°C)で暗所でプレートを1時間インキュベートします。
- ビーズから余分なビオチン化rhPD-L1を洗浄します。
- 密封されたプレートをオービタルシェーカーから磁気プレートセパレーターに2分間移し、ビーズを固定します。
- 粘着プレートシーラーを慎重に取り外し、磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートを反転させ、必要に応じて上澄み液をシンクまたはバイオハザード液体廃棄物容器に捨てます。反転したプレートを吸収性のある紙ティッシュのクッションに優しく、しかし活発に軽くたたいて、残りの上澄みを取り除きます。
- マイクロタイタープレートを磁気プレートセパレーターから取り外し、150 μLのPBS-TBNを各ウェルにピペットで移します。
- 密封されていないプレートを磁気セパレーターに2分間置き、ビーズを固定します。
- 磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートをひっくり返して、必要に応じて上澄み液を流しまたはバイオハザード液体廃棄物容器に捨てます。反転したプレートを吸収性のある紙ティッシュのクッションに優しく、しかし活発に軽くたたいて、残りの上澄みを取り除きます。
- プレート洗浄ステップ3.7.3-3.7.5を2回繰り返し、それぞれ150μLのPBS-TBNで合計3回洗浄します。最後の洗浄ステップの最後にウェルに上澄みが残っていないことを確認してください。井戸底の固定ビーズの乾燥を防ぐために着実に作業します。
- SAPE検出試薬を追加します。
- PBS-TBNのSAPEストック溶液を使用濃度6 μg/mLに希釈します。すべての反応ウェルが100 μL/ウェルを受け取れるように、ピペッティングの損失に対応するのに十分な量のSAPEワーキング溶液を調製します。
- マイクロタイタープレートを磁気プレートセパレーターから取り外します。
- 各反応ウェルに100μLのSAPEワーキング溶液を加え、洗浄したビーズをピペッティングで再懸濁します。
- 96ウェルマイクロタイタープレートをホイルまたはプラスチック粘着プレートシーラーで密封し、オービタルシェーカー上で600rpmの室温(18-22°C)で暗所で1時間インキュベートします。
- マイクロタイタープレートをインキュベーターから取り外し、それを磁性プレートセパレーターに移してビーズを固定化し、粘着プレートシーラーを取り外し、ステップ3.7.3-3.7.5の説明に従って、150μLのPBS-TBNでビーズを3回洗浄します。
- 最終洗浄液を除去した後、プレートを磁気プレートセパレーターから取り外し、ビーズを1ウェルあたり100μLのPBS-TBNに再懸濁します。
- 結果を分析します。
- フロー分析装置( 材料表を参照)のプレートを読み、次の装置設定を使用して各反応の蛍光強度(MFI)の中央値を決定します:吸引量 = 50 μL;最小ビーズ数= 100ビーズ;タイムアウト設定 = 40 秒;ゲーティング= 7,000-17,000;動作モード = シングル レポーター。各条件に対して重複ウェルが実行され、各条件の 2 つの出力 MFI 値が平均化されてから、さらにデータ計算とグラフ化が実行されます。
注:各希釈液の MFI 値は、濃度依存的な結合を示し、ビーズへの許容可能な rhPD-1 カップリング効率を示し、組換え PD-1/PD-L1 タンパク質の良好な相互作用を確認する必要があります。
- フロー分析装置( 材料表を参照)のプレートを読み、次の装置設定を使用して各反応の蛍光強度(MFI)の中央値を決定します:吸引量 = 50 μL;最小ビーズ数= 100ビーズ;タイムアウト設定 = 40 秒;ゲーティング= 7,000-17,000;動作モード = シングル レポーター。各条件に対して重複ウェルが実行され、各条件の 2 つの出力 MFI 値が平均化されてから、さらにデータ計算とグラフ化が実行されます。
4. PD-L1磁気ビーズを用いたPD-1/PD-L1ブロッキングアッセイ
注:このアッセイは、組換えPD1/PD-L1相互作用に対する可溶性メディエーター(抗PDL1ペプチド抗体など)のブロッキング活性を評価します。簡単に説明すると、ビオチン化rhPD-L1は、異なるPDL1-Vaxxペプチド接種後にウサギで生成された抗体とプレインキュベートされます。次に、rhPD-L1+抗PDL1抗体混合物をrhPD-1結合磁気ビーズを用いて捕捉し、ストレプトアビジン-PEを添加することにより、rhPD-1結合ビーズに結合するrhPD-L1を定量する。PE蛍光シグナルは、試験した抗PDL1抗体/阻害剤のブロッキング活性と逆相関します。抗PDL1ペプチド抗体の結合は、BV421結合抗ウサギ抗体(抗PDL1ペプチド抗体用)または抗ヒト用(対照抗体用)二次抗体の結合と、装置の第2チャンネルのBV421蛍光の評価によって同時に評価されます。アッセイのステップを 図1に示します。
- PDL1-Vaxx誘導ポリクローナル抗体候補、陰性対照抗体(トラスツズマブ、ハーセプチン、ヒト化抗HER2モノクローナル抗体)、およびポジティブコントロール抗体(アテゾリズマブ、ヒト化抗PDL1 IgG1モノクローナル抗体)を含む試験抗体の2倍段階希釈シリーズを調製します。各反応では、割り当てられた抗体希釈液を 25 μL 使用するため、表示されている容量は、各条件(条件ごとに 50 μL)で各反応を複製ウェルで実施するのに十分であり、ピペッティングの損失に対応するために余剰分がいくらか残っています。
- ワクチン誘発性抗PDL1-ペプチド抗体および対照抗体のそれぞれについて、試験する最終抗体濃度の範囲が1,000 μg/mLから8 μg/mLの範囲であることを確認してください。すべての抗体のストック溶液を2,000 μg/mLで調製します。
- 各抗体について、希釈チューブに1,000 μg/mL、500 μg/mL、250 μg/mL、125 μg/mL、63 μg/mL、31 μg/mL、16 μg/mL、8 μg/mLとラベル付けし、抗体名を記載します。各抗体について、ビヒクルのみ(PBS-TBN)コントロールとなる「0 μg/mL」チューブも追加します。
注:反応混合物に添加すると、抗体濃度は1:1に希釈されます。抗体希釈チューブは、反応に添加 した後の最終抗体 濃度として標識されており、実際には標識の2倍の量の抗体が含まれています。 - 「0 μg/mL」ビヒクル専用コントロールチューブを含む、「500 μg/mL」以下のラベルが貼られたすべての抗体希釈チューブにPBS-TBNを75 μL添加します。
- 各抗体について、2,000 μg/mLの原液150 μLを「1,000 μg/mL」と表示されたそれぞれのチューブにピペットで移します。これは、各抗体の後続のすべての希釈を行うために使用されます。
- 各抗体について、75 μLを「1,000 μg/mL」チューブから次に低い希釈率(つまり「500 μg/mL」)のチューブにピペットで移し、完全希釈シリーズを作成します。新しく完成した希釈チューブを閉じ、短時間ボルテックスし、「500 μg/mL」チューブから「250 μg/mL」チューブに75 μLを移して希釈系列の構築を続けます。すべての抗体について、最後の希釈液である「8 μg/mL」が得られるまで、このパターンを繰り返します。
注:各抗体の完全希釈シリーズでは、150 μLの容量を含む最も低い希釈率の8 μg/mLを除き、すべてのチューブで75 μLの容量が必要です。各反応では 25 μL の抗体希釈液を使用するため、これらの容量は、各条件(条件ごとに 50 μL)の重複ウェルで各反応を実行するのに十分であり、ピペッティングの損失に対応するために余分に使用できます。
- 希釈した抗体 25 μL を 96 ウェルマイクロタイタープレートの指定されたウェルに入れます。
- ビオチン化rhPD-L1をPBS-TBN中で使用濃度4 μg/mLに希釈し、各条件で25 μL(すなわち、各条件で50 μL)の重複ウェルを含むのに十分な容量で、ピペッティングの損失に対応するために追加します。
注:この研究では、4 μg/mL のビオチン化 rhPD-L1 により、以前のカップリング評価で測定された最大 MFI シグナルの約 50% が得られ、PD-1/PD-L1 ブロッケード分析に使用されました。 - 各反応ウェルにビオチン化rhPD-L1(4μg/mL)25 μLを加え、マイクロタイタープレートをホイルまたはプラスチック接着剤シールで覆い、室温(18-22°C)で1時間インキュベートし、600rpmのオービタルプレートシェーカーで振とうします。
- rhPD-1結合ビーズを50,000ビーズ/mLに希釈し、50 μL/ウェル(2,500ビーズ/ウェル)に十分な容量に加えて、ピペッティングロスに対応するための追加容量を確保します。
- シェーカーから96ウェルマイクロタイター反応プレートを取り外し、接着プレートシールをはがします。
- 50 μLのrhPD-1結合ビーズ混合物を各ウェルに加えます。
- プレートを密封し、暗所で室温(18-22°C)で600rpmのオービタルシェーカーで1時間インキュベートします。
- 密封されたプレートをオービタルシェーカーから磁気プレートセパレーターに2分間移し、ビーズを固定します。
- 粘着板シーラーを慎重に取り外し、磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートを反転させて上澄みを捨てます。反転したプレートを吸収性のある紙ティッシュのクッションにそっとたたいて、余分な上澄みを取り除きます。
- ビーズから余分な反応試薬を洗浄します。
- マイクロタイタープレートを磁性プレートセパレーターから取り外し、各ウェルに150μLのPBS-TBNを添加します。
- マイクロタイタープレートを磁気プレートセパレーターに2分間置き、ビーズを固定します。
- 磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートをひっくり返して上清を捨てます。反転したプレートを吸収性のある紙ティッシュのクッションにそっとたたいて、余分な上澄みを取り除きます。
- プレート洗浄手順4.11.1〜4.11.3を2回繰り返し、PBS-TBNで合計3回洗浄します。最終(3回目)の洗浄液を除去する前に、SAPE試薬が調製されていることを確認してください(下図)。
- SAPE検出試薬を添加します。
- SAPE ストック溶液を PBS-TBN で 6 μg/mL の使用濃度に希釈します。100 μL/ウェルに十分な容量と、ピペッティングロスに対応するための容量を余分に用意します。
- 100 μL/ウェルのSAPE作動溶液を各反応ウェルに加え、ピペッティングでビーズを再懸濁します。
- プレートを密封し、暗所で室温(18-22°C)で600rpmのオービタルシェーカーで1時間インキュベートします。
- 反応液から余分なSAPEをデカントします。
- 密封されたプレートをオービタルシェーカーから磁気プレートセパレーターに2分間移し、ビーズを固定します。
- 粘着プレートシーラーを慎重に取り外し、磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートを反転させて上澄みを捨てます。逆さにしたプレートを吸収性ペーパーティッシュのクッションにそっとたたき、余分なSAPEを含む上澄みを取り除きます。
- ビーズから余分なSAPEを洗い流します。
- マイクロタイタープレートを磁気プレートホルダーから取り外します。
- 150 μLのPBS-TBNを各ウェルに添加し、ビーズを再懸濁します。
- マイクロタイタープレートを磁気プレートセパレーターに2分間置き、ビーズを固定します。
- 磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートをひっくり返して上澄みを捨てます。反転したプレートを吸収性のある紙ティッシュのクッションにそっとたたいて、余分な上澄みを取り除きます。
- 手順4.15.1〜4.15.4を繰り返して、PBS-TBNで合計3回の洗浄ステップをさらに2回実行します。最終(3回目)の洗浄液を除去する前に、BV421を結合させた二次検出抗体を調製し(次のステップ)、準備してもらいます。
- BV421を結合させた二次抗体を添加します。
- BV421 結合抗ヒト IgG(ヒト化コントロール抗体の検出用)および BV421 結合抗ウサギ IgG(PDL1-Vaxx 誘導ポリクローナル抗体の検出用)( 材料表を参照) を 1:400 の洗浄/アッセイバッファーで、それぞれ 100 μL/ウェルを使用するのに十分な量に希釈し、ピペッティング損失に対応するために追加します。
- 希釈したBV421標識抗ヒトIgGまたはBV421標識抗ウサギIgGを100 μL適切なウェルに添加します。
- プレートを密封し、暗所で室温(18-22°C)で600rpmのオービタルシェーカーで1時間インキュベートします。
- ビーズから過剰なBV421標識二次抗体をデカントします。
- 密封されたプレートをオービタルシェーカーから磁気プレートセパレーターに2分間移し、ビーズを固定します。
- 粘着プレートシーラーを慎重に取り外し、磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートを反転させて上澄みを捨てます。反転したプレートを吸収性紙ティッシュのクッションにそっとたたき、過剰なBV421標識二次抗体を含む上清を除去します。
- ビーズから余分なBV421標識二次抗体を洗浄します。
- 150 μLのPBS-TBNを各ウェルに添加し、ビーズを再懸濁します。
- マイクロタイタープレートを磁気プレートセパレーターに2分間置き、ビーズを固定します。
- 磁石とマイクロタイタープレートがしっかりとくっついていることを確認し、プレートをひっくり返して上澄みを捨てます。反転したプレートを吸収性のある紙ティッシュのクッションにそっとたたいて、余分な上澄みを取り除きます。
- 手順4.19.1〜4.19.3を繰り返して、PBS-TBNで合計4回の洗浄ステップを3回追加します。
- 最後(4番目)の洗浄バッファーを除去した後、マイクロタイタープレートを磁気プレートセパレーターから取り出し、ピペッターでビーズを100 μLのPBS-TBN/ウェルに再懸濁します。
- 結果を分析します。
- デュアルレポーターフロー分析システムのプレートを読み取り、以下の装置設定を使用して各反応のMFIを決定します:吸引量 = 50 μL;最小ビーズ数= 100ビーズ;タイムアウト設定 = 40 秒;ゲーティング:7,000-17,000;動作モード = デュアルレポーター。
- デュアルレポーターシステムでは、レポーターチャンネル1がオレンジ色のPE蛍光(rhPD-1標識ビーズに付着したrhPD-L1の量)を測定し、レポーターチャンネル2が青色のBV421蛍光(rhPD-L1に結合したブロッキング抗体の量)を測定していることを確認します。
- 条件ごとにウェルを複製し、各条件の 2 つの出力 MFI 値を平均してから、さらにデータの計算とグラフ化を実行します。
- 各サンプルのMFI値をネガティブコントロールに標準化し、各サンプルの阻害率を計算します。
阻害%=(100×[ネガティブコントロールMFI-サンプルMFI])/ネガティブコントロールMFI
注:ネガティブコントロールMFI値(阻害なし)は最高値です。結合したPD-L1シグナルMFIは100%であり、rhPD-L1のrhPD-1への結合の阻害は0%と定義されています。
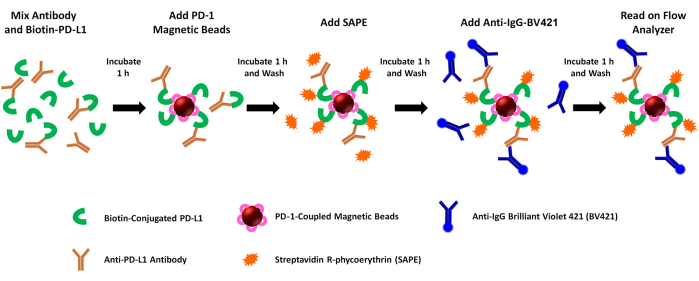
図1:デュアルレポーターPD-1/PD-L1ブロッケードアッセイの概略図。 ビオチン化組換えヒトPD-L1(rhPD-L1)は、選択されたPDL1-Vaxx誘導抗PDL1抗体とプレインキュベートした後、rhPD-1結合磁気ビーズと結合してPD-1/PD-L1チェックポイント複合体を形成します。次に、複合体rhPD-L1が検出され、ストレプトアビジン共役フィコエリトリン(SAPE、オレンジ色素色素)の添加によってマークされます。PDL1-Vaxxエピトープに対する抗体は、磁気ビーズにあらかじめ結合したrhPD-1と複合体を形成したrhPD-L1を標的とし、Brilliant Violet 421標識二次抗体(BV421、青色蛍光色素)を用いて照射します。PD-1と複合体を形成したビオチン化rhPD-L1(PEシグナル)と、rhPD-L1を認識して結合する抗PDL1抗体(BV421シグナル)の両方を、2つの別々のレポーターチャンネルで両方の蛍光色素のサンプルを調査するデュアルレポーターフローサイトメトリー装置を使用して同時に分析します。各サンプルの出力値は、各蛍光色素の蛍光強度の中央値です。次に、異なるPDL1-Vaxx誘導抗体によるPD1/PD-L1複合体形成の阻害を、rhPD-L1に結合しないネガティブコントロールモノクローナル抗体(0%阻害)を用いて生成されたシグナルと比較することにより推定します。 この図の拡大版をご覧になるには、ここをクリックしてください。
結果
このアッセイでは、がん治療薬として研究されているrhPD-L1ワクチンペプチドに対して産生された4つのユニークなポリクローナル抗体によるPD-1/PD-L1相互作用の阻害を正確に定量することができました。このアッセイの概略図を 図1に示します。rhPD-1 結合ビーズに結合したビオチン化 rhPD-L1 の量と、4 つの PLD1-Vaxx 誘導抗体候補によるこの結合の阻害を、rhPD-L1 に直接結合するストレプトアビジン-PE 検出試薬を使用してレポーターチャンネル 1 で測定しました(図 2)。
4つのポリクローナル抗PDL1ペプチド抗体はすべて、マイクロスフェア上に固定化されたrhPD-L1とPD-1との相互作用をさまざまな程度でブロックしました。さまざまな抗PDL1ペプチド抗体の阻害率は、試験した最大濃度1,000 μg/mLで48%から74%の範囲でした。陽性対照モノクローナル抗体アテゾリズマブは、最大試験濃度14 の4 μg/mLでPD-1/PD-L1相互作用の92%阻害を達成しました(図2)。実験したすべてのPDL1-Vaxx抗体は、PD-1/PD-L1システムとの相互作用が予想されていなかったネガティブコントロール抗体であるトラスツズマブと比較して、rhPD-1標識ビーズへのrhPD-L1結合の濃度依存的な阻害を示しました。
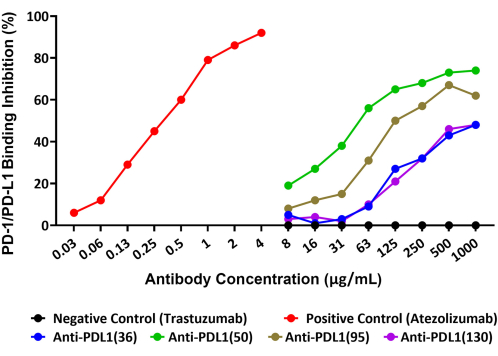
図2:抗PDL1ペプチド抗体による磁気ビーズ結合によるrhPD-L1とrhPD-1の相互作用の遮断(新しい蛍光ビーズベースのイムノアッセイで示 )。組換えヒトPD-1を磁気ミクロスフェアに結合させ、ビーズを異なる抗PDL1ペプチド抗体と事前にインキュベートしたビオチン化rhPD-L1とインキュベートしました。ストレプトアビジン-フィコエリトリン検出試薬を使用してビオチンを結合させ、PD-1に結合できるrhPD-L1の相対量を評価しました。PDL1ペプチドワクチン(抗PDL1[36]、抗PDL1[50]、抗PDL1[95]、および抗PDL1[130])に対するウサギで産生されたポリクローナル抗体は、阻害活性について試験され、試験された最高濃度で組換えPD-1/PD-L1相互作用の48%-74%の遮断を示しました。アテゾリズマブ(別の抗PDL1モノクローナル抗体)をポジティブコントロールとして使用しました。無関係な市販のモノクローナル抗体トラスツズマブ(抗HER2)をネガティブコントロールとして使用しました。この図はGuo et al.14から引用したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。
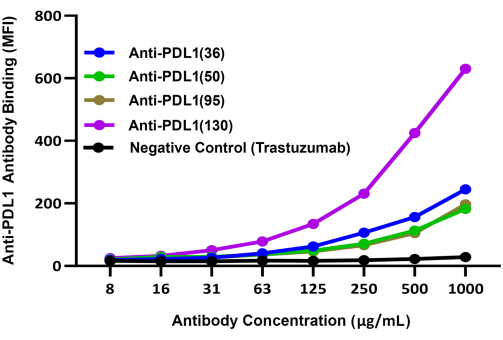
図3:rhPD1でコーティングされた磁気ビーズと複合体を形成したrhPD-L1への異なるPDL1-Vaxx誘導抗体の結合の比較。 Brilliant violet 421標識二次検出抗体を使用して、rhPD-1コーティングビーズ を介した 異なるウサギポリクローナル抗PDL1-ペプチド抗体のrhPD-L1への結合を比較しました。BV421 の青色蛍光シグナルは、デュアルレポーター装置のレポーターチャンネル 2 で記録されました。このシグナルは、実験的な抗PDL1ペプチド抗体の相対的な結合効率と相関しています。PD-1/PD-L1とは異なるチェックポイントを標的とするモノクローナル抗体であるトラステズマブ(抗HER2)をネガティブコントロールとして使用しました。MFIは、条件ごとに重複反応ウェルで測定された平均ビーズ中央値蛍光強度を表します。この図はGuo et al.14から引用したものです。 この図の拡大版をご覧になるには、ここをクリックしてください。
rhPD-L1に結合する4つの実験的PDL1-Vxx誘導抗体候補抗体の相対的な能力を、装置の2番目のレポーターチャネルで評価した別の検出システム(BV421標識抗ウサギIgG)を用いて比較しました。これらの結果は、4つのポリクローナル抗PDL1ペプチド抗体すべてがrhPD-L1に濃度依存的に結合していることを示しました14 (図3)。抗PDL1(130)抗体は、4つのPDL1-Vaxx誘導抗体候補の中で最も高いrhPDL1結合シグナルを示しました。
ディスカッション
チェックポイント関連がん免疫療法の目的は、チェックポイントタンパク質と腫瘍の生存および進行における重要なリガンドとの相互作用を破壊することです2。本研究グループでは、PD-1/PD-L1チェックポイント3,8,13,14を標的とし、それを阻害する抗体応答を誘導する新規PD-1およびPD-L1ワクチンの開発を積極的に進めています。以前は、組換えPD1/PD-L1相互作用の阻害に対する抗PDL1-ペプチド抗体の効果を評価するために、酵素結合免疫吸着アッセイ(ELISA)の2つのバリエーションが実施された14。(1)第1の変異体では、rhPD-L1をマイクロタイタープレート上にコーティングし、希釈した抗PDL1ワクチン候補誘導抗体とインキュベートしました。次に、抗体による組換えPD-1/PD-L1相互作用の阻害を、ビオチン化rhPD-1を添加し、ストレプトアビジン-西洋ワサビペルオキシダーゼ複合体と比色基質を用いて固定化rhPD-L1への結合を定量化することにより評価しました。これを直接封鎖アッセイと定義しました。(2)第2のバリアントでは、PD-1をマイクロタイタープレートにコーティングした。ビオチン化rhPD-L1は、抗PLD1候補誘導ポリクローナル抗体のそれぞれと別々の反応チューブでプレインキュベートしました。次に、rhPDL1/抗PDL1混合物を固定化rhPD-1を含むプレートウェルに添加し、反応させました。潜在的にブロッキングするPDL1-Vaxx誘導抗体の存在下で固定化されたrhPD-1と反応したrhPDL1は、その後のストレプトアビジンHRPおよび比色基質インキュベーションで検出されました。これを逆封鎖アッセイと定義しました。
抗PDL1-ペプチド抗体による組換えPD-1/PD-L1相互作用の逆遮断は、抗体濃度依存的にシグナルの阻害(すなわち、PD-1/PD-L1遮断)を示したが14、直接遮断アプローチは一貫した結果を提供しなかった(図示せず)。ビーズベースのデュアルレポーターブロッケードアッセイは、ELISAの結果を検証し、液相でのPD-1/PD-L1相互作用のブロッセードを調査するために開発されました。ミクロスフェア分析は、リバースブロッケードアッセイを用いた ELISA ブロッキング結果と直接相関しました(図 2)。さらに、蛍光ベースのイムノアッセイは、比色ELISAと比較してアッセイ感度の向上とダイナミックレンジの拡大18を提供し、さらに、マルチプレックスビーズベースのアッセイにより、1回の反応で2つの独立したイムノアッセイを同時に行うことができます。マイクロスフェアとrhPD-1の共有結合に使用されたスルホ-NHSおよびEDCは、直接ブロッケードアッセイと逆ブロッケードアッセイの間に見られる性能の違い、およびELISAとLuminexビーズベースの組換えPD-1/PD-L1相互作用アッセイの間で観察された感度の違いにつながった可能性があります。これらの違いの原因となる可能性のあるメカニズムを研究するために、さらなる化学的および分子レベルの調査が必要です。
ELISA14とビーズベースのアッセイはどちらも、PDL1-Vaxx誘導抗PDL1抗体がPD1/PD-L1チェックポイント複合体の形成を阻害できることを実証しています。ペプチドベースのPDL1-Vaxxは、PD-1/PD-L1相互作用を阻害する抗PDL1抗体の誘導に成功しています。このアプローチは、前臨床動物実験によって裏付けられているように、癌を治療するための新しい治療戦略として役立つ可能性があります3,13,14。計画された臨床試験では、がん患者のチェックポイント免疫療法と疾患管理に対するPDL1-Vaxxの有効性が決定されます。
開示事項
Pravin T.P. Kaumayaは、Imugene, Ltd.のコンサルタントです。
謝辞
著者らは、研究支援をしてくれたLuminex Corporation(テキサス州オースティン)のSherry Dunbar博士(MBA)と、Biomedical Publishing Solutions(フロリダ州パナマシティ、mattsilver@yahoo.com)のMatthew Silverman博士の科学および執筆支援に感謝します。この研究は、米国国立衛生研究所(R21 CA13508およびR01 CA84356)およびオーストラリア、シドニーのImugene Ltd(OSU 900600、GR110567、およびGR124326)のPravin T. P. Kaumaya氏への賞によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
参考文献
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved