Method Article
マウスモデルにおけるパンチトレフィン法を用いた角膜および辺縁部のアルカリ損傷誘導
要約
このプロトコルはマウス モデルで正確で、再生可能なcornealおよびlimbalアルカリの傷害を引き起こす方法を記述する。このプロトコルは、高度に湾曲したマウスの角膜と辺縁部に均等に分散した損傷を可能にするため、有利です。
要約
角膜は視力にとって重要であり、外傷後の角膜の治癒は、その透明性と機能を維持する上で基本的です。角膜損傷モデルの研究を通じて、研究者は角膜がどのように治癒するかについての理解を深め、角膜混濁を予防および管理するための戦略を開発することを目指しています。化学傷害は、マウスで広く研究されている最も一般的な傷害モデルの1つです。以前のほとんどの研究者は、角膜損傷を誘発するために水酸化ナトリウムに浸した平らな紙を使用していました。しかし、平らな濾紙を使用して角膜と辺縁の損傷を誘発することは、マウスの角膜が非常に湾曲しているため、信頼性が低くなります。ここでは、研究者がマウスの角膜と辺縁部に十分に外接し、局在し、均等に分布したアルカリ損傷を作成できるようにする新しい機器である修正生検パンチを紹介します。このパンチトレフィン法により、研究者は、まぶたなどの他の構造を化学物質の影響を受けずに、マウスの角膜と辺縁全体に正確で再現性のある化学火傷を誘発することができます。さらに、この研究では、内側心肺骨を地球の鼻側を識別するためのランドマークとして保存する核出術を紹介します。球と眼瞼結膜、および涙腺もこの技術を使用して無傷に保たれます。眼科検査は、受傷後0、1、2、6、8、および14日目に細隙灯生物顕微鏡とフルオレセイン染色を介して実施されました。臨床的、組織学的、および免疫組織化学的所見により、すべての実験マウスで辺縁幹細胞欠損症および眼表面再生不全が確認されました。提示されたアルカリ角膜損傷モデルは、辺縁幹細胞欠損症、角膜炎症、および線維症の研究に最適です。この方法は、マウスの角膜表面における局所眼科薬の前臨床および臨床効果の調査にも適しています。
概要
角膜は視力にとって重要であり、明瞭な視力の前提条件である透明度など、独自の特性を示します。角膜は、主要な保護的役割を果たすことに加えて、眼の屈折力の2/3を占めています1。視力に重要な役割を果たすため、角膜の損傷と混濁は著しい視力低下を引き起こし、予防可能な失明の原因として世界で2番目に多い原因となっています2,3。重度の辺縁機能障害を伴う角膜損傷では、辺縁のバリア機能が低下し、結膜細胞が角膜表面に向かって移動し、角膜結膜形成4,5が起こり、視力が劇的に低下します。したがって、角膜失明および関連する障害の世界的な負担に対処するために、効果的な予防および治療戦略が必要です。
ヒトの角膜創傷治癒過程に関する現在の理解は、さまざまな損傷に対する角膜の反応を調査した以前の研究に基づいています。さまざまな化学的または機械的角膜損傷を誘発し6,7,8,9、角膜創傷治癒プロセスのさまざまな側面を調査するために、いくつかの技術および動物モデルが採用されています。
アルカリ熱傷モデルは、角膜表面に水酸化ナトリウム(NaOH)を直接塗布するか、または平らな濾紙10を使用して実行される、確立された傷害モデルである。アルカリ損傷は、炎症誘発性メディエーターの放出および多形核細胞の浸潤を、角膜および眼の前房だけでなく網膜にも生じさせる。これにより、意図しない網膜神経節細胞のアポトーシスとCD45+ 細胞の活性化が誘導される11。したがって、アルカリ傷害モデルを使用して過度の意図しない傷害を避けるために、損傷部位を正確に特定することが重要です。
マウスの眼球の軸方向の長さは約3mm12です。角膜と網膜の間の距離が短いため、角膜の湾曲が急峻になり、網膜に光を集中させる高い屈折力が得られます(図1A)。以前に報告したように13、平らな濾紙を使用してこの高曲面に薬害を誘発することは、特に辺縁部では困難です(図1B)。辺縁部への傷害を誘発するには、濾紙を傾ける必要があり、これは円蓋および隣接する結膜に意図しない傷害を引き起こす可能性がある14。別のアプローチでは、角膜表面に薬品を滴として直接塗布します。しかし、この方法では曝露時間を制御できず、結膜、円蓋、まぶたに液体が拡散するため、これらの領域に損傷を誘発するリスクがあります。
これらの限界を克服するために、この研究は、傷害を誘発するための新しいパンチトレフィン法を提示します。この技術には、(i)マウスモデルで角膜表面全体と辺縁部に効果的な化学的損傷を誘発する、(ii)角膜に局所的で十分に限定された損傷を誘発する、(iii)所定の期間、目的の液体を塗布する能力、および(iv)適切な生検パンチを選択することにより、さまざまなサイズの角膜損傷を誘発する能力など、いくつかの利点があります。この方法は、湾曲した角膜表面を示し、眼表面の創傷治癒を研究するために使用される一般的な動物モデルであるラットおよびウサギの傷害モデルにも実行可能です。
プロトコル
すべての手順は、スタンフォード大学の実験動物ケアAPLAC番号33420、科学的目的での動物の使用、および眼科および視力研究における動物の使用に関するARVOステートメントに従って実施されました。生後8-12週齢の雌雄10匹のC57BL/6マウスをIrving L. Weissman研究室から提供した。動物は12時間の明暗サイクルに順応し、水と飼料を 自由に与えました。動物の片目に怪我が誘発されました。
1. 実験の準備
- 資料の準備
注:すべての試薬は室温で維持する必要があります。- パンチトレフィンを準備する:直径3.5 mmの生検パンチを準備し、パンチのシャフトに遠位端から5 mm離れた場所に印を付けます。パンチをしっかりと取り付け、2速回転工具を使用してシャフトのマークされた遠位部分を切断します。このプロセス中は、眼の保護具を着用してください。シャフトを3.5mmの深さでカットし、最後の1.5mmを取り付けたままにします。 図1に示すように、先端を90°曲げます。
- 1 g の NaOH を 50 mL の蒸留水に溶解して、0.5 M NaOH 溶液を調製します。
- 2 mLの100 mg / mLケタミンと1 mLの20 mg / mLキシラジンを組み合わせて、10 mLの麻酔カクテルを調製します。.注射の前に、この混合物を7 mLの0.9%NaCl(生理食塩水)で希釈します。
- 0.1 mLの10% AK-Fluor蛍光液を9.9 mLの滅菌リン酸緩衝生理食塩水(1x PBS)に添加して、0.1%フルオレセインナトリウム溶液を調製します。
- 8 g NaCl、0.2 g KCl、1.44 g Na2HPO4、および0.23 g NaH2PO4を900 mLの蒸留水に溶解してPBS(1x)を調製します。溶液のpHを7.4に調整します。蒸留水を加えて、溶液を最終容量の1Lにします。
- 固定用の4%パラホルムアルデヒド(PFA)溶液を調製します。ケミカルフードの下で、2 g の PFA を 45 mL の PBS に溶解します。混合物を65°Cに加熱し、pHを7.4に滴定します。PFA が溶解したら、溶液を最終容量の 50 mL にします。
2.動物の調製
- マウスの重量を量って、注射用の注射用麻酔薬カクテルの適切な量を決定します。.Machholz et al.15に記載されているようにマウスを適切に取り扱い、拘束した後、麻酔薬カクテルを0.01 mL / gの用量で腹腔内(IP)投与します16,17。下腹部を標的にしてIP注射を行い、臓器の損傷を防ぎます。
- 角膜アルカリ損傷は非常に痛みを伴うため、手術中および手術後に追加の鎮痛のためにブプレノルフィン徐放性注射懸 ?? 液(3.25 mg / kg)を皮下に注射します。.
- 麻酔の深い平面が達成されるまで待ちます。つま先のつまみに対する反応の欠如は、麻酔の深部面が成功したことを示すものとして確認してください。手術開始前に、反対側の目に簡単な眼軟膏を塗って乾燥を防ぎます。
- 麻酔後、標準的なげっ歯類の手術原理18に従って準備された手術台にマウスを置きます。げっ歯類の頭の下に高さ5mmの枕を置き、外側褥瘡の位置に置きます。枕は、手術中にげっ歯類の頭を支えるのに役立ちます。
- さらなる麻酔のためにテトラカイン塩酸塩(0.5%)点眼薬を投与します。.外科用アイスピアーで眼球表面を適切に乾かし、まつげを整えます。
3.アルカリ傷害の誘発
- 手術を開始する前に、標準的なげっ歯類手術の原則18,19に従って手術台を整理し、手術中は手術野を無菌状態に保ちます。麻酔をかけたマウスを適切に可視化するために手術用顕微鏡を配置し、タイマーを30秒に調整します。ひねったペーパータオルを動物の口輪に置き、すすぎプロセス中に意図しない鼻誤嚥を防ぎます。
- 親指と人差し指でマウスのまぶたが大きく開いていることを確認しながら、手術用顕微鏡を使用して辺縁部の周囲を決定します。下向きの圧力をかけずに、きれいなパンチトレフィンを目の軸と平行にそっと保持します。計器を回転させないようにし、パンチトレフィンの軸を地球の軸と平行に保ちます。
- 外科助手に、パンチトレフィンの穴に3滴のNaOH溶液(40μLに相当)を滴下してツールを満たし、角膜表面を適切に覆うように依頼します。液体の表面張力により、機器からの漏れを防ぎます(図1)。
注:NaOH溶液を慎重に滴下するために、50°の角度で平らな先端を備えた27G針を備えた1mmのシリンジを使用しました。 - 30秒後、すぐに角膜をすすぎ、5 mLのPBS(1x)で円膜と円蓋をすすぎます。 ビデオ1 は、化学傷害を誘発する手順を示しています。
- ユニバーサルpHインジケーターペーパーを使用して、負傷した目の角膜表面のpHを7〜7.5に保ちます。次に、化学的に損傷した眼の表面にトリプル抗生物質点眼軟膏を塗布します。
注:手術中の尾の動きは、麻酔薬の深さが低いことの兆候です。麻酔薬を注射して追加の麻酔薬カクテル(ケタミン+キシラジン)を塗布します[ボーラスIP(初期容量の50%)]。 - 手術後、マウスの状態が安定していることを確認してください。動物が痛みを感じている場合は、2回目のブプレノルフィンを投与します。2.2 と同じ処理方法を使用します。動物が麻酔をかけている間に術後検査を開始します。
- 処置後、パンチトレフィンと手術台を70%エタノールで洗浄、乾燥、消毒します。
4. 臨床評価
- 検査のために、ステップ2.1で前述したようにマウスに麻酔をかけます。
- 細隙灯の生物顕微鏡で目(負傷者と非負傷者)を検査します。カメラを使用して写真をキャプチャします(この研究では、シネマティックモードの携帯電話カメラを使用しました)。
- Yoeruekグレーディングシステム20:0 =正常で透明な角膜に従って角膜混濁をスコアリングします。1 = 軽度の不透明度。2 = 不透明度は高くなりますが、虹彩と瞳孔は簡単に区別できます。3 = 虹彩と瞳孔はほとんど区別できません。4 = 角膜は完全に不透明で、瞳孔は見えません。
- 0.1%フルオレセイン点眼薬を塗布します。余分な蛍光液を綿アプリケーターで乾燥させ、コバルトブルーフィルターを使用して角膜上皮欠損の存在を評価します。写真を撮ります。
- 動物が胸骨横臥を維持するのに十分な意識を取り戻すまで監視します。.完全に回復するまで、動物を他の動物に再導入しないでください。
5. 核出術
- 3-5秒21の子宮頸部脱臼による化学傷害誘発の2週間後にマウスを安楽死させます。
- 内側心細胞と眼瞼結膜全体を温存しながら、 動画2のように以下の順番で眼球を摘出します。
- 手術用顕微鏡で、カルアンクルと皮膚の接合部を慎重に解剖します。歯の鉗子を使用して、caruncleを引っ込め、眼瞼結膜の下の外科用ハサミの先端を足根板との接合部に導きます。
- 癒着線に沿って結膜を外側カンサスに向かって切断します。次に、結膜下面の結膜と下足根板の接合部に外科用ハサミを回します。
- 結膜郭清が終わったら、親指と人差し指で上まぶたと下まぶたを鼻側から引っ込めます。引っ込みながら、先端が湾曲したピンセットの先端を、突き出た涙液の後ろに視神経に向かって導きます。視神経をしっかりとつかみ、地球儀を取り出します(図2)。
- グローブをPBS(1x)で洗い流し、固定液に移します。
6. ヘマトキシリンおよびエオシン(H&E)および過ヨウ素酸シッフ(PAS)染色
- 地球儀を10%ホルマリン溶液に室温で一晩固定します。
- 70%エタノール、80%エタノール、90%エタノール、および100%エタノールの濃度の連続した一連の段階的アルコールを使用して、それぞれ10〜15分間組織を脱水します。続いて、目をキシレンに10分間浸します。最後に、目をパラフィンで包みます。
- パラフィンブロックを厚さ6 μmのスライスに切断し、ヘマトキシリンとエオシン(H&E)および過ヨウ素酸シッフ(PAS)染色のためにガラス顕微鏡スライドに取り付けます( 補足ファイル1に記載)。
7. 免疫蛍光イメージングと分析
- 免疫組織化学試験(IHC)では、4% PFAを含むPBS(1x)1 mLに4°Cで一晩固定します。サンプルを1 mLのPBS(1x)で3回、それぞれ5分間洗浄します。
- 氷晶の形成を防ぎ、タンパク質の分子構造を保護するために、PBSで10%のスクロース、20%のスクロース、および30%のスクロース濃度で連続スクロース飽和を実行します。地球儀を光干渉断層撮影ソリューション(OCT; 図2)、-80°Cで保存してください。
- OCTブロックを12 μmの厚さにスライスし、IHC染色のためにガラス顕微鏡スライドにマウントします。
- 0.1% Triton X −100 in PBS (1x) で 15 分間、顕微鏡スライド上の組織切片を透過処理します。次に、PBS(1x)中の5% BSAで非特異的抗原を室温でさらに1時間ブロックします。
- 顕微鏡スライド上の組織切片を、1% BSAを含むPBS(1x)で調製した標的一次抗体のカクテル中で、4°Cで一晩インキュベートします。この実験では、一次抗体は、濃度がそれぞれ2.24 μg/mLおよび1.56 μg/mLの1:100希釈ウサギ抗ケラチン13(K13)および抗ケラチン12(K12)抗体でした。
- インキュベーション後、顕微鏡スライド上の組織切片をPBS(1x)で3回洗浄します。続いて、1:500希釈したロバ抗ウサギIgGで結合した一次抗体を検出します。二次抗体と4°Cで暗所で1時間インキュベートします。その後、PBS(1x)で3回、それぞれ5分間洗浄します。
- DAPIを含む褪色防止蛍光封入剤を顕微鏡の組織切片に一滴塗布し、カバーガラスで覆います。サンプルを暗所で乾燥させ、蛍光顕微鏡で通常の目と怪我をした目に対して同じレーザー設定で調べます。
結果
辺縁幹細胞欠損症(LSCD)の誘発におけるこの方法の有効性は、LSCDの臨床的および組織学的徴候を評価することによって評価されました。臨床評価は、細隙灯顕微鏡と前眼部光干渉断層撮影法(AS-OCT)イメージングによって行われました(図3 および 図4)。
再上皮化は求心的に起こり、角膜の側頭部では鼻部よりも速かった。負傷した眼は、化学的損傷の直後に2+-3+角膜霞を発症しました(図3)。上皮細胞は、辺縁損傷後に結膜から角膜表面に移動しました。大きな角膜上皮欠損は12〜14日目に完全に再上皮化され、同様のサイズで無傷の基底膜と間質の角膜上皮損傷と比較して時間がかかり、通常は損傷後5日以内に治癒しました8,9。LSCDにより、負傷した眼の50%が2週目の終わりに持続的な上皮欠損を発症しました(図3)。角膜浮腫は最初の数日間でより顕著でしたが(図3、図4)、角膜線維症は2週目に顕著で、負傷した目の100%で4+の角膜混濁が発生しました。
血管新生(NV)の初期の兆候は、 図 5に示すように、化学傷害誘発の24時間後に臨床的および組織学的に観察され、損傷22の24時間後に辺縁NVの兆候を示したKvantaらの研究によって特定されたNVのタイムラインと一致しています。治癒の過程で、新しい血管が成熟し、損傷後14日目までに、NVは辺縁部を横切り、角膜中央に到達しました。結膜と角膜の境界を規定する辺縁部が破壊されました。
辺縁幹細胞欠損症および結膜形成の組織学的証拠は、PAS +杯細胞および間質血管の出現によって観察された23,24,25,26。杯細胞は、本傷害モデルで観察され、図6の矢印で示されました。
結膜上皮と角膜上皮は、主にそれぞれK13とK12という固有のケラチンを発現する27。辺縁部損傷後、結膜に由来する新しい上皮細胞が剥離した角膜を覆い、損傷後2週間は損傷動物の角膜表面にK12が発現しませんでした。この所見は、他の研究28と一致して、完全なLSCDと角膜表面に角膜上皮細胞がないことを示しました。しかし、Parkらの研究では、損傷後20週間と32週間でK12の発現が検出され、上皮細胞の分化転換の可能性が示唆されました。
その結果、化学的損傷により辺縁部と辺縁幹細胞が破壊され、結膜上皮細胞が角膜の中心に移動し、剥がれた角膜表面を覆うことが観察されました。これは、 図 7に示すように、結膜と角膜表面全体に発現した結膜上皮細胞マーカーK13によってさらに検証されています。

図1:正常なマウスの右眼と、角膜と辺縁の損傷を誘発するパンチトレフィン 。 (A)角膜が大きく湾曲したマウスの眼球の側面図(矢印は辺縁を示す)。(B)この画像は、大きな濾紙でさえ、辺縁部を適切に覆うには不十分であることを示しています。マウスの眼の辺縁部間の直径はほぼ4mmであり、外径4.5mm、内径3.5mmのパンチ生検(パネル D および H)は、パネル(C)および(E)に示すように角膜および辺縁面を適切に覆っている。(F)パンチトレフィンは、辺縁部の周囲に地球上に適切に保持されます。(g)パンチトレフィンの縁部から漏れがないように、パンチトレフィンを地球儀と平行な軸に適切に配置した後、穴をメチレンブルーで埋める。メチレンブルーの漏れは検出されません。スケールバー = 1 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
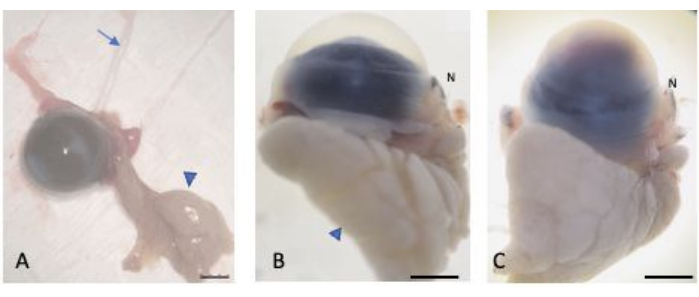
図2:摘出された眼球。 (A)眼球と眼瞼結膜、涙腺(矢じり)、視神経(矢印)を温存しながら眼球を摘出した。正常眼(B)と負傷した眼(C)は、クライオ結晶形成から保護するために30%のスクロースで飽和した。地球儀の鼻の部分は、鼻のcaruncle(Nとラベル付け)で認識できます。スケールバー = 1 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
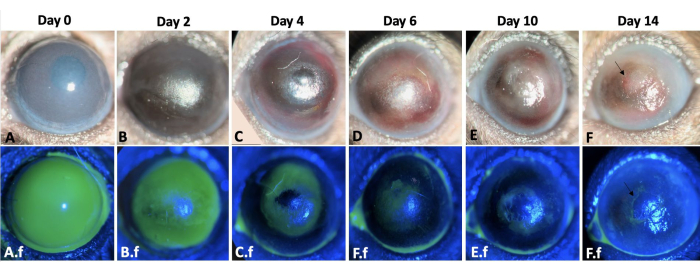
図3:左目の創傷治癒。 角膜および辺縁部のアルカリ損傷後2週間にわたるマウス左眼の創傷治癒過程を、マウスモデルに示します(A-F)。目の細隙灯検査。角膜浮腫は0日目と2日目(A、B)でより顕著ですが、線維症は受傷後2週間(E-F)に顕著です。 A.f-F.fは 、同じ眼の再上皮化過程を示す。損傷誘発直後の角膜および辺縁上皮の総欠損は、A.f.で観察されます。上皮欠損は、結膜上皮細胞の遊走によって求心性パターンで12〜14日までに治癒した(A.f-F.f)。しかし、負傷した眼の50%は、FおよびF.f画像の矢印で示されているように、2週目の終わりに持続的な上皮欠損を発症しました。スケールバー = 1 mm (パネル C)。 この図の拡大版をご覧になるには、ここをクリックしてください。
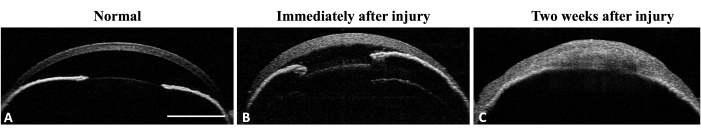
図4:マウスの眼の前眼部OCT。 (A)AS-OCTは、正常な角膜湾曲と前房を示す。虹彩の構造は明確に定義され、認識可能です。虹彩の中間末梢には虹彩角膜の癒着は検出されません。(B)受傷直後は浮腫の形成により角膜の厚さが増加し、虹彩の中央周辺に虹彩角膜癒着が発生します。(C)受傷から2週間後、角膜の湾曲が変化し、前房の破壊を伴う虹彩角膜の癒着が見られます。スケールバー = 1 mm。 この図の拡大版をご覧になるには、ここをクリックしてください。
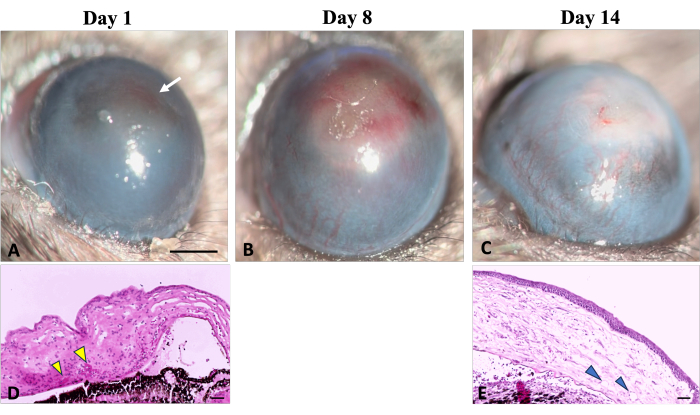
図5:角膜血管新生。 角膜血管新生の臨床的および組織学的徴候は、水酸化ナトリウム(NaOH)損傷後の創傷治癒プロセス中に観察できます。(A)血管新生の初期徴候は、角膜の赤みを帯びた変色(白い矢印で示される)を特徴とする、損傷後の最初の日に検出可能になります。この変色は、対応する組織学的画像(D)に示されているように、間質中の赤血球の凝集に起因します(黄色の矢印で示されています)。(B)再生の最初の1週間で、新しい血管が徐々に増加し、角膜全体に広がります。(C)2週間の終わりまでに、辺縁部は破壊され、新しい血管は進化し続けます。(E)角膜の組織学的切片は、深部間質新生血管新生の存在をさらに示している(矢印で示す)。細隙灯 画像スケールバー = 1 mm、組織学画像スケールバー = 50 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
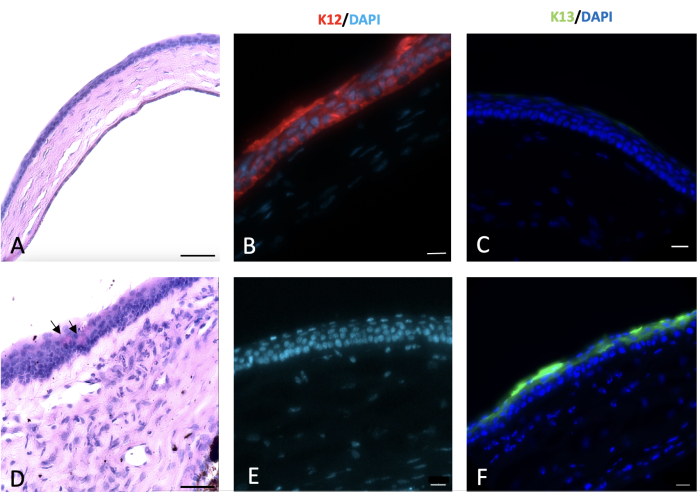
図6:角膜の過ヨウ素酸シッフ染色と免疫組織化化学(IHC)染色。 正常な角膜と損傷した角膜の過ヨウ素酸シッフと免疫組織化学的染色は、損傷の2週間後に行われました。正常なマウス角膜上皮は、4〜5層の細胞で構成されています(A)。角膜と辺縁部へのアルカリ損傷は、(D)の黒い矢印で示すように、角膜表面に杯細胞の出現を伴う角膜の結膜形成を引き起こしました。正常な角膜上皮細胞はK12(B)を発現しますが、これは損傷した角膜を覆う結膜細胞(E)では発現しません。結膜上皮細胞の特徴的なマーカーであるK13は、正常な角膜上皮細胞には発現していません(C)。しかし、それは角膜結膜形成の徴候である水酸化ナトリウム(NaOH)の損傷した角膜表面に存在します(F)。組織学画像スケールバー = 50 μm、IHC 染色画像スケールバー = 20 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
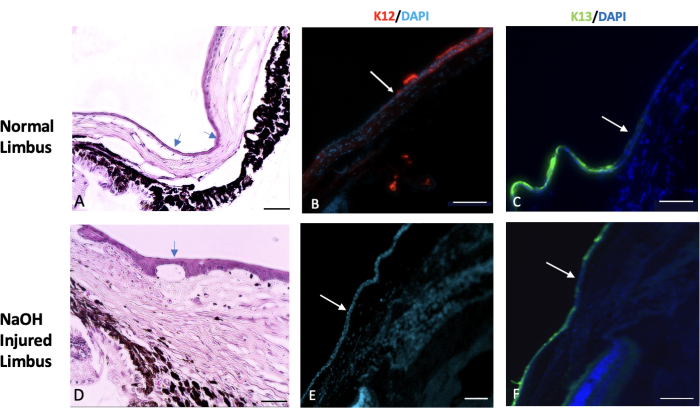
図7:ヘマトキシリンとエオシン、および免疫組織化学的染色。 ヘマトキシリンとエオシン(H&E)と、正常および損傷した辺縁部組織の免疫組織化学的染色が行われました。(A)正常な辺縁部は、強膜の終わりと角膜の始まりの間の移行領域を示します。この領域は、通常、結膜上皮細胞の1層または2層で覆われています(矢印で示されています)。健康な眼では、K12と呼ばれる特定の角膜上皮マーカーの発現は辺縁部から始まり、角膜の表面まで広がります(画像 Bを参照)。一方、K13として知られる結膜マーカーの発現は辺縁に限定されており、それを超えて伸びることはありません(画像 Cの白い矢印で示されています)。水酸化ナトリウム(NaOH)によって損傷した眼では、辺縁の境界が破壊されます。これにより、結膜細胞が損傷した角膜に向かって移動します。(D)NaOHで損傷した辺縁部の画像は、上皮層の下と間質組織内の両方で血管新生の存在を示しています。損傷後、損傷した角膜表面にはK12(E)が欠如していますが、角膜表面にはK13が豊富に発現しています(F)。組織学画像スケールバー = 50 μm、IHC 染色画像スケールバー = 100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
補足ファイル1:染色プロトコル。このファイルをダウンロードするには、ここをクリックしてください。
ビデオ1:パンチトレフィンを用いたマウスモデルにおけるNaOH角膜および辺縁部の損傷。 このビデオでは、パンチトレフィンを装着したマウスモデルにおいて、NaOH角膜および辺縁部の損傷を誘発する手順を実演しています。パンチトレフィンを地球儀と平行な軸に保持し、辺縁部に最小限の圧力を加えることが重要です。この適切な技術は、漏れを防ぎ、最適な結果を得るために不可欠です。 このビデオをダウンロードするには、ここをクリックしてください。
動画2:球結膜温存中の摘出術の図解。 地球の鼻側と側頭側を区別するために、鼻のcaruncleは地球儀と一緒に保存されます。結膜全体は、その接合部から足根板まで解剖されます。最小の圧力で、軌道の内容物は外側に突き出ます。鉗子を地球の後ろに向かって誘導することで、視神経をつかみ、組織を摘出します。摘出された組織には、球体、眼窩脂肪、および眼窩涙腺が含まれます。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、マウスモデルで効果的で再現性のある角膜および辺縁の損傷をうまく誘導するために使用できる革新的なデバイスであるパンチトレフィンを提案します。この辺縁幹細胞欠損モデルは、損傷後の角膜創傷治癒と結膜形成の動態を調査するのに理想的です。
証拠は、マウス角膜の辺縁ニッチと中央部分の両方に幹細胞が含まれていることを示唆しています30。したがって、幹細胞欠損モデルを作成するには効率的な角膜および辺縁部の損傷が必要であり、ここで提示する損傷モデルでは、湾曲した角膜辺縁部を特定の期間化学物質に曝露することができます。NaOH損傷の最適な濃度と期間を決定するために、さまざまなNaOH濃度と期間で損傷を与えました。NaOH濃度が高くなったり、曝露時間が長くなったりすると、組織の損傷や線維化が増加しました。したがって、研究者は、研究の特定の目標と望ましい傷害の重症度に基づいて、これらのパラメーターを調整できます。
この角膜および四肢損傷モデルを正常に再現するには、いくつかの重要な考慮事項を考慮する必要があります。まず、パンチの適切なサイズを決定するために、対象となる目の辺縁から辺縁までの直径を測定することが不可欠です。この直径より0.5〜1mm大きい外径の生検パンチを選択することをお勧めします。
使用する液体の表面張力は、 図1Gに示すように、眼球表面とパンチトレフィンのエッジとの界面での漏れを防ぐ上で重要な要素です。したがって、パンチ生検の先端に圧力をかける必要はありません。
組織に機械的損傷を与えないようにするには、パンチトレフィンを目と平行な軸に保持し、辺縁部に圧力をかけないようにすることが重要です。パンチトレフィン軸の不適切な調整は、漏れのリスクを高め、損傷部位の中心がずれ、不正確な結果をもたらす可能性があります。
この技術の潜在的な制限には、適切なパンチサイズを選択する必要性、パンチトレフィンの保持に習熟すること、および機械的損傷を引き起こす潜在的なリスクが含まれます。ただし、これらの制限は、練習とこのプロトコルで概説されている指示に従うことで克服できます。マウスの系統と年齢範囲は、再上皮化プロセスに影響を与える他の要因であり、研究で考慮する必要があります。
さらに、提案されたプロトコルは、球と眼瞼結膜を保存し、マーカーとして外科的縫合糸を適用せずに地球の鼻部分の決定を可能にする摘出法を詳述しているため、有利です。以前の研究では、眼の鼻領域は角膜の他の領域と比較して神経支配が最も低いことが示されており、血管新生や再生効果の低下に対してより脆弱になります31,32。
要約すると、角膜混濁(CO)、持続性上皮欠損症、角膜血管新生(NV)などのLSCDの臨床徴候と、杯細胞化生、角膜表面でのK13の発現、角膜表面でのK12の欠如などの観察された組織学的変化により、このモデルにおけるLSCDの存在が確認されます。これらの知見は、この新しい技術がLSCDの誘導に有効であるという証拠を提供する。この化学的損傷モデルは、角膜損傷と再生の分野における新薬や薬物治療を調査するための前臨床試験に採用できます。
開示事項
著者はいずれも、この研究で説明されている企業や製品のいずれにも金銭的利害関係を持っていません。著者は、他の利益相反を宣言しません。
謝辞
我々は、NEI P30-EY026877がこの研究を支持していることを認める。スタンフォード大学幹細胞生物学・再生医療研究所のシャーリーン・ワン博士とアーヴ・ワイスマン研究室には、実験動物の提供に多大なるご協力をいただき、大変感謝いたします。画像の準備と編集におけるHirad Rezaeipoorの協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
参考文献
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved