Method Article
마우스 모델에서 펀치-트레핀 기술을 사용한 각막 및 변막 알칼리 손상 유도
요약
이 프로토콜은 마우스 모델에서 정확하고 재현 가능한 각막 및 윤부 알칼리 손상을 유도하는 방법을 설명합니다. 이 프로토콜은 고도로 구부러진 쥐의 각막과 변두리에 고르게 분포된 손상을 허용하기 때문에 유리합니다.
초록
각막은 시력에 매우 중요하며, 외상 후 각막 치유는 각막의 투명성과 기능을 유지하는 데 필수적입니다. 각막 손상 모델 연구를 통해 연구자들은 각막이 어떻게 치유되는지에 대한 이해를 높이고 각막 혼탁을 예방하고 관리하기 위한 전략을 개발하는 것을 목표로 합니다. 화학적 손상은 쥐를 대상으로 광범위하게 연구된 가장 인기 있는 부상 모델 중 하나입니다. 대부분의 이전 연구자들은 각막 손상을 유도하기 위해 수산화나트륨에 적신 납작한 종이를 사용했습니다. 그러나 납작한 여과지를 사용하여 각막 및 사지 손상을 유도하는 것은 쥐의 각막이 매우 구부러져 있기 때문에 신뢰할 수 없습니다. 여기에서 우리는 연구원들이 쥐 각막과 변두리에 잘 둘러싸여 있고 국소적이며 고르게 분포된 알칼리 손상을 만들 수 있도록 하는 새로운 도구인 수정된 생검 펀치를 제시합니다. 이 펀치-트레핀 방법을 통해 연구자들은 눈꺼풀과 같은 다른 구조는 화학 물질의 영향을 받지 않고 전체 쥐 각막과 변두리에 정확하고 재현 가능한 화학적 화상을 유도할 수 있습니다. 또한, 본 연구는 내측 척추를 지구의 비강 쪽을 식별하기 위한 랜드마크로 보존하는 적출 기술을 소개합니다. 구근과 구개 결막, 눈물샘도 이 기술을 사용하여 온전하게 유지됩니다. 안과 검사는 부상 후 0, 1, 2, 6, 8 및 14일에 세극등 생체현미경과 플루오레세인 염색을 통해 수행되었습니다. 임상적, 조직학적, 면역조직화학적 소견은 모든 실험 마우스에서 윤부 줄기세포 결핍과 안구 표면 재생 실패를 확인했습니다. 제시된 알칼리 각막 손상 모델은 변연 줄기 세포 결핍, 각막 염증 및 섬유증을 연구하는 데 이상적입니다. 이 방법은 쥐 각막 표면에 대한 국소 안과 약물의 전임상 및 임상 효능을 조사하는 데에도 적합합니다.
서문
각막은 시력에 매우 중요하며 선명한 시력의 전제 조건인 투명도를 포함한 고유한 특성을 나타냅니다. 각막은 중요한 보호 역할을 할 뿐만 아니라 눈의 굴절력의 2/3를 차지합니다1. 각막 손상과 혼탁은 시력에 중요한 역할을 하기 때문에 시력을 크게 저하시키며 전 세계적으로 예방 가능한 실명의 두 번째로 높은 원인입니다 2,3. 심각한 윤부 기능 장애를 동반한 각막 손상에서는 변연의 장벽 기능이 감소하여 결막 세포가 각막 표면으로 이동하고 각막 결막형성 4,5로 시력이 급격히 저하됩니다. 따라서 각막 실명 및 관련 장애의 전 세계적인 부담을 해결하기 위해 효과적인 예방 및 치료 전략이 필요합니다.
인간의 각막 상처 치유 과정에 대한 현재의 이해는 다양한 부상에 대한 각막 반응을 조사한 이전 연구를 기반으로 합니다. 다양한 화학적 또는 기계적 각막 손상을 유도하고 각막 상처 치유 과정의 다양한 측면을 조사하기 위해 여러 기술과 동물 모델이 사용되었습니다 6,7,8,9.
알칼리 연소 모델은 수산화나트륨(NaOH)을 각막 표면에 직접 도포하거나 평평한 여과지(10)를 사용하여 수행되는 잘 정립된 손상 모델입니다. 알칼리 손상은 전염증성 매개체의 방출과 눈의 각막과 전방뿐만 아니라 망막에도 다형성 핵 세포의 침윤을 초래합니다. 이는 의도하지 않은 망막 신경절 세포 사멸(retinal ganglion cell apoptosis)과 CD45+ 세포 활성화를 유도한다11. 따라서 알칼리 손상 모델을 사용하여 의도하지 않은 과도한 부상을 방지하기 위해 부상 부위의 위치를 정확하게 파악하는 것이 중요합니다.
쥐 안구의 축 길이는 약3mm12이다. 각막과 망막 사이의 거리가 짧기 때문에 가파른 각막 곡률은 망막에 빛을 집중시키는 높은 굴절력을 제공합니다(그림 1A). 앞서13에서 보고한 바와 같이, 평평한 여과지를 사용하여 이 고도로 구부러진 표면에 화학적 손상을 입히는 것은 특히 림버스에서 어렵습니다(그림 1B). 변막에 손상을 입히기 위해서는 여과지를 기울여야 하는데, 이는 결막과 인접한 결막에 의도하지 않은 부상을 입힐 가능성이 있다14. 또 다른 방법은 화학 약품을 각막 표면에 방울로 직접 바르는 것입니다. 그러나 이 방법은 노출 시간에 대한 제어가 부족하고 액체가 이러한 영역으로 확산되어 결막, 위협 및 눈꺼풀에 부상을 유발할 수 있는 잠재적인 위험이 있습니다.
이러한 한계를 극복하기 위해 본 연구는 부상을 유발하는 새로운 펀치-트레핀 방법을 제시합니다. 이 기술은 (i) 마우스 모델에서 전체 각막 표면 및 변연에 효과적인 화학적 손상을 유도하고, (ii) 각막에 국소적이고 잘 둘러싸인 손상을 유도하고, (iii) 미리 결정된 기간 동안 관심있는 액체를 적용할 수 있는 능력, (iv) 적절한 생검 펀치를 선택하여 다양한 크기의 각막 손상을 유도하는 능력을 포함한 몇 가지 이점을 가지고 있습니다. 이 방법은 각막 표면이 구부러져 있고 안구 표면 상처 치유를 연구하는 데 사용되는 일반적인 동물 모델인 쥐 및 토끼 부상 모델에도 가능합니다.
프로토콜
모든 절차는 Stanford laboratory animal care APLAC 번호 33420, 과학적 목적을 위한 동물 사용, 안과 및 시력 연구에서의 동물 사용에 대한 ARVO 선언문에 따라 수행되었습니다. 8-12주 된 총 10마리의 수컷 및 암컷 C57BL/6 마우스가 Irving L. Weissman 실험실에 의해 넉넉하게 제공되었다. 동물들은 12시간의 밝음-어두움 주기에 적응하였고 물과 먹이를 제공받았다. 동물의 한쪽 눈에 부상을 입혔다.
1. 실험 준비
- 재료 준비
알림: 모든 시약은 실온에서 보관해야 합니다.- 펀치 트레핀 준비: 직경 3.5mm의 생검 펀치를 준비하고 펀치의 샤프트를 말단 가장자리에서 5mm 떨어진 곳에 표시합니다. 펀치를 단단히 고정하고 2단 회전 도구를 사용하여 샤프트의 표시된 말단 부분을 자릅니다. 이 과정에서 안구 보호구를 착용하십시오. 샤프트를 3.5mm 깊이로 자르고 마지막 1.5mm는 부착된 상태로 둡니다. 그림 90과 같이 팁을 1° 구부립니다.
- 증류수 50mL에 NaOH 1g을 용해시켜 0.5M NaOH 용액을 제조합니다.
- 100mg/mL 케타민 2mL와 자일라진 1mL 20mL를 혼합하여 마취 칵테일 10mL를 준비합니다. 주입하기 전에 이 혼합물을 7mL의 0.9% NaCl(생리식염수)로 희석합니다.
- 0.1% AK-Fluor 형광 액체 0.1mL를 멸균 인산염 완충 식염수(9.9mL)에 첨가하여 1% 플루오레세인 나트륨 용액을 준비합니다(1x PBS).
- 900mL의 증류수에 8g NaCl, 0.2g KCl, 1.44gNa2HPO4및 0.23g NaH2PO4를 녹여 PBS(1x)를 제조합니다. 용액의 pH를 7.4로 조정합니다. 증류수를 추가하여 용액을 최종 부피 1L로 만듭니다.
- 고정을 위해 4% 파라포름알데히드(PFA) 용액을 준비합니다. 화학 후드 아래에서 PFA 2g을 PBS 45mL에 녹입니다. 혼합물을 65°C로 가열하고 pH를 7.4로 적정합니다. PFA가 용해되면 용액을 최종 부피 50mL로 가져옵니다.
2. 동물 준비
- 마우스의 무게를 측정하여 주사할 수 있는 마취 칵테일의 적절한 양을 결정합니다. Machholz et al.15에 기술된 바와 같이 마우스를 적절하게 취급하고 구속한 후, 0.01mL/g의 용량으로 마취 칵테일을 복강내(IP)로 투여한다16,17. 장기 손상을 방지하기 위해 IP 주입을 위해 하복부 사분면을 표적으로 합니다.
- 각막 알칼리 손상은 매우 고통스러우므로 수술 중 및 수술 후 추가적인 진통을 위해 부프레노르핀 서방형 주사 현탁액(3.25mg/kg)을 피하 주사합니다.
- 깊은 마취가 이루어질 때까지 기다리십시오. 성공적인 심부 마취의 표시로 발가락 꼬집음에 대한 반응 부족을 확인하십시오. 수술을 시작하기 전에 반대쪽 눈이 건조해지는 것을 방지하기 위해 간단한 눈 연고를 바르십시오.
- 마취 후 표준 설치류 수술 원칙18에 따라 준비된 수술 테이블에 마우스를 놓습니다. 설치류의 머리 아래에 5mm 높이의 베개를 놓고 측면 욕창 위치에 놓습니다. 베개는 수술 중 설치류의 머리를 지지하는 데 도움이 됩니다.
- 추가 마취를 위해 테트라카인 염산염(0.5%) 점안액을 투여합니다. 수술용 눈 창으로 안구 표면을 적절하게 말리고 속눈썹을 다듬습니다.
3. 알칼리 손상의 유도
- 수술을 시작하기 전에 표준 설치류 수술 원칙18,19에 따라 수술 테이블을 구성하고 수술 중 수술 필드를 멸균 상태로 유지하십시오. 마취된 마우스를 적절하게 시각화하도록 수술용 현미경을 배치하고 타이머를 30초로 조정합니다. 헹굼 과정에서 의도하지 않은 코 흡인을 방지하기 위해 동물의 주둥이에 꼬인 종이 타월을 놓습니다.
- 엄지와 검지를 사용하여 쥐의 눈꺼풀이 활짝 열려 있는지 확인하면서 수술용 현미경을 사용하여 가장자리 영역 둘레를 결정합니다. 깨끗한 펀치 트레핀을 눈의 축과 평행하게 아래쪽에 압력을 가하지 않고 부드럽게 잡습니다. 악기를 돌리지 말고 펀치-트레핀의 축을 지구본의 축과 평행하게 유지하십시오.
- 수술 보조원에게 NaOH 용액 3방울(40μL에 해당)을 펀치 트레핀의 구멍에 떨어뜨려 도구를 채우고 각막 표면을 적절하게 덮도록 요청합니다. 액체의 표면 장력은 기기 외부로의 누출을 방지합니다(그림 1).
참고: NaOH 용액을 조심스럽게 떨어뜨리기 위해 50° 각도의 평평한 팁이 있는 27G 바늘이 있는 1mm 주사기를 사용했습니다. - 30초 후 즉시 각막과 포르닉스를 5mL의 PBS(1x)로 헹굽니다. 비디오 1 은 화학적 손상을 유발하는 절차를 보여줍니다.
- 범용 pH 지시약 용지를 사용하여 손상된 눈의 각막 표면에 pH가 7 - 7.5가 되도록 합니다. 그런 다음 화학적으로 손상된 안구 표면에 삼중 항생제 안과 연고를 바릅니다.
참고: 수술 중 꼬리의 움직임은 마취 깊이가 낮다는 신호입니다. 마취제[bolus IP(초기 부피의 50%)]를 주입하여 추가 마취 칵테일(케타민+자일라진)을 적용합니다. - 수술 후 마우스의 상태가 안정적인지 확인하십시오. 동물이 고통스러워하는 경우 두 번째 부프레노르핀을 투여하십시오. 2.2에서와 동일한 처리 기술을 사용합니다. 동물이 마취된 상태에서 수술 후 검사를 시작합니다.
- 시술 후 펀치 트레핀과 수술 테이블을 70% 에탄올로 세척, 건조 및 소독합니다.
4. 임상 평가
- 검사를 위해 이전에 2.1단계에서 설명한 대로 마우스를 마취합니다.
- 슬릿 램프 생체 현미경으로 눈(부상 및 비부상)을 검사합니다. 카메라를 사용하여 사진을 캡처합니다(이 연구에서는 시네마틱 모드의 휴대폰 카메라를 사용함).
- Yoeruek 등급 시스템에 따른 각막 불투명도점수 20: 0 = 정상, 투명 각막; 1 = 약한 불투명도; 2 = 불투명도가 높지만 홍채와 동공을 쉽게 구별할 수 있습니다. 3 = 홍채와 동공을 거의 구별할 수 없습니다. 4 = 각막이 완전히 불투명하고 동공이 보이지 않습니다.
- 0.1% 플루오레세인 점안액을 바릅니다. 면 어플리케이터로 과도한 형광 액체를 건조시키고 코발트 블루 필터를 사용하여 각막 상피 결함의 존재 여부를 평가합니다. 사진을 캡처합니다.
- 동물이 흉골 누운 상태를 유지하기에 충분한 의식을 회복할 때까지 모니터링하십시오. 완전히 회복될 때까지 동물을 다른 동물에게 다시 소개하지 마십시오.
5. 적출
- 3-5 s에서 자궁 경부 탈구에 의한 화학적 손상 유도 후 2 주 후에 마우스를 안락사시킨다21.
- 내측 결막과 전체 구개 결막을 보존하면서 눈의 적출을 비디오 2와 같이 다음과 같은 순서로 실시합니다.
- 수술용 현미경으로 caruncle과 피부의 접합부를 조심스럽게 절개합니다. 치아 집게를 사용하여 caruncle을 집어넣고 수술용 가위의 끝을 구개 결막 아래의 족근판과의 접합부 쪽으로 안내합니다.
- 유착선을 따라 외안각을 향해 결막을 자릅니다. 그런 다음 수술용 가위를 결막하 평면에서 결막과 하족골판의 접합부로 돌립니다.
- 결막 박리를 마친 후 엄지와 검지로 코 쪽에서 위 눈꺼풀과 아래 눈꺼풀을 수축시킵니다. 후퇴하면서 돌출된 눈물샘 뒤에 있는 구부러진 팁 핀셋 끝을 시신경 쪽으로 안내합니다. 시신경을 단단히 잡고 구체를 추출합니다(그림 2).
- PBS(1x)로 지구본을 헹구고 고정 용액으로 옮깁니다.
6. 헤마톡실린과 에오신(H&E) 및 주기적 산-쉬프(PAS) 염색
- 실온에서 밤새 10% 포르말린 용액에 글로브를 고정합니다.
- 각각 70-15분 동안 70% 에탄올, 80% 에탄올, 90% 에탄올 및 100% 에탄올의 농도로 등급이 매겨진 일련의 등급이 매겨진 알코올을 사용하여 조직을 탈수합니다. 그런 다음 눈을 크실렌에 10분 동안 담그십시오. 마지막으로 눈을 파라핀으로 감쌉니다.
- 파라핀 블록을 6μm 두께의 조각으로 나누고 보충 파일 1에 설명된 대로 헤마톡실린 및 에오신(H&E) 및 주기적 산-쉬프(PAS) 염색을 위해 유리 현미경 슬라이드에 장착합니다.
7. 면역형광 이미징 및 분석
- 면역조직화학 연구(IHC)의 경우 4% PFA가 함유된 PBS(1x) 1mL에 밤새 4°C에서 눈을 고정합니다. 샘플을 PBS 1mL(1x)에 각각 3분 동안 5회 세척합니다.
- 얼음 결정 형성을 방지하고 단백질의 분자 구조를 보호하기 위해, PBS에서 10% 슈크로스, 20% 슈크로스 및 30% 슈크로스 농도로 연속 슈크로스 포화를 수행한다. 광간섭 단층촬영(OCT; 그림 2), -80°C에서 보관합니다.
- OCT 블록을 12μm 두께의 조각으로 나누고 IHC 염색을 위해 유리 현미경 슬라이드에 장착합니다.
- 15분 동안 PBS(1x)의 0.1% Triton X −100에서 현미경 슬라이드의 조직 절편을 투과시킵니다. 그런 다음 PBS(1x)에서 5% BSA로 비특이적 항원을 실온에서 추가로 1시간 동안 차단합니다.
- 1% BSA를 함유한 PBS(1x)에서 준비한 표적 1차 항체 칵테일에서 4°C의 현미경 슬라이드에서 하룻밤 동안 조직 절편을 배양합니다. 이 실험에서 1차 항체는 각각 2.24μg/mL 및 1.56μg/mL 농도의 1:100 희석된 토끼 항케라틴 13(K13) 및 항케라틴 12(K12) 항체였습니다.
- 배양 후 현미경 슬라이드의 조직 절편을 PBS(1x)로 3번 세척합니다. 그 후, 1:500 희석된 당나귀 항-토끼-IgG로 결합된 1차 항체를 검출합니다. 2차 항체와 함께 어두운 곳에서 4°C에서 1시간 동안 배양합니다. 그런 다음 PBS(1x)에서 각각 5분 동안 3번 세척합니다.
- DAPI가 포함된 페이드 방지 형광 장착 매체를 현미경의 조직 절편에 한 방울 떨어뜨리고 커버슬립으로 덮습니다. 샘플을 어두운 곳에서 건조시키고 정상 눈과 손상된 눈에 대해 동일한 레이저 설정으로 형광 현미경으로 검사합니다.
결과
윤부 줄기 세포 결핍증(LSCD)을 유도하는 방법의 효능은 LSCD의 임상 및 조직학적 징후를 평가하여 평가되었습니다. 임상 평가는 세극등 현미경 및 전방 분절 광학 간섭 단층 촬영(AS-OCT) 이미징으로 수행되었습니다(그림 3 및 그림 4).
재상피화는 구심성 방식으로 발생했으며 비강 부분에 비해 각막의 측두부에서 더 빨랐습니다. 손상된 눈은 화학적 손상 직후 2+-3+ 각막 혼탁이 발생했습니다(그림 3). 상피 세포는 변연 손상 후 결막에서 각막 표면으로 이동했습니다. 큰 각막 상피 결손은 12-14일에 완전히 재상피화되었는데, 이는 일반적으로 손상 후 5일 이내에 치유되는 비슷한 크기와 온전한 기저막 및 기질의 각막 상피 손상에 비해 더 오래 걸렸습니다 8,9. LSCD로 인해 손상된 눈의 50%에서 2주차에 지속적인 상피 결손이 발생했습니다(그림 3). 각막 부종은 처음 며칠 동안 더 두드러진 반면(그림 3, 그림 4), 각막 섬유증은 두 번째 주에 유의하여 손상된 눈의 100%에서 4+ 각막 혼탁을 초래했습니다.
신생혈관화(NV)의 초기 징후는 그림 5와 같이 화학적 손상 유도 후 24시간 후에 임상적 및 조직학적으로 관찰되었으며, 이는 손상22 후 24시간 후에 limbal NV의 징후를 보인 Kvanta et al. 연구에 의해 확인된 NV의 타임라인과 일치합니다. 치유 과정에서 새로운 혈관이 성숙해졌고 부상 후 14일째 되는 날에는 NV가 림버스를 가로질러 중앙 각막에 도달했습니다. 결막과 각막 사이의 경계를 정의하는 변연계가 파괴되었습니다.
윤부 줄기 세포 결핍 및 결막화의 조직학적 증거는 PAS+ 잔 세포와 기질 혈관 23,24,25,26의 출현에 의해 관찰되었다. 잔 세포는 본 손상 모델에서 관찰되었으며 그림 6의 화살표로 표시되었습니다.
결막과 각막 상피는 주로 독특한 케라틴인 K13과 K12를 각각 발현한다27. 윤부 손상 후 결막에서 유래한 새로운 상피 세포가 박힌 각막을 덮었고 손상 후 2주 동안 손상된 동물의 각막 표면에서 K12가 발현되지 않았습니다. 이 소견은 다른 연구들(28)과 일치하며, 완전한 LSCD와 각막 표면에 각막 상피세포가 없음을 나타냈다. 그러나 Park et al.29의 연구에서는 손상 후 20주와 32주에 K12 발현이 감지되어 상피 세포의 trans-differentiation이 가능함을 시사했습니다.
결과적으로, 화학적 손상으로 인해 변연 줄기세포와 변연 줄기세포가 파괴되어 결막 상피세포가 각막 중앙으로 이동하여 박피된 각막 표면을 덮는 것을 관찰했습니다. 이는 결막 상피 세포 마커인 K13에 의해 추가로 검증되었으며, 이는 그림 7과 같이 전체 결막과 각막 표면에서 발현되었습니다.

그림 1: 정상 쥐의 오른쪽 눈과 각막 및 윤부 손상을 유도하기 위한 펀치-트레핀. (A) 각막이 심하게 구부러진 쥐의 눈을 보여주는 측면도(화살촉은 림부를 나타냄). (B) 이미지는 큰 여과지조차도 가장자리 영역을 적절하게 덮기에 충분하지 않다는 것을 보여줍니다. 쥐 눈의 limbus-limbus 직경은 거의 4mm이며, 패널 (C) 및 (E)와 같이 외경 4.5mm, 내경 3.5mm(패널 D 및 H)의 펀치 생검이 각막과 limbal 표면을 적절하게 덮습니다. (F) 펀치-트레핀은 변연 부위 주위의 지구상에 적절하게 고정되어 있습니다. (G) 펀치 트레핀의 가장자리를 통해 누출이 없도록 펀치 트레핀을 글로브와 평행 축에 적절하게 배치 한 후 구멍을 메틸렌 블루로 채웁니다. 메틸렌 블루의 누출이 감지되지 않습니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
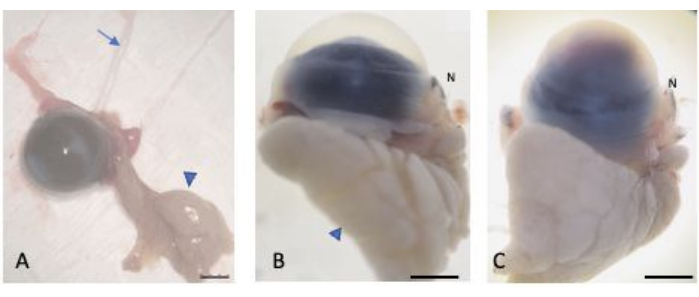
그림 2: 융기된 눈. (A) 눈은 구근과 구개뇌 결막, 눈물샘(화살촉), 시신경(화살표)을 보존하면서 적출되었습니다. 정상(B) 및 부상(C) 눈은 동결결정 형성으로부터 보호하기 위해 30% 자당에 포화되었습니다. 구체의 코 부분은 코 caruncle (N으로 표시됨)을 통해 인식 할 수 있습니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
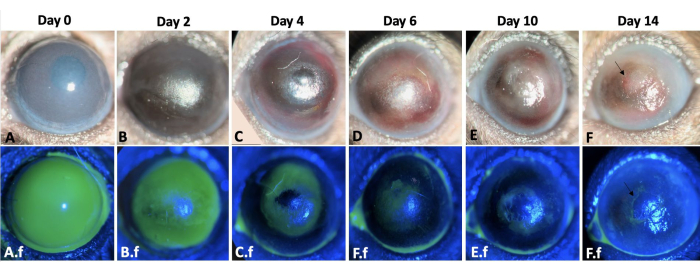
그림 3: 왼쪽 눈의 상처 치유. 마우스 모델에서 각막 및 윤부 알칼리 손상 후 2주 동안 왼쪽 마우스 눈의 상처 치유 과정이 여기에 나와 있습니다(A-F). 눈의 세극등 검사. 각막 부종은 0일과 2일(A,B)에 더 두드러지는 반면, 섬유증은 부상 후 2주(E-F)에 더 뚜렷합니다. A.f-F.f는 같은 눈의 재상피화 과정을 보여줍니다. 부상 유도 직후의 전체 각막 및 변막 상피 결손은 A.f.에서 관찰됩니다. 상피 결손은 12-14일(A.f-F.f)까지 구심성 패턴으로 결막 상피 세포 이동에 의해 치유되었습니다. 그러나 손상된 눈의 50%는 F 및 F.f 이미지에서 화살표로 표시된 것처럼 2주 말에 지속적인 상피 결손이 발생했습니다. 축척 막대 = 1mm(패널 C). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
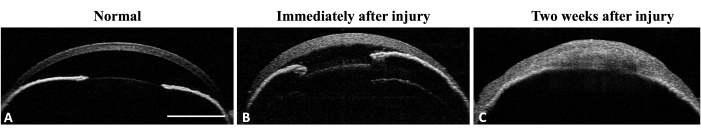
그림 4: 쥐 눈의 전방 분절 OCT. (A) AS-OCT는 정상적인 각막 곡률과 전방을 보여줍니다. 홍채 구조는 잘 정의되어 있고 인식할 수 있습니다. 홍채의 중간 주변부에서는 홍채 각막 유착이 감지되지 않습니다. (B) 손상 직후 부종 형성으로 인해 각막 두께가 증가하고 홍채 중간 주변부에 홍채 각막 유착이 발생합니다. (C) 손상 후 2주가 지나면 각막 만곡이 변하고 전방 파괴를 동반한 홍채 각막 유착이 보입니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
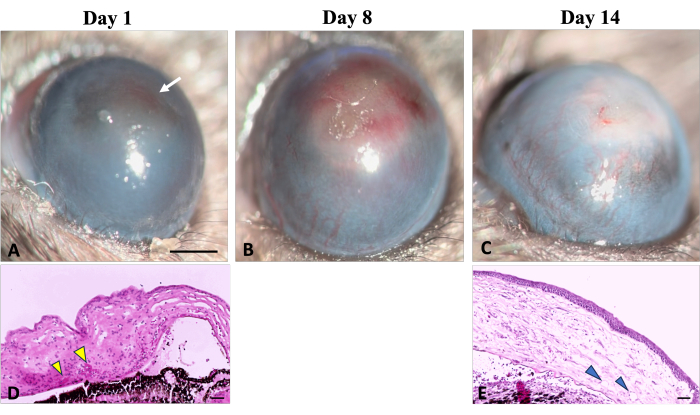
그림 5: 각막 신생혈관 형성. 각막 신생혈관화의 임상 및 조직학적 징후는 수산화나트륨(NaOH) 손상 후 상처 치유 과정에서 관찰할 수 있습니다. (A) 신생혈관 형성의 초기 징후는 부상 후 첫날에 감지할 수 있으며, 각막의 붉은 변색(흰색 화살표로 표시)이 특징입니다. 이 변색은 해당 조직학적 이미지(D)(노란색 화살촉으로 표시)에 설명된 대로 기질의 적혈구 응집으로 인해 발생합니다. (B) 재생 첫 주에 걸쳐 새로운 혈관이 점진적으로 증가하여 각막 전체로 퍼집니다. (C) 2주가 지나면 가장자리 부위가 파괴되고 새로운 혈관이 계속 진화합니다. (E) 각막의 조직학적 부분은 깊은 기질 신생혈관화(화살촉으로 표시)의 존재를 추가로 보여줍니다. 세극등 이미지 스케일 바 = 1mm, 조직학 이미지 스케일 바 = 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
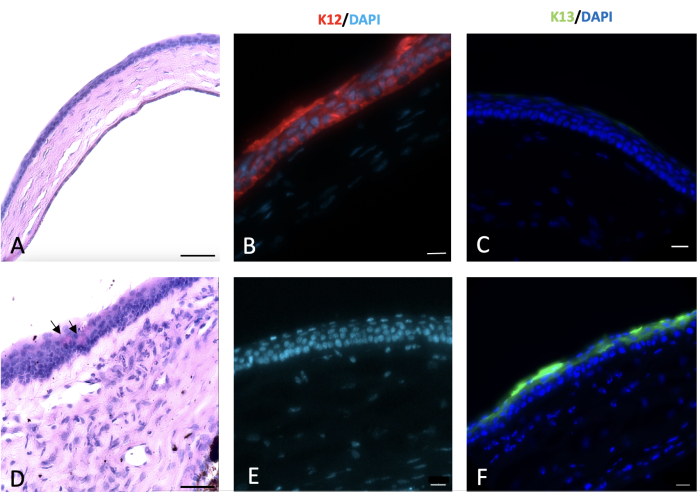
그림 6: 각막의 주기적 acid-Schiff 및 면역조직화학(IHC) 염색. 정상 각막과 손상된 각막의 주기적인 acid-Schiff 및 면역조직화학적 염색은 손상 후 2주 후에 수행되었습니다. 4-5개의 세포층(A)으로 구성된 정상 쥐 각막 상피. 각막과 변두리의 알칼리 손상은 (D)의 검은색 화살표에서 볼 수 있듯이 각막 표면에 잔 세포가 나타나는 각막의 결막화로 이어졌습니다. 정상적인 각막 상피 세포는 손상된 각막(E)을 덮고 있는 결막 세포에서는 발현되지 않는 K12(B)를 발현합니다. 결막 상피세포의 특징적인 표지자인 K13은 정상적인 각막 상피세포(C)에서는 발현되지 않습니다. 그러나 수산화나트륨(NaOH) 손상 각막 표면에 존재하며 이는 각막 결막화(F)의 징후입니다. 조직학 이미지 스케일 바 = 50 μm, IHC 염색 이미지 스케일 바 = 20 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
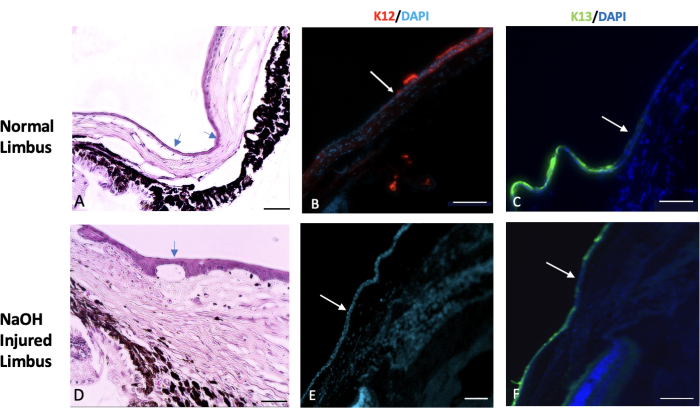
그림 7: 헤마톡실린과 에오신, 면역조직화학적 염색. 헤마톡실린 및 에오신(H&E) 및 정상 및 손상된 림버스 조직의 면역조직화학적 염색을 수행했습니다. (A) 정상 림버스는 공막의 끝과 각막의 시작 사이의 전이 영역을 표시합니다. 이 영역은 일반적으로 한 개 또는 두 개의 결막 상피 세포(화살표로 표시)로 덮여 있습니다. 건강한 눈에서는 K12라고 하는 특정 각막 상피 표지자의 발현이 변두리에서 시작하여 각막 표면까지 확장됩니다(이미지 B 참조). 반면에, K13으로 알려진 결막 표지자의 발현은 림버스로 제한되며 그 이상으로 확장되지 않습니다(이미지 C에서 흰색 화살표로 표시). 수산화나트륨(NaOH)에 의해 손상된 눈에서는 변연계의 경계가 파괴됩니다. 이로 인해 결막 세포가 손상된 각막 쪽으로 이동합니다. (D) NaOH에 손상된 림버스의 이미지는 상피층 아래와 기질 조직 내에서 신생혈관화의 존재를 보여줍니다. 부상 후 손상된 각막 표면에는 K12(E)가 없는 반면 각막 표면(F)에는 K13이 풍부하게 발현됩니다. 조직학 이미지 스케일 바 = 50 μm, IHC 염색 이미지 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 염색 프로토콜. 이 파일을 다운로드하려면 여기를 클릭하십시오.
비디오 1: 펀치 트레핀이 있는 마우스 모델의 NaOH 각막 및 윤부 손상. 이 비디오는 펀치 트레핀을 사용하여 마우스 모델에서 NaOH 각막 및 사지 손상을 유도하는 절차를 보여줍니다. 펀치-트레핀을 지구본과 평행축으로 잡고 림버스에 최소한의 압력을 가하는 것이 중요합니다. 이 적절한 기술은 누출을 방지하고 최적의 결과를 얻는 데 필수적입니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
동영상 2: 구근결막을 보존하면서 적출하는 기법의 그림. 구체의 비강 쪽과 측두를 구별하기 위해 비강 caruncle은 지구본과 함께 보존됩니다. 전체 결막은 접합부에서 족근판까지 절개됩니다. 최소한의 압력으로 궤도 내용물이 바깥쪽으로 돌출됩니다. 집게를 지구의 뒤쪽으로 유도하여 시신경을 잡고 조직을 적출합니다. 적출된 조직에는 구체, 안와 지방 및 안와 눈물샘이 포함됩니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
이 연구는 마우스 모델에서 효과적이고 재현 가능한 각막 및 연부 손상을 성공적으로 유도하는 데 사용할 수 있는 혁신적인 장치인 펀치-트레핀을 제안합니다. 이 윤부 줄기 세포 결핍 모델은 각막 상처 치유 및 손상 후 결막화의 역학을 조사하는 데 이상적입니다.
증거는 쥐 각막의 가장자리 틈새와 중앙 부분 모두 줄기 세포(30)를 포함하고 있음을 시사한다. 따라서, 줄기세포 결핍 모델을 생성하기 위해서는 효율적인 각막 및 변측 손상이 필요하며, 여기에 제시된 손상 모델은 특정 기간 동안 구부러진 각막 림버스를 화학 약품에 노출시킬 수 있습니다. NaOH 손상의 최상의 농도와 지속 시간을 결정하기 위해 다양한 NaOH 농도 및 지속 시간으로 부상을 입혔습니다. NaOH 농도가 높거나 노출 시간이 길면 조직 손상과 섬유화가 증가했습니다. 따라서 연구자들은 연구의 특정 목표와 원하는 부상 정도에 따라 이러한 매개변수를 조정할 수 있습니다.
이 각막 및 변부 손상 모델을 성공적으로 재현하려면 몇 가지 주요 고려 사항을 고려해야 합니다. 먼저, 펀치의 적절한 크기를 결정하기 위해 표적 눈의 limbal-limbal 직경을 측정하는 것이 필수적입니다. 이 직경보다 0.5 - 1 mm 더 큰 외경을 가진 생검 펀치를 선택하는 것이 좋습니다.
사용된 액체의 표면 장력은 그림 1G와 같이 안구 표면과 펀치 트레핀 가장자리 사이의 계면에서 누출을 방지하는 데 중요한 요소입니다. 따라서 펀치 생검의 끝부분에 압력을 가할 필요가 없습니다.
조직에 기계적 손상을 입히지 않으려면 펀치 트레핀을 눈과 평행한 축으로 잡고 림버스에 압력을 가하지 않는 것이 중요합니다. 펀치 트레핀 축을 부적절하게 조정하면 누출 위험이 증가하고 부상 부위가 손상되고 부정확한 결과가 발생할 수 있습니다.
이 기술의 몇 가지 잠재적인 한계에는 적절한 펀치 크기를 선택해야 하는 필요성, 펀치 트레핀을 잡는 숙련도 및 기계적 부상을 유발할 수 있는 잠재적 위험이 포함됩니다. 그러나 이러한 한계는 연습을 통해 그리고 이 프로토콜에 설명된 지침을 따라 극복할 수 있습니다. 마우스의 균주와 연령 범위는 재상피화 과정에 영향을 미치는 다른 요인이며 연구에서 고려해야 합니다.
더욱이, 제안된 프로토콜은 구근 및 구개뇌 결막을 보존하고 외과적 봉합사를 마커로 적용하지 않고도 구체의 코 부분을 결정할 수 있는 적출 방법을 자세히 설명하기 때문에 유리합니다. 이전 연구에 따르면 눈의 코 영역은 각막의 다른 영역에 비해 신경 신경 분포가 가장 낮기 때문에 신생혈관 형성에 더 취약하고 재생 효능이 감소합니다31,32.
요약하면, 각막 혼탁(CO), 지속적인 상피 결손 및 각막 신생혈관화(NV)와 같은 LSCD의 임상 징후와 함께 잔 세포 화생, 각막 표면의 K13 발현, 각막 표면의 K12 부재를 포함한 관찰된 조직학적 변화는 이 모델에서 LSCD의 존재를 확인합니다. 이러한 발견은 이 새로운 기술이 LSCD를 유도하는 데 효과적이라는 증거를 제공합니다. 이 화학적 손상 모델은 각막 손상 및 재생 분야에서 새로운 약물 및 약물 치료를 조사하기 위한 전임상 연구에 사용할 수 있습니다.
공개
저자 중 누구도 이 연구에 설명된 회사나 제품에 대한 재정적 이해관계가 없습니다. 저자는 다른 이해 상충이 없음을 선언합니다.
감사의 말
우리는 NEI P30-EY026877가 이 연구를 지원한다는 것을 인정합니다. 우리는 실험 동물을 제공하는 데 도움을 준 스탠포드 대학의 줄기 세포 생물학 및 재생 의학 연구소의 Charlene Wang과 Irv Weissman Lab 박사에게 깊은 감사를 드립니다. 이미지 준비 및 편집에 도움을 주신 Hirad Rezaeipoor의 도움에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
참고문헌
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유