Method Article
Induktion von Hornhaut- und Limbusalkaliverletzungen mit einer Stanz-Trephin-Technik in einem Mausmodell
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode zur Induktion einer genauen und reproduzierbaren Hornhaut- und Limbusalkaliverletzung in einem Mausmodell. Das Protokoll ist vorteilhaft, da es eine gleichmäßig verteilte Verletzung der stark gekrümmten Hornhaut und des Limbus der Maus ermöglicht.
Zusammenfassung
Die Hornhaut ist entscheidend für das Sehvermögen, und die Heilung der Hornhaut nach einem Trauma ist von grundlegender Bedeutung, um ihre Transparenz und Funktion zu erhalten. Durch die Untersuchung von Hornhautverletzungsmodellen wollen die Forscher ihr Verständnis dafür verbessern, wie die Hornhaut heilt, und Strategien zur Vorbeugung und Behandlung von Hornhauttrübungen entwickeln. Chemische Verletzungen sind eines der beliebtesten Verletzungsmodelle, das ausgiebig an Mäusen untersucht wurde. Die meisten früheren Forscher haben ein flaches, in Natriumhydroxid getränktes Papier verwendet, um eine Hornhautverletzung herbeizuführen. Die Induktion von Hornhaut- und Limbusverletzungen mit flachem Filterpapier ist jedoch unzuverlässig, da die Hornhaut der Maus stark gekrümmt ist. Hier stellen wir ein neues Instrument, eine modifizierte Biopsiestanze, vor, die es den Forschern ermöglicht, eine gut umschriebene, lokalisierte und gleichmäßig verteilte Alkaliverletzung der Hornhaut und des Limbus der Maus zu erzeugen. Diese Stanz-Trepan-Methode ermöglicht es den Forschern, eine genaue und reproduzierbare chemische Verbrennung der gesamten Hornhaut und des Limbus der Maus herbeizuführen, während andere Strukturen, wie z. B. die Augenlider, von der Chemikalie unberührt bleiben. Darüber hinaus wird in dieser Studie eine Enukleationstechnik vorgestellt, die den medialen Karunkel als Orientierungspunkt für die Identifizierung der nasalen Seite des Globus bewahrt. Auch die bulbäre und palpebrale Bindehaut sowie die Tränendrüse werden mit dieser Technik intakt gehalten. Die ophthalmologischen Untersuchungen wurden mittels Spaltlampenbiomikroskop und Fluoresceinfärbung an den Tagen 0, 1, 2, 6, 8 und 14 nach der Verletzung durchgeführt. Klinische, histologische und immunhistochemische Befunde bestätigten bei allen Versuchsmäusen einen limbalen Stammzellmangel und ein Versagen der Regeneration der Augenoberfläche. Das vorgestellte alkalische Hornhautverletzungsmodell ist ideal für die Untersuchung von limbalem Stammzellmangel, Hornhautentzündung und Fibrose. Diese Methode eignet sich auch zur Untersuchung der präklinischen und klinischen Wirksamkeit topischer ophthalmologischer Medikamente auf der murinen Hornhautoberfläche.
Einleitung
Die Hornhaut ist entscheidend für das Sehvermögen und weist einzigartige Eigenschaften auf, einschließlich der Transparenz, die eine Voraussetzung für klares Sehen ist. Die Hornhaut erfüllt nicht nur eine wichtige Schutzfunktion, sondern macht auch 2/3 der Brechkraft des Auges aus1. Aufgrund ihrer bedeutenden Rolle für das Sehvermögen verursachen Hornhautverletzungen und -trübungen eine signifikante Verschlechterung des Sehvermögens und sind weltweit für die zweithäufigste Ursache für vermeidbare Erblindung verantwortlich 2,3. Bei Hornhautverletzungen mit schwerer Limbusdysfunktion nimmt die Barrierefunktion des Limbus ab, was zu einer Migration von Bindehautzellen in Richtung Hornhautoberfläche und einer Hornhautkonjunktivalisierung führt 4,5, was das Sehvermögen dramatisch beeinträchtigt. Wirksame präventive und therapeutische Strategien sind daher erforderlich, um der globalen Belastung durch Hornhautblindheit und damit verbundene Behinderungen zu begegnen.
Das derzeitige Verständnis des Wundheilungsprozesses der menschlichen Hornhaut basiert auf früheren Studien, die die Reaktionen der Hornhaut auf verschiedene Verletzungen untersucht haben. Verschiedene Techniken und Tiermodelle wurden eingesetzt, um verschiedene chemische oder mechanische Hornhautverletzungen zu induzieren 6,7,8,9 und verschiedene Aspekte des Hornhautwundheilungsprozesses zu untersuchen.
Das Alkaliverbrennungsmodell ist ein etabliertes Verletzungsmodell, das durch direktes Auftragen von Natriumhydroxid (NaOH) auf die Hornhautoberfläche oder durch Verwendung von flachem Filterpapier10 durchgeführt wird. Eine Alkaliverletzung führt zur Freisetzung von entzündungsfördernden Mediatoren und zur Infiltration von polymorphkernigen Zellen nicht nur in die Hornhaut und die vordere Augenkammer, sondern auch in die Netzhaut. Dies induziert eine unbeabsichtigte Apoptose der retinalen Ganglienzellen und eine CD45+ -Zellaktivierung11. Daher ist es wichtig, die Verletzungsstelle genau zu lokalisieren, um übermäßige unbeabsichtigte Verletzungen mit einem alkalischen Verletzungsmodell zu vermeiden.
Die axiale Länge des murinen Augapfels beträgt ca. 3 mm12. Aufgrund dieses kurzen Abstands zwischen der Hornhaut und der Netzhaut besteht eine steile Hornhautkrümmung, die eine hohe Brechkraft bietet, um das Licht auf die Netzhaut zu fokussieren (Abbildung 1A). Wie wir bereits berichtethaben 13, ist es schwierig, diese stark gekrümmte Oberfläche mit einem flachen Filterpapier chemisch zu verletzen, insbesondere im Limbus (Abbildung 1B). Um eine Verletzung des Limbus herbeizuführen, muss das Filterpapier gekippt werden, was zu einer unbeabsichtigten Verletzung des Fornix und der angrenzenden Bindehautführen kann 14. Ein anderer Ansatz besteht darin, den chemischen Wirkstoff direkt als Tropfen auf die Hornhautoberfläche aufzutragen. Bei dieser Methode fehlt jedoch die Kontrolle über die Expositionszeit, und es besteht die potenzielle Gefahr, dass die Bindehaut, der Fornix und die Augenlider durch die Diffusion der Flüssigkeit in diese Bereiche verletzt werden.
Um diese Einschränkungen zu überwinden, wird in dieser Studie eine neuartige Stanz-Trepan-Methode zur Induktion von Verletzungen vorgestellt. Diese Technik hat mehrere Vorteile, einschließlich (i) der Induktion einer effektiven chemischen Verletzung der gesamten Hornhautoberfläche und des Limbus im Mausmodell, (ii) der Induktion einer lokalisierten und gut umschriebenen Verletzung der Hornhaut, (iii) der Fähigkeit, jede Flüssigkeit von Interesse für eine vorbestimmte Dauer aufzutragen, und (iv) der Fähigkeit, Hornhautverletzungen unterschiedlicher Größe durch Auswahl geeigneter Biopsiestanzen zu induzieren. Diese Methode ist auch für Verletzungsmodelle von Ratten und Kaninchen geeignet, die ebenfalls eine gekrümmte Hornhautoberfläche aufweisen und gängige Tiermodelle sind, die zur Untersuchung der Wundheilung auf der Augenoberfläche verwendet werden.
Protokoll
Alle Verfahren wurden in Übereinstimmung mit der Stanford Laboratory Animal Care APLAC-Nummer 33420, der Verwendung von Tieren für wissenschaftliche Zwecke und der ARVO-Erklärung für die Verwendung von Tieren in der Augen- und Sehforschung durchgeführt. Insgesamt 10 männliche und weibliche C57BL/6-Mäuse im Alter von 8-12 Wochen wurden großzügig vom Irving L. Weissman-Labor zur Verfügung gestellt. Die Tiere wurden an einen 12-stündigen Hell-Dunkel-Zyklus gewöhnt und ad libitum mit Wasser und Futter versorgt. Ein Auge des Tieres wurde verletzt.
1. Vorbereitung auf das Experiment
- Vorbereitung von Materialien
HINWEIS: Alle Reagenzien müssen bei Raumtemperatur aufbewahrt werden.- Bereiten Sie die Stanz-Trepan vor: Bereiten Sie eine Biopsie-Stanze mit einem Durchmesser von 3,5 mm vor und markieren Sie den Schaft der Stanze 5 mm von der distalen Kante entfernt. Befestigen Sie den Stempel fest und schneiden Sie den markierten distalen Teil des Schaftes mit einem zweistufigen Drehwerkzeug ab. Tragen Sie während dieses Vorgangs einen Augenschutz. Schneiden Sie den Schaft in einer Tiefe von 3,5 mm ab und lassen Sie die letzten 1,5 mm dran. Biegen Sie die Spitze um 90°, wie in Abbildung 1 gezeigt.
- Bereiten Sie 0,5 M NaOH-Lösung vor, indem Sie 1 g NaOH in 50 ml destilliertem Wasser auflösen.
- Bereiten Sie 10 ml Anästhesiecocktail zu, indem Sie 2 ml 100 mg/ml Ketamin und 1 ml 20 mg/ml Xylazin kombinieren. Vor der Injektion wird diese Mischung mit 7 ml 0,9 % NaCl (normale Kochsalzlösung) verdünnt.
- Bereiten Sie 0,1%ige Fluorescein-Natriumlösung vor, indem Sie 0,1 ml 10%ige AK-Fluor-Fluoreszenzflüssigkeit in 9,9 ml sterile phosphatgepufferte Kochsalzlösung (1x PBS) geben.
- Bereiten Sie PBS (1x) vor, indem Sie 8 g NaCl, 0,2 g KCl, 1,44 gNa2HPO4 und 0,23 gNaH2 PO4in 900 ml destilliertem Wasser auflösen. Stellen Sie den pH-Wert der Lösung auf 7,4 ein. Die Lösung wird durch Zugabe von destilliertem Wasser auf ein Endvolumen von 1 l gebracht.
- Bereiten Sie eine 4%ige Paraformaldehyd-Lösung (PFA) für die Fixierung vor. Unter einer chemischen Haube 2 g PFA in 45 ml PBS auflösen. Die Mischung wird auf 65 °C erhitzt und der pH-Wert auf 7,4 titriert. Sobald sich das PFA aufgelöst hat, wird die Lösung auf ein Endvolumen von 50 ml gebracht.
2. Zubereitung von Tieren
- Wiegen Sie die Maus, um das geeignete Volumen des injizierbaren Anästhesiecocktails für die Injektion zu bestimmen. Nach ordnungsgemäßer Behandlung und Fixierung der Maus, wie in Machholz et al.15 beschrieben, wird der Anästhesiecocktail intraperitoneal (IP) in einer Dosis von 0,01 ml/gverabreicht 16,17. Konzentrieren Sie sich auf die unteren abdominalen Quadranten für die IP-Injektion, um Organschäden zu vermeiden.
- Injizieren Sie die injizierbare Buprenorphin-Suspension mit verlängerter Freisetzung (3,25 mg/kg) subkutan für eine zusätzliche Analgesie während und nach der Operation, da eine Hornhautalkaliverletzung äußerst schmerzhaft ist.
- Warten Sie, bis eine tiefe Anästhesie erreicht ist. Prüfen Sie, ob eine mangelnde Reaktion auf das Einklemmen der Zehen ein Hinweis auf eine erfolgreiche Tiefenanästhesie ist. Tragen Sie vor Beginn der Operation eine einfache Augensalbe für das kontralaterale Auge auf, um es vor dem Austrocknen zu schützen.
- Legen Sie die Maus nach der Anästhesie auf den Operationstisch, der nach den Standardprinzipien der Nagetierchirurgie18 vorbereitet wurde. Legen Sie ein 5 mm hohes Kissen unter den Kopf des Nagetiers, das sich in der seitlichen Dekubitusposition befindet. Das Kissen hilft, den Kopf des Nagetieres während der Operation zu stützen.
- Verabreichen Sie Tetracainhydrochlorid (0,5%) Augentropfen zur weiteren Anästhesie. Trocknen Sie die Augenoberfläche mit einem chirurgischen Augenspeer richtig ab und schneiden Sie die Wimpern ab.
3. Induktion von Alkalischäden
- Organisieren Sie vor Beginn der Operation den Operationstisch gemäß den Standardprinzipien der Nagetierchirurgie18,19 und halten Sie das Operationsfeld während der Operation steril. Positionieren Sie das Operationsmikroskop, um die anästhesierte Maus richtig zu visualisieren, und stellen Sie den Timer auf 30 s ein. Legen Sie ein gedrehtes Papiertuch auf die Schnauze des Tieres, um eine unbeabsichtigte Nasenaspiration während des Spülvorgangs zu verhindern.
- Bestimmen Sie den Limbusumfang mit dem Operationsmikroskop und achten Sie darauf, dass die Augenlider der Maus mit Daumen und Zeigefinger weit geöffnet sind. Halten Sie das saubere Punch-Trephin vorsichtig parallel zur Augenachse, ohne Druck nach unten auszuüben. Vermeiden Sie es, das Instrument zu drehen, und halten Sie die Achse des Punch-Trepans parallel zur Achse des Globus.
- Bitten Sie die chirurgische Assistentin, 3 Tropfen NaOH-Lösung (entspricht 40 μl) in das Loch des Stanz-Trepans zu geben, um das Werkzeug zu füllen und die Hornhautoberfläche entsprechend zu bedecken. Die Oberflächenspannung der Flüssigkeit verhindert ein Austreten aus dem Gerät (Abbildung 1).
HINWEIS: Wir haben eine 1-mm-Spritze mit einer 27G-Nadel mit einer abgeflachten, um 50° abgewinkelten Spitze zu verwenden, um die NaOH-Lösung vorsichtig tropfen zu lassen. - Nach 30 s sofort Hornhaut und Fornix mit 5 ml PBS (1x) spülen. Video 1 zeigt das Verfahren zur Induktion einer chemischen Verletzung.
- Verwenden Sie ein universelles pH-Indikatorpapier, um einen pH-Wert von 7 - 7,5 auf der Hornhautoberfläche des verletzten Auges sicherzustellen. Tragen Sie dann die dreifach antibiotische Augensalbe auf die chemisch verletzte Augenoberfläche auf.
HINWEIS: Schwanzbewegungen während der Operation sind ein Zeichen für eine geringe Anästhesietiefe. Tragen Sie einen zusätzlichen Anästhesiecocktail (Ketamin + Xylazin) auf, indem Sie ein Anästhetikum injizieren [Bolus IP (50% des Ausgangsvolumens)]. - Vergewissern Sie sich nach der Operation, dass sich die Maus in einem stabilen Zustand befindet. Verabreichen Sie ein zweites Buprenorphin, wenn das Tier Schmerzen hat. Verwenden Sie die gleiche Handhabungstechnik wie in 2.2. Beginnen Sie mit der postoperativen Untersuchung, während sich das Tier in Narkose befindet.
- Nach dem Eingriff waschen, trocknen und desinfizieren Sie das Punch-Trephin und den OP-Tisch mit 70%igem Ethanol.
4. Klinische Bewertung
- Zur Untersuchung wird die Maus wie zuvor in Schritt 2.1 beschrieben betäubt.
- Untersuchen Sie die Augen (verletzte und unverletzte) unter einem Spaltlampen-Biomikroskop. Verwenden Sie eine Kamera, um Fotos aufzunehmen (in dieser Studie wurde eine Telefonkamera im Kinomodus verwendet).
- Bewerten Sie die Hornhauttrübung nach dem Yoeruek-Bewertungssystem20: 0 = normale, klare Hornhaut; 1 = leichte Deckkraft; 2 = größere Opazität, aber Iris und Pupille sind leicht zu unterscheiden; 3 = Iris und Pupille sind kaum zu unterscheiden; 4 = Die Hornhaut ist völlig undurchsichtig mit einer unsichtbaren Pupille.
- Tragen Sie 0,1%ige Fluorescein-Augentropfen auf. Trocknen Sie überschüssige fluoreszierende Flüssigkeit mit einem Baumwollapplikator ab und untersuchen Sie das Vorhandensein von Hornhautepitheldefekten mit dem Kobaltblaufilter. Nehmen Sie Fotos auf.
- Überwachen Sie das Tier, bis es wieder zu Bewusstsein kommt, um das Brustbein zu halten. Setzen Sie das Tier erst wieder mit anderen Tieren aus, wenn es sich vollständig erholt hat.
5. Enukleation
- Euthanasie der Mäuse 2 Wochen nach der Induktion einer chemischen Verletzung durch Luxation des Gebärmutterhalses in 3-5 s21.
- Enukleation des Auges unter Erhalt des medialen Karunkels und der gesamten Lidbindehaut in der folgenden Reihenfolge, wie in Video 2 gezeigt.
- Unter dem Operationsmikroskop die Verbindung von Karunkel und Haut vorsichtig sezieren. Ziehen Sie den Karunkel mit einer Zahnzange zurück und führen Sie die Spitze der chirurgischen Schere unter der Lidbindehaut in Richtung der Verbindung mit der Fußwurzelplatte.
- Schneiden Sie die Bindehaut entlang der Adhäsionslinie in Richtung des lateralen Kanthus. Drehen Sie dann die chirurgische Schere auf die Verbindung von Bindehaut und unterer Tarsalplatte in der subkonjunktivalen Ebene.
- Nach Abschluss der Bindehautdissektion ziehen Sie die oberen und unteren Augenlider mit Daumen und Zeigefinger von der Nasenseite zurück. Führen Sie beim Zurückziehen die Spitze einer Pinzette mit gebogener Spitze hinter die vorgeschobene Tränenflüssigkeit in Richtung Sehnerv. Fassen Sie den Sehnerv fest und ziehen Sie die Kugel heraus (Abbildung 2).
- Spülen Sie den Globus mit PBS (1x) ab und geben Sie ihn in die Fixierlösung.
6. Hämatoxylin- und Eosinfärbung (H&E) und Periodsäure-Schiff (PAS)
- Fixieren Sie die Kugeln in 10%iger Formalinlösung über Nacht bei Raumtemperatur.
- Dehydrieren Sie das Gewebe mit einer aufeinanderfolgenden Reihe von abgestuftem Alkohol mit Konzentrationen von 70 % Ethanol, 80 % Ethanol, 90 % Ethanol und 100 % Ethanol jeweils 10-15 Minuten lang. Anschließend die Augen 10 Minuten lang in Xylol eintauchen. Zum Schluss die Augen mit Paraffin umhüllen.
- Schneiden Sie die Paraffinblöcke in 6 μm dicke Scheiben und montieren Sie sie auf Objektträger aus Glas für die Hämatoxylin- und Eosin- (H&E) und Periodsäure-Schiff (PAS)-Färbung, wie in Ergänzungsdatei 1 beschrieben.
7. Immunfluoreszenz-Bildgebung und -Analyse
- Für immunhistochemische Untersuchungen (IHC) fixieren Sie die Augen über Nacht in 1 ml PBS (1x) mit 4 % PFA bei 4 °C. Waschen Sie die Probe 3x in 1 ml PBS (1x) für jeweils 5 Minuten.
- Um die Bildung von Eiskristallen zu verhindern und die molekularen Strukturen der Proteine zu schützen, führen Sie eine serielle Saccharosesättigung mit 10 % Saccharose, 20 % Saccharose und 30 % Saccharose in PBS durch. Einbetten der Globen in optische Kohärenztomographie-Lösung (OCT; Abbildung 2) und lagern Sie sie bei -80 °C.
- Schneiden Sie den OCT-Block in 12 μm dicke Scheiben und montieren Sie ihn auf Objektträger mit Glas, um die IHC-Färbung zu färben.
- Permeabilisierung von Gewebeschnitten auf Objektträgern in 0,1 % Triton X −100 in PBS (1x) für 15 Minuten. Blockieren Sie dann unspezifische Antigene mit 5% BSA in PBS (1x) für weitere 1 h bei Raumtemperatur.
- Gewebeschnitte auf Objektträgern werden über Nacht bei 4 °C im Cocktail der in PBS (1x) hergestellten Primärantikörper mit 1 % BSA inkubiert. In diesem Experiment waren die primären Antikörper 1:100 verdünnte Kaninchen-Anti-Keratin-13 (K13) und Anti-Keratin-12-Antikörper (K12) mit einer Konzentration von 2,24 μg/ml bzw. 1,56 μg/ml.
- Nach der Inkubation waschen Sie die Gewebeschnitte auf Objektträgern 3x mit PBS (1x). Anschließend werden gebundene Primärantikörper mit 1:500 verdünntem Esel-Anti-Kaninchen-IgG nachgewiesen. Mit dem Sekundärantikörper bei 4 °C für 1 h im Dunkeln inkubieren. Anschließend in PBS (1x) 3x für jeweils 5 min waschen.
- Tragen Sie einen Tropfen des DAPI-haltigen Anti-Fade-Fluoreszenz-Eindeckmediums auf die Gewebeschnitte des Mikroskops auf und decken Sie es mit einem Deckglas ab. Lassen Sie die Proben im Dunkeln trocknen und untersuchen Sie sie unter einem Fluoreszenzmikroskop mit der gleichen Lasereinstellung für normale und verletzte Augen.
Ergebnisse
Die Wirksamkeit der Methode bei der Induktion eines limbalen Stammzellmangels (LSCD) wurde durch die Bewertung der klinischen und histologischen Symptome der LSCD bewertet. Die klinische Beurteilung erfolgte mittels Spaltlampenmikroskopie und optischer Kohärenztomographie (AS-OCT) (Abbildung 3 und Abbildung 4).
Die Reepithelisierung erfolgte zentripetal und war im temporalen Teil der Hornhaut schneller als im nasalen Teil. Verletzte Augen entwickelten unmittelbar nach der chemischen Verletzung einen 2+-3+ Hornhauttrübung (Abbildung 3). Epithelzellen wanderten nach einer Limbusverletzung von der Bindehaut auf die Hornhautoberfläche. Der große Hornhautepitheldefekt wurde an den Tagen 12-14 vollständig reepithelialisiert, was im Vergleich zu einer Hornhautepithelverletzung ähnlicher Größe und intakter Basalmembran und Stroma, die typischerweise innerhalb von 5 Tagen nach der Verletzung heilte, länger dauerte 8,9. Aufgrund der LSCD entwickelten 50 % der verletzten Augen am Ende der zweiten Woche persistierende Epitheldefekte (Abbildung 3). Das Hornhautödem war in den ersten Tagen stärker ausgeprägt (Abbildung 3, Abbildung 4), während die Hornhautfibrose in der zweiten Woche signifikant war, was zu einer Hornhauttrübung von 4+ bei 100% der verletzten Augen führte.
Frühe Anzeichen einer Neovaskularisation (NV) wurden klinisch und histologisch 24 Stunden nach der Induktion einer chemischen Verletzung beobachtet, wie in Abbildung 5 dargestellt, was mit der von der Studie von Kvanta et al. identifizierten Zeitachse der NV übereinstimmt, die 24 Stunden nach der Verletzung Anzeichen einer limbalen NV zeigte22. Während des Heilungsprozesses reiften neue Gefäße heran und am 14. Tag nach der Verletzung überquerte NV den Limbus und erreichte die zentrale Hornhaut. Der Limbus, der die Grenze zwischen Bindehaut und Hornhaut definiert, wurde zerstört.
Histologische Hinweise auf einen limbalen Stammzellmangel und eine Konjunktivalisierung wurden durch das Auftreten von PAS+-Becherzellen und stromalen Blutgefäßen beobachtet 23,24,25,26. Becherzellen wurden im vorliegenden Verletzungsmodell beobachtet und durch den Pfeil in Abbildung 6 angedeutet.
Bindehaut- und Hornhautepithelien exprimieren hauptsächlich einzigartige Keratine, K13 bzw. K1227. Nach der limbalen Verletzung bedeckten neue Epithelzellen, die aus der Bindehaut stammten, die entblößte Hornhaut, und K12 wurde 2 Wochen nach der Verletzung nicht auf der Hornhautoberfläche der verletzten Tiere exprimiert. Dieser Befund, der mit anderen Studienübereinstimmte 28, deutete auf eine vollständige LSCD und das Fehlen von Hornhautepithelzellen auf der Hornhautoberfläche hin. In der Studie von Park et al.29 wiesen sie jedoch 20 und 32 Wochen nach der Verletzung eine K12-Expression nach, was auf eine mögliche Transdifferenzierung der Epithelzellen hindeutet.
Folglich beobachteten wir, dass chemische Verletzungen den Limbus und die limbalen Stammzellen zerstörten, was zur Migration von Bindehautepithelzellen in das Zentrum der Hornhaut führte, um die entblößte Hornhautoberfläche zu bedecken. Dies wird durch den konjunktivalen Epithelzellmarker K13 bestätigt, der in der gesamten Bindehaut- und Hornhautoberfläche exprimiert wurde, wie in Abbildung 7 dargestellt.

Abbildung 1: Rechtes Auge der normalen Maus und das Punch-Trephin zur Induktion von Hornhaut- und Limbusverletzungen. (A) Seitenansicht mit stark gekrümmter Hornhaut (Pfeilspitzen zeigen den Limbus). (B) Das Bild zeigt, dass selbst ein großes Filterpapier nicht ausreicht, um den Limbusbereich ausreichend abzudecken. Der Limbus-zu-Limbus-Durchmesser des Mausauges beträgt fast 4 mm und eine Stanzbiopsie mit einem Außendurchmesser von 4,5 mm und einem Innendurchmesser von 3,5 mm ( Tafeln D und H) deckt die Hornhaut und die Limbusoberfläche angemessen ab, wie in den Tafeln (C) und (E) gezeigt. (F) Das Stanz-Trepan wird in geeigneter Weise über den Globus um den Limbusbereich gehalten. (G) Um sicherzustellen, dass keine Leckage durch den Rand des Stanz-Trepans entsteht, wird das Loch nach entsprechender Positionierung des Stanz-Trepans in einer parallelen Achse mit der Kugel mit Methylenblau gefüllt. Es wird kein Austritt von Methylenblau festgestellt. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
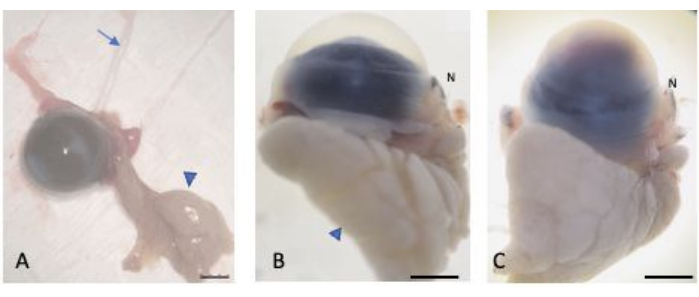
Abbildung 2: Enukleierte Augen. (A) Die Augen wurden enukleiert, wobei die bulbäre und palpebrale Bindehaut, die Tränendrüse (Pfeilspitze) und der Sehnerv (Pfeil) erhalten blieben. Die normalen (B) und verletzten (C) Augen wurden mit 30% Saccharose gesättigt, um vor Kryokristallbildung zu schützen. Der nasale Teil der Kugel ist am Nasenkarunkel (mit N bezeichnet) zu erkennen. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
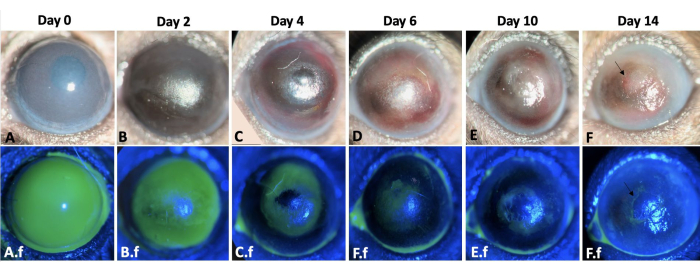
Abbildung 3: Wundheilung des linken Auges. Der Wundheilungsprozess des linken Mausauges während 2 Wochen nach Hornhaut- und Limbusalkaliverletzung in einem Mausmodell ist hier dargestellt (A-F). Die Spaltlampenuntersuchung des Auges. Das Hornhautödem ist an den Tagen 0 und 2 stärker ausgeprägt (A,B), während die Fibrose in der zweiten Woche nach der Verletzung (E-F) deutlicher ist. A.F-F.F zeigen den Re-Epithelisierungsprozess desselben Auges. Ein totaler Hornhaut- und Limbusepitheldefekt unmittelbar nach der Verletzungsinduktion wird bei A.f. Der Epitheldefekt heilte durch Bindehautepithelzellwanderung in einem zentripetalen Muster nach 12-14 Tagen (A.f-F.f). Allerdings entwickelten 50% der verletzten Augen am Ende der zweiten Woche einen persistierenden Epitheldefekt, wie der Pfeil in den F- und F.f-Bildern zeigt. Maßstabsleiste = 1 mm (Tafel C). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
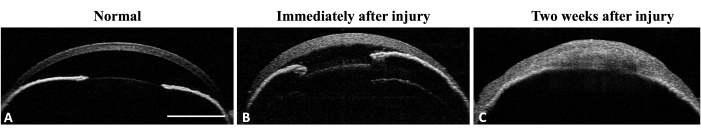
Abbildung 4: OCT des vorderen Augenabschnitts des Mausauges. (A) Die AS-OCT zeigt die normale Hornhautkrümmung und die vordere Kammer. Die Irisstruktur ist gut definiert und erkennbar. An der mittleren Peripherie der Iris ist keine iridokorneale Adhäsion nachweisbar. (B) Unmittelbar nach der Verletzung nimmt die Hornhautdicke aufgrund der Ödembildung zu und es entwickelt sich eine Iridokornealadhäsion an der mittleren Peripherie der Iris. (C) Zwei Wochen nach der Verletzung hat sich die Hornhautkrümmung verändert und eine totale iridokorneale Adhäsion mit Zerstörung der Vorderkammer ist sichtbar. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
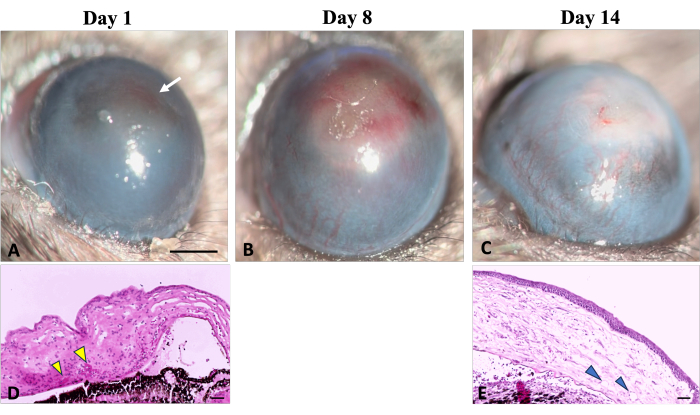
Abbildung 5: Hornhautneovaskularisation. Klinische und histologische Anzeichen einer Hornhautneovaskularisation können während des Wundheilungsprozesses nach einer Natriumhydroxid (NaOH)-Verletzung beobachtet werden. (A) Die ersten Anzeichen einer Neovaskularisation werden am ersten Tag nach der Verletzung nachweisbar und sind durch eine rötliche Verfärbung der Hornhaut gekennzeichnet (gekennzeichnet durch einen weißen Pfeil). Diese Verfärbung resultiert aus der Aggregation roter Blutkörperchen im Stroma, wie in der entsprechenden histologischen Aufnahme (D) dargestellt (gekennzeichnet durch gelbe Pfeilspitzen). (B) In der ersten Woche der Regeneration vermehren sich die neuen Gefäße allmählich und breiten sich über die gesamte Hornhaut aus. (C) Nach 2 Wochen ist der Limbusbereich zerstört und die neuen Gefäße entwickeln sich weiter. (E) Der histologische Schnitt der Hornhaut verdeutlicht das Vorhandensein einer tiefen stromalen Neovaskularisation (dargestellt durch Pfeilspitzen). Spaltlampe Bildmaßstab = 1 mm, Histologie-Bildmaßstab = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
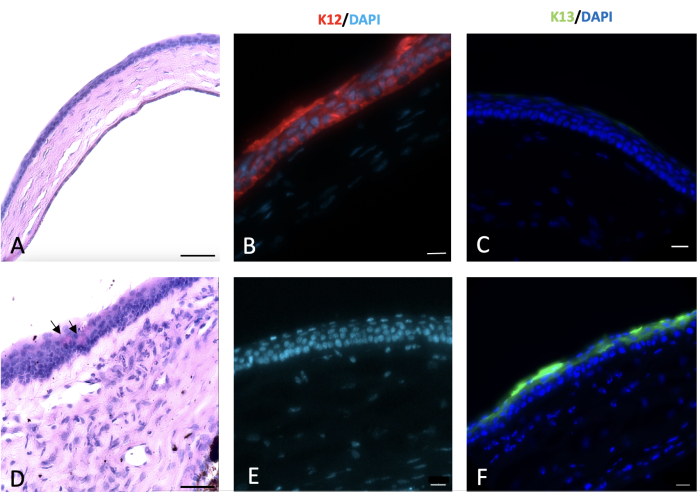
Abbildung 6: Periodische Säure-Schiff- und immunhistochemische (IHC) Färbung der Hornhaut. Eine periodische Säure-Schiff- und immunhistochemische Färbung der normalen und verletzten Hornhaut wurde 2 Wochen nach der Verletzung durchgeführt. Normales Hornhautepithel der Maus, das aus 4-5 Zellschichten besteht (A). Eine alkalische Schädigung der Hornhaut und des Limbus führte zu einer Konjunktivalisierung der Hornhaut mit dem Auftreten von Becherzellen auf der Hornhautoberfläche, wie durch schwarze Pfeile in (D) dargestellt. Normale Hornhautepithelzellen exprimieren K12 (B), das von den Bindehautzellen, die die verletzte Hornhaut bedecken, nicht exprimiert wird (E). K13, ein charakteristischer Marker für Bindehautepithelzellen, wird auf den normalen Hornhautepithelzellen nicht exprimiert (C). Es ist jedoch auf der durch Natriumhydroxid (NaOH) geschädigten Hornhautoberfläche vorhanden, was ein Zeichen für eine Hornhautkonjunktivalisierung (F) ist. Maßstabsbalken für Histologie-Bilder = 50 μm, Maßstabsbalken für IHC-gefärbte Bilder = 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
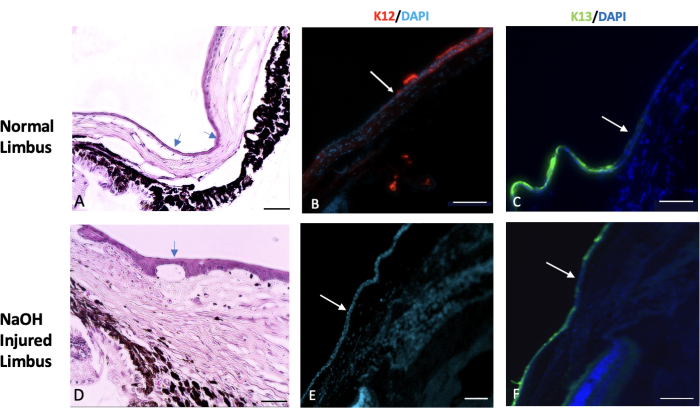
Abbildung 7: Hämatoxylin- und Eosin- und immunhistochemische Färbung. Hämatoxylin und Eosin (H&E) sowie immunhistochemische Färbungen des normalen und verletzten Limbusgewebes wurden durchgeführt. (A) Der normale Limbus markiert den Übergangsbereich zwischen dem Ende der Sklera und dem Beginn der Hornhaut. Diese Region ist typischerweise von einer oder zwei Schichten von Bindehautepithelzellen bedeckt (gekennzeichnet durch die Pfeile). In einem gesunden Auge beginnt die Expression eines spezifischen Hornhautepithelmarkers namens K12 am Limbus und erstreckt sich bis zur Oberfläche der Hornhaut (siehe Bild B). Andererseits ist die Expression eines Bindehautmarkers, der als K13 bekannt ist, auf den Limbus beschränkt und erstreckt sich nicht über ihn hinaus (angedeutet durch den weißen Pfeil in Bild C). Bei Augen, die durch Natriumhydroxid (NaOH) verletzt wurden, sind die Grenzen des Limbus gestört. Dies führt zu einer Wanderung von Bindehautzellen in Richtung der verletzten Hornhaut. (D) Die Bilder des NaOH-verletzten Limbus zeigen das Vorhandensein einer Neovaskularisation sowohl unter der Epithelschicht als auch innerhalb des Stromagewebes. Nach der Verletzung fehlt der verletzten Hornhautoberfläche das Vorhandensein von K12 (E), während K13 auf der Hornhautoberfläche reichlich exprimiert ist (F). Maßstabsbalken für Histologie-Bilder = 50 μm, Maßstabsbalken für IHC-gefärbte Bilder = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsdatei 1: Färbeprotokoll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Video 1: NaOH-Hornhaut- und Limbusverletzung in einem Mausmodell mit einem Punch-Trepan. Das Video zeigt das Verfahren zur Induktion von NaOH-Hornhaut- und Limbusverletzungen in einem Mausmodell mit einem Punch-Trepan. Es ist wichtig, das Punch-Trephin in einer parallelen Achse mit der Kugel zu halten und minimalen Druck auf den Limbus auszuüben. Diese richtige Technik ist unerlässlich, um Leckagen zu vermeiden und optimale Ergebnisse zu erzielen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Illustration der Enukleationstechnik unter Erhalt der bulbären Bindehaut. Um die nasale Seite der Kugel von der temporalen Seite zu unterscheiden, wird der Nasenkarunkel zusammen mit der Kugel erhalten. Die gesamte Bindehaut wird von ihrem Übergang zur Tarsalplatte aus präpariert. Mit minimalem Druck ragt der Orbitainhalt nach außen. Indem die Zange in Richtung des hinteren Globus geführt wird, wird der Sehnerv erfasst und das Gewebe entnommen. Das entkernte Gewebe umfasst den Globus, das orbitale Fett und die orbitale Tränendrüse. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
In dieser Studie wird ein innovatives Gerät vorgeschlagen, das Punch-Trepan, mit dem eine effektive und reproduzierbare Hornhaut- und Limbusverletzung in einem Mausmodell erfolgreich induziert werden kann. Dieses limbale Stammzelldefektmodell ist ideal, um die Dynamik der Hornhautwundheilung und Konjunktivalisierung nach Verletzungen zu untersuchen.
Es gibt Hinweise darauf, dass sowohl die limbale Nische als auch der zentrale Teil der murinen Hornhaut Stammzellen enthalten30. Daher ist eine effiziente Hornhaut- und Limbusverletzung erforderlich, um ein Stammzellmangelmodell zu erstellen, und das hier vorgestellte Verletzungsmodell ermöglicht die Exposition des gekrümmten Hornhautlimbus gegenüber einem chemischen Wirkstoff für einen bestimmten Zeitraum. Um die beste Konzentration und Dauer der NaOH-Verletzung zu bestimmen, wurden Verletzungen mit unterschiedlichen NaOH-Konzentrationen und -Dauern zugefügt. Höhere NaOH-Konzentrationen oder längere Expositionsdauer führten zu einer erhöhten Gewebeschädigung und Fibrose. Daher können die Forscher diese Parameter auf der Grundlage der spezifischen Ziele ihrer Studie und der gewünschten Schwere der Verletzung anpassen.
Um dieses Modell der Hornhaut- und Limbusverletzung erfolgreich zu reproduzieren, sollten mehrere wichtige Überlegungen berücksichtigt werden. Zunächst ist es zwingend erforderlich, den Limbus-zu-Limbus-Durchmesser des Zielauges zu messen, um die geeignete Größe des Standes zu bestimmen. Es wird empfohlen, eine Biopestanze mit einem Außendurchmesser zu wählen, der 0,5 - 1 mm größer als dieser Durchmesser ist.
Die Oberflächenspannung der verwendeten Flüssigkeit ist ein wichtiger Faktor, um Leckagen an der Grenzfläche zwischen der Augenoberfläche und dem Rand des Stanztrepans zu verhindern, wie in Abbildung 1G dargestellt. Daher ist es nicht erforderlich, Druck auf die Spitze der Stanzbiopsie auszuüben.
Um eine mechanische Schädigung des Gewebes zu vermeiden, ist es wichtig, die Stanztrepan in einer parallelen Achse mit dem Auge zu halten und keinen Druck auf den Limbus auszuüben. Eine unsachgemäße Einstellung der Stanztrepanachse kann das Risiko von Leckagen erhöhen und zu einer dezentrierten Verletzungsstelle und ungenauen Ergebnissen führen.
Zu den möglichen Einschränkungen dieser Technik gehören die Notwendigkeit, die geeignete Stempelgröße auszuwählen, der Erwerb von Fertigkeiten im Halten des Stanztrepans und das potenzielle Risiko, mechanische Verletzungen zu verursachen. Diese Einschränkungen können jedoch durch Übung und durch Befolgen der in diesem Protokoll beschriebenen Anweisungen überwunden werden. Der Stamm und die Altersspanne der Mäuse sind weitere Faktoren, die den Re-Epithelisierungsprozess beeinflussen und in der Studie berücksichtigt werden müssen.
Darüber hinaus ist das vorgeschlagene Protokoll vorteilhaft, da es eine Enukleationsmethode beschreibt, die die bulbäre und palpebrale Bindehaut erhält und die Bestimmung des nasalen Teils der Kugel ohne die Anwendung von chirurgischem Nahtmaterial als Marker ermöglicht. Frühere Forschungen haben gezeigt, dass die Nasenregion des Auges im Vergleich zu anderen Bereichen der Hornhaut die geringste neuronale Innervation besitzt, was sie anfälliger für Neovaskularisation und eine verminderte regenerative Wirksamkeit macht31,32.
Zusammenfassend lässt sich sagen, dass die klinischen Anzeichen der LSCD, wie Hornhauttrübung (CO), persistierende Epitheldefekte und Hornhautneovaskularisation (NV), zusammen mit den beobachteten histologischen Veränderungen, einschließlich Becherzellmetaplasie, Expression von K13 auf der Hornhautoberfläche und Abwesenheit von K12 auf der Hornhautoberfläche, das Vorhandensein von LSCD in diesem Modell bestätigen. Diese Ergebnisse liefern Hinweise darauf, dass diese neuartige Technik bei der Induktion von LSCD wirksam ist. Dieses chemische Verletzungsmodell kann in präklinischen Studien eingesetzt werden, um neue Medikamente und pharmazeutische Behandlungen im Bereich der Hornhautverletzung und -regeneration zu untersuchen.
Offenlegungen
Keiner der Autoren hat ein finanzielles Interesse an einem der in dieser Studie beschriebenen Unternehmen oder Produkte. Die Autoren erklären, dass keine weiteren Interessenkonflikte bestehen.
Danksagungen
Wir erkennen an, dass NEI P30-EY026877 diese Forschung unterstützt. Wir danken Charlene Wang und dem Dr. Irv Weissman Lab am Institut für Stammzellbiologie und Regenerative Medizin der Stanford University für ihre freundliche Unterstützung bei der Bereitstellung von Versuchstieren. Wir danken Hirad Rezaeipoor für seine Unterstützung bei der Vorbereitung und Bearbeitung der Bilder.
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
Referenzen
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten