Method Article
Bir fare modelinde punch-trephine tekniği kullanılarak kornea ve limbal alkali yaralanma indüksiyonu
Bu Makalede
Özet
Bu protokol, bir fare modelinde doğru ve tekrarlanabilir bir kornea ve limbal alkali hasarını indüklemek için bir yöntemi açıklar. Protokol, oldukça kavisli fare korneası ve limbusunda eşit olarak dağılmış bir yaralanmaya izin verdiği için avantajlıdır.
Özet
Kornea görme için kritik öneme sahiptir ve travma sonrası kornea iyileşmesi, şeffaflığını ve işlevini korumada esastır. Araştırmacılar, kornea yaralanma modellerinin incelenmesi yoluyla, korneanın nasıl iyileştiğine dair anlayışlarını geliştirmeyi ve kornea opasitelerini önlemek ve yönetmek için stratejiler geliştirmeyi amaçlamaktadır. Kimyasal yaralanma, fareler üzerinde kapsamlı bir şekilde incelenen en popüler yaralanma modellerinden biridir. Önceki araştırmacıların çoğu, kornea hasarını indüklemek için sodyum hidroksite batırılmış düz bir kağıt kullanmıştır. Bununla birlikte, fare korneası oldukça kavisli olduğundan, düz filtre kağıdı kullanarak kornea ve uzuv yaralanmasını indüklemek güvenilir değildir. Burada, araştırmacıların murin korneası ve limbusa iyi sınırlı, lokalize ve eşit olarak dağılmış bir alkali yaralanması oluşturmasını sağlayan yeni bir enstrüman, modifiye edilmiş bir biyopsi yumruğu sunuyoruz. Bu yumruk-trephine yöntemi, araştırmacıların tüm murin korneası ve limbusu doğru ve tekrarlanabilir bir kimyasal yanık indüklerken, göz kapakları gibi diğer yapıları kimyasaldan etkilenmeden bırakmalarını sağlar. Ayrıca, bu çalışma, medial karınkülü dünyanın nazal tarafını tanımlamak için bir dönüm noktası olarak koruyan bir enükleasyon tekniğini tanıtmaktadır. Bulbar ve palpebral konjonktiva ve gözyaşı bezi de bu teknik kullanılarak sağlam tutulur. Oftalmolojik muayeneler yaralanma sonrası 0., 1., 2., 6., 8. ve 14. günlerde yarık lamba biyomikroskobu ve floresein boyama ile yapıldı. Klinik, histolojik ve immünohistokimyasal bulgular tüm deney farelerinde limbal kök hücre eksikliğini ve oküler yüzey rejenerasyon yetmezliğini doğruladı. Sunulan alkali kornea hasarı modeli, limbal kök hücre eksikliği, kornea iltihabı ve fibrozu incelemek için idealdir. Bu yöntem aynı zamanda topikal oftalmolojik ilaçların murin kornea yüzeyindeki klinik öncesi ve klinik etkinliklerini araştırmak için de uygundur.
Giriş
Kornea görme için kritik öneme sahiptir ve net görme için bir ön koşul olan şeffaflık da dahil olmak üzere benzersiz özellikler sergiler. Kornea, önemli bir koruyucu rol oynamanın yanı sıra, gözün kırma gücünün 2/3'ünü oluşturur1. Görmedeki önemli rolü nedeniyle, kornea yaralanmaları ve opaklık önemli görme kaybına neden olur ve dünya çapında önlenebilir körlüğün ikinci en yüksek nedeninden sorumludur 2,3. Şiddetli limbal disfonksiyonu olan kornea yaralanmalarında, limbusun bariyer fonksiyonu azalır, bu da konjonktival hücrelerin kornea yüzeyine doğru göçüne ve kornea konjonktivalizasyonuna 4,5 neden olur, bu da görmeyi önemli ölçüde tehlikeye atar. Bu nedenle, kornea körlüğü ve ilgili sakatlığın küresel yükünü ele almak için etkili önleyici ve terapötik stratejiler gereklidir.
İnsan kornea yara iyileşme sürecinin mevcut anlayışı, çeşitli yaralanmalara kornea tepkilerini araştıran önceki çalışmalara dayanmaktadır. Çeşitli kimyasal veya mekanik kornea yaralanmalarını indüklemek için çeşitli teknikler ve hayvan modellerikullanılmıştır 6,7,8,9 ve kornea yara iyileşme sürecinin çeşitli yönlerini araştırmak için.
Alkali yanık modeli, sodyum hidroksit (NaOH) doğrudan kornea yüzeyine uygulanarak veya düz filtre kağıdı10 kullanılarak gerçekleştirilen köklü bir yaralanma modelidir. Bir alkali hasar, proinflamatuar mediatörlerin salınmasına ve polimorfonükleer hücrelerin sadece kornea ve gözün ön kamarasında değil, aynı zamanda retinada da infiltrasyonuna neden olur. Bu, istenmeyen retinal ganglion hücre apoptozunu ve CD45+ hücre aktivasyonunuindükler 11. Bu nedenle, bir alkali yaralanma modeli kullanarak aşırı istenmeyen yaralanmaları önlemek için yaralanma bölgesini tam olarak lokalize etmek çok önemlidir.
Murin göz küresinin eksenel uzunluğu yaklaşık 3 mm'dir12. Kornea ve retina arasındaki bu kısa mesafe nedeniyle, ışığı retinaya odaklamak için yüksek kırma gücü sağlamak için dik bir kornea eğriliği mevcuttur (Şekil 1A). Daha önce13'te bildirdiğimiz gibi, düz bir filtre kağıdı kullanarak bu yüksek kavisli yüzeyde kimyasal yaralanmaya neden olmak, özellikle limbusta zordur (Şekil 1B). Limbusun yaralanmasına neden olmak, forniks ve bitişik konjonktivada istenmeyen yaralanmaya neden olma potansiyeline sahip olan filtre kağıdının eğilmesini gerektirir14. Başka bir yaklaşım, kimyasal ajanın doğrudan kornea yüzeyine damla olarak uygulanmasını içerir. Bununla birlikte, bu yöntem maruz kalma süresi üzerinde kontrolden yoksundur ve sıvının bu bölgelere difüzyonu nedeniyle konjonktiva, forniks ve göz kapaklarında yaralanmaya neden olma riski vardır.
Bu sınırlamaların üstesinden gelmek için, bu çalışma yaralanmayı indüklemek için yeni bir punch-trephine yöntemi sunmaktadır. Bu tekniğin (i) fare modelinde tüm kornea yüzeyinde ve limbusta etkili bir kimyasal hasara neden olması, (ii) korneada lokalize ve iyi sınırlandırılmış bir yaralanmaya neden olması, (iii) önceden belirlenmiş bir süre boyunca ilgilenilen herhangi bir sıvıyı uygulama yeteneği ve (iv) uygun biyopsi zımbalarını seçerek farklı boyutlarda kornea yaralanmalarına neden olma yeteneği dahil olmak üzere çeşitli avantajları vardır. Bu yöntem, aynı zamanda kavisli bir kornea yüzeyi sergileyen ve oküler yüzey yara iyileşmesini incelemek için kullanılan yaygın hayvan modelleri olan sıçan ve tavşan yaralanma modelleri için de uygundur.
Protokol
Tüm prosedürler Stanford laboratuvar hayvanları bakımı APLAC numarası 33420, hayvanların bilimsel amaçlarla kullanımı ve hayvanların oftalmik ve görme araştırmalarında kullanımına ilişkin ARVO Beyanı'na uygun olarak gerçekleştirilmiştir. Yaşları 8-12 arasında değişen toplam 10 erkek ve dişi C57BL/6 fare, Irving L. Weissman laboratuvarı tarafından cömertçe sağlandı. Hayvanlar 12 saatlik bir aydınlık-karanlık döngüsüne alıştırıldı ve su ve ad libitum yemi ile sağlandı. Hayvanın bir gözünde yaralanma meydana geldi.
1. Deney için hazırlık
- Malzemelerin hazırlanması
NOT: Tüm reaktifler oda sıcaklığında muhafaza edilmelidir.- Punch-trephine'i hazırlayın: 3,5 mm çapında bir biyopsi zımbası hazırlayın ve zımbanın şaftını distal kenarından 5 mm uzakta işaretleyin. Zımbayı sıkıca takın ve iki hızlı döner alet kullanarak milinin işaretli distal kısmını kesin. Bu işlem sırasında oküler koruma kullanın. Mili 3,5 mm derinlikte kesin ve son 1,5 mm'yi takılı bırakın. Ucu Şekil 90'de gösterildiği gibi 1° bükün.
- 1 g NaOH'yi 50 mL damıtılmış suda çözerek 0,5 M NaOH çözeltisi hazırlayın.
- 2 mL 100 mg/mL ketamin ve 1 mL 20 mg/mL ksilazini birleştirerek 10 mL anestezik kokteyl hazırlayın. Enjeksiyondan önce, bu karışımı 7 mL% 0.9 NaCl (normal salin) ile seyreltin.
- 9.9 mL steril fosfat tamponlu salin (1x PBS) içine 0.1 mL %10 AK-Fluor floresan sıvı ekleyerek %0.1 floresein sodyum çözeltisi hazırlayın.
- 8 g NaCl, 0.2 g KCl, 1.44 gNa2HPO4ve 0.23 g NaH2PO4'ü 900 mL damıtılmış suda çözerekPBS'yi(1x) hazırlayın. Çözeltinin pH'ını 7.4'e ayarlayın. Damıtılmış su ekleyerek çözeltiyi 1 L'lik son hacme getirin.
- Fiksasyon için% 4 paraformaldehit (PFA) çözeltisi hazırlayın. Kimyasal bir başlık altında, 2 g PFA'yı 45 mL PBS içinde çözün. Karışımı 65 °C'ye ısıtın ve pH'ını 7.4'e titre edin. PFA çözüldükten sonra, çözeltiyi 50 mL'lik son hacme getirin.
2. Hayvan hazırlama
- Enjeksiyon için uygun enjekte edilebilir anestezik kokteyl hacmini belirlemek için fareyi tartın. Fareyi Machholz ve ark.15'te tarif edildiği gibi uygun şekilde kullandıktan ve kısıtladıktan sonra, anestezik kokteyli 0.01 mL / g 16,17'lik bir dozda intraperitoneal (IP) olarak uygulayın. Organ hasarını önlemek için IP enjeksiyonu için alt karın kadranlarını hedefleyin.
- Kornea alkali hasarı son derece ağrılı olduğundan, ameliyat sırasında ve sonrasında ek analjezi için deri altına buprenorfin uzatılmış salimli enjekte edilebilir süspansiyon (3.25 mg / kg) enjekte edin.
- Derin bir anestezi düzlemi elde edilene kadar bekleyin. Başarılı bir derin anestezi düzleminin bir göstergesi olarak ayak parmağı sıkışmasına yanıt eksikliği olup olmadığını kontrol edin. Ameliyata başlamadan önce kuruluğunu önlemek için karşı göze basit göz merhemi sürün.
- Anesteziden sonra, fareyi standart kemirgen cerrahisi prensiplerine göre hazırlanmış ameliyat masasına yerleştirin18. Lateral dekübit pozisyonunda konumlandırılmış kemirgen başının altına 5 mm yüksekliğinde bir yastık yerleştirin. Yastık, ameliyat sırasında kemirgenin başını desteklemeye yardımcı olur.
- Daha fazla anestezi için tetrakain hidroklorür (% 0.5) göz damlası uygulayın. Oküler yüzeyi cerrahi bir göz mızrağıyla düzgün bir şekilde kurulayın ve kirpikleri düzeltin.
3. Alkali hasarının indüksiyonu
- Ameliyata başlamadan önce ameliyat masasını standart kemirgen cerrahisi prensiplerine18,19 göre düzenleyin ve ameliyat sırasında cerrahi alanı steril tutun. Anestezi uygulanmış fareyi düzgün bir şekilde görselleştirmek için cerrahi mikroskobu konumlandırın ve zamanlayıcıyı 30 saniyeye ayarlayın. Durulama işlemi sırasında istenmeyen burun aspirasyonunu önlemek için hayvanın ağzına bükülmüş bir kağıt havlu yerleştirin.
- Başparmak ve işaret parmaklarını kullanarak farenin göz kapaklarının tamamen açık olduğundan emin olurken cerrahi mikroskobu kullanarak limbal alan çevresini belirleyin. Temiz punch-trephine'i aşağı doğru herhangi bir baskı uygulamadan gözün eksenine paralel olarak nazikçe tutun. Aleti döndürmekten kaçının ve zımba-trefin eksenini kürenin eksenine paralel tutun.
- Cerrahi asistandan, aleti doldurmak ve kornea yüzeyini uygun şekilde kaplamak için zımba-trephine deliğine 3 damla NaOH solüsyonu (40 μL'ye eşit) damlatmasını isteyin. Sıvının yüzey gerilimi, cihazdan herhangi bir sızıntıyı önler (Şekil 1).
NOT: NaOH çözeltisini dikkatlice düşürmek için 1 ° açılı düzleştirilmiş bir uca sahip 27G iğneli 50 mm'lik bir şırınga kullandık. - 30 saniye sonra kornea ve forniksi hemen 5 mL PBS (1x) ile durulayın. Video 1 , kimyasal yaralanmaya neden olma prosedürünü göstermektedir.
- Yaralı gözün kornea yüzeyinde 7 - 7,5 pH olmasını sağlamak için evrensel bir pH indikatör kağıdı kullanın. Ardından, üçlü antibiyotik oftalmik merhemi kimyasal olarak yaralanmış oküler yüzeye uygulayın.
NOT: Ameliyat sırasında kuyruk hareketi, düşük anestezi derinliğinin bir işaretidir. Bir anestezik [bolus IP (başlangıç hacminin% 50'si)] enjekte ederek ek anestezik kokteyl (ketamin + ksilazin) uygulayın. - Ameliyattan sonra, farenin stabil bir durumda olduğunu onaylayın. Hayvan acı çekiyorsa ikinci buprenorfin uygulayın. 2.2'deki ile aynı kullanım tekniğini kullanın. Hayvan anestezi altındayken ameliyat sonrası muayeneye başlayın.
- İşlemden sonra, punch-trephine ve ameliyat masasını% 70 etanol ile yıkayın, kurutun ve sterilize edin.
4. Klinik değerlendirme
- Muayene için, fareyi daha önce adım 2.1'de açıklandığı gibi uyuşturun.
- Yarık lambalı biyomikroskop altında gözleri (yaralı ve yaralanmamış) inceleyin. Fotoğraf çekmek için bir kamera kullanın (bu çalışmada Sinematik modda bir telefon kamerası kullanılmıştır).
- Yoeruek derecelendirme sistemine göre kornea opaklığını puanlayın20: 0 = normal, berrak kornea; 1 = hafif opaklık; 2 = daha fazla opaklık, ancak iris ve göz bebeği kolayca ayırt edilebilir; 3 = iris ve göz bebeği zar zor ayırt edilebilir; 4 = Kornea, görünmez bir göz bebeği ile tamamen opaktır.
- % 0.1 floresein göz damlası uygulayın. Fazla floresan sıvıyı pamuklu bir aplikatör ile kurutun ve kobalt mavisi filtreyi kullanarak kornea epitel kusurlarının varlığını değerlendirin. Fotoğraf çekin.
- Sternal yaslığı korumak için yeterli bilinci yeniden kazanana kadar hayvanı izleyin. Tamamen iyileşene kadar hayvanı diğer hayvanlara tekrar sokmayın.
5. Enükleasyon
- Kimyasal yaralanmadan 2 hafta sonra farelere 3-5 saniye içinde servikal çıkık ile ötenazi indüksiyonu yapın21.
- Video 2'de gösterildiği gibi, medial karuncle ve tüm palpebral konjonktivayı aşağıdaki sırayla korurken gözü enüklee edin.
- Cerrahi mikroskop altında, karuncle ve cildin birleşimini dikkatlice inceleyin. Diş forsepslerini kullanarak, karuncle'ı geri çekin ve cerrahi makasın ucunu palpebral konjonktiva altında tarsal plaka ile birleştiği yere doğru yönlendirin.
- Konjonktivayı yapışma çizgisi boyunca lateral kantusa doğru kesin. Ardından, cerrahi makası subkonjonktival düzlemde konjonktiva ve inferior tarsal plakanın birleştiği yere çevirin.
- Konjonktival diseksiyonu tamamladıktan sonra, üst ve alt göz kapaklarını başparmak ve işaret parmaklarıyla nazal taraftan geri çekin. Geri çekilirken, kavisli uçlu bir cımbızın ucunu çıkıntılı gözyaşının arkasına optik sinire doğru yönlendirin. Optik siniri sıkıca kavrayın ve küreyi çıkarın (Şekil 2).
- Küreyi PBS (1x) ile durulayın ve sabitleme solüsyonuna aktarın.
6. Hematoksilen ve eozin (H&E) ve periyodik asit-Schiff (PAS) boyama
- Küreleri gece boyunca oda sıcaklığında% 10 formalin çözeltisine sabitleyin.
- Her biri 10-15 dakika boyunca %70 etanol, %80 etanol, %90 etanol ve %100 etanol konsantrasyonlarına sahip sıralı bir dizi dereceli alkol kullanarak dokuları kurutun. Daha sonra, gözleri 10 dakika boyunca ksilene batırın. Son olarak, gözleri parafinle kaplayın.
- Parafin bloklarını 6 μm kalınlığında dilimler halinde bölümlere ayırın ve Ek Dosya 1'de açıklandığı gibi hematoksilen ve eozin (H & E) ve periyodik asit-Schiff (PAS) boyama için cam mikroskop slaytlarına monte edin.
7. İmmünofloresan görüntüleme ve analiz
- İmmünohistokimya çalışmaları (IHC) için, gözleri gece boyunca 4 ° C'de% 4 PFA içeren 1 mL PBS (1x) içinde sabitleyin. Numuneyi 3x 1 mL PBS (1x) içinde her biri 5 dakika yıkayın.
- Buz kristali oluşumunu önlemek ve proteinlerin moleküler yapılarını korumak için PBS'de %10 sakkaroz, %20 sakkaroz ve %30 sükroz konsantrasyonları ile seri sakkaroz doygunluğu gerçekleştirin. Küreleri optik koherens tomografi çözeltisine gömün (OCT; Şekil 2) ve -80 °C'de saklayın.
- OCT bloğunu 12 μm kalınlığında dilimler halinde bölümlere ayırın ve IHC boyama için cam mikroskop slaytlarına monte edin.
- Mikroskop lamları üzerindeki doku kesitlerini PBS'de (1x) %0.1 Triton X −100'de 15 dakika boyunca geçirgenleştirin. Daha sonra, oda sıcaklığında 1 saat daha PBS'de (1x) %5 BSA ile spesifik olmayan antijenleri bloke edin.
- Doku kesitlerini% 1 BSA içeren PBS'de (1x) hazırlanan hedeflenen primer antikorların kokteylinde gece boyunca 4 ° C'de mikroskop lamları üzerinde inkübe edin. Bu deneyde, birincil antikorlar sırasıyla 2.24 μg/mL ve 1.56 μg/mL konsantrasyonlu 1:100 seyreltilmiş tavşan anti-keratin 13 (K13) ve anti-keratin 12 (K12) antikorlarıydı.
- İnkübasyondan sonra, mikroskop slaytlarındaki doku kesitlerini 3x PBS (1x) ile yıkayın. Daha sonra, 1:500 seyreltilmiş eşek anti-tavşan-IgG ile bağlı primer antikorları tespit edin. İkincil antikor ile karanlıkta 1 saat boyunca 4 ° C'de inkübe edin. Daha sonra PBS (1x) 3x'te her biri 5 dakika yıkayın.
- Mikroskopta doku kesitlerine DAPI içeren bir damla anti-fade floresan montaj ortamı uygulayın ve bir lamel ile örtün. Numunelerin karanlıkta kurumasını bekleyin ve normal ve yaralı gözler için aynı lazer ayarıyla floresan mikroskop altında inceleyin.
Sonuçlar
Yöntemin limbal kök hücre eksikliğini (LSCD) indüklemedeki etkinliği, LSCD'nin klinik ve histolojik bulguları değerlendirilerek değerlendirildi. Klinik değerlendirme yarık lamba mikroskobu ve ön segment optik koherens tomografi (AS-OCT) görüntüleme ile yapıldı (Şekil 3 ve Şekil 4).
Re-epitelizasyon merkezcil bir şekilde meydana geldi ve korneanın temporal kısmında nazal kısmına göre daha hızlıydı. Yaralı gözlerde kimyasal yaralanmadan hemen sonra 2+-3+ kornea bulanıklığı gelişti (Şekil 3). Limbal yaralanmayı takiben epitel hücreleri konjonktivadan kornea yüzeyine göç etti. Büyük kornea epitel defekti 12-14. günlerde tamamen yeniden epitelize edildi, bu da benzer büyüklükte ve sağlam bazal membran ve stroma kornea epitel yaralanmasına kıyasla daha uzun sürdüve tipik olarak yaralanmadan sonraki 5 gün içinde iyileşti 8,9. LSCD nedeniyle, yaralanan gözlerin %50'sinde ikinci haftanın sonunda kalıcı epitel defektleri gelişti (Şekil 3). Kornea ödemi ilk birkaç gün daha belirginken (Şekil 3, Şekil 4), ikinci haftada kornea fibrozisi anlamlıydı ve yaralı gözlerin %100'ünde 4+ kornea opaklığı ile sonuçlandı.
Neovaskülarizasyonun (NV) erken belirtileri, Şekil 5'te gösterildiği gibi, kimyasal yaralanma indüksiyonundan 24 saat sonra, Kvanta ve ark. yaralanmadan 24 saat sonra limbal NV belirtisi gösteren çalışma22. İyileşme sürecinde yeni damarlar olgunlaştı ve yaralanmadan sonraki 14. günde NV limbusu geçti ve merkezi korneaya ulaştı. Konjonktiva ve kornea arasındaki sınırı tanımlayan limbus yok edildi.
Limbal kök hücre eksikliği ve konjonktivalizasyonun histolojik kanıtı, PAS+ goblet hücrelerinin ve stromal kan damarlarının ortaya çıkmasıyla gözlendi 23,24,25,26. Mevcut yaralanma modelinde kadeh hücreleri gözlendi ve Şekil 6'daki okla gösterildi.
Konjonktival ve kornea epiteli esas olarak sırasıyla K13 ve K12 olmak üzere benzersiz keratinleri ifade eder27. Limbal yaralanmadan sonra, konjonktivadan kaynaklanan yeni epitel hücreleri, denuded korneayı kapladı ve yaralanmadan sonraki 2 hafta boyunca herhangi bir yaralı hayvanın kornea yüzeyinde K12 eksprese edilmedi. Bu bulgu, diğer çalışmalarlatutarlı 28, tam LSCD'yi ve kornea yüzeyinde kornea epitel hücrelerinin yokluğunu gösterdi. Bununla birlikte, Park ve ark.29 tarafından yapılan çalışmada, yaralanmadan 20 ve 32 hafta sonra K12 ekspresyonunu tespit ettiler ve bu da epitel hücrelerinin olası bir trans-farklılaşmasını düşündürdü.
Sonuç olarak, kimyasal hasarın limbus ve limbal kök hücreleri tahrip ettiğini ve bunun sonucunda konjonktival epitel hücrelerinin korneanın merkezine göç ederek kornea yüzeyini örttüğünü gözlemledik. Bu, Şekil 7'de gösterildiği gibi tüm konjonktiva ve kornea yüzeylerinde eksprese edilen konjonktival epitel hücre belirteci K13 ile daha da doğrulanır.

Şekil 1: Normal fare sağ gözü ve kornea ve limbal yaralanmayı indüklemek için punch-trephine. (A) Oldukça kavisli korneaya sahip fare gözünü gösteren yanal görünüm (ok uçları limbusu gösterir). (B) Görüntü, büyük bir filtre kağıdının bile limbal alanı yeterince kaplamak için yetersiz olduğunu göstermektedir. Fare gözünün limbus-limbus çapı yaklaşık 4 mm'dir ve dış çapı 4,5 mm ve iç çapı 3,5 mm ( panel D ve H) olan bir punch biyopsisi, panel (C) ve (E)'de gösterildiği gibi kornea ve limbal yüzeyi uygun şekilde kaplar. (F) Punch-trephine, limbal alanın etrafındaki küre üzerinde uygun şekilde tutulur. (G) Punch-trephine'in kenarından sızıntı olmamasını sağlamak için, punch-trephine'i küre ile paralel bir eksende uygun şekilde konumlandırdıktan sonra, delik metilen mavisi ile doldurulur. Metilen mavisi sızıntısı tespit edilmedi. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
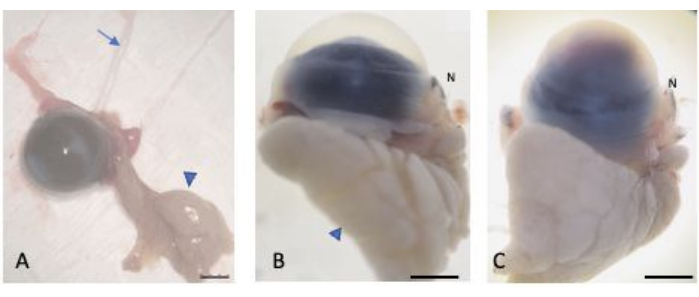
Şekil 2: Enükleasyonlu gözler. (A) Bulbar ve palpebral konjonktiva, gözyaşı bezi (ok ucu) ve optik sinir (ok) korunarak gözler enüklee edildi. Normal (B) ve yaralı (C) gözler, kriyokristal oluşumuna karşı korunmak için% 30 sükroza doyuruldu. Dünyanın burun kısmı, burun karınkülü (N etiketli) aracılığıyla tanınabilir. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
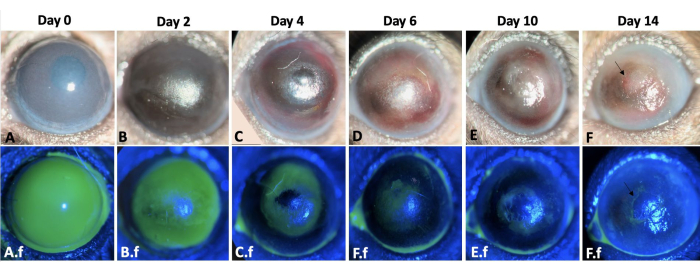
Şekil 3: Sol gözün yara iyileşmesi. Bir fare modelinde kornea ve limbal alkali hasarından sonraki 2 hafta boyunca sol fare gözünün yara iyileşme süreci burada gösterilmektedir (A-F). Gözün yarık lamba muayenesi. Kornea ödemi 0. ve 2. günlerde (A,B) daha belirginken, fibrozis yaralanma sonrası ikinci haftada (E-F) daha belirgindir. A.f-F.f aynı gözün yeniden epitelizasyon sürecini gösterir. A.f.'de yaralanma indüksiyonundan hemen sonra total kornea ve limbal epitel defekti izlendi. Epitel defekti, konjonktival epitel hücre göçü ile merkezcil bir düzende 12-14 gün (A.f-F.f) iyileşti. Bununla birlikte, yaralı gözlerin %50'sinde F ve F.f görüntülerinde okla gösterildiği gibi ikinci haftanın sonunda kalıcı epitel defekti gelişti. Ölçek çubuğu = 1 mm (panel C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
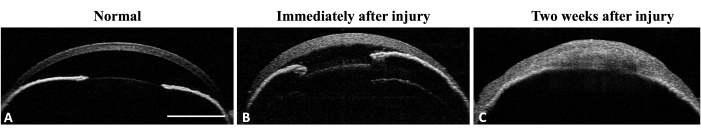
Şekil 4: Fare gözünün ön segment OCT'si. (A) AS-OCT, normal kornea eğriliğini ve ön kamarayı gösterir. İris yapısı iyi tanımlanmış ve tanınabilir. İrisin orta çevresinde iridokorneal yapışma saptanamaz. (B) Yaralanmadan hemen sonra ödem oluşumuna bağlı olarak kornea kalınlığı artar ve irisin orta çevresinde iridokorneal adezyon gelişir. (C) Yaralanmadan iki hafta sonra kornea eğriliği değişmiştir ve ön kamara harabiyeti ile toplam iridokorneal yapışma görülebilir. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
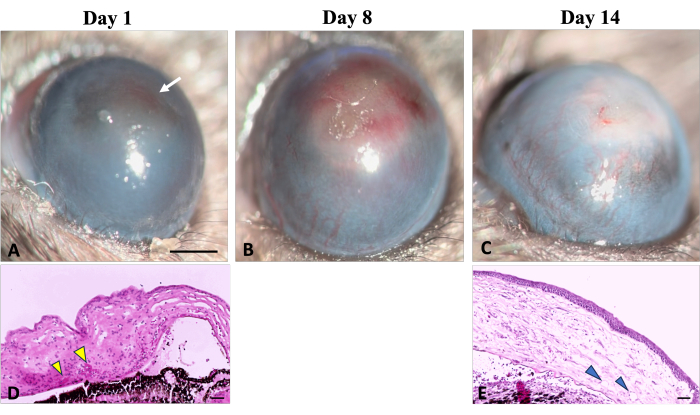
Şekil 5: Kornea neovaskülarizasyonu. Kornea neovaskülarizasyonunun klinik ve histolojik belirtileri, sodyum hidroksit (NaOH) hasarını takiben yara iyileşme sürecinde gözlenebilir. (A) Neovaskülarizasyonun ilk belirtileri, korneanın kırmızımsı bir renk değişikliği (beyaz bir okla gösterilir) ile karakterize edilen yaralanmadan sonraki ilk gün tespit edilebilir hale gelir. Bu renk değişikliği, ilgili histolojik görüntüde (D) (sarı ok uçlarıyla gösterilir) gösterildiği gibi, stromadaki kırmızı kan hücrelerinin toplanmasından kaynaklanır. (B) Rejenerasyonun ilk haftasında, yeni damarlar giderek artar ve kornea boyunca yayılır. (C) 2 haftanın sonunda, limbal bölge tahrip olur ve yeni damarlar gelişmeye devam eder. (E) Korneanın histolojik kesiti ayrıca derin stromal neovaskülarizasyonun varlığını gösterir (ok uçlarıyla gösterilir). Yarık lamba Görüntü ölçek çubuğu = 1 mm, histoloji görüntü ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
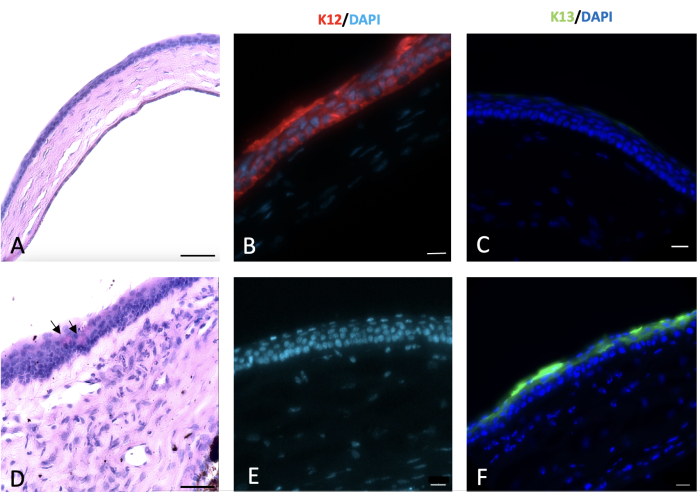
Şekil 6: Korneanın periyodik asit-Schiff ve immünohistokimyasal (IHC) boyanması. Normal ve yaralı korneanın periyodik asit-Schiff ve immünohistokimyasal boyaması yaralanmadan 2 hafta sonra yapıldı. Normal fare kornea epiteli 4-5 hücre katmanından (A) oluşur. Kornea ve limpustaki alkali hasar, (D)'de siyah oklarla gösterildiği gibi kornea yüzeyinde goblet hücrelerinin ortaya çıkmasıyla korneanın konjonktivalizasyonuna yol açtı. Normal kornea epitel hücreleri, yaralı korneayı (E) kaplayan konjonktival hücreler tarafından eksprese edilmeyen K12 (B) eksprese eder. Konjonktival epitel hücrelerinin karakteristik bir belirteci olan K13, normal kornea epitel hücrelerinde (C) eksprese edilmez. Bununla birlikte, kornea konjonktivalizasyonunun (F) bir işareti olan sodyum hidroksit (NaOH) ile yaralanmış kornea yüzeyinde bulunur. Histoloji görüntü ölçek çubuğu = 50 μm, IHC lekeli görüntü ölçek çubuğu = 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
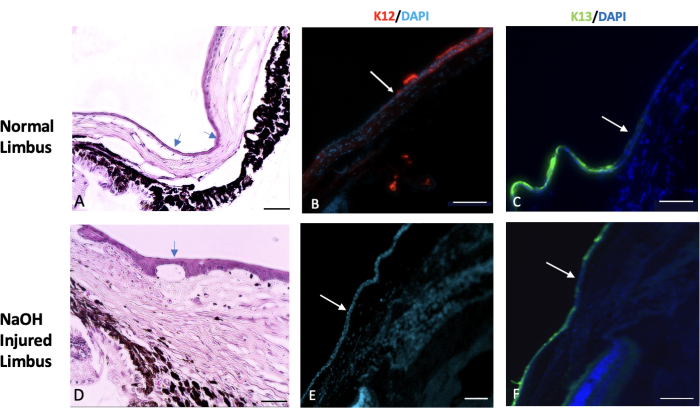
Şekil 7: Hematoksilen ve eozin ve immünohistokimyasal boyama. Normal ve yaralı limbus dokusunun hematoksilen ve eozin (H&E) ile immünohistokimyasal boyanması yapıldı. (A) Normal limbus, skleranın sonu ile korneanın başlangıcı arasındaki geçiş alanını işaretler. Bu bölge tipik olarak bir veya iki kat konjonktival epitel hücresi ile kaplıdır (oklarla gösterilir). Sağlıklı bir gözde, K12 adı verilen spesifik bir kornea epitel belirtecinin ekspresyonu limbusta başlar ve korneanın yüzeyine kadar uzanır (resim B'de gösterilmiştir). Öte yandan, K13 olarak bilinen bir konjonktival işaretleyicinin ifadesi limbus ile sınırlıdır ve onun ötesine uzanmaz (resim C'deki beyaz okla gösterilir). Sodyum hidroksit (NaOH) ile yaralanan gözlerde limbusun sınırları bozulur. Bu, konjonktival hücrelerin yaralı korneaya doğru göç etmesine yol açar. (D) NaOH ile yaralanmış limbusun görüntüleri, hem epitel tabakasının altında hem de stromal doku içinde neovaskülarizasyonun varlığını göstermektedir. Yaralanmayı takiben, yaralı kornea yüzeyinde K12 (E) varlığı yoktur, K13 ise kornea yüzeyinde (F) bol miktarda eksprese edilir. Histoloji görüntü ölçek çubuğu = 50 μm, IHC lekeli görüntü ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Boyama protokolü. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Video 1: Punch-trephine ile bir fare modelinde NaOH kornea ve limbal yaralanma. Video, bir yumruk-trephine ile bir fare modelinde NaOH kornea ve limbal yaralanmayı indükleme prosedürünü göstermektedir. Punch-trephine'i küre ile paralel bir eksende tutmak ve limbusa minimum basınç uygulamak çok önemlidir. Bu uygun teknik, sızıntıyı önlemek ve en iyi sonuçları elde etmek için gereklidir. Bu videoyu indirmek için lütfen buraya tıklayın.
Video 2: Bulbar konjonktivayı korurken enükleasyon tekniğinin gösterimi. Kürenin nazal tarafını temporal taraftan ayırt etmek için, burun karınkülü küre ile birlikte korunur. Tüm konjonktiva, kavşağından tarsal plakaya kadar diseke edilir. Minimum basınçla, yörünge içeriği dışa doğru çıkıntı yapar. Forsepsleri dünyanın arkasına doğru yönlendirerek, optik sinir kavranır ve doku çıkarılır. Enükleasyonlu doku, küre, orbital yağ ve orbital gözyaşı bezini içerir. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, bir fare modelinde etkili ve tekrarlanabilir bir kornea ve limbal yaralanmayı başarılı bir şekilde indüklemek için kullanılabilecek yenilikçi bir cihaz olan punch-trephine'i önermektedir. Bu limbal kök hücre eksikliği modeli, yaralanma sonrası kornea yara iyileşmesi ve konjonktivalizasyon dinamiklerini araştırmak için idealdir.
Kanıtlar, murin korneasının hem limbal nişinin hem de orta kısmının kök hücreleriçerdiğini göstermektedir 30. Bu nedenle, bir kök hücre eksikliği modeli üretmek için etkili bir kornea ve limbal yaralanma gereklidir ve burada sunulan yaralanma modeli, kavisli kornea limbisinin belirli bir süre boyunca kimyasal bir ajana maruz kalmasını sağlar. NaOH hasarının en iyi konsantrasyonunu ve süresini belirlemek için, çeşitli NaOH konsantrasyonları ve süreleri ile yaralanmalar meydana geldi. Daha yüksek NaOH konsantrasyonları veya daha uzun maruz kalma süreleri, doku hasarının artmasına ve fibrozise neden oldu. Bu nedenle, araştırmacılar bu parametreleri çalışmalarının belirli hedeflerine ve istenen yaralanma ciddiyetine göre ayarlayabilirler.
Bu kornea ve ekstremite yaralanması modelini başarılı bir şekilde yeniden üretmek için birkaç önemli husus göz önünde bulundurulmalıdır. İlk olarak, zımbanın uygun boyutunu belirlemek için hedeflenen gözün limbal-limbal çapını ölçmek zorunludur. Dış çapı bu çaptan 0,5 - 1 mm daha büyük olan bir biyopsi punchının seçilmesi önerilir.
Kullanılan sıvının yüzey gerilimi, Şekil 1G'de gösterildiği gibi oküler yüzey ile punch trephine kenarı arasındaki arayüzde sızıntıyı önlemede önemli bir faktördür. Bu nedenle punch biyopsisinin ucuna baskı uygulanmasına gerek yoktur.
Dokuda mekanik hasara neden olmaktan kaçınmak için, punch trephine'i gözle paralel bir eksende tutmak ve limbusa baskı uygulamaktan kaçınmak çok önemlidir. Zımba trephine ekseninin yanlış ayarlanması, sızıntı riskini artırabilir ve destatik bir yaralanma bölgesine ve yanlış sonuçlara neden olabilir.
Bu tekniğin bazı potansiyel sınırlamaları arasında uygun zımba boyutunu seçme ihtiyacı, zımba trephine'i tutma konusunda yeterlilik kazanma ve mekanik yaralanmaya neden olma potansiyel riski yer alır. Bununla birlikte, bu sınırlamalar uygulama yoluyla ve bu protokolde belirtilen talimatlar izlenerek aşılabilir. Farelerin suşu ve yaş aralığı, yeniden epitelizasyon sürecini etkileyen diğer faktörlerdir ve çalışmada dikkate alınmalıdır.
Ayrıca, önerilen protokol, bulbar ve palpebral konjonktivayı koruyan ve bir belirteç olarak cerrahi sütürler uygulanmadan dünyanın nazal kısmının belirlenmesine izin veren bir enükleasyon yöntemini detaylandırdığı için avantajlıdır. Önceki araştırmalar, gözün nazal bölgesinin korneanın diğer bölgelerine kıyasla en düşük nöral innervasyona sahip olduğunu göstermiştir, bu da onu neovaskülarizasyona karşı daha savunmasız hale getirir ve rejeneratif etkinliği azaltır31,32.
Özetle, kornea opaklığı (CO), kalıcı epitel defektleri ve kornea neovaskülarizasyonu (NV) gibi LSCD'nin klinik belirtileri, goblet hücre metaplazisi, kornea yüzeyinde K13 ekspresyonu ve kornea yüzeyinde K12 yokluğu dahil olmak üzere gözlenen histolojik değişiklikler, bu modelde LSCD'nin varlığını doğrulamaktadır. Bu bulgular, bu yeni tekniğin LSCD'yi indüklemede etkili olduğuna dair kanıt sunmaktadır. Bu kimyasal yaralanma modeli, kornea yaralanması ve rejenerasyonu alanında yeni ilaçları ve farmasötik tedavileri araştırmak için klinik öncesi çalışmalarda kullanılabilir.
Açıklamalar
Yazarların hiçbirinin bu çalışmada açıklanan herhangi bir şirket veya üründe herhangi bir finansal çıkarı yoktur. Yazarlar başka hiçbir çıkar çatışması beyan etmezler.
Teşekkürler
NEI P30-EY026877'in bu araştırmayı desteklediğini kabul ediyoruz. Charlene Wang'a ve Stanford Üniversitesi Kök Hücre Biyolojisi ve Rejeneratif Tıp Enstitüsü'ndeki Dr. Irv Weissman Laboratuvarı'na deney hayvanları sağlama konusundaki tüm yardımları için teşekkür ederiz. Hirad Rezaeipoor'un görüntülerin hazırlanması ve düzenlenmesindeki yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
Referanslar
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır