JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
일반 CNS의 실시간 PCR에 의한과 Neuroinflammation 동안 Microglia에 MicroRNAs의 탐지
요약
Microglia은 중추 신경계의 방어 및 면역 감시의 첫번째 라인을 제공 macrophages를 거주하고 있습니다. MicroRNAs는 활성화 및 macrophages의 차별화 등 많은 생리 과정에 중요한 역할을 규제 분자입니다. 이 문서에서는 microglia에서 microRNAs의 측정을위한 방법을 설명합니다.
초록
Microglia는 중추 신경계 (CNS) 1에 상주 골수양 혈통의 세포입니다. 이러한 세포는 여러 경화증 (MS) 2 등 neuroinflammation과 관련된 많은 질병의 pathologies에 중요한 역할을한다. 정상 CNS의 Microglia는 대식 세포 표시자 CD11b 표현과 같은 CD45와 같은 활성 마커의 낮은 수준을 표현하여 휴식 표현형을 나타냅니다. CNS의 병적인 행사 기간 동안 microglia는 CD45의 upregulation과 다른 마커 3 등의 결정이 활성화된다. microglia의 표현형 및 CNS의 기능에 영향을 미치는 요인을 잘 공부하지 않습니다. MicroRNAs는 (miRNAs) 등 세포 성장과 분화 4와 같은 염증 5와 pathologies 많은 정상적인 생리 과정에 관여하고 보존 분자 (~ 22 세포핵 길이)의 성장하는 가족입니다. MiRNAs가들의 구속력을 보완 시퀀스에서 특정 타겟 유전자의 표현을 downregulateIR mRNAs하고 macrophages 6 microglia 7을 포함하여 타고난 면역 세포의 활성화에 중요한 역할을한다. microglial 표현형, 생물 학적 기능을 정의하고, macrophages 다른 유형에서 microglia를 구별하는 miRNA-매개 경로를 조사하기 위해서는 양적 CNS 상주 microglia의 고유한 하위 집합에서 특정 microRNAs의 표현을 평가하는 것이 중요합니다. CNS의 miRNAs의 표현을 측정하는 일반적인 방법은 전체의 연결 조직에서하고 원위치 하이브리드화의 정량 PCR을 포함합니다. 그러나, 전체 조직 homogenate에서 정량 PCR은의 연결 조직 세포의 유일한 5~15%을 대표 microglia에서 miRNA의 표현의 평가를 허용하지 않습니다. 현장에서 하이브 리다이 제이션은 조직 섹션에서 특정 세포 유형에서 microRNA의 표현의 평가를 가능하지만,이 방법은 전적으로 양적 없습니다. 이 보고서에서는 양적와 SENS을 설명정상 CNS이나 실험적인 면역 encephalomyelitis (EAE), MS에 대한 마우스 모델을 사용 neuroinflammation 동안 격리 microglia의 실시간 PCR에 의한 miRNA의 검출을위한 itive 방식입니다. 설명한 방법은 정상 CNS에서 또는 MS, 뇌졸중, 외상성 부상, 알츠하이머 질환과 뇌종양 등 각종 pathologies과 관련된 neuroinflammation 중 microglia의 microRNAs의 표현의 수준을 측정하는 것이 유용할 것이다.
프로토콜
1. 일반 CNS에서 Microglia의 분리
microglia의 분리는 수정 3 이전에 설명한대로 수행됩니다.
- 가위, 포셉, 27g 바늘, 15 ML 다운스 호모 지 나이저 (테플론 / 유리), 40 μm의 나일론 셀 스트레이너, 40 % 및 70% Percoll 솔루션, 1X PBS 갖춘 10 ML의 주사기 : 해부 및 재관류에 대한 악기를 준비합니다.
- CO 2 카메라의 빠른 질식 (산소 부족)에 의해 쥐를 안락사시켜야하며 즉시 수술 조작 및 재관류에 대한 실험실 벤치로 전송할 수 있습니다.
- 수술 조작 (이용 가위와 집게 및 살균 등 70 %의 에탄올) 수행 : 오픈 복막 캐비티를 다이어프램, 오픈 흉강을 자르고 가위로 오른쪽 안마당을 자르지.
- 좌심실로 10-ML 주사기를 주입하고 압력을 적용하여 전체 - 몸 intracardial 재관류를 수행합니다. 느리고 꾸준한 PA의 혈액 순환을 통해 1X PBS의 8-10 ML을 전달CE.
- 반복 그룹의 모든 생쥐 (일반적으로 5-10 쥐)에 대한 1.2-1.4 단계를 반복합니다. 모든 생쥐가 perfused 때까지 재관류 후 얼음에 마우스를 보관하십시오.
- 모든 생쥐의 재관류 후, 뇌, 척수 코드를 해부. (선택 사항 : 두뇌의 다른 영역에서 miRNAs의 표현을 공부하고, 그러한 소뇌 5-10 마우스 및 균질화 함께 수영장을의 그룹의 해마 등 이러한 특정 분야를 해부).
- 15 ML 다운스 호모 지 나이저를 사용하여 뇌, 척수 코드를 Homogenize. 장소 일사불란 한 척수 균 질기와 1X PBS의 5 ML에 추가합니다. 10-20 부드러운 공격을 수행, 커다란 원심 분리기 5-7분 2000 RPM 50 ML-원뿔 튜브 및 인증서로 셀 스트레이너를 통해 homogenate를 전달합니다.
- 70 % Percoll과 40 % Percoll의 오버레이 7 ML 중 5-7 ML에 2-3 생쥐에서 뜨는, resuspend 뇌 / 척수의 homogenate 폐기하십시오. 30 분간 2,000 RPM (노 브레이크!)에서 봐.
- 70 % 위에 손상된 세포 / myelin 파편을 취소하고 모노를 수집40% / 70 %의 인터페이스에서 핵 세포. 적어도 5~7분 2000 rpm으로 1X PBS와 스핀과 1:1에서 수집된 세포를 희석. PBS 0.5 ML에서 세포를 Resuspend 및 1.7 ML ependorf 튜브로 그들을 전송합니다. 일반적인 수확량은 두뇌 후 2-3 생쥐의 척수 코드에서 세포의 준비를 위해 microglial 세포의 수를 ~ 0.5 ML에 1x10 6 주겠어요 마우스 당 mononuclear 세포의 ~ 500 × 10 3.
2. 유동세포계측법 의한 Microglia의 순도 제어
이전에 수정 7,8로 설명된대로 항체와 염색법이 수행됩니다.
- PE, 안티 CD45-APC-Cy7 항체, PBS에 1 % paraformaldehyde - FACS 버퍼 (2 % FBS와 1X PBS), FcR 차단 항체, 안티 CD11b를 준비합니다.
- 1.9 단계에서 세포의 50 μl를 타고 새로운 1.7 ML Eppendorf 튜브로 전송하여 FACS 완충액 350 μl를 추가합니다.
- 안티 FcR 항체의 5-10 μl을 넣고 10-15을 품어얼음 분.
- 이 Eppendorf 튜브에 세포를 분할. 연결한 튜브 1 항 CD11b의 μl 추가 - PE와 2 μl 안티 CD45-APC-Cy7 항체를 얼음에 10-15분을 품어. 둘째 튜브 항체 염색법에 대한 부정적인 컨트롤로 사용됩니다. 항체와 배양은 5 분 5400 RPM의 작은 원심 분리기에서 모두 튜브와 스핀에 FACS 버퍼 1 ML을 추가한 후. 방적 후 PBS와 vortexing의 1 % paraformaldehyde 400 μl에 그들을 resuspending하여 세포를 고정시킨다.
- 8 설명한대로 보상 제어를 위해 BD compubeads (BD Biosciences)를 사용하여 유동 cytometer (LSR II, BD Biosciences)에 유동세포계측법 분석을 수행합니다. 좋고 나쁜 준비의 예는 그림에 표시됩니다. 1A, B.
3. Neuroinflammation의 마우스 모델에서 염증 CNS에서 Microglia 및 주변 기기 Macrophages의 분리
이전에 설명한대로 실험적 면역 뇌염 (EAE)를 유도합니다우리 신문 7, FACS 정렬이 게시 프로토콜 8 비슷하게 수행됩니다.
- 150 MG 8-12-주 된 C57BL / 6 마우스의 5-10 그룹의 4 밀리그램 / ML 전체 Freund의 도움이되는 (CFA)에서 35-55 펩타이드를 집고 양이와 함께 피하 예방 접종으로 EAE를 유도. 백일해 독소는 하루가 제로와 일 두 사후 예방 접종에 IP를 (150 NG / 마우스) 부여하여야한다. 마우스는 10 일 사후 예방 접종을 시작하는 질병의 징후를 관찰하고 있으며, 다음과 같이 질병 심각도는 0-5의 숫자 규모 득점하지 않습니다 : 0) 어떠한 질환, 1) 약한 꼬리 또는 갔다리 걸어서 2) 뒷다리 사지 부전 마비를; 3) 뒷다리 마비, 4) 뒷다리와 forelimb 마비, 그리고 5) 사망 또는 인도적인 이유로 안락사. 질병의 정상에서 마우스는 (d21 사후 예방 접종) 1.5에서 2.5에 이르는 전형적인 질병 점수가 실험을 위해 사용됩니다.
- 단계 1.1-1.4에서와 같이 5-10 쥐 그룹의 CNS에서 mononuclear 세포를 격리하고 단계 2.1-2.4에서와 안티 CD11b 및 안티 CD45 항체에 세포를 얼룩.2.4 단계에서 1X PBS 대신 1 % paraformaldehyde 400 μl에서 그들을 resuspend 대신 세포를 해결하지 않습니다.
- 미래에 우리는 같이 이러한 세포를 참조할 것이다 "; 셀 정렬은 CD11b의 인구 + CD45 낮은 microglia 및 CD11b + CD45 안녕 세포 (중 ~ 80 %가 주변 macrophages 있고 ~ 그 중 20 %가 microglia 세 활성화되기 위해 FACSAria에 의해 수행되는 macrophages "). 샘플 수집을위한 1.7-ML ependorf 튜브를 사용하십시오. 10% FBS와 1X PBS 300 μl는 정렬된 세포의 손상을 방지하기 위해 수집 튜브에 추가되어 있어야합니다. 세 microglia의 인구, macrophages, 그리고 lymphocytes의 예는 그림에 표시됩니다. 그림 적절한 정렬 게이트 설정 2A. 2B. 정렬 microglia의 인구 (그림 2C)와 macrophages (그림 2D)를 reanalyzing 정한 일반 정렬 purities는 98-100%에 있었다. 일반적인 수율은 microglia를위한 x10 세 20-50하며다섯 생쥐의 그룹에서 고립 macrophages를위한 50-100 x10 3.
4. RNA의 분리
RNA는 수정과 제조 업체의 지침에 따라 mirVana 키트를 사용하여 격리됩니다.
- 신중하게 뜨는 버리고 드라이 아이스에 대한 세포 알약을 얼려 단계 1.9 또는 microglia 및 소형 원심 분리기의 5~7분 위해 5400 RPM에서 1.7-ML Eppendorf 튜브의 단계 3.3에서 macrophages의 정렬된 집합에서 정상 CNS에서 microglia를 봐. 4.2 단계거나 2~3개월 동안 저장할 수 -70 C에 냉동 세포 알약을 전송할 진행합니다.
- 해동을 위해 정기적으로 얼음으로 냉동 세포 알약을 전송합니다. mirVana Kit의 용해 완충액 300 μl을 넣고 부드럽게 5-7 회 pipeting하여 섞는다.
- , 섞어 10 분 동안 얼음이 계속 mirVana 키트, 와동 삼십초에서 Homogenate 첨가물의 30 μl를 추가하십시오
- 5m 위해 mirVana 키트, 와동 30 초입니다, 스핀에서 클로로포름 : 산성 - Pehnol 300 μl 추가작은 원심 분리기에서 10,000 RPM의 인치
- 조심스럽게 위 수성 위상 (300 μl)을 타고 또 다른 1.7 ML Eppendorf 튜브, 100 % 에탄올을 375 μl와 혼합으로 전송, 10,000 RPM에서 1 분 동안 mirVana 키트와 스핀에서 카트리지를 필터링할 전송합니다.
- 삭제 흐름을 통해 버퍼 워시 솔루션 mirVana 키트부터 내가하고, 10,000 RPM 1 분 스핀 700 μl를 추가합니다.
- mirVana 키트의 워시 솔루션 II 500 μl으로 두 번 이상 씻어 마침내 미리 온수 nuclease 프리 물을 60 μl와 카트리지로부터 RNA를 elute.
- RNA의 양과 품질 Nanodrop 분광 광도계를 사용하여 평가된다. RNA의 농도는 5 ~ 20 NG / ML 및 OD λ260 / 범위 1.7-2.0 이내 λ280 비율로 있어야합니다. RNA의 농도가 NG / ML 및 OD 260λ/280λ 1.6보다 낮은 3보다 낮으면 샘플이 삭제됩니다. RNA 샘플은 6-12 개월 -70 ° C에 저장할 수 있습니다.
- RNA, 샘플 AR의 품질에 대한 평가를 위해전자는 15 % TBE-우레아 젤 (생명 기술)에 겔 전기 영동을 사용하여 분석했다. RNA의 준비 좋고 나쁜 품질의 전형적인 예는 그림에 표시됩니다. 각각 3A와 Fig.3b.
5. Microglia 및 Macrophages에 miRNA의 탐지
miRNA의 표현의 분석을 위해 실시간으로 양적 반전 transcriptase PCR (qRT-PCR)이 분석은 primers와 형광 프로브 관심있는 특정 microRNA과 ubiquitously 표현 짧은 RNAs 중 하나 (예 : snoRNA-55, snoRNA로 TaqMan의 assays를 사용하여 수행됩니다 정규화에 대한 -135 또는 U6). 인간 또는 마우스 miRNA의 특정 세트에 대한 Primers 및 형광 프로브는 여기에서 우리는 정상화를위한 예제와 같은 관심과 snoRNA-55의 miRNA를위한 예제로 미르-124을 사용합니다 생명 기술 주식 회사에서 구입하실 수 있습니다.
- TaqMan 역방향 전송 키트를 사용하여 RNA 샘플로부터 cDNA 만들 transcriptase 반응을 반대로 수행 :
| 아이템 | 샘플 당 볼륨 (μl) |
| 5 배 RT의 프라이머 | 1.00 |
| RNA 샘플 | 1.67 |
| RT 효소 믹스 | |
| 25 MM 각 (100 밀리미터 총) dNTPs에게 | 0.050 |
| 역방향 Transcriptase를 MultiScribe) | 0.333 |
| 10X RT 버퍼 | 0.500 |
| AB RNase 억제제 | 0.063 |
| Nuclease없는 물 | 1.388 |
| 합계 | 5.00 |
농도 3 NG / μl로 샘플을 RNA 희석. RT 효소 믹스를 준비하고 PCR 튜브에 3.33 μL를 넣어 RNA 샘플의 1.67 μl를 추가합니다. 16 ° C에서 PCR 악기 (BioRad)에 품어30 분, 42 ° C에서 30 분, 85 ° C에서 5 분, 그리고 ° C에 보관중인 4에 설정을위한입니다.
- TaqMan PCR 믹스를 사용하여 실시간 PCR 반응을 수행합니다 :
| 아이템 | 샘플 당 볼륨 (μl) |
| RT 제품 | 1.0 |
| 2X TaqMan 마스터 믹스 | 5.0 |
| 5 배 프로브 | 2.0 |
| Nuclease없는 물 | 2.0 |
| 합계 | 10.0 |
각각의 반응과 실시간 PCR 기기 AB 7900 HT를위한 384도 투명 광학 반응 플레이트 (생명 기술)를 사용합니다. 사이클링 조건 : 95 ° C에서 10 분, 용, [95 ° C 5 초, 60 ° 60 초위한 C] X 40주기.
- fluo의 금액에 대한 일반적인 곡선rescently microglia 및 골수 파생 macrophages (BMDMs) 대주기의 수 (x-축)에서 고립 RNA 샘플 (각 예제는 중복입니다)에 대한 snoRNA-55 호-124에 대한 특정 PCR 제품 (Y-축)하고 분류 그림. 4A, B.
6. 정규화 및 데이터 분석
관심 miRNA (미르-124)에 대한 상대적인 표현 수위는 이전에 RNA의 초기 금액의 정상화를 위해 snoRNA-55을 사용하여 7,9에 설명된대로 ΔΔCT 방법을 사용하여 계산됩니다.
- microglia 및 BMDMs 용 미르 - 124 표현의 상대적인 수준의 계산의 예제는 표 봐도로 표시됩니다.
- 첫 번째 단계로 snoRNA-55 호-124에 대한 CT 값은 qRT-PCR 커브에서 microglia 및 BMDMs위한 결정됩니다 (Fig.4, 표 전, 컬럼 : snoRNA-55 호 - 124).
- 두 번째 단계로서, ΔCt는 값미르-124 (실험) (CT (규격), CT (특급) 및 ΔCt 표 전, 열)에 대한 CT에서 snoRNA-55 (정상화)에 대한 CT의 뺄셈하여 각 시료의 각 사본에 대해 계산됩니다.
- 세 번째 단계로서. ΔΔCt 값은 다른 샘플 (ΔΔCt 표 전, 열)의 ΔCt 값에서 기준 시료의 ΔCt의 뺄셈 (ΔCt (심판))에 의해 계산됩니다. 하나의 샘플을 참조로 정의되며이 샘플에 대한 miRNA 표현의 상대적 수준은 1.0으로 정의됩니다. 다른 모든 샘플이 레퍼런스 샘플과 비교됩니다. 우리의 경우에, 우리는 1.0로 microglia에 대한 첫 번째 예제에서 미르-124의 수준을 정의 그러므로 ΔCt (심판) = 0.49 (빨간색으로 표시된 표 전, 첫 번째 행).
- 미르-124 E : 마지막으로, 표현의 상대적 수준은 2-ΔΔCt (표 전, 칼럼으로 계산됩니다xpression).
- 모든 qRT-PCRs이 triplicates 또는 중복 수행되며, 표현의 상대적 수준이 평균으로 제공됩니다 ± (그림의 5A, B) triplicates 또는 그림과 같이 나란히 두 중복 사이드 같은 표준 편차 (SD). 5c.
7. 대표 결과
실시간 PCR 및 중부 표준시 값 미르-124 용 (관심 microRNA)와 snoRNA-55 (정상화)뿐 아니라 미르-124의 표현의 상대적 수준에 대한 일반적인 곡선은 그림에 표시됩니다. 4와 표 전합니다. 우리 실험에서는 정상화를위한 컨트롤로 snoRNA-55를 사용했습니다. 우리가 위에서 언급한 바와 같이, 다른 유비 쿼터스 RNAs은 또 snoRNA-135와 U6 등 정상화를 위해 사용될 수 있습니다.
성인 microglia 대 뼈 - 골수 파생 macrophages (BMDMs)에서 미르-124의 표현의 예제는 그림에 표시됩니다. 5A는 (BMDMs는 presenc 재배되었다M-CSF의 전자처럼) 7 설명했다. 그림에서. 5B, 우리는 CD45 낮은 microglia 대 CD45 안녕하세요 macrophages의 정렬 인구의 미르-124의 표현을 비교했다. 이러한 실험 모두에서 우리는 microglia가 미르-124보다 높은 수준의 표현을 다른 macrophages과 다른 것을 보여주었다. 비슷한 실험은 생체내 또는 체외에서 microglia 활성화의 동력학을 위해 미래에 수행할 수 있습니다.
개발의 다른 단계에 C57BL의 CNS / 6 생쥐에서 고립 microglia의 미르-124은 표현이 그림에 표시됩니다. 5c. 이 데이터는 활성화된 표현형 7 상호 낮은 개발 특급 호-124 수준의 초기 단계에 해당 microglia를 보여줍니다. 소뇌, S : 비슷한 분석은 이러한 CNS의 다른 지역에서 고립 microglia에서 특정 miRNAs의 표현의 비교 등 정상 CNS에서 microglia의 기능을 연구하기 위해 수행할 수pinal 코드, 해마 등
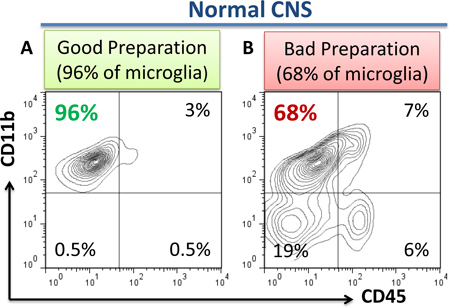
1 그림. 유동세포계측법 결정으로 microglia의 좋고 나쁜 준비의 예입니다. 정상 CNS에서 microglia의 "좋은"고립의 경우 세포의 95~98%은 CD11b 후 2-5 %의 CD11b + CD45 낮은 microgla을 대표 + CD45 하이 perivascular의 macrophages. CD11b의 1 % 미만 - CD45 안녕하세요 lymphocytes 또는 CD11b - CD45 - astroglial 또는 oligodendroglial 셀 또는 셀 조각 ()가 있어야합니다. CD45 - - 세포가 부족 Percoll 기울기 분리를 제안 (B, 왼쪽 하단 사분면) 존재하는 "나쁜"준비의 경우는 (b)는 CD11b 오염의 18 %는 어디에 여기에 표시됩니다. 좋은 준비의 경우 세포의 95-98%은 CD11b + CD45을 표현한다낮은 microglia는 (a, 사분), 모든 셀을 후 2-5 %가 CD11b + CD45 하이 perivascular macrophages를 (, 오른쪽 상단 분면) 대표한다, 모든 세포의 1 % 미만은 CD11b 부정적인 오염 세포 (대표한다 ) 왼쪽 4 분면을 낮출. "나쁜 준비"의 경우, CD11b의 상당 오염 - CD45 - 세포 또는 세포 조각 (astroglia, myelin 입자 등) RNA 격리와 더욱 적합 세포의 준비를하게하는, (B, 왼쪽 하단 사분면) 존재 분석. 또한, CD11b - CD45 하이 전지 부족 재관류에 의한 혈액 lymphocytes에 의한 오염을 나타내는 (B, 오른쪽 아래 사분면)도 "나쁜 준비"의 경우에 존재할 수 있습니다.
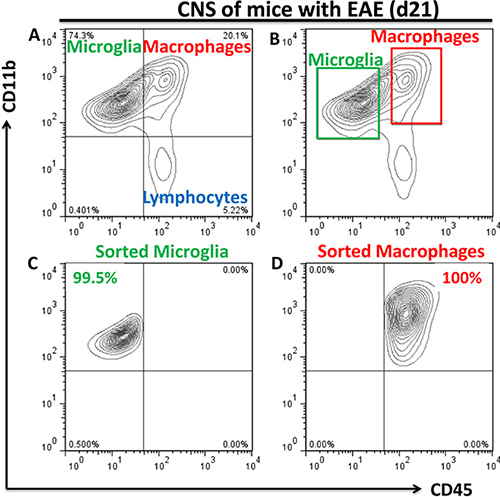
그림 2. 흐름 cytometry analysis와 병에 걸린 CNS에서 microglia 및 주변 macrophages의 인구로 분류 () neuroinflammation 동안 세포의 세 인구가 CNS에 존재한다 : CD11b + CD45 낮은 (microglia), CD11b + CD45 님 (macrophages) 및 CD11b - CD45. 등 각각 왼쪽 상단, 오른쪽 상단과 오른쪽 하단에 표시된 quadrants 님 (lymphocytes). CD11b + CD45 낮은 microglia 및 CD11b의 인구로 분류를위한 게이츠가 + CD45 안녕하세요 macrophages는 (B)와 reanalyzed 정렬 인구의 purities는 (C, D)에 표시된 표시됩니다. FSC / SSC 매개 변수를 기반으로 실행 가능한 세포에 대한 예비 게이팅이 구현되었습니다.
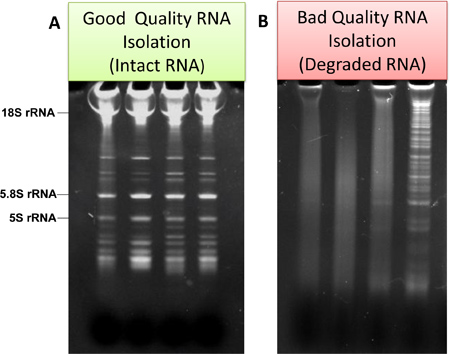
그림 3. "좋은"과 "나쁜"qualit의 예microglia로부터 격리되고 겔 전기 영동하여 분석 RNAs의 이거야 있습니다. 양질의 경우에는 RNA 사다리 및 ribosomal RNA는 (a) 분명하다. 나쁜 품질, 비방, 낮은 분자량 저하 제품의 경우 뚜렷하지 (B)가 있습니다.
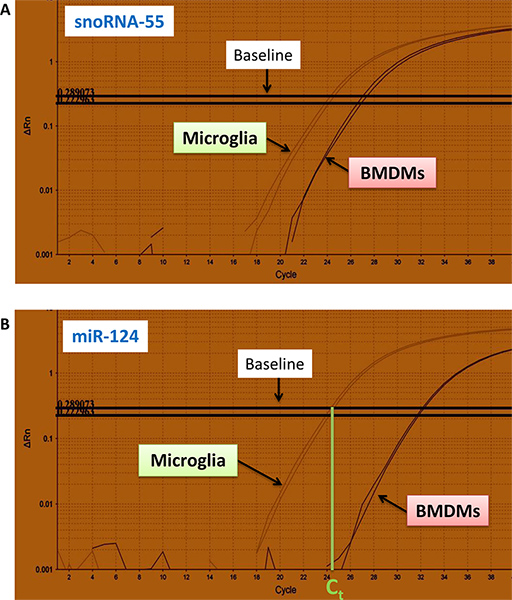
4 그림. 를위한 실시간 qRT-PCR 커브 fluorescently 미르-124 및 snoRNA-55 PCR 제품 라벨. snoRNA-55 (a)와 미르-124 (B)의 곡선이 microglia과 뼈 - 골수 파생 macrophages (BMDMs)에 표시됩니다. 실험은 중복으로 수행되었다. (나)와 같이 CT 값이 qRT-PCR의 선형 범위의 하단 부분과 기준선의 교차에 의해 결정하는 것은 곡선이고. 큰 그림을 보려면 여기를 누르십시오 .
| snoRNA-55 | 미르-124 | DCT = CT (특급) - CT (규격) | DDCt = DCT-DCT (참조) | 표현의 상대 레벨 = 2-DDCt | |
| CT (규격) | CT (특급) | DCT | DDCt | 미르 - 124 표현 | |
| 정상 CNS에서 Microglia | 24.082 | 24.572 | 0.49 (심판) | 0 | 1.0 |
| 23.766 | 24.291 | 0.525 | 0.035 | 1.02 | |
| 뼈 - 골수 파생 macrophages (BMDMs) | 26.879 | 320.231 | 5.352 | 5.317 | 0.025 |
| 26.526 | 32.078 | 5.552 | 5.517 | 0.022 |
미르-124 (관심 microRNA)와 snoRNA-55 (정상화를위한 제어)에 대한 C t 값을 기반 microglia 대 골수 파생 macrophages의 미르-124 표현의 상대적인 수준의 표 I. 계산.
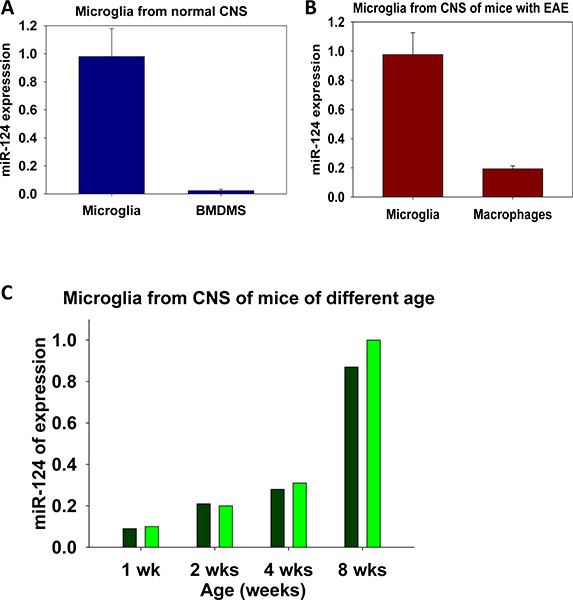
그림 5. microglia와 macrophages의 미르-124 표현의 분석. 정상 CNS 대 골수 파생 macrophages (BMDMs)에서 microglia의 미르-124 표현의 비교는 ()에 표시됩니다. microglia 대 neuroinflammation와 생쥐에의 CNS 격리 주변 macrophages의 미르-124의 비교는 (B)로 표시됩니다. 추이성인 쥐 (8 주 이전에)에 비해 이전 1, 2, 4 주 생쥐에서 개발 중에 microglia의 미르-124의 표현의 수준 (C)로 표시됩니다. (가, 나) 실험이 의미와 세중의로 진행되었다 ± 별도의 세 가지 PCR 반응의 SD에서 표시됩니다.에서 지시로 (C) 실험을 중복으로 수행되었다.
토론
최근에는 상당한 관심이 microglia 및 neuroinflammation 및 neurodegeneration와 관련된 많은 pathologies에서 이러한 세포의 관여로 주어졌다. 또한, 면역과 암 세포의 분화에 microRNAs의 역할이 극적으로 지난 몇 년 5,10 이상 성장했습니다. 우리는 이전에 정상 CNS 7 microglia의 비 활성 또는 휴식 표현형의 유지에 미르-124의 역할을보고했지만 microglia의 표현형 및 활성화 상태에있는 microRNAs의 다른 종...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
작품은 NIH R01 NS071039-01A1 연구 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 1X PBS | GIBCO | 14,190 | 7.2-7.4 : 실험실, 산도에서 건조 구성 요소에서 준비할 수 |
| 10X PBS | 써모 과학 | SH30258.02 | 7.2-7.4 : 실험실, 산도에서 건조 구성 요소에서 준비할 수 |
| DMEM, FBS | GBCO | 11,965, 10,438 | |
| miRVana 키트 | Invitrogen | AM1561 | |
| Percoll | 시그마 | P4937-500 ML | 100 % Percoll 100 ML은 10X PBS의 10 ML과 시그마에서 Percoll의 90 ML을 혼합하여 준비가되어 있습니다. 70 % Percoll의 50 ML입니다100 % Percoll 35 ML로 혼합하여 준비과 DMEM의 15 ML 40 % Percoll의 50 ML는 혼합 100 % Percoll 20 ML 및 1X PBS의 30 ML에 의해 준비가되어 있습니다 |
| 35-55 펩타이드를 집고 양이 | AnaSpec INC | 60130-5 | |
| CFA | DIFCO | 263,810 | |
| 백일해 독소 | 시그마 | P7208 | |
| FcR는 항체를 차단 | BD Biosciences | 553,142 | 클론 2.4G2 |
| 안티 CD11b - 체육 mAb | BD Biosciences | 553,311 | 다른 fluorophores (예 : AF488)와 함께 사용할 수 있습니다 |
| 안티 CD45-APC-Cy7의 mABs | Biolegend | 103,116 | 다른 fluorophores (예 : APC)와 함께 사용할 수 있습니다 |
| Paraformaldehyde (16 %) | EMS INC | 15,710 | 1X PBS에서 1시 15분를 희석 |
| 15% TBE-우레아 젤 | 생명 기술 주식 회사 | EC68855BOX | |
| TaqMan의 MicroRNA 역방향 전송 키트 | 생명 기술 INC | 4,366,596 | |
| TaqMan 범용 PCR 마스터 믹스 | 생명 기술 INC | 4,304,437 | |
| TaqMan의 MicroRNA의 Assays MMU - 미르-124a | 생명 기술 INC | 4,427,975 ID 001182 | |
| TaqMan의 MicroRNA의 Assays snoRNA-55 | 생명 기술 INC | 4,427,975 ID 001228 | |
| Nuclease없는 물 | 생명 기술 INC | AM9937 | Nuclease없는 물 |
| 384도 투명 광학 반응 플레이트 | 생명 기술 주식 회사 | 4,309,849 | 다른 실시간 PCR 장비에서 다른 접시 (예 : 96도 강판)로 대체 수 |
| 다운스 호모 지 나이저 (15 ML) | Wheaton의 과학 제품. | 358,044 | 테플론 / 유리 |
| 40 μ 나일론 셀 스트레이너 | 매 | 352,340 | |
| 커다란 원심 분리기 | Sorval | RT 6000B | 로터 직경 18.5 cm |
| 소형 원심 분리기 | Eppendorf | 5415 R | 로터 직경 6.5 cm |
| 실시간 PCR 기기 | 생명 기술 주식 회사 | AB 7900 HT | 다른 장비로 대체 수 |
| 흐름 cytometer | BD Biosciencess | LSR II | 다른 장비로 대체 수 |
| FACS | BD Biosciences | FACSAria | 다른 장비로 대체 수 |
| Nanodrop 분광 광도계 | 써모 과학 | Nanodrop 1000 |
참고문헌
- Tremblay, M. E. The Role of Microglia in the Healthy Brain. J. Neurosci. 31, 16064-16069 (2011).
- Graeber, M. B., Li, W., Rodriguez, M. L. Role of microglia in CNS inflammation. FEBS Lett. , (2011).
- Ponomarev, E. D., Shriver, L. P., Maresz, K., Dittel, B. N. Microglial cell activation and proliferation precedes the onset of CNS autoimmunity. J. Neurosci. Res. 81, 374-389 (2005).
- Perruisseau-Carrier, C., Jurga, M., Forraz, N., McGuckin, C. P. miRNAs stem cell reprogramming for neuronal induction and differentiation. Mol. Neurobiol. 43, 215-227 (2011).
- McCoy, C. E. The role of miRNAs in cytokine signaling. Front Biosci. 17, 2161-2171 (2010).
- He, M., Xu, Z., Ding, T., Kuang, D. M., Zheng, L. MicroRNA-155 regulates inflammatory cytokine production in tumor-associated macrophages via targeting C/EBPbeta. Cell Mol. Immunol. 6, 343-352 (2009).
- Ponomarev, E. D., Veremeyko, T., Barteneva, N., Krichevsky, A. M., Weiner, H. L. MicroRNA-124 promotes microglia quiescence and suppresses EAE by deactivating macrophages via the C/EBP-alpha-PU.1 pathway. Nat. Med. 17, 64-70 (2011).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of Specific Cell Population by Fluorescence Activated Cell Sorting (FACS). J. Vis. Exp. (41), e1546-3791 (2010).
- Gabriely, G. MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators. Mol. Cell Biol. 28, 5369-5380 (2008).
- Caffarelli, E., Filetici, P. Epigenetic regulation in cancer development. Front Biosci. 17, 2682-2694 (2011).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1, 1947-1951 (2006).
- Gordon, R. A simple magnetic separation method for high-yield isolation of pure primary microglia. J. Neurosci. Methods. 194, 287-296 (2011).
- Moltzahn, F., Hunkapiller, N., Mir, A. A., Imbar, T., Blelloch, R. High Throughput MicroRNA Profiling: Optimized Multiplex qRT-PCR at Nanoliter Scale on the Fluidigm Dynamic ArrayTM IFCs. J. Vis. Exp. (54), e2552 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유