Method Article
플라스미드 벡터를 생성 깁슨 어셈블리를 사용하여 인간의 신장 요인-1α의 발기인의 규정에 따라 FLAG-태그 단백질을 표현
요약
Synthesis of custom plasmids is labor and time consuming. This protocol describes the use of Gibson assembly cloning to reduce the work and duration of custom DNA cloning procedure. The protocol described also produces reliable tagged protein constructs for mammalian expression at similar cost to the traditional cut-and-paste DNA cloning.
초록
깁슨 어셈블리 (GA) 복제는 기존의 DNA 복제 방법에 신속하고 안정적이며 유연한 대안을 제공합니다. 우리는 마우스 배아 줄기 세포에 외래 유전자 (mESCs)의 발현을위한 맞춤형 플라스미드를 만들 GA를 사용했다. SV40 인간 거대 세포 바이러스 프로모터의 통제하에 외래 유전자의 발현은 mESCs에 형질 전환 후 빠르게 감소한다. 이 감소 된 발현을위한 해결책은 유전자 발현을 구동하도록 인간 신장 인자 1 알파 (hEF1α) 프로모터를 사용하는 것이다. hEF1α를 포함하는 플라스미드 벡터는 SV40- 또는 CMV-포함하는 플라스미드, 특히도 포함 N- 말단 3xFLAG-태그 널리 사용할 수 없습니다. 여기에 설명 된 프로토콜은 hEF1α 프로모터의 표현력 규제에서 FLAG-태그 인 CstF-64 인 CstF-64 돌연변이 체를 발현하는 플라스미드를 제작하는 빠른 방법이다. GA 가능한 DNA 단편의 말단을 겹치는 클로닝을 할 DNA의 엑소 뉴 클레아 제, DNA 폴리머 라제 및 DNA 리가 아제를 사용하여 혼합.우리가 가능했다 템플리트 DNA를 바탕으로, 우리는 우리의 구조는 하나의 시퀀스로 조립 될 수 있도록 설계. 우리의 디자인은 네 개의 DNA 조각 사용 : pcDNA 벡터 3.1 벡터 백본, hEF1α 프로모터 1 부 (이중 가닥 합성 DNA 단편을 구입 3xFLAG 태그를 포함) 및 중 하나 인 CstF-64 또는 특정 인 CstF-64 돌연변이 hEF1α 프로모터 2 부. 이 단편의 서열은 DNA 단편을 생성하기위한 적절한 PCR 프라이머를 설계하기 프라이머 생성 도구에 업로드 하였다. PCR 후, DNA 단편을 선택 마커 및 복제 GA 반응을 포함하는 벡터가 조립 된 혼합 하였다. 개별 변형 박테리아 식민지에서 플라스미드를 분리 하였다. 플라스미드의 초기 화면은 순서 다음에, 제한 효소에 의해 수행되었다. 결론적으로, GA은 우리가 화면 및 검증을 구성 포함 5 일에서 유전자 발현을위한 맞춤형 플라스미드를 만들 수있었습니다.
서문
통상적 인 DNA 클로닝 절차 함께 DNA 단편 가입 DNA 및 DNA 리가 아제를 절단하는 제한 효소의 사용에 의존한다. 다른 DNA 단편을 포함하는 발현 정의 구조는 하나의 생성 및 / 또는 다수의 제한 엔도 뉴 클레아 및 라이 게이션을 통해 DNA 단편의 후속 삽입에 DNA의 절단을 포함하는 순차적 인 절차이다. 이 절차의 주요 단점은 불가 관심 전장 단백질의 성공적인 DNA 클로닝 렌더링 (즉, 여러 절단 부위가있을 수) DNA 단편의 하나에 대한 적당한 제한 효소를 식별하기 어려울 수도 있다는 것이다. 따라서, 사용자 정의 표현의 생성을 사용자 정의 단백질 태그 효율적으로 세포의 종류 - 특이 적 프로모터의 전사 조절하에 구축은 매우 세심한 설계가 필요합니다. 또한 시간과 노동력이 소요되는 기술이다. 최근 여러 보고서 multip를 조립하는 방법을 설명제한없이 사용할 1 또는 2 단계 반응의 어느 하나를 동시에 연속 시퀀스 르 다른 합성 DNA 단편 1-3 효소. 클로닝 한 단계 반응 (모든 준비 작업 단계가 제외), 엑소 뉴 클레아 제의 DNA, DNA 중합 효소, DNA 리가 제 3 및 DNA 단편의 중첩 단부 (도 1)의 블렌드의 사용에 의존한다. 제한 효소의 사용은 전혀 존재하지 않기 때문에, 임의의 크기 및 (고도로 반복적 서열 제외) 시퀀스 조성물의 DNA 단편 원활한 구조에 융합 될 수있다. 최근 상용 키트 (깁슨 어셈블리; GA) 한 단계 복제 반응에 대한이 가능하게되었다. 이 키트는 사용자 정의 발기인 및 단백질 태그와 하나의 벡터의 모든 DNA 조각의 신속하고 비용 효율적으로 조립을 할 수 있습니다.
포유 동물 세포 배양 모델에서 외래 단백질을 발현하는 데 널리 사용되는 플라스미드 발현 벡터는 전사 레지 하에서 종종바이러스 성 거대 세포 바이러스 (CMV) 또는 유인원 바이러스 40 (SV40) 발기인의 위험률. 이러한 바이러스 성 프로모터는 포유 동물 세포 배양 계 대부분 모델에서 외인성 단백질의 강력한 일시적 발현을 제공한다. 그러나, 외래 단백질을 안정하게 발현하는 세포주의 생성으로 인해 확립 처리 4,5 중에 CMV 또는 SV40 프로모터의 전사의 침묵 종종 실패. 또한, SV40 프로모터 및 CMV 바이러스 충분히 림프 혈통 또는 배아 줄기 세포로부터의 세포에서 -6,7- 외인성 단백질의 발현을 촉진하지 않을 것이다. 바이러스 성 프로모터의 본질적인 제한에 대한 해결책은 강한 구성 적 프로모터 비 바이러스 8-10를 사용하는 것이다. 인간의 기원 중 하나는 잘 특성화 구조적으로 강하게 비 바이러스 성 프로모터 (hEF1α 리보솜 11 아미노 아실 tRNA에의 GTP 의존 관계의 촉매 작용에 관여) 신장 인자 1α (hEF1α) 프로모터이다. 그러나,hEF1α 프로모터를 함유하는 발현 벡터가 특히 것들 또한 관심 단백질의 아미노 말단 단부에서 3 × FLAG를 함유하는 플라스미드를 포함하는 바이러스 성 촉진제로서 널리 사용할 수 없습니다.
64,000 MW 절단 자극 인자 단백질 (인 CstF-64)는 복제 의존 히스톤의 mRNA 14,15 12,13 mRNA를 포함한 대부분의 3 '말단 처리에 관여한다. 인 CstF-64은 모든 신체 조직 (12)로 표현된다. 그 RNA 인식 모티브 절단 및 폴리아 데 닐화 사이트 (16)의 하류 초기 성적에 GU 풍부한 RNA 서열에 결합한다. 인 CstF-64 미리의 mRNA에 결합이 초기 성적 증명서를 효율적으로 endonucleolytic 분열을 촉진한다.
여기서, 프로토콜은 DNA 단편의 PCR 증폭을 사용하는 것이 기재되어있다 (화학적 유능한 박테리아 세포를 포함) 깁슨 어셈블리 클로닝 키트 3xFLAG 태깅 m 벡터의 정의를 생성하는 단계여러개 인 CstF-64 또는 돌연변이 인 CstF-64 hEF1α 프로모터 1의 발현에 따라 자신의 아미노 말단에.
프로토콜
중복 프라이머의 실리 플라스미드의 설계 및 생성 1.
주 :이 단계의 목적은 구조의 완전한 뉴클레오타이드 서열을 조립하고 프라이머 GA 클로닝 단부를 겹치는 단편을 생성하기 위해 사용되는 설계하는 것이다.
- 최종 플라스미드를 나타내는 연속 염기 서열을 디자인합니다.
- 구하거나 PCR의 템플릿으로 사용되는 실제 플라스미드 및 DNA 조각을 나열합니다.
참고 : 쉽게 사용할 수없는 DNA 조각 - 같은 태그와 발기인의 서로 다른 조합으로 - 단일 또는 다중 합성 이중 가닥 DNA 조각 (SDNA)으로 주문할 수 있습니다. 이러한 단편은 비교적 낮은 비용으로 시판되고 길이 2킬로바이트 (자재 표 참조)까지 일 수있다. - PCR에 적합한 DNA 조각으로 단계 1.1 조립 구조의 연속적인 염기 서열을 나눈다. Confir단편 가능한 플라스미드 및 SDNA 단편 일치 m. DNA는 NT (200)보다 작은 단편하지 마십시오.
- 프라이머 생성 도구에 액세스 (장비의 표 참조). "설정 환경 설정"메뉴를 선택합니다. "변경 깁슨 총회 설정"팝업 창에서 "변경 환경 설정"탭을 클릭하여 적절한 설정을 선택합니다.
주 : 프라이머 디자인은 프라이머 생성 도구를 사용하지 않고 수행 될 수있다. 그러나, 프라이머 생성 도구의 사용은 공정을 단순화한다. - "구조를 구축"메뉴를 선택하여 구조를 구축 시작합니다. 마지막 '3'5에서 프라이머 생성 도구 순차적으로 분할 DNA 조각을 삽입합니다.
주 : 플라스미드 골격으로 사용 된 DNA 단편은 편리 두 부분으로 나눌 수있다. 최종 PCR 제품의 마지막 조각의 끝 5 '이 첫 번째 단편과 3의 끝'은 하나의 연속 DN에서 서로 연결되어벡터 백본을 나타내는 조각입니다. - "벡터 또는 삽입 단편 입력"팝업 창에 FASTA 포맷 벡터 DNA (염기 서열의 텍스트 기반 표현)의 5 '말단을 나타내는 최초의 DNA 단편을 붙여. DNA 단편의 이름을 지정합니다. 어느 PCR, 또는 RE 다이제스트 합성법, DNA 단편을 수득 할 수있는 적절한 방법을 선택한다. "계속"탭을 클릭합니다.
- "어셈블리에 삽입 조각 추가"창에 제공된 "빨리 감기 또는 계 프라이머 스페이서"공백을 최종 구조의 교차점에 추가 뉴클레오티드 / 제한 사이트를 추가 할 필요가있는 경우. 두 조각에 단 하나의 DNA 단편이 아닌 기타의 뉴클레오티드 / 제한 사이트를 추가합니다. "DONE"탭을 클릭합니다.
- 구조가 완료 될 때까지 모든 조각을 반복합니다. "보기 프라이머"메뉴를 선택하고 프라이머 시퀀스를 검토합니다.
- (b 벡터의 모든 구조에 대해 반복ackbones 및 삽입), 또는 다른 DNA 단편합니다.
핫 스타트 교정 DNA 중합 효소를 사용하여 PCR에 의한 DNA 조각 2. 증폭 (배 마스터 믹스)
주 :이 단계까지의 목적은 PCR을 사용하여 조립 반응을위한 충분한 DNA를 얻는 것이다.
- 탈염 제품으로 이전 단계에서와 가능한 가장 작은 규모로 설계된 PCR 프라이머를 구입. 물이나 TE 10 μM (10 mM 트리스 - 염산, pH가 7.9, 1 mM의 EDTA)에 희석.
- SDNA 조각으로 쉽게 사용할 수없는 DNA 조각을 구입합니다.
- 물에 1 NG / μL로 PCR을 템플릿으로 사용되는 SDNA 조각을 포함한 모든 DNA 조각을, 희석.
- 실온에서 PCR 반응을 조립한다. 간단히, 프라이머 쌍의 각각의 프라이머 템플릿 DNA 단편, 1 μL (1 NG에서 / μL 원액), 25 μ의 (10 μM 원액에서) 2.5 μl를 사용뜨거운 시작 교정 DNA 중합 효소의 리터 19 μL 물 (; 2 배 마스터 믹스 DNA 폴 포트는 재료의 표 참조). 부드러운 긋기에 의해 튜브를 혼합하고 간단한 원심 분리하여 액체 방울을 수집합니다.
- DNA 폴 포트의 권장 사항에 따라 비슷한 크기의 별도의 튜브 DNA 단편을 동시에 증폭. 28 PCR 사이클 또는 충분한 DNA 수율을 생산주기의 수를 결정 - (25)을 수행합니다.
- 에 티듐 브로마이드 (0.2 ㎍ / ml의 최종 농도)로 염색 표준 아가 로즈 겔 전기 영동에 PCR 반응 부피로 (5 μL)의 10 %를 실행. PCR 제품을 나타내는 하나의 DNA 밴드를 볼 수 있는지 확인합니다. DNA 분자량 표준을 사용하여 DNA 단편의 크기와 상대적인 양을 확인. 필요한 경우, DNA 단편의 충분한 양을 획득하기 위해 PCR을 반복한다.
PCR 제품의 3 DpnI 소화
참고 :이 단계의 목적은 dige하는 것입니다댐 + 균주에서 성장 DNA 플라스미드가 발생할 때, 이러한 메틸화 된 경우에만 DpnI 플라스미드 DNA를 소화한다 항에서의 PCR에서 잔존 성 플라스미드 DNA 주형. 플라스미드 DNA는 GA 반응에서 DNA 단편으로 사용될 경우, 따라서 DpnI로 처리하지 않는다.
- 1 시간 동안 37 ℃에서 인큐베이션 2 항에서 제조 한 PCR 산물의 45 μL에 DpnI 제한 효소 2㎕의 추가. 필요할 때까지 -20 ° C에서 4 절 또는 동결을 진행합니다.
DNA 정제 자석 구슬 이상 4. 정제 및 DNA 파편의 농도
주 :이 단계의 목적은 정화 및 제 2 조 및 제 3의 다른 PCR 정제 방법에서 얻어진 PCR 산물이 또한 사용될 수있다 집중한다.
- 실온 DNA 정제 자성 비드 평형화. 간단한 와동에 의해 구슬을 다시 일시 중지합니다.
- PCR들에게 사전 소화 위스콘신로 이동1.5 ml의 튜브에 일 DpnI 및 각 튜브에 DNA 정화 자석 구슬의 81 μl를 추가합니다. 10 분 동안 실온에서 혼합물을 인큐베이션.
- 약 2 분 동안 자기 집에 튜브를 놓습니다. 피펫을 사용하여 투명한 액체를 폐기하십시오. 30 초 동안 80 % 에탄올 200 μL로 두 번 세척 하였다.
- 펠렛을 건조하도록 허용합니다. 자기 집에 위치 튜브, 열린 관의 뚜껑을 유지합니다.
- 다시 일시 중지 10 mM 트리스 - 염산, 산도 8.0의 10 μL에있는 말린 구슬. 2 분 동안 실온에서 배양한다. 튜브의 바닥에 액체를 수집하기 위해 간단히 스핀.
- 2 분 동안 자기 집에 튜브를 배치합니다. 맑은 용액 10 μL와 새로운 사전 레이블 튜브에 배치 - 8.5를 제거합니다. UV 분광법에 의해 DNA 단편의 농도를 결정 (시설의 표 참조).
E.의 제품 5. 조립 복제 반응 및 변환 대장균
참고 : 삽입 : 1 비율 : 벡터 및 조립 반응을 수행하는이 단계의 목표는 3을 계산하는 것입니다.
- 선택성 마커를 운반하는 벡터 골격 또는 DNA 단편을 나타내는 DNA 단편 중 적어도 100ng의 사용. 인서트로 사용할 DNA 단편에 대한 3 배 몰 과량을 계산한다.
- 각각의 특정 인서트 필요 NG에 몰 - 과잉을 변환합니다.
주 : 계산을 할 수있는 편리한 방법 (장비의 표 참조) 웹 기반 응용 프로그램을 사용하는 것입니다. - , PCR 튜브에 DNA 단편의 계산 된 양을 섞어 10 μL에 볼륨을 조정한다. GA 마스터 믹스 10 μl를 추가 (2 배, 재료의 표 참조). 6 단편 또는 열 순환기 PCR 2-3 단편의 조립을위한 15 분 - (4)의 조립을 위해 1 시간 동안 50 ℃에서 반응을 인큐베이션.
- 유능한 E.에서 조립 제품의 변환을 진행합니다 대장균은 -20에서 제품을 동결 또는° C가 필요할 때까지.
- 화학 물질 또는 전기 유능한 세포를 함께 제공되는 변환 절차를 따르십시오. 일반적으로, 변환 반응에 따라 조립 반응의 2 μl를 사용합니다.
- 변환이 완료되면, 적절한 선택적 항생제가 보충 된 아가 플레이트 상에 형질 전환 세포를 확산.
6. 플라스미드 분리, 제한 효소 분해 및 시퀀싱
주 :이 단계의 목적은 E.로부터 플라스미드 DNA를 분리하는 것이다 대장균은 다음 제한 소화 및 시퀀싱에 의해 구조를 확인합니다.
- 미니 최상의 상태로 준비 플라스미드 격리를위한 여러 단일 콜로니를 전파합니다. 사용 2-5 ml의 하룻밤 LB 액체 문화는 적절한 항생제로 보충. 사용되는 미니 프렙 키트에서 설명하는 절차에 따라 상응하는 플라스미드를 분리.
- 분광을 이용하여 획득 양과 플라스미드 농도를 결정광도계.
- 하나 또는 여러 제한 엔도 뉴 클레아 정제 된 플라스미드 ~ 0.5 μg의에로 제한 효소를 수행합니다. DNA 구조에 대한 소화 특성의 고유 패턴을 제공 제한 효소를 사용합니다.
- 특정 또는 표준 프라이머를 이용하여 DNA 염기 서열에 의한 DNA 복제의 성공을 확인합니다. 정확성을 위해 시퀀싱 데이터를 분석 할 수 있습니다.
결과
따랐다 프로토콜의 흐름은도 2a에 도시된다. 우리는 인 CstF-64 및 hEF1α 프로모터 (그림 2B 및 그림 3)의 표현력 규정에 따라 3xFLAG 태그에 융합 돌연변이 인 CstF-64 단백질을 복제하고 싶었다. 3xFLAG 태그 다음에 플라스미드를 포함 hEF1α은 우리에게 사용할 수 없습니다. 그러나 다음 플라스미드 사용할 수 있었던 : pcDNA 벡터 3.1 myc의-그의 (A, 미카엘라 젠슨에서 관대 한 선물), hEF1α 포함하는 플라스미드 (믈라덴 Yovchev에서 관대 한 선물)와 마우스 인 CstF-64 플라스미드 (12) (그림 3). 구조 (들)에 대한 전체 시퀀스는 뉴클레오타이드 및 텍스트 편집 응용 프로그램 (; 장비의 표를 그림 3 참조)를 사용하여 조립되었다. 이어서, 시퀀스 (S)를 가능한 플라스미드 DNA에 대응 편리 네 개 (도 2B, 빨간색 블록도 3)으로 나누었다. 증폭 페이지, NT (25)의 최소 겹쳐 6 조각 "변경 깁슨 총회 설정"팝업 창에서 설정 - rimers 4의 제약 프라이머 생성 도구 (장비의 표 참조)을 사용하여 설계되었다. 및 효소 NheI를 NotI 제한 부위가 올바르게 조립 플라스미드를 식별하기위한 목적으로 설계 프라이머에 포함시켰다. 된 NheI 사이트는 pcDNA 벡터 3.1 및 hEF1α 프로모터의 5 '말단의 프라이머 순서에 있습니다. NotI에 사이트는 종결 코돈 인 CstF-64와 pcDNA 벡터 3.1 벡터 백본 (UGA) 뒤에 위치. hEF1α 프로모터, 3xFLAG 및 인 CstF-64 또는 돌연변이로 구성된 두 효소 DNA 단편을 동시에 소화시 인 CstF-64 (아래 참조 그림 2B) 발표 될 예정이다. 프라이머는 가능한 가장 작은 규모에 주문하고 탈염 하였다. 3xFLAG-태그 DNA 단편을 함유 hEF1α 프로모터의 두 번째 부분은 (BP 490,도 2B,도 3)은 단일 SDNA 단편 (들로 구입재료의 EE 표). 어셈블리 반응에 사용 DNA 단편을 DNA의 POL (자재 표 참조)를 사용하여 증폭 하였다. hEF1α 프로모터 1 부, hEF1α 프로모터, 2 부 전체 길이 돌연변이 인 CstF-64의 DNA 단편의 DNA 폴의 공급 업체의 권고에 따라 28주기 (그림 4A)에 대해 별도의 튜브에서 동시에 증폭되었다 (재료의 표를 참조 각주기 변성 98 ° C, 어닐링 55 ° C에서 45 초, 신장 72 ° C에서 90 초)에서 7 초였다. 우선, 3.1 pcDNA 벡터 백본 (72 ° C에서 3 분으로 설정 하였다 신도 시간을 제외하고 상기와 동일한 조건을 사용) 22 사이클 동안 증폭 하였다. 그러나, 얻어진 DNA 수율은 반응 어셈블리 (도 4a)에 사용하는 충분하지 않았다. 따라서, 추가적인 증폭 충분한 DNA를 얻었다.
PCR 산물을 수득플라스미드 템플릿으로부터 ED 달리 어셈블리 결과 반응 생성물을 오염 것이며 위양성 약제 내성 박테리아 콜로니를 만들어 플라스미드 DNA를 제거 DpnI 제한 효소로 분해되어야한다. 따라서, PCR 생성물은 클리브 헤미 메틸화 및 메틸화 된 플라스미드 DNA가 댐 + E.로부터 단리 DpnI 제한 효소로 소화시켰다 대장균 균주. 템플릿 메틸화 또는 헤미 메틸화 된 염기를 포함하지 않는 화학 합성 DNA 보낸 DpnI로 분해 할 필요가 없기 때문에 PCR 제품, 합성 DNA 단편을 이용하여 획득.
pcDNA 벡터 3.1 벡터 백본 PCR을 함께 합하고 프로토콜 4 단계에서 설명되고 사용 된 DNA 정제 자성 비드의 양을 적절하게 조정 된 바와 같이 DNA 단편 (자재 표 참조) 정제하고 DNA 정제 자성 비드를 통해 농축 하였다. DNA 수율을 결정 하였다분광 광도계 (시설의 표 1 및 표)를 사용. 인 CstF-64과 돌연변이 인 CstF-64 구조에 대한 의회의 반응은 얼음 (표 1)에 조립되었다. "삽입"으로 간주 DNA 단편의 3 배 몰 과량의 (표 1,도 3)를 사용했다. 혼합 된 DNA 단편의 최종 용적을 물 10 μL 및 어셈블리 마스터 믹스 (2 ×)을 가하고 10 μL로 조정 하였다. 반응은 혼합하고, 1 시간 동안 50 ℃에서 배양 하였다. 긍정적 인 제어 반응 또한 GA 키트 설명서의 권고에 따라 조립 및 인 CstF-64과 돌연변이 인 CstF-64 반응과 동시에 배양 하였다. 프로토콜에서 권장 된 바와 같이, 조립체 반응의 각각 2㎕의 능력은 화학적으로 변형 된 E. 대장균 어셈블리 클로닝 키트 (자재 표 참조)로 공급된다. 키트에 기재된 바와 같이 형질 전환을 행했다매뉴얼. 긍정적 인 클론 암피실린 한천 / LB 플레이트에 선정되었다. 각 조립 반응 당 6 콜로니를 무작위로 전파하기 위해 선택되었다. 플라스미드 DNA는 (재료의 표 참조) 플라스미드 분리 미니 키트를 사용하여 분리 하였다. 제한과 구조의 실리 소화가 된 NheI 및 NotI으로는 4590 BP, 인 CstF-64 및 4590 BP에 대한 3032 bp의 크기의 두 조각의 결과 효소, 돌연변이 인 CstF-64 (그림 2B 그림 4B)에 대한 2711 BP. 제한과 소화를 HindIII 및 NotI으로는 다음과 같은 크기의 세 단편 결과 효소 (5,872 BP, 1005 BP, 745 BP (인 CstF-64)와 5872 BP, 1005 BP, 424 bp의 돌연변이 인 CstF-64, 그림 2B와 도 4c). 실제로, 고립 된 플라스미드의 소화는 예상 특성 패턴 (그림 4B, C)를 표시. 또, 인 CstF-64의 돌연변이를 HindIII 및 NotI으로 절단에 의해 생성 된 424 염기쌍의 DNA 단편그림 4C에 플라스미드는 약하게 작은 크기로 인해 염색된다. 6 고립 된 플라스미드 중 2 시퀀싱 보내졌다. 우리는 hEF1α 프로모터 염기 서열, 및 인 CstF-64 또는 돌연변이 인 CstF-64 구조의 일부가 더 삭제, 삽입 또는 대체가 없는지 확인합니다. 우리는 매우이 발생하는 DNA 구조 또는 PCR 기반 프로토콜의 순서를 권장합니다. 순서는 각각의 염기 서열을 플라스미드 중 하나가 hEF1α, 3xFLAG 태그와 인 CstF-64 또는 돌연변이 인 CstF-64의 지역에서 예상되는 순서를 함유하는 것으로 나타났다. 다른 플라스미드 각각 대응하는 DNA 단편의 증폭 중에 도입 된 점 돌연변이를 가지고 있었다. 마우스 배아 줄기 세포 인 CstF-64를 함유하는 플라스미드의 발현은 야생형 식 (17)에 필적하는 외래 단백질의 풍부한 양을 생산했다.
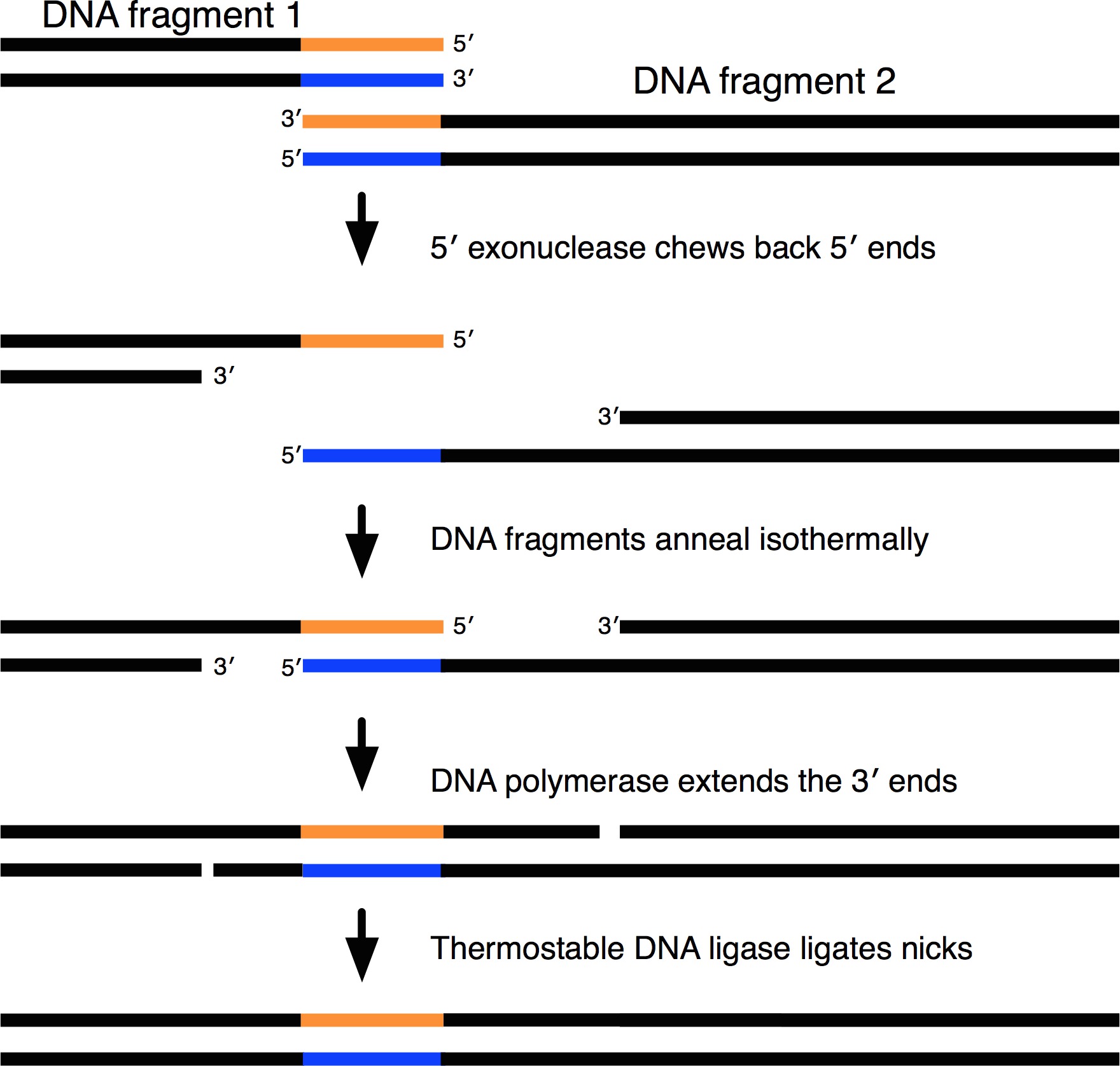
깁슨 조립기구의 도식 표현을 그림. DNA 조각을 끝 등온 하나의 연속적인 순서로 조립 된 겹치는. 중복 먼저 점차적으로 불 활성화 된 열 5 '엑소 뉴 클레아 제에 의해 다시 씹 종료합니다. 따라서, 중첩 단부와 다른 DNA 단편을 등온 적으로 어닐링된다. DNA 중합 효소는 빈틈과 닉 ligates 내열성 DNA 리가 아제를 입력합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

프로토콜의도 2 (A)는 조립 순서도 클로닝 기재. 플라스미드의 (B)의 표현은, PGA-인 CstF GA-64 키트를 사용하여 생성 된 적색 - 어셈블리 반응에 사용되는 DNA 단편 :. pcDNA 벡터를3.1; hEF1α 프로모터 1 부 (hEF1a - 1); hEF1α 프로모터 2 부 (hEF1a - 2) 합성 DNA로 주문; 마우스 인 CstF-64 (mCstF-64). 블루 - 오픈 리딩 프레임. 바이올렛 - 바이러스 성 및 비 바이러스 성 발기인. 녹색 -. 절단 및 폴리아 데 닐화 지역 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 깁슨 어셈블리 인 CstF-64 플라스미드 3. 디자인. 블랙 박스는 실리코 순서에서 단일 깁슨 어셈블리 인 CstF-64을 설계 할 수 있었다 DNA 조각을 나타냅니다. 이어서, 서열은 PCR로 증폭 하였다 네 DNA 조각으로 분할 하였다. 때문에 순서가 hEF1α 홍보와 함께 SDNA로 디자인 된 3xFLAG 태그의 작은 크기주의 할 점 omoter 2 부. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

클로닝 반응 및 수득 된 플라스미드를 나타내는 제한 효소 소화에 사용 된 DNA 단편의도 4 PCR (A) 주제의 PCR 뜨거운 어셈블리 반응에 사용 된 DNA 단편에 대한 높은 충실도 배 마스터 믹스를 시작하여 :. (B) 주제 hEF1α, 전체 길이 인 CstF-64, pcDNA 벡터 3.1 구조 (PGA-인 CstF-64) 및 hEF1α, 돌연변이 인 CstF-64, pcDNA 벡터 3.1 구조 (PGA-mutCstF-64) 된 NheI 및 NotI을 함께 소화의 플라스미드. (C) B와 동일한 플라스미드를 NotI과 HindIII로 효소로."_blank">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| DNA 단편의 명칭 | 예상 크기 (BP) | Concn. (NG / μL) | 에 희석 (NG / μL) | μl의 희석에서 GA 인 CstF-64에 사용 | μl의 희석에서, GA mutCstF-64에 사용 | 몰비 (기능 : VEC) |
| pcDNA 벡터 3.1 (벡터) | 4,618 | (158) | 원액 | (1) | (1) | |
| hEF1_ 프로모터 1 부 | (825) | (213) | (75) | (1) | (1) | 3 : 1 |
| 인 CstF-64 hEF1_ 프로모터 2 부 | (516) | 229 | (50) | (1) | 3 : 1 | |
| 인 CstF-64 | 1,796 | (161) | 원액 | (1) | 3 : 1 | |
| 돌연변이 인 CstF-64 hEF1_ 프로모터 2 부 | (516) | 199 | (50) | (1) | 3 : 1 | |
| 돌연변이 인 CstF-64 | 1,448 | (201) | (171) | (1) | 3 : 1 |
표 1. 자석 구슬, 희석에 집중 한 후 DNA 조각의 수율 및 조립 반응을 설정합니다.
토론
GA 복제의 성공적인 사용은 항상 전체 구조 (그림 2와 그림 3)의 세심한 설계가 선행되어야한다.
프라이머 생성 도구를 설계 프라이머 서열주의 깊게 확인도 좋습니다. GA 프라이머는 프라이머 생성 도구를 사용하지 않고 생성 될 수있다. 그러나, 공구의 사용은 공정을 단순화하기 때문에 고도로 권장된다. 일반적으로, GA 복제에 대한 프라이머는 두 개의 기능적으로 서로 다른 시퀀스가 있어야합니다. 제 1 시퀀스는 DNA 단편을 특정하고, PCR을 사용하여 단편의 증폭을 허용한다. 두 번째 순서는 GA 조립에 필요한 인접 단편과 겹칩니다. 일반적인 DNA 단편 특정 시퀀스의 길이는 18-22 nt의 것이다. 동일한 DNA를 증폭하기 위해 사용되는 DNA 단편 특이 서열은 유사한 용융 온도와 GC 함량을 가져야한다. 중복 순서는해야 15 이상NT 적어도 48 ℃의 융해 온도와 길이. 4 개 이상의 DNA 단편의 조립체는 적어도 20 NT로 중첩 시퀀스를 필요로 할 것이다. 긴 중복 더 제대로 조립 된 DNA 조각의 결과로 어닐링의 증가 특이성을 수 있습니다. 그것은 왜곡 된 시퀀스가 적절한 DNA 어셈블리를 손상시킬 수 있기 때문에, 자신의 GC 또는 중복 시퀀스를 개발 콘텐츠 AT 왜곡되는 시퀀스를 방지하는 것이 좋습니다.
또한 어떠한 약물 내성 박테리아 콜로니, GA 반응에서 벡터 골격에 대응하는 단지 DNA 단편을 생성하지 않아야 음성 대조군으로 사용하여 제시한다. 대안 적으로, "삽입"을 포함하는 DNA 단편 중 하나도없는 약제 내성 세균 콜로니를 초래한다 GA 반응에서 생략 될 수있다. COMPL의 어셈블리를 렌더링 더 식민지가 인접한 DNA 조각의 중복 끝의 부족 될 것입니다 성장하지 않습니다 이유,죽어 야지 플라스미드.
프로토콜 설명에서 사용 때문에 DNA 단편의 수 (도 3)로, NT 프라이머 세트를 생성하기 위해 사용 하였다 (25)의 서열을 중첩. 6 DNA 단편 - 프라이머 생성 도구 웹 사이트의 추천 4 조립 적어도 20 NT 겹치는 서열을 사용하는 것 (장비 표 참조). 또한, 긴 DNA 가닥의 적절한 보완을 보장 시퀀스 겹치는 정확하게 조립 제품의 수를 증가 (도 1 참조).
현재, 원활한 복제에 대한 여러 시스템을 사용할 수 있습니다. 그러나, 이러한 시스템의 일부는 여전히 (즉, 골든 게이트 18 복제) 제한 효소를 사용합니다. 다른 사람들은 같은 생물학적 소스 (19)에서 우두 바이러스 DNA 중합 효소 및 단일 가닥 DNA 결합 단백질에 따라 효소의 독점적 인 혼합을 사용합니다. 두 시스템은 쇼어 GA와 비교하여 제한되어시퀀스를 중첩 터 길이. 짧은 중첩 서열은 23 개 이상의 문제 DNA 단편의 적절한 어셈블리 렌더링 인접하는 DNA 단편을 어닐링 단계, 충분한 특이성을 제공 할 수 있기 때문에. 이러한 단점은 GA 시스템에 존재하지 않습니다.
(길이 즉, 8 미만 KBP) PCR에 의해 증폭 확실 크기를 초과하지 않도록 증폭되는 DNA 단편의 크기 역시 고려되어야한다. 심지어 지난 10 년의 DNA 중합 효소의 기능의 개선, 큰 DNA 조각은 덜 정확하고 효과적으로 증폭 될 것이다. 필요한 경우, 큰 DNA 단편을 플라스미드 단리 및 제한 효소 소화 적절한 DNA에 의해, 예를 들면 PCR 대안 다른 소스로부터 얻어 질 수있다. 구체적으로는, 현재의 원고에 기재된 프로토콜을 위해, 우리는 PCR을 사용하는 것이보다 합리적 모든 덜이었다 가능한 DNA 단편의 크기에 근거했다5 KBP. 아가로 오스 겔 전기 영동에 의해 식별되는 하나 이상의 PCR 생성물이 존재하는 경우, 바람직한 단편 크기의 겔 정제 가능한 분자 생물학 기술 또는 적합한 키트 중 하나를 사용하여 추천합니다. 현재 프로토콜에서 내열성 DNA 중합 효소 (재료의 표 참조)에 사용됩니다. 그러나 높은 충실도 및 수율을 제공하는 임의의 DNA 중합 효소는이 프로토콜에서 사용하기에 적합 할 것이다. 프로토콜에 설명 된 것과 다른 고성능 DNA 중합 효소를 사용할 수있는 경우 각각의 매뉴얼에 설명 된대로 설정 조건을 사용합니다. 현재 프로토콜에서 화학적으로 유능한 E. 콜라이 세포 GA 키트와 함께 제공되는 사용된다. 또한, 화학적 또는 전기 관할 E. 이러한 DH5α 또는 DH10B 대장균 균주로서 사용할 수있다.
배 마스터 믹스를 복제 어셈블리는 최소한의 실습 시간 사용이 편리합니다. 그러나 정확한 피펫은 북동 때문에 작은 볼륨으로 필요합니다eded 함께 혼합한다. 굿 분자 생물학 기법뿐만 아니라 항상 행사 될 필요가있다.
GA 복제는 더 이상 크기가 3 KBP보다 DNA 조각, 플라스미드 및 벡터의 건설을위한 무한한 가능성을 제공합니다. 그것은 예를 들면, 합성 및 조립을 허용하기 때문에 또한 그것은, 전체 세균 (미코 mycoides) 게놈 또는 효모 (사카로 미세스 세 레비 시아) 염색체 (20, 21), 합성 생물학의 분야에서 광범위한 영향을 미친다. 종래의 클로닝 원활한 구조를 생성하기 위해 필요에 기술도 적용 가능하다.
결론적으로, GA 복제는 기존의 DNA 복제 과정에 신속하고 안정적이고 유연한 대안을 제공합니다.
공개
Open Access publication and production fees were supplied by New England BioLabs Inc.
감사의 말
우리는 관대하게 제공하여 pcDNA 3.1 myc의-그의 (A) 및 hEF1α 프로모터 포함하는 플라스미드를 들어, 텍사스 테크 대학 건강 과학 센터, 러벅, 텍사스와 믈라덴 Yovchev 피츠버그 의료 센터의 대학, 피츠버그에서 PA를 미카엘라 젠슨에게 감사의 말씀을 전합니다 . 이 책에서보고 된 연구는 보너스 번호 (CCM에) R01HD037109에서 아동 건강과 국립 보건원 (National Institutes of Health)의 인간 개발의 유니스 케네디 슈라이버 국립 연구소에 의해 지원되었다. 추가 지원은 여성의 건강에 대한 (CCM 및 PNG에) 로라 부시 연구소했다. 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 대변하지 않습니다.
저자는 그들이 더 경쟁 금융 이익이 없다는 것을 선언합니다.
자료
| Name | Company | Catalog Number | Comments |
| Synthetic double-stranded DNA fragment (sDNA) | Integrated DNA Technologies | We used gBlocks, which can be up to 2 kb in length. However, there are many commercial sources of synthetic DNA available. | |
| DNA purification magnetic beads | Beckman Coulter | A63880 | Agencourt AMPure XP - PCR Purification system |
| Plasmid Isolation Mini Kit | Omega Bio-Tek Inc | D6942-01 | E.Z.N.A. Plasmid Mini Kit I |
| Gibson Assembly Cloning Kit | New England BioLabs | E5510S | |
| DNA polymerase | New England BioLabs | M0494S | Q5 Hot Start High Fidelity 2x Master Mix |
| DpnI | New England BioLabs | R0176S | |
| NheI | New England BioLabs | R3131S | |
| NotI | New England BioLabs | R3189S | |
| HindIII | New England BioLabs | R3104S | |
| Spectrophotometer | Thermo Scientific | NanoDrop device | |
| EditSeq | DNASTAR | Part of Lasergene Core Suite | |
| SeqBuilder | DNASTAR | Part of Lasergene Core Suite | |
| Word | Microsoft | Part of Microsoft Office | |
| NEBuilder | New England BioLabs | primer generation tool: http://nebuilder.neb.com | |
| NEBioCalculator | New England BioLabs | ligation calculator: http://nebiocalculator.neb.com/#!/ligation |
참고문헌
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods in enzymology. 498, 349-361 (2011).
- Gibson, D. G., Smith, H. O., Hutchison, C. A., Venter, J. C., Merryman, C. Chemical synthesis of the mouse mitochondrial genome. Nature methods. 7, 901-903 (2010).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature methods. 6, 343-345 (2009).
- Bowtell, D. D., Johnson, G. R., Kelso, A., Cory, S. Expression of genes transferred to haemopoietic stem cells by recombinant retroviruses. Molecular biology & medicine. 4, 229-250 (1987).
- Challita, P. M., Kohn, D. B. Lack of expression from a retroviral vector after transduction of murine hematopoietic stem cells is associated with methylation in vivo. Proceedings of the National Academy of Sciences of the United States of America. 91, 2567-2571 (1994).
- Lutzko, C., Senadheera, D., Skelton, D., Petersen, D., Kohn, D. B. Lentivirus vectors incorporating the immunoglobulin heavy chain enhancer and matrix attachment regions provide position-independent expression in B lymphocytes. Journal of Virology. 77, 7341-7351 (2003).
- Meilinger, D., et al. Np95 interacts with de novo DNA methyltransferases, Dnmt3a and Dnmt3b, and mediates epigenetic silencing of the viral CMV promoter in embryonic stem cells. EMBO reports. 10, 1259-1264 (2009).
- Chan, K. K., Wu, S. M., Nissom, P. M., Oh, S. K., Choo, A. B. Generation of high-level stable transgene expressing human embryonic stem cell lines using Chinese hamster elongation factor-1 alpha promoter system. Stem cells and development. 17, 825-836 (2008).
- Chung, S., et al. Analysis of different promoter systems for efficient transgene expression in mouse embryonic stem cell lines. Stem cells. 20, 139-145 (2002).
- Qin, J. Y., et al. Systematic comparison of constitutive promoters and the doxycycline-inducible promoter. PloS one. 5, e10611 (2010).
- Lund, A., Knudsen, S. M., Vissing, H., Clark, B., Tommerup, N. Assignment of human elongation factor 1alpha genes: EEF1A maps to chromosome 6q14 and EEF1A2 to 20q13.3. Genomics. 36, 359-361 (1996).
- Wallace, A. M., et al. Two distinct forms of the 64,000 Mr protein of the cleavage stimulation factor are expressed in mouse male germ cells. Proceedings of the National Academy of Sciences of the United States of America. 96, 6763-6768 (1999).
- MacDonald, C. C., McMahon, K. W. Tissue-specific mechanisms of alternative polyadenylation: testis, brain, and beyond. Wiley interdisciplinary reviews. RNA. 1, 494-501 (2010).
- Sabath, I., et al. 3'-End processing of histone pre-mRNAs in Drosophila: U7 snRNP is associated with FLASH and polyadenylation factors. Rna. 19, 1726-1744 (2013).
- Yang, X. C., et al. A complex containing the CPSF73 endonuclease and other polyadenylation factors associates with U7 snRNP and is recruited to histone pre-mRNA for 3'-end processing. Molecular and cellular biology. 33, 28-37 (2013).
- Grozdanov, P. N., Macdonald, C. C. High-Throughput Sequencing of RNA Isolated by Cross-Linking and Immunoprecipitation (HITS-CLIP) to Determine Sites of Binding of CstF-64 on Nascent RNAs. Methods in molecular biology. 1125, 187-208 (2014).
- Youngblood, B. A., Grozdanov, P. N., MacDonald, C. C. CstF-64 supports pluripotency and regulates cell cycle progression in embryonic stem cells through histone 3' end processing. Nucleic acids research. , (2014).
- Engler, C., Kandzia, R., Marillonnet, S. A one pot, one step, precision cloning method with high throughput capability. PloS one. 3, e3647 (2008).
- Irwin, C. R., Farmer, A., Willer, D. O., Evans, D. H. In-fusion(R) cloning with vaccinia virus DNA polymerase. Methods in molecular biology. 890, 23-35 (2012).
- Annaluru, N., et al. Total synthesis of a functional designer eukaryotic chromosome. Science. 344, 55-58 (2014).
- Gibson, D. G., et al. Creation of a bacterial cell controlled by a chemically synthesized genome. Science. 329, 52-56 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유