Method Article
구두 항생제 치료 후 Murine 장 Microbiota의 정량적 중 합 효소 연쇄 반응-기반 분석
요약
여기 우리가 제공 자세한 프로토콜 항생제의 구강 관리에 대 한 쥐, 배설물 샘플, DNA 추출 및 배설물 박테리아의 정량화를 정량 하 여.
초록
본질적인 microbiota은 인간의 건강에 중앙 영향. 미생물 dysbiosis 선 동적인 장 질병, 천식, 관절염 등 많은 일반적인 immunopathologies와 연결 됩니다. 따라서, 중요 한 중요성의 이다 누화 microbiota 면역 시스템을 기본 메커니즘을 이해. 병원 체 허가 방 조 하는 동안 항생제 관리는 또한 크기와 인간의 건강에 영향을 미칠 수 있는 장내 세균 커뮤니티의 구성에 과감 한 변화를 유도 합니다. 쥐에 항생제 치료 영향 및 항생제 치료 환자에서 인간의 microbiota에 장기적인 변화가 고 미생물 지역 사회 변화 및 면역 세포 기능 간의 기계적 링크의 조사. 쥐의 항생제 치료에 대 한 몇 가지 메서드를 설명 하는 동안 그들 중 일부는 심한 탈수와 체중 데이터의 해석을 복잡 하 게 유도. 여기, 구두 항생제 관리 주요 체중 감량을 유도 하지 않고 마우스의 장기 처리를 위해 사용 될 수 있는 두 개의 프로토콜 제공 합니다. 이러한 프로토콜 항생제의 조합을 대상으로 그람 양성 및 그람 음성 박테리아 사용 하 게 하 고 어느 광고 libitum 식용 수 또는 구강에 의해 제공 될 수 있다. 또한, 항생제 치료의 효능을 확인 하는 데 사용할 수 있는 정량 하 여 배설물 샘플에 미생물 밀도의 정량화 하는 방법을 설명 합니다. 이러한 접근의 조합 장 microbiota의 조작 및 쥐에 항생제 치료의 효과의 연구에 대 한 신뢰할 수 있는 방법론을 제공합니다.
서문
포유류 위장 점 막의 호스트와 함께 mutualistic 관계를 설정 하는 매우 복잡 한 혼합물에 의해 식민지 독특한 환경 이다. 장 점 막의 방어 시스템 구성 상피 층과 그들의 수 및 다양성을 유지 하면서 소장 내에서 공생을 제한 하는 면역 세포의 과다. 반대로, 공생 생물은 완전히 기능 면역 시스템의 개발에 필요한. 호스트 및 공생 박테리아 사이의 상호 작용은 일반적으로 도움이 되 고 점점 더 분명 그 dysregulated 면역 시스템 microbiota 누화 만성 염증 성 질병, asinflammatory 대 장 등의 개발을 찬성 수 있습니다. 질병, 관절염 이나 천식1,2.
본질적인 microbiota 다양 한 요인에 의해 변경 될 수 있습니다 하지만 아마도 가장 급격 한 변화는 심각 하 게 변경 하는 크기와 세균성 지역 사회3,4의 항생제 치료에 의해 유도 된다. 감염을 치료 하는 항생제의 장점은 의심, 하는 동안 인간의 항생제 노출에 의해 유도 된 microbiota 변화 건강에 해로운 영향으로 이어질 수 있는 면역 방어를 수정할 수도 있습니다. 예를 들어, 인 간에 있는 항생제 치료 Clostridium 남과 어울리지 않는의 위험 증가에 연결 되었습니다-설사, 천식 그리고 특정 유형의 암3유도. 쥐에 항생제 치료 영향 및 장기 변경 항생제 치료 환자의 창 자 커뮤니티에서 발견이 고 미생물 지역 사회 변화 및 면역 세포 기능 간의 기계적 링크의 조사를 사용할 수 있다. 그러나, 몇 가지 보고서로 쥐의 파울 맛5,6때문에 아마도 식 수에서 참 음료수 광고 libitum 에 항생제의 관리 매우 눈에 띄는 체중 감량 결과 나타났습니다. 따라서, 이러한 모델에 구두 항생제 관리를 수 반하는 심한 탈수 있습니다 복잡 하 게 면역 세포 기능에 항생제 치료의 효과 확인 하는 것을 목표로 하는 실험의 해석.
몇 가지 방법은 크기와 장 구획7미생물 커뮤니티의 구성에 사용할 수 있습니다. 하지만 차세대 시퀀싱 기술 이러한 메서드는 상대적으로 저렴이 문제8, 귀중 한 데이터 제공 하 고 데이터의 해석에 대 한 전문가 bioinformatic 분석 필요. 다른 한편으로, 전통 미생물 문화 방법 세균성 종 검출을 허용 하지만 그들은 낮은 감도 있고 공생 박테리아 (특히 anaerobes)의 큰 분수는 매우 어렵거나와 육성 현재 사용할 수 있는 방법8. 정량적 중 합 효소 연쇄 반응 (정량) 기법 사용 되고있다 점점 정량화 및 지저분한 세균성 종의 식별에 대 한 총 미생물 부하의 신속 하 고 안정적인 문화 독립적인 측정을 제공 하는 그들은. 따라서, 정량 방법 나이 또는 선 동적인 장 질병9,10를 포함 하 여 여러 질병의 진행과 관련 된 microbiota에 변화를 공부 하는 데 유용 증명. 이 맞춰 정량 메서드는 지저분한 세균성 부하 및 microbiota 구성10,,1112(항생제 등) 다양 한 치료의 효과 확인 하기 위해 신속 하 고 비용 효율적인 접근을 제공 합니다.
여기, 선물이 구두 항생제 관리에 대 한 두 가지 프로토콜의 자세한 단계별 계정 쥐, 배설물 샘플 수집, DNA 추출, 표준의 준비 및 배설물 샘플에서 박테리아의 정량화를 정량 하 여. 이러한 프로토콜 쥐에서 장 microbiota를 조작 하 고 장내 항상성 및 질병에 항생제 치료의 효과의 연구를 신뢰할 수 있는 방법을 제공 합니다.
프로토콜
여기에 설명 된 실험 6-8 주 오래 된 야생-타입 (C57BL6/J) 마우스는 특정 병원 체 자유롭게 (SPF) 시설에서 유지 관리를 사용 하 여 수행 했다. 모든 동물 실험은 왕의 대학 런던 및 프랜시스 크릭 연구소 동물 복지와 윤리적 검토 기관 및 영국 홈 오피스에 의해 승인 되었다. 어떤 동물 절차를 시작 하기 전에 적절 한 권한을 지역 기관/단체를 통해 가져온 확인 하십시오.
1입니다. 항생제의 관리
참고: 항생제 치료에 대 한 두 가지 대체 방법을 제공 됩니다: 구강 (단계 1.1) 및 식 수 (1.2 단계)를 통해 항생제의 관리.
- 구강
- 다음과 같은 농도에서 압력가 마로 소독 물에 그들을 용 해 하 여 개별 항생제의 주식을 준비: 100 mg/mL에서 암 피 실린, 100 mg/mL에서 Gentamicin, 100 mg/mL에서 네오 마이 신, 10 mg/mL에 Metronidazole 및 100 mg/mL에서 Vancomycin. 필터는 0.45 μ m 필터를 사용 하 여 소독. 약 수와-20 ° c.에 게
- 위에 준비 하는 주식을 혼합 하 여 항생제의 칵테일을 준비 합니다. 1 mL의 볼륨에 대 한 암 피 실린 (5 mg/mL 최종)의 50 µ L, Gentamicin (5 mg/mL 최종)의 50 µ L, 네오 마이 신 (5 mg/mL 최종)의 50 µ L, Metronidazole (5 mg/mL 최종)의 500 µ L, Vancomycin (2.5 mg/mL 최종)의 25 µ L과 325 µ L의 물 혼합. 사용 하기 전에 칵테일 신선한 준비.
- 살 균 1 mL 주사기로 항생제 혼합을 로드 하 고 모든 거품을 제거 하는 동안 적절 한 게이지 gavage 바늘 (20 G 15-20 g 마우스)을 수정.
- 항생제 혼합의 200 µ L와 gavage 쥐입니다.
- 마우스 어깨 피부를 단단히 잡고, 머리와 목 식도을 스트레칭. 볼-지붕 입 및 인 두의 뒤쪽을 따라 먹이 바늘의 팁을 직접. 그런 다음, 부드럽게 식도로 통과 하 고 200 μ 솔루션을 주입.
- 실험의 기간에 대 한 항생제 칵테일 한 번을 매일 관리 합니다.
- 식 수에 항생제
주의:은 신중 하 게 항생제 관리 식 수에서의 첫 2 주 동안 매일에 마우스 체중을 모니터링 합니다.- 압력가 마로 소독 물 1 L에 다음을 용 해 하 여 항생제의 칵테일을 준비: 암 피 실린 (1 g/L 최종), 네오 마이 신 (1 g/L 최종)에 Metronidazole (1 g/L 최종), Vancomycin (0.5 g/L 최종) 및 인공의 8 향 낭 (각 0.75 g) 0.5 g 1 g 1 g 1 g 감미료 (60 g/L 최종)입니다. 해산 때까지 흔들어. 4 ° c.에 게
참고: 감미료를 항생제의 맛을 숨기고 쥐 탈수를 방지 추가 됩니다. 몇 가지 감미료 브랜드 수 있습니다 작동 하는 동안 필요한 최종 농도 각 특정 브랜드에 대 한 달라질 수 있습니다. - 물 병에 항생제 칵테일을 입력 (~ 100 mL/병) 마우스 케이지는 병을 놓습니다.
참고: 갈색 병을 사용 하거나 빛에서 항생제를 보호 하기 위해 호 일 병을 커버. - 실험 기간 동안 일주일에 두 번 신선한 주식으로 항생제 칵테일을 바꿉니다.
- 압력가 마로 소독 물 1 L에 다음을 용 해 하 여 항생제의 칵테일을 준비: 암 피 실린 (1 g/L 최종), 네오 마이 신 (1 g/L 최종)에 Metronidazole (1 g/L 최종), Vancomycin (0.5 g/L 최종) 및 인공의 8 향 낭 (각 0.75 g) 0.5 g 1 g 1 g 1 g 감미료 (60 g/L 최종)입니다. 해산 때까지 흔들어. 4 ° c.에 게
2.의 자, 회장, 내용과 회장 벽에서 배설물 샘플의 수집
- 무게 및 레이블 2 mL 샘플 컬렉션 압력가 관.
- 신선한 대변 샘플의 컬렉션에 대 한 각 마우스는 restrainer에 놓고 컬렉션 튜브의 항문에서 직접 분 변 알갱이 수집 합니다.
참고: 샘플 또한 깨끗 한 압력가 장에 마우스를 배치 하 고 깨끗 한 소독된 집게와 대변 샘플을 수집 하 여 얻을 수 있습니다. - CO2 질 식 자 궁 경관 탈 구 다음으로 쥐를 안락사.
- 완전히 노출 하는 복 부와 마우스 시체를 복 부 지역 70% 에탄올 스프레이.
- 소독된 집게와가 위를 사용, 어떤 내부 조직을 손상 하지 않고 복 노출 하 복 부에 가로 절 개를 만들. 복 들어올린 내장 노출 절 개.
- 집게와가 위 (위장 콜론)에서 내장을 제거 하 고 멸 균 페 트리 접시에 놓습니다.
- 신중 하 게 사용 하 여 집게 소장 (SI)를 애타게 mesenteric 동맥과 지방. 소장을 확장 하 고 깨끗 한 실험실 지우기에 배치.
- 통치자, 측정 고 시 (맹에 가까운 부분)의 말 초 회장의 4 cm를 잘라. 잘라내어 버리고 맹 근 위 소장 1 cm. 회장은 장내 박테리아를 수집 하는 데 사용할 것입니다 왼쪽의 3 cm 부분 있을 것입니다.
- 2 mL 무 균 튜브에 회장 부분 (3 cm)를 개최. 밀어내어 직접 장과 colleting 튜브에서 샘플 장 콘텐츠를 수집 합니다. 이 샘플은 회장 내용에서 박테리아를 있을 것 이다.
- 버퍼링 차가운 인산 염 (PBS)와 20 mL 주사기를 준비 하 고 플러시 회장 부분 (흐름을 통해 삭제).
- 깨끗 한 종이 타월에 회장 부분을 놓고가 위 경도 열.
- 메스와 회장 벽의 내부를 다쳤어요.
- 깨끗 한 원심 분리기 튜브 위에 PBS의 1 mL를 메스를 세척 하 여 메스에 어떤 박테리아를 수집 합니다. 작은 박테리아는 상쾌한 삭제를 5 분 동안 8000 × g 에서 회전 합니다. 이 샘플은 회장 벽에서 박테리아를 포함 합니다.
참고:의 자, 회장 콘텐츠 및 벽에서 배설물 샘플 냉동 고 사용까지-80 ° C에서 저장 될 수 있습니다. - 무게는 튜브의 자 및 회장 콘텐츠 샘플을 포함 하 고 각 샘플에 배설물로 무게를 (에서 2.1 단계) 빈 관에서 체중을 빼기.
- 자, 회장 콘텐츠 및 상용 키트를 사용 하 여 회장 벽 샘플에서 세균성 DNA를 추출 합니다. 사용까지-20 ° C에서 DNA 샘플을 저장 합니다.
3입니다. 정량에 의해 장 Microbiota의 정량화
참고:이 절차 포함 표준 (3.1 단계)의 생성 및 표준과 배설물 샘플 (3.2 단계)에 대 한 정량 설정 하는 방법
- 정량에 대 한 표준의 생성
- 연쇄 반응 (PCR)를 사용 하 여 게놈 DNA 추출 시 약13 및 표 1에 자세히 설명 하는 PCR 조건 사용 하 여 세균성 문화에서에서 16S rRNA 유전자를 증폭 하는.
- 1.5 %agarose 젤에 PCR 제품을 실행 하 고 상용 DNA 추출 키트를 사용 하 여 DNA 밴드를 정화.
- 순화 된 DNA 조각 사용 하 여 참조 테이블의 자료, 항생제 내성 마커 및 블루/화이트 식민지 선택에 대 한 β-galactosidase (LacZ) 유전자 융해를 포함 하는 벡터를 사용 하 여 키트는 복제 선 DH10 유능한 변환 대장균 제조업체의 지침에 따라. 암 피 실린에 변환 접시 (100 µ g/mL), X-여자 (20 µ g/mL) Luria Bertani (파운드) 한 천 배지 (10 g/L Tryptone, 효 모 추출 물, 10 g/L NaCl, 15 g/L 한 천 5 g/L). 품 어 오버 나이트 (O/N) 37 ° c.
- 접시에서 단일 포지티브 (흰색) 식민지를 선택 합니다. 5 mL 파운드 국물 100 µ g/mL 암 피 실린 포함 된에서 예방 하 고 O/N 37 ° C, 250 rpm에서 떨고에서 품 어.
- O/N 문화에서 분리 하 고 제조업체의 지침에 따라 상업 miniprep 키트를 사용 하 여 플라스 미드 정화.
참고:이 단계에서 플라스 미드 16S rRNA 유전자의 복사본을 하나만 포함 되어 있는지 확인 하 고 자료 쌍 (bp)의 길이 결정 하는 플라스 미드 삽입 순서 중요 하다. - 플라스 미드를 한 번만 인하를 제한 효소로 플라스 미드 선형화
- 상업적으로 사용할 수 있는 키트를 사용 하 여 선형화 플라스 미드 정화.
- 260에서 흡 광도 측정 하 여 플라스 미드의 농도 결정 nm는 분 광 광도 계를 사용 하 여.
- 다음 수식14를 사용 하 여 샘플의 플라스 미드 복사본 / µ L의 수를 계산.
복사본의 수 = (금액 * 6.022 × 1023) / (길이 * 1 × 109 * 650)
금액이 3.1.8 (ng / µ L);에 단계에서 얻은 DNA 농도 그리고 길이 혈압에 (삽입)와 플라스 미드의 총 길이. 사본의 수 복사본 / µ L로 얻을 것 이다.
참고: 플라스 미드 사본의 수의 쉬운 계산 수 있도록 위의 수식에 따라 온라인 도구가 있습니다. - 약 수 그리고 저장소 사용까지-20 ° C에서 필요에 따라 표준.
- 정량 표준 및 배설물 샘플에 대 한 설정
- 녹여 정량 (에서 단계 3.1.10) 표준, (에서 단계 2.15) 배설물 샘플 DNA 및 얼음에 (에서 상용 키트) 정량 시 약.
참고:이 예제에서 사용 하는 정량 Pcr 시 약 포함 SYBR 녹색 정량 Pcr 반응 혼합 및 역방향 뇌관 (표 2). - 10에서 범위에서 살 균 DNA 무료 물에서 표준 희석7 102 복사본 / µ L (10에서예를 들어, 1/5 직렬 희석7 102 복사본 / µ L x 6.4). 희석 배설물 샘플 DNA를 1/2, 1/5, 1/10.
- 반응 플러스 1 (표 2)의 총 수에 대 한 마스터 혼합 반응을 확인 합니다.
- 믹스 마스터 및 서식 파일 (표준, 샘플 또는 부정적인 제어를 위한 물)의 5 µ L의 믹스 30 µ L
- 384 잘 광 정량 접시에 각 잘에이 혼합의 10 µ L를 추가 합니다. 3 중 각 반응을 수행 합니다.
- 정량 장소 인감, 간단히 원심 및 로드 자전거 다음과 프로그램 정량 Pcr 기계에 접시: 95 ° C의 40 주기 뒤 20 분 동안 95 ° C 15 s를 1 분 동안 60 ° C.
- 표준 및 샘플에 대 한 CT 값을 가져옵니다.
- (으로 단계 3.1.9에서에서 계산) 플라스 미드의 사본 숫자의 로그 대 표준에 대 한 CT 값을 플롯 하 여 표준 곡선을 생성 합니다. 표준 곡선의 직계 회귀를 수행 합니다.
- 표준 곡선에서 (단계 3.2.2에서에서 얻은) CT 값을 보간하여 배설물 샘플 16S rDNA 복사본 수를 계산 합니다.
참고: 각 샘플에 대 한 16S rDNA 복사 번호 수정 해야 합니다 (으로 단계 3.2.2에서에서 준비) 샘플의 희석 비율을 고려 하 고 최종 볼륨 핵 산 (2.15 단계)에서 eluted 했다 그를 분 변 샘플 (에서 계산된 단계 2.14)의 양 유전자는 배설물의 그램 당 복사합니다.
- 녹여 정량 (에서 단계 3.1.10) 표준, (에서 단계 2.15) 배설물 샘플 DNA 및 얼음에 (에서 상용 키트) 정량 시 약.
결과
여기 우리는 쥐의 경구 항생제 치료에 대 한 두 개의 대체 프로토콜을 제공합니다. 그림 1 마우스 연속 10 일 동안 항생제로 구강 (빨간색) 이나 식 수 (블루) 치료에 몸 무게 (각 동물에 대 한 원래 기본 선 두께 관련)의 비율을 보여줍니다. 아니 눈에 띄는 체중 감량은 구강으로 항생제를 수신 하는 쥐에서 발견 된다. 때 마우스 항생제 광고 libitum 식 수에서로 처리 됩니다, 그들은 체중 (~ 10%), 항생제 관리의 처음 몇 일 이내에 그러나, 복구 정상적인 체중 증가 그 후 (그림 1). 그럼에도 불구 하 고, 약 5-10% 식용 수에서 항생제를 받은 쥐의 도달할 수 > 20% 체중 감소 치료의 첫 번째 주 내에서 그들은 안락사는 어떤 경우에.
분 변 샘플에서 박테리아의 정량화는 정량 (3.2.7 단계)에서 얻은 CT 값 대 (와 단계 3.2.2에서에서 계산 된) 표준에 대 한 복사 숫자의 로그를 플롯 하 여 적절 한 표준 곡선의 사용을 해야 합니다. 그림 2A 는 R2 값이 0.99827,-3.09 및 효율을 기울기의 표준 곡선 성능 기준에 부합 하는 표준 곡선에서 대표적인 예를 보여 줍니다 ((-1 + 110%의 10^(-1/slope))*100). 0.99 및 PCR 효율 90 ~ 110%의 범위 내에서 R2 값은 기본 설정입니다. 선형 범위 내에서 회귀 분석 방정식 배설물 샘플 내에서 16S rDNA 풍부의 정량화를 수 있습니다. 그림 2B 지저분한 대변, 시 내용과 시 벽에 16S rDNA 복사본의 수를 나타냅니다. 그림 2B 에서 데이터는 지저분한 대변 및 SI 콘텐츠에 대 한 배설물 샘플의 16S rDNA 복사본/g로 표시 됩니다. 시 벽에 대 한 데이터 (수량 시작 물자의 정확한 무게를 너무 작습니다)로 시 벽의 3 cm에서 복구 하는 박테리아에서 얻은 16S rDNA의 총 수로 표시 됩니다.
분 변 샘플에서 박테리아의 밀도에 항생제의 효과 평가 하려면 마우스 했다 항생제로 치료 구강에 의해 매일 10 일 동안 (1 ~ 10 일) 전날 (0), 대변 샘플 수집 된 및 항생제 치료 (동안 서로 다른 시간 지점에서 일 5, 10), 그리고 항생제 관리 (하루 17; 중지 한 후 7 일 그림 3A)입니다. 그림 3B에서 같이, 항생제 치료 16S rDNA 복사본/g 5와 10 일 동안 정상 수준 (전처리에 비해) 후 1 주 복구 하는 배설물에 박테리아의 밀도 배설물의 수에서 강한 감소를 유도 항생제 관리 (17 일) 중지 되었습니다.
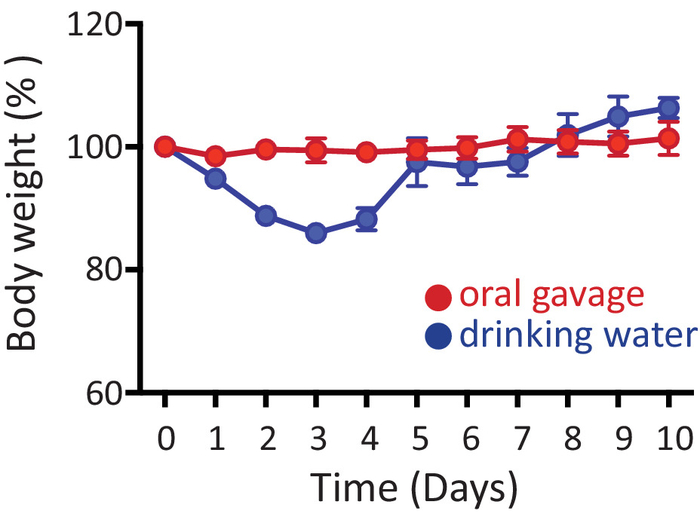
그림 1: 항생제의 관리. 마우스 구강 (빨간색) 이나 식 수 (블루) 10 일 연속에 대 한 항생제를 받았다. 플롯 항생제 관리 (0 일) 전에 원래 무게를 기준으로 실험 기간 내내 쥐의 가중치를 보여 줍니다. 데이터 평균 ± SEM.로 표시 됩니다 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
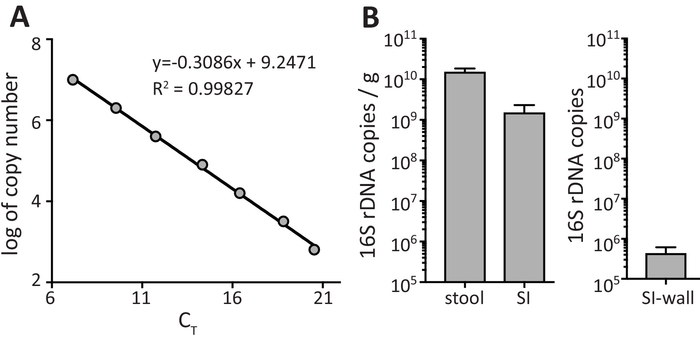
그림 2: 표준 및 배설물 샘플의 16S rRNA 유전자 정량 Pcr 증폭. (A) 표준 곡선 설명자 표준 곡선의 선형 회귀. (B) 유전자 나타났는데 지저분한 샘플에서 계산 합니다. 데이터 평균 ± SEM.로 표시 됩니다 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
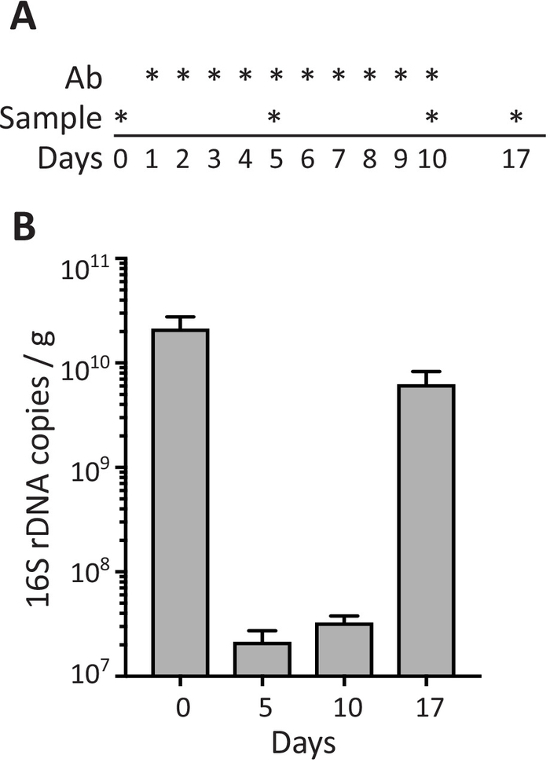
그림 3: 배설물 박테리아 항생제 치료 중. 구강 (Ab) 및 샘플 컬렉션으로 표시 하 여 항생제 관리에 대 한 일정의 개략도 (A) *. (B) 16S rDNA 마우스 표시 일 수집에서 대변 샘플에 배설물의 그램 당 복사 합니다. 데이터 평균 ± SEM.로 표시 됩니다 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 시 약 | 볼륨 | |
| DNA | 8 Μ L | |
| 버퍼 10 X | 2 Μ L | |
| dNTPs (10 mM) | 0.4 Μ L | |
| Eubacteria-F 뇌관 (10 mM) | 1 Μ L | |
| Eubacteria-R 뇌관 (10 mM) | 1 Μ L | |
| Taq Polimerase | 0.2 Μ L | |
| H2O | 7.4 Μ L | |
| 총 볼륨 | 20 Μ L | |
| 뇌관 순서 | ||
| Eubacteria-F 뇌관 | 5 ' 3' ACTCCTACGGGAGGCAGCAGT | |
| Eubacteria-R 뇌관 | 5 ' 3' ATTACCGCGGCTGCTGGC | |
| 사이클링 조건 | ||
| 온도 | 시간 | 사이클 |
| 94 ° C | 5 분 | 1 x |
| 94 ° C | 30 s | 30 x |
| 60 ° C | 30 s | 30 x |
| 72 ° C | 1 분 | 30 x |
| 72 ° C | 5 분 | 1 x |
| 4 ° C | ∞ | 1 x |
표 1: PCR 시 약 및 조건. 이 표에서 시 약 및 정량 분석 실험에서 사용 하는 표준의 생성에 대 한 세균성 문화에서 16S rRNA 유전자 증폭 PCR 순환 상태를 제공 합니다. 뇌관 시퀀스 Kruglov 그 외 여러분 에 의해 원래 간행 되었다 13.
| 시 약 | 볼륨 |
| SYBR 녹색 마스터 믹스 (2 배) | 17.5 Μ L |
| Eubacteria-F 뇌관 (10 mM) | 0.7 Μ L |
| Eubacteria-R 뇌관 (10 mM) | 0.7 Μ L |
| H2O | 11.1 Μ L |
표 2: 정량 마스터 믹스. 볼륨 표시 (최종 볼륨 35 µ L) 3 중 (10 µ L 각) 384-잘 정량 접시 (5 µ L pipetting 오류에 대 한 추가 고려)에 실행 되도록 단일 샘플에 대 한 있습니다. 양은 분석할 샘플 수에 따라 확장할 수 있습니다.
토론
여기 우리가 제공 실험 프로토콜 항생제의 구강 관리에 대 한 마우스 및 배설물 박테리아의 정량화를 정량 하 여. 항생제의 조합 그람 양성 및 그람 음성 박테리아, 박테리아의 전체 스펙트럼에 대 한 살 균 활동을 제공 하 고이 프로토콜 (암 피 실린, gentamicin, 네오 마이 신, metronidazole, vancomycin를 포함 하는) 대상에 사용. 구강 및 식 수에 항생제의 관리 크게 배설물 박테리아 감소 로드5,,612. 또한, 두 치료 그들은 몇 가지 특성 감소 비장의 크기 확대 맹 등 무 균 쥐의 전형적인 개발 쥐의 표현 형에 깊은 영향을 있다. 항생제 관리에 대 한 특정 메서드의 선택 가능 하 게 따라 달라질 수 있습니다 실험의 길이에 구강 방법을 필요로 더 노동 집약 되 고 가능 하 게에 더 많은 불편을 초래 하는 항생제의 매일 관리는 장기간에서 동물입니다.
식 수에 항생제의 관리에 대 한 주의 해야 합니다 촬영 항생제 혼합물에 감미료의 추가 함께이 탈수에서 생쥐를 유지 하는 중요 한 요소입니다. 몇몇 그룹 (감미료의 추가) 없이 식 수에 항생제의 관리 모든 쥐 실험5 의 처음 몇 일 이내에 초기 몸 무게의 20%를 잃고 매우 심각 하 고 급속 한 체중 감량을 리드 어떻게 나타났습니다. , 6. 우리의 프로토콜에 기반 설탕 감미료를 사용 하 여 물, 항생제 관리 후 처음 몇 일에 무게를 잃은 마우스에 항생제 맛을 마스크에 충분 한 것 같았다 하지만 그 ( 후 그들의 무게를 신속 하 게 복구 그림 1). 그럼에도 불구 하 고, 우리의 실험에서 쥐의 5-10% 아직도 도달의 인간의 끝점 > 기준선의 20% 손실 체중 및 안락사 될 하는 데 필요한. 우리는 또한 완전히 쥐 탈수를 방지 하지 못했습니다 sucralose 기반 감미료 테스트 (쥐 손실의 100% > 체중의 20%) 다른 저자는 감미료 아스파탐 기반5,6에 대 한 유사한 오류를 출판 하는 동안. 이것에 추가, 나이, 유전적 배경 및 일반적인 건강 상태는 실험을 위해 사용 하는 마우스의 고려 되어야 한다, 그들은 영향을 미칠 수-체중 및 동물 복지 항생제 치료 중으로. 따라서, 마우스 무게와 일반 건강 상태 주의 모니터링 구두 항생제 관리의 첫 2 주 동안 매일 수행 되어야 한다.
정량 방법 배설물 샘플에 16S rRNA의 정량화에 대 한 신속 하 고 비용 효율적인 접근 방식을 제공합니다. 그러나, 몇 가지 제한 사항이 포함 하 여이 기술에 대해 고려해 야 합니다: 내가) 믿을 수 있는 높은 품질 표준;에 대 한 요구 사항 ii) 설계 및 정량 Pcr 뇌관;의 효율성 3) 미생물 16S rRNA 유전자의 다른 복사본 수를 할 수 있다는 사실, 따라서 유전자 사본 수 있습니다 직접 평등 하지 셀 수15. 그럼에도 불구 하 고, 정량 배설물 샘플의 신속한 분석을 가능 하 게 강력 하 고 중요 한 방법입니다. 이 메서드는 신속 하 게 자세한 여기로 배설물의 세균 중에 다양 한 치료 (항생제 등)의 효과 확인 하기 위해 특히 유용할 수 있습니다. 또한, 우리가 총 16 기의 정량화에 대 한 프로토콜을 제공 rRNA,이 방법을 적용할 수 있습니다 쉽게 (특정 뇌관16여)을 양적 모두 제공 하는 개별 세균성 taxa의 식별을 가능 하 게 하 고 미생물 크기와 구성에 대 한 질적 정보입니다.
요약 하자면, 우리가 제공한 두 개의 프로토콜 마우스 및 배설물 박테리아에 항생제 유도 변화 척도를 정량 기반 방법의 경구 항생제 치료에 대 한. 이러한 프로토콜을 더 최적화 될 수 있으며 개별 실험 필요에 따라 다른 접근에와 함께, 그들은 수 역할을 빠르고 비용 효율적이 고 안정적인 도구 murine 장 microbiota를 조작 하 고 효과의 연구 장 항상성 그리고 질병에 항생제 치료.
공개
저자는 공개 없다.
감사의 말
이 작품은 영국 의학 연구 위원회 (샌드위치 미스터/L008157/1 부여);에 의해 투자 되었다 R.J. 마리 퀴리 Intra-European 화목 (H2020-MSCA-IF-2015-703639);에 의해 지원 되었다 P.M.B. 영국 의학 연구 위원회와 생물 의학 (미스터/N013700/1)에 왕의 대학 런던 박사 훈련 파트너십에서 재학 하 여 지원 했다.
자료
| Name | Company | Catalog Number | Comments |
| Ampicillin sodium salt | Sigma-Aldrich (Merck) | A9518 | |
| Neomycnin trisulfate salt hydrate | Sigma-Aldrich (Merck) | N1876 | |
| Metronidazole | Sigma-Aldrich (Merck) | M3761 | |
| Vancomycin hydrochloride | Sigma-Aldrich (Merck) | V2002 | |
| Gentamicin sulfate salt | Sigma-Aldrich (Merck) | G3632 | |
| Tryptone | Sigma-Aldrich (Merck) | T7293 | |
| Yeast Extract | Sigma-Aldrich (Merck) | Y1625 | |
| NaCL | Sigma-Aldrich (Merck) | S7653 | |
| Sweetener Sweet'n Low | Sweet'N Low | Available in the UK from Amazon.co.uk | |
| X-Gal (5-brom-4-chloro-3-indoyl B-D-galactopyranoside) | Fisher scientific | 10234923 | |
| Phosphate Buffered Saline | Thermo Fisher Scientific (Gibco) | 10010023 | |
| Ultrapure Agarose | Thermo Fisher Scientific (Invitrogen) | 16500500 | |
| RT-PCR grade water | Thermo Fisher Scientific (Invitrogen) | AM9935 | |
| Phusion High-Fidelity DNA Polymerase | New England BioLabs | M0530 | |
| Deoxynucleotide (dNTP) Solution Mix | New England BioLabs | N0447 | |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 1725124 | with ROX |
| TOPO TA cloningTM for sequencing | Thermo Fisher Scientific (Invitrogen) | 450030 | |
| QIAamp fast DNA Stool mini kit | Qiagen | 51604 | |
| QIAprep spin Miniprep kit | Qiagen | 27106 | |
| QIAquick gel extraction kit | Qiagen | 28704 | |
| Syringe filter 0.45 µm | Fisher scientific | 10460031 | |
| Swann-MortonTM Carbon steel sterile scalpel blades | Fisher scientific | 11792724 | |
| Syringe (1 mL) | BD Plastipak | 303172 | |
| Syringe (20 mL) | BD Plastipak | 300613 | |
| 1.5 mL Crystal clear microcentriguge tube | StarLab | E1415-1500 | |
| 2 mL Ultra high recovery microcentrifuge tube | StarLab | I1420-2600 | |
| Oral dosing needles 20 G x 38 mm curved (pk/3) | Vet-Tech | DE008A | |
| Sterilin petri dish 50 mm | Scientific Laboratory Supplies | PET2020 | |
| Absolute qPCR plate seals | Thermo Fisher Scientific | AB1170 | |
| MicroAmpTM optical 384-well plate | Thermo Fisher Scientific (Applied Biosystems) | 4309849 | |
| ViiA7TM 7 real-time PCR system with 384-well block | Thermo Fisher Scientific (Applied Biosystems) | 4453536 | |
| Spectrophotometer (Nanodrop 1000) | Thermo Fisher Scientific | ND-1000 | |
| Labnet Prism microcentrifuge | Labnet | C2500 | |
| MultiGene Optimax Thermal cycler | Labnet | TC9610 |
참고문헌
- Belkaid, Y., Hand, T. W. Role of the microbiota in immunity and inflammation. Cell. 157 (1), 121-141 (2014).
- Hooper, L. V., Littman, D. R., Macpherson, A. J. Interactions between the microbiota and the immune system. Science. 336 (6086), 1268-1273 (2012).
- Ubeda, C., Pamer, E. G. Antibiotics, microbiota, and immune defense. Trends in Immunology. 33 (9), 459-466 (2012).
- Dethlefsen, L., Huse, S., Sogin, M. L., Relman, D. A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS Biology. 6 (11), e280 (2008).
- Reikvam, D. H., et al. Depletion of murine intestinal microbiota: effects on gut mucosa and epithelial gene expression. PLoS One. 6 (3), e17996 (2011).
- Hill, D. A., et al. Metagenomic analyses reveal antibiotic-induced temporal and spatial changes in intestinal microbiota with associated alterations in immune cell homeostasis. Mucosal Immunology. 3 (2), 148-158 (2010).
- Fraher, M. H., O'Toole, P. W., Quigley, E. M. Techniques used to characterize the gut microbiota: a guide for the clinician. Nature Reviews Gastroenterology & Hepatology. 9 (6), 312-322 (2012).
- Eckburg, P. B., et al. Diversity of the human intestinal microbial flora. Science. 308 (5728), 1635-1638 (2005).
- Sokol, H., et al. Low counts of Fecalibacterium prausnitzii in colitis microbiota. Inflammatiry Bowel Diseases. 15 (8), 1183-1189 (2009).
- Bartosch, S., Fite, A., Macfarlane, G. T., McMurdo, M. E. Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota. Applied Environmental Microbiology. 70 (6), 3575-3581 (2004).
- Ubeda, C., et al. Vancomycin-resistant Enterococcus domination of intestinal microbiota is enabled by antibiotic treatment in mice and precedes bloodstream invasion in humans. Journal of Clinical Investigation. 120 (12), 4332-4341 (2010).
- Saez de Guinoa, J., et al. CD1d-mediated lipid presentation by CD11c(+) cells regulates intestinal homeostasis. EMBO Journal. 37 (5), (2018).
- Kruglov, A. A., et al. Nonredundant function of soluble LTalpha3 produced by innate lymphoid cells in intestinal homeostasis. Science. 342 (6163), 1243-1246 (2013).
- Wilhelm, J., Pingoud, A., Hahn, M. Real-time PCR-based method for the estimation of genome sizes. Nucleic Acids Research. 31 (10), e56 (2003).
- Kembel, S. W., Wu, M., Eisen, J. A., Green, J. L. Incorporating 16S gene copy number information improves estimates of microbial diversity and abundance. PLoS Computational Biology. 8 (10), e1002743 (2012).
- Yang, Y. W., et al. Use of 16S rRNA Gene-Targeted Group-Specific Primers for Real-Time PCR Analysis of Predominant Bacteria in Mouse Feces. Applied Environmental Microbiology. 81 (19), 6749-6756 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유