É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Membranas de troca de íons para a fabricação do dispositivo de eletrodiálise reversa
Neste Artigo
Resumo
Demonstramos a fabricação de um dispositivo de eletrodiálise reversa usando uma membrana de troca de cáção (CEM) e membrana de troca de ânion (AEM) para geração de energia.
Resumo
A eletrodiálise reversa (RED) é uma maneira eficaz de gerar energia misturando duas concentrações de sal diferentes na água usando membranas de troca de cáção (CEM) e membranas de troca de ânion (AEM). A pilha RED é composta por um arranjo alternado da membrana de troca de cá de cáção e membrana de troca de ânion. O dispositivo RED atua como um potencial candidato para atender à demanda universal por futuras crises energéticas. Aqui, neste artigo, demonstramos um procedimento para fabricar um dispositivo de eletrodiálise reversa utilizando CEM e AEM em escala laboratorial para produção de energia. A área ativa da membrana de troca de íons é de 49 cm2. Neste artigo, fornecemos um procedimento passo-a-passo para sintetizar a membrana, seguido da montagem da pilha e medição de energia. As condições de medição e o cálculo da saída de energia líquida também foram explicados. Além disso, descrevemos os parâmetros fundamentais que são levados em consideração para a obtenção de um resultado confiável. Também fornecemos um parâmetro teórico que afeta o desempenho geral da célula relacionada à membrana e à solução de alimentação. Em suma, este experimento descreve como montar e medir células VERMELHAs na mesma plataforma. Ele também contém o princípio de trabalho e o cálculo utilizados para estimar a saída de energia líquida da pilha RED usando membranas CEM e AEM.
Introdução
A coleta de energia dos recursos naturais é um método econômico que é ecologicamente correto, tornando nosso planeta verde e limpo. Vários processos foram propostos até agora para extrair energia, mas a eletrodiálise reversa (RED) tem um enorme potencial para superar a questão da crise energética1. A produção de energia da eletrodiálise reversa é um avanço tecnológico para a descarbonização da energia global. Como o nome sugere, o RED é um processo inverso, onde o compartimento de células alternativas é preenchido com a solução de sal de alta concentração e solução de sal de baixa concentração2. O potencial químico gerado pela diferença de concentração de sal entre as membranas de troca de íons, coletados dos eletrodos na extremidade do compartimento.
Desde o ano 2000, muitos artigos de pesquisa foram publicados, fornecendo insights sobre o RED teoricamente e experimentalmente3,4. Estudos sistemáticos sobre as condições de operação e estudos de confiabilidade em condições de estresse melhoraram a arquitetura da pilha e melhoraram o desempenho geral das células. Vários grupos de pesquisa desviaram sua atenção para a aplicação híbrida red, como RED com processo de dessalinização5, RED com energia solar6, VERMELHO com osmose reversa (RO) processo5, VERMELHO com a célula de combustível microbiano7, e VERMELHO com o processo de resfriamento radiativo8. Como mencionado anteriormente, há muito escopo na implementação da aplicação híbrida da RED para resolver o problema de energia e água limpa.
Vários métodos foram adotados para melhorar o desempenho da célula RED e a capacidade de troca de íons da membrana. A alfaiataria das membranas de troca de cáção com diferentes tipos de íons utilizando grupo de ácido sulfônico (-SO3H), grupo de ácido fosfônico (-PO3H2) e grupo de ácido carboxílico (-COOH) é uma das formas eficazes de alterar as propriedades físico-químicas da membrana. As membranas de troca de ânion são adaptadas com grupos de amônio ( 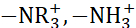 )9. A alta condutividade iônica de AEM e CEM sem deteriorar a resistência mecânica da membrana é o parâmetro essencial para a seleção de uma membrana adequada para aplicação do dispositivo. A membrana robusta sob condições de estresse proporciona estabilidade mecânica à membrana e aumenta a durabilidade do dispositivo. Aqui, uma combinação única de poli sulfoado livre de alto desempenho (cetona éter) (sPEEK) como membranas de troca de cáation com FAA-3 como membranas de troca de ânion são usadas na aplicação RED. A Figura 1 mostra o fluxograma do procedimento experimental.
)9. A alta condutividade iônica de AEM e CEM sem deteriorar a resistência mecânica da membrana é o parâmetro essencial para a seleção de uma membrana adequada para aplicação do dispositivo. A membrana robusta sob condições de estresse proporciona estabilidade mecânica à membrana e aumenta a durabilidade do dispositivo. Aqui, uma combinação única de poli sulfoado livre de alto desempenho (cetona éter) (sPEEK) como membranas de troca de cáation com FAA-3 como membranas de troca de ânion são usadas na aplicação RED. A Figura 1 mostra o fluxograma do procedimento experimental.
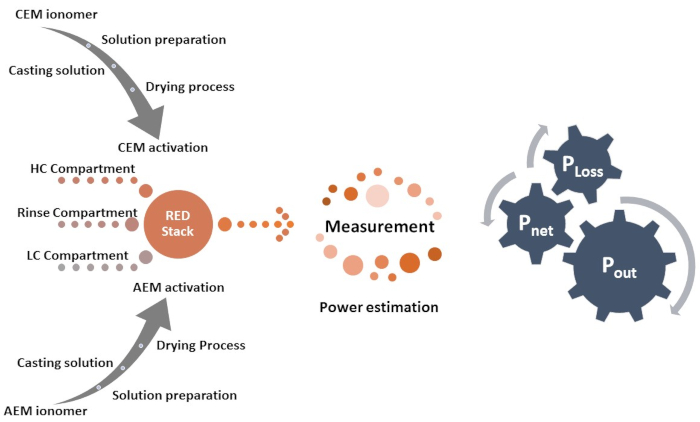
Figura 1: Gráfico de procedimento. O fluxograma apresenta o procedimento adotado para a preparação da membrana de troca de íons seguida do processo de medição da eletrodiálise reversa. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. Exigência experimental
- Compre polímero de ionômero de troca de íons, fibra de polímero E-550 sulfonated-PEEK para preparar CEM e FAA-3 para preparar a AEM. Certifique-se de que todos os polímeros de ionômeros sejam armazenados em um ambiente limpo, seco e sem poeira antes de usar.
- Utilize solventes de alta pureza (>99%), incluindo N-Methyl-2- pyrrolidone com peso molecular 99,13 g mol-1 e N, N-Dimethylacetamida com peso molecular 87,12, para preparar solução de ionômero homogêneo. Certifique-se de que todos os produtos químicos e solventes de grau analítico são usados para a preparação da membrana, conforme recebido sem qualquer purificação adicional.
- Após o processo de ativação das membranas, mergulhe imediatamente todas as membranas em uma solução naCl de 0,5 M para melhor desempenho. Após a ativação de ambas as membranas, não é necessária a secagem. A água com resistividade é de 18,2 MΩ à temperatura ambiente foi usada em toda a síntese da membrana.
- Caracterize propriedades de membrana usando uma membrana seca. A descrição detalhada das técnicas de caracterização e suas propriedades físico-químicas, como capacidade de troca de íons, ion-condutividade, espessura, análise térmica e morfologia superficial, são apresentadas nas literaturas10,11.
- Use um cortador para moldar a membrana para CEM e AEM para o tamanho da pilha RED com uma área ativa de 49 cm2,como mostrado na Figura 2.
- Para a fabricação da pilha RED, faça um arranjo alternativo de CEM e AEM, separado por espaçador e junta; uma imagem real da pilha RED de trabalho é apresentada na Figura 3a, e seu diagrama esquemático de cada camada é ilustrado na Figura 3b.
- Primeiro, coloque a placa PMMA voltada para o eletrodo de cabeça; agora, coloque a junta de borracha e espaçador sobre ele, em seguida, coloque o CEM. Depois disso, coloque a junta de silicone com o espaçador no CEM e coloque o AEM sobre ele. Da mesma forma, adicione a junta de silício e o espaçador na parte superior do AEM seguido pelo CEM. Agora, coloque a placa pmma final, a junta de borracha e o espaçador seguido com aperto usando parafusos e parafusos de porca.
- Após a montagem da pilha RED, verifique o fluxo livre da alta concentração (HC), baixa concentração (LC) e enxágue as soluções uma a uma. Qualquer fluxo cruzado ou vazamento deve ser eliminado antes da medição.
- Antes da medição da corrente e da tensão, monitore a taxa de fluxo de soluções de sal e a leitura do medidor de pressão e certifique-se de que ela fique estabilizada. Certifique-se de que todas as conexões estejam no lugar exato antes do início da medição. Evite tocar na pilha RED e seus tubos de conexão enquanto a medição estiver em execução.
NOTA: A solução HC e LC fluem de seus compartimentos para descartar compartimento através de uma bomba peristáltica, medidor de pressão e pilha RED, respectivamente. - Use o método galvanostat para a medição da corrente e da tensão, o instrumento do medidor de origem conectado à pilha RED através de clipes de crocodilo.

Figura 2: Tamanho e forma da membrana preparada, junta e espaçador para a fabricação de eletrodiálise reversa. (a) junta de silicone exterior,(b) espaçador externo e espaçador interno,(c)junta de silicone interno,(d)membrana de troca de cation, (e)membrana de troca de ânion e(f)junta e conjunto de membrana. Clique aqui para ver uma versão maior desta figura.
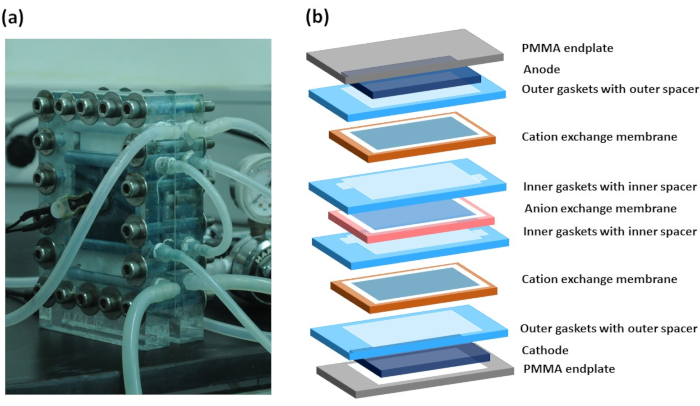
Figura 3: Pilha de eletrodiálise reversa. (a) configuração de pilha de eletrodiálise reversa com tubos de conexão, e (b) ilustração esquemática de diferentes camadas, incluindo placas finais pmma, eletrodos, junta, espaçador, CEM e AEM. Clique aqui para ver uma versão maior desta figura.
2. Preparação da membrana de troca de íons
NOTA: A quantidade de material precursor foi otimizada para a obtenção de uma membrana com 18 cm de diâmetro e ~50 μm de espessura.
-
Membrana de troca de cation
- Tome 5 wt% de fibras sulfosadas-PEEK em um frasco de fundo redondo de 250 mL e dissolva as fibras em Dimethylacetamida (DMAc) como solvente com peso molecular de 87,12 g mol-1. Agite o frasco por 10 minutos para que todos os polímeros ionômeros se acalmem.
- Coloque uma barra magnética no frasco e, em seguida, mantenha a mistura no banho de óleo de silício, seguido de mexer vigorosamente a 500 rpm por 24h a 80 °C para obter uma solução homogênea.
- Filtre a solução sulfoinada-PEEK através de um filtro politetrafluoroetileno de tamanho de poro de 0,45 μm (PTFE).
- Depois disso, despeje a solução filtrada em uma antena de vidro circular com um diâmetro de 18 cm. Certifique-se de que todas as bolhas de ar sejam removidas usando um soprador de ar antes de colocar a placa de Petri no forno.
- Coloque a placa de Petri dentro de um forno para secar a solução a 90 °C por 24 h, resultando em uma membrana livre de ~50 μm de espessura. Faça isso para extrair membrana autônoma: Para retirar a membrana da placa de Petri, encha a placa de Petri com água quente de destila (~60 °C) e deixe-a ficar por 10 min intocadas. A membrana de pé livre sairá automaticamente.
- Para ativação da membrana, mergulhe a membrana de pé livre preparada em ácido sulfúrico de 1 M (H2SO4) solução aquosa, ou seja, 98,08 g, em 1 L de água destilada, e incubar por 2h a 80 °C.
NOTA: Esta etapa garantirá a remoção de partículas estranhas e outros produtos químicos, como solventes que reduzirão a possibilidade de membrana de incrustar. - Lave a membrana encharcada com 1 L de água destilada por 10 minutos, pelo menos três vezes à temperatura ambiente.
- Membrana de troca de ânion
- Dissolver a solução ionômera FAA-3 10 wt.% no solvente N-Methyl-2-pyrrolidone (NMP).
- Mantenha a solução para mexer à temperatura ambiente por 2h a ~500 rpm.
- Depois disso, filtre a solução usando a malha com tamanho de poros de 100 μm.
- Despeje ~30 mL de solução filtrada em uma placa de vidro circular de Petri com um diâmetro de 18 cm. Certifique-se de que todas as bolhas de ar foram removidas usando um soprador de ar antes de colocar a placa de vidro Petri no forno. O processo de secagem ocorre a 100 °C durante 24 horas.
- Para obter uma membrana de pé livre, despeje água quente destilada na placa de vidro Petri e mantenha-a por pelo menos 10 minutos. Agora retire as membranas e coloque em 1 litro de solução de hidróxido de sódio (NaOH) (concentração 1M e peso molecular 40 g mol-1) por 2 h.
- Em seguida, lave bem a membrana com 1 L de água destilada por 10 minutos, pelo menos três vezes em condição ambiente.
NOTA: Todas as membranas preparadas foram armazenadas na solução NaCl de 0,5 M durante a noite antes de usá-la na pilha RED. Para que a condutividade da membrana seja melhorada e possa alcançar o desempenho estabilizado da saída durante a medição da pilha RED. A Tabela 1 descreve as propriedades da membrana10,11.
| Especificação | Unidade | CEM | AEM |
| Grau de inchaço | % | 5±1 | 1±0.5 |
| Densidade de carga ou capacidade de troca de íons | meq/g | 1.8 | ~1.6 |
| Propriedades mecânicas (Força de tração) | Mpa | >40 | 40-50 |
| Alongamento para quebrar | % | ~42 | 30-50 |
| Jovem Módulo (MPa) | 1500±100 | 1000-1500 | |
| Condutividade à temperatura ambiente | S/cm | ~0.03 | ~0.025 |
| Permseletividade | % | 98-99 | 94-96 |
| Espessura | μm | 50±2 | 50±3 |
| Solvente | - | Dimetilacetamida (DMAc) | N-metil-2-pyrrolidone (NMP) |
Tabela 1: Propriedades de membranas. Resumo das propriedades da membrana de troca de cáção e de troca de ânion.
3. Fabricação de eletrodiálise reversa
-
Montagem da pilha RED
- Prepare uma solução de modelo utilizando NaCl de 0,6 M para alta concentração (HC) e 0,01 M NaCl para compartimentos de baixa concentração (LC)12.
NOTA: Aqui, a água do rio é considerada uma solução de sal de baixa concentração, e a água do mar é representada como uma solução de sal de alta concentração. - Prepare 5 L de alta concentração e solução de baixa concentração em um grande recipiente conectado com os tubos. Mantenha as soluções mexendo em condições ambientais (temperatura ambiente) por pelo menos 2 h antes de ser usada na pilha RED.
- Prepare a mistura de 0,05 M de [Fe (CN)6]-3/ [Fe (CN)6]-4 e 0,3 M NaCl em água de 500 mL como solução de enxágue para VERMELHO.
- Conecte todos os três recipientes de solução com pilha RED usando tubos de borracha através da bomba peristáltica e medidores de pressão. Use o tubo de tamanho L/S 16 para a solução de lavagem e use o tubo de tamanho L/S 25 para solução HC e LC.
- Para fazer uma pilha VERMELHA, pegue duas placas finais compostas de metacrilato de polimetila (PMMA). Conecte as duas placas finais horizontalmente cara a cara com porcas, parafusos e arruelas usando força de 25 Nm usando um driver de chave digital. A espessura das placas finais pmma 3 cm, e o caminho dos canais de fluxo foi projetado em placas para HC, LC e solução de enxágue por um perfurador2.
- Coloque dois eletrodos de malha feitos de titânio metálico (Ti) revestidos com uma mistura de Iridium (Ir) e Rutênio (Ru) em uma proporção de 1:1 e coloque no final das placas pmma. Ambos os eletrodos finais estão conectados com o clipe de crocodilo do medidor de origem.
NOTA: Ambas as placas finais do PMMA são equipadas com eletrodos de malha, ambos os eletrodos foram em camadas com um espaçador de formato quadrado, e a placa final PMMA coberta com uma junta de borracha voltada para dentro. Depois disso, CEM e AEM são colocados de forma alternativa, separados por junta de silicone e espaçador, como mostrado na Figura 3. - Instale juntas de silício, espaçadores de polímeros e membranas de troca de íons (CEM e AEM) camada por camada, conforme apresentado no diagrama esquemático Figura 4 e Figura 5. Certifique-se de que a área ativa dos eletrodos, ambas as membranas, espaçador externo e interno, a junta externa e interna é 7 x 7 = 49 cm2.
- Passe soluções de alta concentração e baixa concentração a partir de respectivos compartimentos por bombas peristálticas, conforme mostrado no diagrama esquemático na Figura 4.
- Circule a solução de enxágue nos compartimentos externos de eletrodo e membrana no modo de recirculação usando bombas peristálticas. A taxa de fluxo utilizada para a solução de lavagem é de 50 mL min-1.
- A taxa de fluxo fixo é utilizada para analisar o desempenho de cada membrana. Neste experimento, usamos 100 mL min-1 através de uma bomba peristáltica.
- Prepare uma solução de modelo utilizando NaCl de 0,6 M para alta concentração (HC) e 0,01 M NaCl para compartimentos de baixa concentração (LC)12.
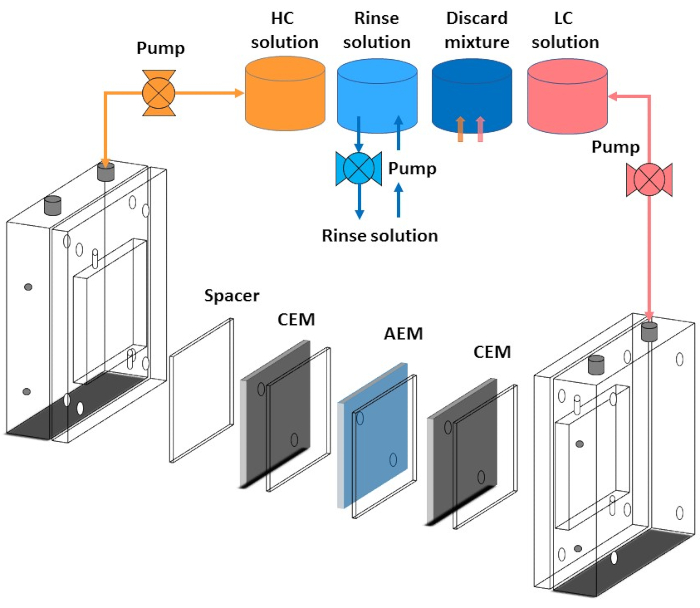
Figura 4: Representação esquemática da conexão do tubo com pilha de eletrodiálise reversa. Conexão da eletrodiálise reversa com bombas peristálticas, recipiente de solução de alta concentração, recipiente de solução de baixa concentração, recipiente de solução de lavagem e recipiente de solução de descarte. Também mostra o alinhamento do espaçador com uma membrana de troca de ânion (AEM) e membrana de troca de cáção (CEM). Clique aqui para ver uma versão maior desta figura.
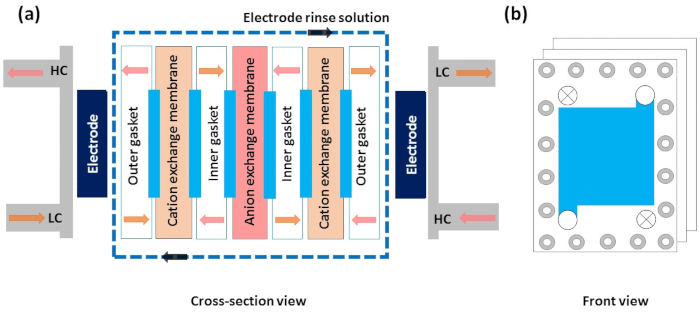
Figura 5: O diagrama esquemático de diferentes camadas na configuração de eletrodiálise reversa. (a) A visão transversal de uma ilustração esquemática da eletrodiálise reversa mostra a direção de fluxo da solução de alta concentração, solução de baixa concentração e solução de lavagem de eletrodos. Outros componentes como eletrodos, juntas externas e internas, espaçadores externos e internos, membrana de troca de cáation e membrana de troca de ânion. bVisão frontal da pilha, que mostra a direção de fluxo de uma solução. Clique aqui para ver uma versão maior desta figura.
4. Medição da eletrodiálise reversa
-
Cálculo de energia
- Deixe a solução de alta concentração, baixa concentração e lavagem, passe pela pilha pelo menos por 5 minutos. Meça o desempenho da saída RED por um medidor de origem, que está conectado a ambos os eletrodos da pilha RED13.
- Calcule as características de tensão atual da pilha RED em termos de densidade de energia usando o método galvanostat.
NOTA: No método galvanostat, uma corrente constante é aplicada entre eletrodos e mede a corrente resultante. A corrente resultante é a corrente gerada devido à reação eletroquímica na pilha. A medição é realizada sob tensão estática de 0,05 V com uma corrente de varredura fixa de 10 mA. - A densidade máxima de potência para a pilha RED é medida com a ajuda da seguinte equação 1.
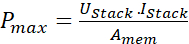 (1)
(1)
Aqui, pmax é a densidade máxima de potência da pilha RED (Wm-2),U stack é a tensão (V) produzida pela membrana na pilha, euempilhar é a corrente registrada (A), e Amem é a área ativa das membranas (m2).
Resultados
Saída de energia líquida
A célula vermelha geralmente gera energia elétrica a partir do gradiente de salinidade da solução de sal, ou seja, o movimento dos íons na direção oposta através da membrana. Para montar a pilha RED corretamente, é preciso alinhar todas as camadas, incluindo eletrodos, juntas, membranas e espaçadores na pilha cuidadosamente, como demonstrado no diagrama esquemático da Figura 4 e Figura 5. Se a pilha não ...
Discussão
O princípio de trabalho do RED é dominado principalmente pelas propriedades físico-químicas da membrana, que é uma parte crucial do sistema RED, conforme ilustrado na Figura 3. Aqui, descrevemos as características fundamentais da membrana para a entrega de um sistema RED de alto desempenho. A permeabilidade de íons específico da membrana faz com que passe um tipo de íons através de seu nanocanal de polímero. Como o nome sugere, o CEM pode passar o cáção de um lado para o outro ...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pela Fundação Nacional de Pesquisa da Coreia (NRF) financiada pelo governo da Coreia (MEST) (No. NRF-2017R1A2A2A05001329). Os autores do manuscrito são gratos à Universidade de Sogang, Seul, República da Coreia.
Materiais
| Name | Company | Catalog Number | Comments |
| AEM based membrane | Fumion | P1810-194 | Ionomer |
| CEM based membrane | Fumion | E550 | Ionomer |
| Digital torque wrench | Torqueworld | WP2-030-09000251 | wrench |
| Labview software | Natiaonal Instrument | - | Software |
| Laptop | LG | - | PC |
| Magnetic stirrer | Lab Companion | - | MS-17BB |
| N, N-Dimethylacetamide | Sigma aldrich | 271012 | Chemical |
| N-Methyl-2- pyrrolidone | Daejung | 872-50-4 | Chemical |
| Peristaltic pump | EMS tech Inc | - | EMP 2000W |
| Potassium hexacyanoferrate(II) trihydrate | Sigma aldrich | P3289 | Chemical |
| Potassium hexacyanoferrate(III) | Sigma aldrich | 244023 | Chemical |
| Pressure Gauge | Swagelok | - | Guage |
| Reverse electrodialysis setup | fabricated in lab | - | Device |
| RO system pure water | KOTITI | - | Water |
| Rotary evaporator | Hitachi | YEFO-KTPM | Induction motor |
| Sodium Chloride | Sigma aldrich | S9888 | Chemical |
| Sodium Hydroxide | Merk | 1310-73-2 | Chemical |
| Source meter | Keithley | - | 2410 |
| Spacer | Nitex, SEFAR | 06-250/34 | Spacer |
| Sulfuric acid | Daejung | 7664-93-9 | Chemical |
| Tube | Masterflex tube | 96410-25 | Rubber tube |
Referências
- Dlugolecki, P., Gambier, A., Nijmeijer, K., Wessling, M. Practical potential of reverse electrodialysis as process for sustainable energy generation. Environmental Science & Technology. 43, 6888-6894 (2009).
- Kim, D., Kwon, K., Kim, D. H., Li, L. . Energy Generation Using Reverse Electrodialysis: Principles, Implementation, and Applications. , (2019).
- Mei, Y., Tang, C. Y. Recent developments and future perspectives of reverse electrodialysis technology: A review. Desalination. 425, 156-174 (2018).
- Yip, N. Y., Brogioli, D., Hamelers, H. V. M., Nijmeijer, K. Salinity gradients for sustainable energy: primer, progress, and prospects. Environmental Science & Technology. 50, 12072-12094 (2016).
- Li, W., et al. A novel hybrid process of reverse electrodialysis and reverse osmosis for low energy seawater desalination and brine management. Applied Energy. 104, 592-602 (2013).
- Brauns, E. Salinity gradient power by reverse electrodialysis: effect of model parameters on electrical power output. Desalination. 237, 378-391 (2009).
- Cusick, R. D., Kim, Y., Logan, B. E. Energy capture from thermolytic solutions in microbial reverse-electrodialysis cells. Science. 335, 1474-1477 (2012).
- Kim, D. H., Park, B. H., Kwon, K., Li, L., Kim, D. Modeling of power generation with thermolytic reverse electrodialysis for low-grade waste heat recovery. Applied Energy. 189, 201-210 (2017).
- Hong, J. G., et al. Potential ion exchange membranes and system performance in reverse electrodialysis for power generation: A review. Journal of Membrane Science. 486, 71-88 (2015).
- Choi, S. -. Y., et al. Controlling fuel crossover in open electrochemical cells by tuning the water nanochannel for power generation. ACS Sustainable Chemistry & Engineering. 8, 8613-8623 (2020).
- Shah, S. A., et al. Modified single-wall carbon nanotube for reducing fouling in perfluorinated membrane-based reverse electrodialysis. International Journal of Hydrogen Energy. 45, 30703-30719 (2020).
- Kwon, K., Han, J., Park, B. H., Shin, Y., Kim, D. Brine recovery using reverse electrodialysis in membrane-based desalination processes. Desalination. 362, 1-10 (2015).
- Kwon, K., Park, B. H., Kim, D. H., Kim, D. Parametric study of reverse electrodialysis using ammonium bicarbonate solution for low-grade waste heat recovery. Energy Conversion and Management. 103, 104-110 (2015).
- Hatzell, M. C., Ivanov, I., Cusick, R. D., Zhu, X., Logan, B. E. Comparison of hydrogen production and electrical power generation for energy capture in closed-loop ammonium bicarbonate reverse electrodialysis systems. Physical Chemistry Chemical Physics. 16, 1632-1638 (2014).
- Zhu, X. P., He, W. H., Logan, B. E. Reducing pumping energy by using different flow rates of high and low concentration solutions in reverse electrodialysis cells. Journal of Membrane Science. 486, 215-221 (2015).
- Vermaas, D. A., Saakes, M., Nijmeijer, K. Doubled power density from salinity gradients at reduced intermembrane distance. Environmental Science & Technology. 45, 7089-7095 (2011).
- Veerman, J., Saakes, M., Metz, S. J., Harmsen, G. J. Reverse electrodialysis: Performance of a stack with 50 cells on the mixing of sea and river water. Journal of Membrane Science. 327, 136-144 (2009).
- Veerman, J., Saakes, M., Metz, S. J., Harmsen, G. J. Electrical power from sea and river water by reverse electrodialysis: a first step from the laboratory to a real power plant. Environmental Science & Technology. 44, 9207-9212 (2010).
- Batchelor, C. K., Batchelor, G. K. . An Introduction to Fluid Dynamics. , (2000).
- Schock, G., Miquel, A. Mass transfer and pressure loss in spiral wound modules. Desalination. 64, 339-352 (1987).
- Da Costa, A. R., Fane, A. G., Wiley, D. E. Spacer characterization and pressure drop modelling in spacer-filled channels for ultrafiltration. Journal of Membrane Science. 87, 79-98 (1994).
- Vermaas, D. A., Veerman, J., Saakes, M., Nijmeijer, K. Influence of multivalent ions on renewable energy generation in reverse electrodialysis. Energy & Environmental Science. 7, 1434-1445 (2014).
- Vermaas, D. A., Saakes, M., Nijmeijer, K. Enhanced mixing in the diffusive boundary layer for energy generation in reverse electrodialysis. Journal of Membrane Science. 453, 312-319 (2014).
- Moreno, J., Grasman, S., van Engelen, R., Nijmeijer, K. Upscaling reverse electrodialysis. Environmental Science & Technology. 52, 10856-10863 (2018).
- Sarkar, S., SenGupta, A. K., Prakash, P. The donnan membrane principle: opportunities for sustainable engineered processes and materials. Environmental Science & Technology. 44, 1161-1166 (2010).
- Kim, H. -. K., et al. High power density of reverse electrodialysis with pore-filling ion exchange membranes and a high-open-area spacer. Journal of Materials Chemistry A. 3, 16302-16306 (2015).
- Długołęcki, P., Nymeijer, K., Metz, S., Wessling, M. Current status of ion exchange membranes for power generation from salinity gradients. Journal of Membrane Science. 319, 214-222 (2008).
- Geise, G. M., Curtis, A. J., Hatzell, M. C., Hickner, M. A., Logan, B. E. Salt concentration differences alter membrane resistance in reverse electrodialysis stacks. Environmental Science & Technology Letters. 1, 36-39 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados