Method Article
Análise da Restrição de SAMHD1 por Citometria de Fluxo em Células U937 Mieloides Humanas
Neste Artigo
Resumo
Descrito aqui é um método estabelecido para determinar a extensão da restrição do HIV-1 pela proteína inibitória celular SAMHD1. As células U937 da linhagem mieloide humana são transduzidas com um vetor de expressão SAMHD1 co-expressando YFP, diferenciadas e, em seguida, desafiadas com HIV-RFP. O nível de restrição é determinado pela análise de citometria de fluxo.
Resumo
A proteína 1 contendo domínio α motivo/histidina-aspartato (SAMHD1) inibe a replicação do HIV-1 em células mieloides quiescentes. As células U937 são amplamente utilizadas como um sistema celular conveniente para analisar a atividade SAMHD1 devido a um baixo nível de expressão de RNA SAMHD1, levando à expressão indetectável de proteínas endógenas. Com base em ensaios semelhantes desenvolvidos no laboratório Stoye para caracterizar outros fatores de restrição retroviral, o laboratório Bishop desenvolveu um ensaio de restrição de duas cores para analisar SAMHD1 em células U937. Leucemia murina Partículas semelhantes a vírus expressando SAMHD1, juntamente com YFP expresso a partir de um IRES, são usadas para transduzir células U937. As células são então tratadas com acetato de miristato de forbol para induzir a diferenciação a um fenótipo quiescente. Após a diferenciação, as células são infectadas com partículas semelhantes ao vírus HIV-1 que expressam um repórter fluorescente. Após 48 h, as células são colhidas e analisadas por citometria de fluxo. A proporção de células infectadas pelo HIV na população que expressa SAMHD1 é comparada com a de células de controle interno sem SAMHD1. Essa comparação revela uma taxa de restrição. A expressão de SAMHD1 leva a uma redução de cinco vezes na infecção pelo HIV, correspondendo a uma razão de restrição de 0,2. Nossa recente substituição da RFP pela GFP original como o gene repórter da infecção pelo HIV facilitou a análise da citometria de fluxo.
Este ensaio tem sido utilizado com sucesso para caracterizar o efeito das substituições de aminoácidos na restrição de SAMHD1 por meio da transdução com vírus que codificam proteínas SAMHD1 alteradas, derivadas da mutagênese sítio-dirigida do vetor de expressão. Por exemplo, as substituições de sítio catalítico HD206-7AA mostram um fenótipo de restrição de 1, indicando uma perda de atividade de restrição. Da mesma forma, a suscetibilidade de diferentes vírus testadores pode ser determinada. O ensaio pode ser adaptado para incorporar o efeito do status de diferenciação, estado metabólico e modificadores SAMHD1 para entender melhor a relação entre SAMHD1, estado metabólico celular e restrição viral.
Introdução
A proteína 1 contendo domínio de α motivo/histidina-aspartato estéril (SAMHD1) impede a replicação do Vírus da Imunodeficiência Humana tipo 1 (HIV-1) em células quiescentes da linhagem mielóide. SAMHD1 bloqueia a replicação através de sua atividade enzimática como uma dNTP trifosfohidrolase, o que resulta em diminuição dos níveis de dNTPs intracelulares. Como resultado, o HIV-1 não pode realizar o processo de transcrição reversa de forma eficiente. Muito progresso foi feito nos poucos anos desde esta observação inicial, particularmente no que diz respeito à contribuição de domínios específicos e aminoácidos para a atividade antiviral do SAMHD1. Esses insights foram feitos usando ensaios bioquímicos, bem como sistemas celulares que imitam o ambiente mieloide quiescente fisiologicamente relevante. As células U9371 são amplamente utilizadas como um sistema de células mieloides conveniente para analisar a atividade SAMHD1. Isto é devido à falta de expressão endógena de SAMHD1, pensado para ser devido a baixos níveis de RNA em comparação com as células que expressam SAMHD1 (uma área de pesquisa em andamento). Aqui, o protocolo descreve a transdução transitória de células U937 com partículas semelhantes a vírus co-expressando SAMHD1 e um repórter de proteína fluorescente amarela (YFP) para examinar o mecanismo de restrição SAMHD1 do HIV-1. Esses ensaios transitórios de citometria de fluxo de duas cores para examinar restrições retrovirais foram desenvolvidos pela primeira vez no laboratório Stoye2 e, desde então, foram adaptados para investigar outros fatores de restrição, incluindo as proteínas do motivo tripartido (TRIM)3. Inspirado por esses ensaios, o laboratório Bishop desenvolveu um ensaio de duas cores para analisar a restrição de SAMHD1 em células U937.
O fluxo de trabalho do experimento é mostrado na Figura 1. Partículas semelhantes ao Vírus da Leucemia Murina (MLV) contendo uma mensagem bi-cistrônica codificando SAMHD1 ao lado de YFP expressa a partir de um IRES são usadas para transduzir células U937. As células são então tratadas com acetato de miristato de forbol (PMA) para induzir a diferenciação a um fenótipo quiescente. As células são infectadas em seguida com partículas semelhantes ao vírus HIV-1 que expressam proteína fluorescente vermelha (RFP). Após 48 h, as células são colhidas e analisadas por citometria de fluxo de duas cores. Este ensaio também é usado com YFP e proteína fluorescente verde (GFP), exigindo menos combinações de filtros padrão para análise de citometria de fluxo. O uso do HIV-RFP permite uma compensação mais direta e, portanto, o ensaio é mais facilmente acessível a usuários de citometria de fluxo menos experientes e alcançável com a maioria dos citômetros.
Durante a análise, a proporção de células infectadas pelo HIV é comparada entre as células que expressam SAMHD1 e aquelas que não possuem SAMHD1 dentro do mesmo poço de células. Isso proporciona um controle interno no tubo de citometria de poço/fluxo, que é uma característica fundamental. A comparação dos níveis de infecção em células transduzidas e não transduzidas revela uma razão de restrição. Uma razão de 1,0 indica que o fator transduzido não tem efeito sobre a infectividade. A expressão de SAMHD1 do tipo selvagem leva a uma redução de cinco vezes na infecção pelo HIV neste ensaio, correspondendo a uma razão de restrição de 0,2. Embora esse efeito seja modesto em comparação com fatores de restrição mais clássicos, como o TRIM5, o efeito é, no entanto, reprodutível e permite a classificação de expressores SAMHD1 modificados naqueles que se restringem de maneira equivalente à proteína do tipo selvagem, aqueles que não conseguem restringir e aqueles com um fenótipo intermediário.
Este ensaio tem sido usado com sucesso para caracterizar os fenótipos de restrição do domínio SAMHD1 e dos mutantes de aminoácidos, transduzindo com vírus codificando sequências SAMHD1 mutantes. Por exemplo, as substituições de local catalítico HD206-7AA não conseguem restringir neste ensaio. Da mesma forma, a suscetibilidade de diferentes vírus testadores pode ser determinada. Por exemplo, os mutantes da transcriptase reversa do HIV-1 são mais suscetíveis à restrição mediada pela SAMHD1 (por exemplo, 151V4). Este protocolo descreve os detalhes da produção de partículas semelhantes a vírus (VLP), transdução de U937 com vetores de expressão SAMHD1, infecção por HIV portando um repórter fluorescente e a análise subsequente por citometria de fluxo. Este artigo discute quais dados esperar e como evitar resultados abaixo do ideal. Finalmente, usos alternativos para o ensaio são delineados, além de examinar diferentes variantes de SAMHD1 para entender a interação entre SAMHD1, níveis de dNTP e infecção viral mais profundamente. Dado o papel do SAMHD1 no centro do metabolismo celular, com ligações adicionais ao câncer, esta continua a ser uma área de intenso interesse.
Protocolo
Este protocolo não contém estudos envolvendo animais ou participantes humanos realizados por nenhum dos autores. Todas as etapas deste protocolo foram realizadas seguindo as diretrizes e códigos de prática das instituições onde foram realizadas.
1. Transfecção de células 293T para produção de VLP (vetores de expressão SAMHD1 e partículas de HIV do testador)
NOTA: Os contribuintes mais significativos para o sucesso da produção de partículas virais são a saúde das células 293T produtoras, a confluência na transfecção e o momento da colheita. Os laboratórios normalmente terão seus reagentes de transfecção preferidos e protocolo para a produção de partículas retrovirais. O protocolo a seguir produz partículas infecciosas de boa qualidade, mas protocolos equivalentes também seriam adequados para esta aplicação. Para manter a boa qualidade das células 293T, passe pelo menos três vezes por semana para manter uma taxa de crescimento constante. As células devem ser semeadas na fase logarítmica de crescimento para uma transfecção eficiente.
- Dia 1: Semeia o número necessário de pratos de 10 cm com uma divisão de 1/4 de um prato quase confluente de células 293T para produzir cerca de 60% de confluência no dia seguinte (aproximadamente 5 x 105 células / mL). Várias densidades podem precisar ser semeadas para alcançar uma densidade apropriada para transfecção no dia seguinte ao trabalhar com um novo estoque de células.
- Dia 2 (manhã): Verifique a confluência de aproximadamente 60% por microscopia e substitua suavemente o meio nas células com 10 mL de meio Eagle Modificado (DMEM) fresco da Dulbecco.
- Dia 2 (tarde, pelo menos 4 h após a mudança de mídia): Transfect para produção de VLP.
- Completar a mistura de diluição de ADN contendo 3 μg cada de plasmídeo expressor gag-pol , plasmídeo repórter de repetição terminal longa (LTR) e plasmídeo expressor da proteína G do vírus da estomatite vesicular (VSV-G) (total de 9 μg, ver NOTA) em 600 μL de DMEM isento de soro. Vórtice e centrífuga brevemente (15 s, >500 x g).
- Adicionar 20 μL de reagente de transfecção (ver Tabela de Materiais), vórtice (não centrifugar) e incubar a 20 °C durante 15-20 min. Adicione a mistura de transfecção gota a gota à placa, gire suavemente para misturar e retorne à incubadora.
NOTA: Para MLV VLP expressando SAMHD1 use KB4 5,6 (plasmídeo expressor gag-pol), pLGatewaySAMHD1IeYFP1 (plasmídeo repórter orientado por LTR) e pczVSV-G7. Para HIV-RFP VLP, use p8.91 8,9 (plasmídeo expressor gag-pol), SCRPSY10 (plasmídeo repórter orientado por LTR) e pczVSV-G. As alternativas são discutidas na Tabela de Materiais. As proporções de plasmídeos podem precisar ser otimizadas para diferentes sistemas plasmídicos/transfeccionados.
- Dia 3 (final da manhã): Retire o meio cuidadosamente das células por pipetagem, lave com 5 mL de DMEM fresco e substitua por 5 mL de DMEM fresco.
- Dia 4 (manhã): Colha o vírus coletando o sobrenadante das células e substitua por 5 mL de DMEM fresco. Passar o sobrenadante contendo VLP através de um filtro de 0,45 nm, alíquota e transferir para -70 °C para armazenamento. Certifique-se de que as alíquotas sejam de um tamanho adequado para experimentos planejados (250 μL como sugestão), pois ciclos repetidos de congelamento-descongelamento resultarão em perda de título viral.
- Dia 5 (manhã): Colha o vírus como em 1,5, mas descarte as placas após a coleta do sobrenadante.
2. Titulação de novo VLP antes do uso
- Dia 1: Semente 293T a 2 x 105 células por poço de uma placa de 24 poços - 4 poços por vírus a serem titulados, incluindo um vírus de infectividade conhecida para cada espinha dorsal. Otimize a densidade de semeadura para um determinado estoque de células.
- Dia 2: Observe a placa para verificar a confluência (idealmente ~ 70%). Descongele o sobrenadante que contém vírus das etapas 1.5 e 1.6. Adicione 0, 10, 25 ou 100 μL a cada poço.
- Dia 4 (Manhã): Colha as células para análise por citometria de fluxo.
- Remova o meio por pipetagem ou aspiração cuidadosas. Lave as células suavemente com 250 μL de solução salina tamponada com fosfato (PBS). Remova as células da placa pipetando para cima e para baixo com PBS de 250 μL e transfira para um tubo de microcentrífuga. Adicionar 250 μL de paraformaldeído a 4% (levando a concentração final a 2%).
CUIDADO: O paraformaldeído é tóxico. Não deve ser misturado com desinfetantes à base de cloro. - Pellet as células por centrifugação a 500 x g por 5 min, descartar o sobrenadante e ressuspender o pellet celular em 200 μL de PBS ou tampão alternativo de citometria de fluxo. Analise RFP ou YFP, conforme apropriado, por citometria de fluxo. Normalizar a infectividade de um determinado estoque de vírus em relação aos valores de um estoque de infecciosidade conhecida.
NOTA: A VLP também pode ser normalizada pelo ensaio imunoenzimático p24 (ELISA); no entanto, este não é necessariamente um bom indicador de infecciosidade de VLP, especialmente quando os estoques de VLP são preparados em diferentes transfecções. Os métodos de dose infecciosa de cultura de tecidos mediana publicada ou multiplicidade de infecção (TCID50/MOI)11 também podem fornecer quantificação relativa, embora estes não estejam bem estabelecidos para MLV. A fluorescência relativa fornece uma alternativa econômica aos métodos comerciais de ELISA de transcriptase reversa.
- Remova o meio por pipetagem ou aspiração cuidadosas. Lave as células suavemente com 250 μL de solução salina tamponada com fosfato (PBS). Remova as células da placa pipetando para cima e para baixo com PBS de 250 μL e transfira para um tubo de microcentrífuga. Adicionar 250 μL de paraformaldeído a 4% (levando a concentração final a 2%).
3. Transdução de U937 com VLP expressando SAMHD1 e YFP
NOTA: As etapas 3 a 6 constituem o experimento de restrição. Os dias são contados para facilitar o planejamento.
- Dia 1 (tarde): Descongelar VLP para transdução, incluindo MLV-Wild-type SAMHD1-YFP (controle positivo), MLV-SAMHD1(HD206-7AA)-YFP (controle negativo) e variante MLV-SAMHD1-YFP (amostras experimentais). Diluir a VLP normalizada para um volume final de 500 μL com o Roswell Park Memorial Institute 1640 media (RPMI) em um tubo de microfuga, adicionar 0,5 μL de polibreno (10 mg/mL) e misturar por cintilação.
- Se a VLP não puder ser titulada de antemão, use 100 μL em primeira instância. Use uma proporção máxima de 1:1 de VLP para RPMI para limitar a toxicidade induzida por VLP. Apontar para aproximadamente 30% de transdução.
- Aliquota 5 x 105 células U937 em um tubo de microfuga estéril para cada condição de transdução. Pellet por centrifugação a 500 x g durante 5 min e remover o sobrenadante (incluir dois tubos adicionais como controlos não transduzidos para citometria de fluxo). Ressuscite o pellet celular em 500 μL de VLP diluído (ou RPMI para controles não transduzidos) e transfira para um poço de uma placa de 24 poços.
- Espinoculado numa centrífuga de mesa a 800 x g durante 90 min a 20 °C. Adicione 1 mL de RPMI de 37 °C ao poço e deixe recuperar em uma incubadora de 37 °C por 3 dias.
4. Diferenciação do U937 transduzido
- Dia 4 (manhã): Ressuspeite as células pipetando suavemente e transfira 350 μL para cada um dos 4 poços de uma placa de 12 poços. Adicionar 700 μL de 37 °C RPMI contendo 150 nM PMA a cada poço dando uma concentração final de 100 nM e deixar diferenciar durante 3 dias.
NOTA: O PMA é comprado como um pó e deve ser ressuspenso a 1 mM em DMSO e armazenado no escuro. Deve ser preparado um material de trabalho de 100 μM diluindo 1/10 do stock de 1 mM com DMSO.
5. Infecção de U937 diferenciado, que expressa SAMHD1 com HIV-RFP
- Dia 7: Observe as células por microscopia. Certifique-se de que as células são aderentes. Aspirar o meio de todos os poços, adicionar 1 mL de RPMI ao poço 1 de cada conjunto de 4, permitindo o controle não transduzido e não infectado, bem como controles de cor única. Adicione de volta 0,5 mL de RPMI contendo aproximadamente 10 μL de HIV-1-RFP (aproximadamente 10 ng p24 como guia) a todos os outros poços. Apontar para aproximadamente 50% de infecção.
- Dia 8 (manhã): Adicione 0,5 mL de RPMI a cada um dos poços infectados.
6. Análise da citometria de fluxo
NOTA: É uma boa prática incluir uma mancha de morte viva em tubulações de citometria de fluxo. No entanto, se as células U937 forem de boa qualidade, esta etapa pode ser omitida sem consequências negativas para a análise a jusante. A pipetagem suave de células tripsinizadas deve facilmente resultar em uma única suspensão celular.
- Dia 10 (manhã): Aspirar o meio dos poços e lavar uma vez com PBS. Adicione 300 μL de enzima de dissociação celular (ou tripsina) por 5-10 min. Adicione mais 300 μL de PBS, ressuspenda completamente, certificando-se de que todas as células saíram da placa e transfira para tubos de citometria de fluxo.
- Adicionar 300 μL de paraformaldeído a 4% (levando a concentração final a 2%). Pellet as células por centrifugação a 500 x g por 5 min, descartar o sobrenadante e ressuspender o pellet celular em 200 μL de PBS ou tampão alternativo de citometria de fluxo. Analise por citometria de fluxo.
NOTA: As etapas abaixo são para um analisador Fortesa, mas a análise equivalente pode ser alcançada usando qualquer analisador capaz de ler fluorescência RFP e YFP. Consulte o suporte de citometria de fluxo local ou outro pesquisador experiente antes de configurar qualquer análise de citometria de fluxo. Quando muitas amostras precisam ser examinadas ao mesmo tempo, um amostrador de alto rendimento pode ser apropriado. Neste caso, um maior número de células e volume são aconselhados.
7. Análise da citometria de fluxo
- Ligue o citômetro 10 min antes de ser necessário e ligue o computador. Verifique se os resíduos estão vazios e se o tanque da bainha está cheio.
- Faça login na máquina e abra o software de análise.
- Mova o braço para o lado, retire o tubo de água, defina a taxa de fluxo como Alta e pressione Prime. Espere a luz se apagar e repita mais três vezes.
- Coloque a água de volta e corra para cima por 3 minutos e, em seguida, mude para Baixo e pressione Standby até prosseguir para a aquisição.
- Enquanto isso, configure o experimento dentro do software:
- Selecione Experimentar/Novo experimento (nome de acordo com a orientação local). No inspetor, exclua os fluorocromos desnecessários, deixando o Laser Azul 530/30 e o Laser Amarelo 610/20 ou as combinações recomendadas de laser e filtro para YFP e RFP para a máquina.
- Clique com o botão direito do mouse no experimento e escolha Configurações do citômetro/Configurações do aplicativo/Criar planilha. Na planilha, crie um borrão de pontos FSC-A/Área de Dispersão Lateral (FSC-A) e histograma YFP, histograma RFP e mancha de pontos GFP/YFP clicando no ícone correspondente e alterando os eixos clicando no rótulo do eixo.
- Clique com o botão direito do mouse novamente em Experimentar e adicione Novo Espécime. Renomeie conforme apropriado. Abra a amostra clicando no sinal de mais para revelar um novo tubo.
- Abra o painel de aquisição em Exibir, carregue o controle não infectado e não transduzido e pressione Adquirir. Ajuste as tensões FSC e SSC no painel para posicionar as células no quadrante inferior esquerdo (sem células nos eixos). Portão em torno desta população P1. Clique com o botão direito do mouse em outros gráficos e selecione mostrar P1 para remover detritos da análise subsequente.
- Carregue o controle de cor única para YFP (somente SAMHD1 do tipo selvagem) e adquira. Ajuste a tensão YFP no painel de instrumentos para que as células mais fluorescentes estejam dentro do alcance do detector (não na borda do eixo). Repita para controle de RFP de cor única.
- Execute a compensação automática usando os controles não transduzidos, não infectados e de cor única.
- Selecione Configuração de Compensação de > de Experimento > Criar Controles de Compensação no menu para alternar para uma planilha normal. Selecione a planilha normal não manchada, pressione Executar e adquira para o controle não manchado.
- Desenhe um portão ao redor das células intactas (P1) e registre. Remova o tubo e coloque a máquina em modo de espera. Clique com o botão direito do mouse em P1, clique em Aplicar a Todos os Controles de Compensação.
- Alterne para a planilha RFP normal e pressione Executar. Grave o controle RFP de cor única e coloque a máquina em modo de espera. O software deve selecionar automaticamente a população positiva.
- Repita para o controle de cor única YFP. Selecione Configuração de Compensação de > de Experimento > Calcular Compensação > Vincular e Salvar.
- Alterne para a planilha global. Adquirir as células transduzidas com SAMHD1 tipo selvagem, infectadas com HIV-RFP e verificar se quatro populações distintas podem ser vistas nos cantos dos quadrantes que estão alinhados vertical e horizontalmente para YFP e RFP, respectivamente. Remova o tubo e pressione Standby.
- Recarregue a amostra não transduzida e não infectada, pressione Executar e Gravar 30.000 eventos com P1 como a porta de parada. Repetir para as amostras restantes (incluindo outros controles). Renomeie os exemplos durante a execução ou post hoc. Uma vez exportados, os arquivos não podem ser renomeados.
- Exporte os dados como arquivos .fcs e limpe os fluidics de acordo com as instruções locais.
8. Análise dos dados
Observação : as etapas a seguir correspondem à análise no FlowJo v10; no entanto, etapas equivalentes podem ser facilmente executadas em outros softwares de análise.
- Abra o software e arraste todos os arquivos .fcs para o painel. Selecione os controles de compensação e arraste-os para a subpasta de compensação. Abra o arquivo para o tubo não transduzido e não infectado clicando duas vezes, o que exibirá o gráfico FSC-A/SSC-A.
- Selecione a ferramenta de polígono e a porta na população de células intactas, excluindo detritos no canto inferior esquerdo. Nomeie esta Célula. Arraste este portão para toda a população de tubos na barra Todas as amostras . Percorra cada amostra individual usando os botões de seta horizontal para garantir que o gating seja apropriado para cada tubo.
- Clique duas vezes na população de células para a amostra não transduzida e não infectada e ajuste os eixos para FSC-Height (H) vs FSC-Area (A). Selecione a única grande população usando um portão retangular para excluir duplicatas. O software irá sugerir automaticamente o nome deste Single Cells.
- Arraste esse portão para todas as populações de células e, novamente, verifique se o bloqueio é apropriado para todas as amostras. Selecione a população de Células Únicas para a amostra não infectada e não transduzida, altere os eixos para laser azul compensado (y , YFP) versus laser amarelo compensado (x, RFP). Pressione T no eixo e selecione Escala biexponencial para x e y.
- Selecione a Ferramenta de Bloqueio de Quadrante e clique no extremo superior direito da população de células negativas. Aplique esse controle preliminar a todas as populações de Célula Única arrastando para a barra Todas as Amostras . Quando as portas do quadrante não separam satisfatoriamente as populações, pode ser necessário portar quadrantes individuais usando a ferramenta de polígonos, como na Figura 2.
- Role até a amostra somente SAMHD1 do tipo selvagem (somente YFP) e verifique se o limite entre o não transduzido (YFP negativo) e o YFP positivo está correto. Pode ajudar a mudar para a visão de contorno para discriminar as células YFP negativas das fracas. Se as células YFP +ve superiores estiverem espalhadas amplamente, ajuste o portão vertical superior à direita.
- Percorra todas as amostras e verifique o gating em relação à positividade do YFP. Use a melhor divisão entre YFP negativo e positivo que seja válida para todas as amostras.
NOTA: A compensação terá sido calculada com base no nível de expressão YFP SAMHD1 do tipo selvagem. Se os níveis de infecção forem muito diferentes entre diferentes células transduzidas SAMHD1-YFP, a compensação pode precisar ser ajustada. Portanto, é preferível que o YFP VLP seja normalizado antes do uso. - Role até o tubo infectado pelo HIV-RFP não transduzido e verifique se o limite entre RFP negativo não infectado e RFP positivo infectado está correto. Ajuste conforme apropriado, usando a visualização de contorno, se necessário, e percorra as amostras restantes para verificar se o gating é válido para todas as amostras.
- Cada amostra requer duplo negativo (Q4: inferior esquerdo, não transduzido, não infectado), YFP positivo (Q1: canto superior esquerdo, SAMHD1 expresso, não infectado), RFP-positivo (Q3: inferior direito, não transduzido, infectado pelo HIV) e duplo positivo (Q2: canto superior direito, SAMHD1 expressando infectado pelo HIV). Abra o editor de tabelas clicando no ícone e arraste as quatro portas do quadrante para o painel. Selecione Excel Export e clique em Create Table. Salve a planilha gerada de acordo com as convenções de nomenclatura de arquivos locais.
- Para exportar representações de gráficos e estratégias de bloqueio, clique no ícone Editor de layout . Selecione cada população e arraste para o editor com os eixos, a rotulagem e o espaçamento necessários.
- Para criar um layout com os mesmos gráficos mostrados para todos os exemplos, selecione uma coluna e pressione Lote. Pressione Dimensionar para Largura e, em seguida, Evitar Quebras de Página. Salve no formato de arquivo necessário.
- Na planilha exportada, calcule a razão de restrição gerando colunas de porcentagem de RFP de YFP-ves (RFP+ve / (duplo negativo + RFP+ve)) e porcentagem de RFP de YFP+ves (duplo positivo / (duplo positivo + YFP+ve)) e, em seguida, uma coluna final de (%RFP de YFP+ve / %RFP de YFP-ve), consulte a Figura 1. Calcule a média dos dados replicados para cada construção SAMHD1 e calcule se os valores de restrição para variantes SAMHD1 testadas são significativamente diferentes do tipo selvagem e/ou 206-7AA usando o software de análise de dados apropriado.
Resultados
Os resultados da análise acima devem produzir uma razão de restrição de 0,25 ou menor para o controle positivo SAMHD1 do tipo selvagem e 1,0 para o controle negativo. Se essas duas verificações de controle de qualidade forem válidas, considere a significância estatística dos resultados. As variantes SAMHD1 que não mostram diferença significativa do tipo selvagem, portanto, carregam substituições que não afetam a restrição SAMHD1 neste contexto. Aqueles significativamente diferentes do tipo selvagem mostram restrição prejudicada. Se estes não forem significativamente diferentes do controle negativo, então eles não têm a capacidade de restringir nesse contexto (Figura 4 painéis à esquerda).
Se o valor de restrição SAMHD1 do tipo selvagem for maior que 0,3, os resultados para vírus de teste podem ser indicativos, mas não podem ser confiáveis. A restrição ineficaz por proteína do tipo selvagem pode resultar do uso de células U937 muito cedo após a recuperação da reconstituição (dentro de 2 semanas) ou quando estiverem muito velhas (>2-3 meses). Esses parâmetros podem precisar ser determinados empiricamente para um determinado estoque de células. Normalmente, quanto menor a passagem, mais confiáveis as células se diferenciam e, portanto, fornecem o ambiente apropriado para a restrição SAMHD1. O nível de infecção inadequado com SAMHD1-YFP ou HIV-RFP também pode resultar em dificuldades com a compensação e a determinação a jusante da razão de restrição. Um exemplo é ilustrado nos painéis à direita da Figura 4.
Se o controle negativo se desviar de 1,0 (fora da faixa de 0,9-1,2), isso pode indicar um problema com a análise, seja a proporção de células infectadas, a estratégia de bloqueio ou a saúde das células estão afetando o ensaio. Consulte as NOTAS acima.
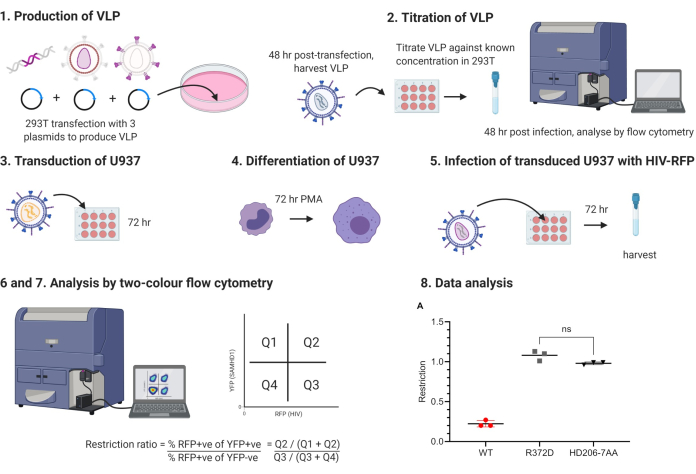
Figura 1: Protocolo de estrutura de tópicos esquemáticos. VLP, partículas semelhantes a vírus, PMA, acetato de miristato de phorbol. Os estágios numerados correspondem aos estágios do protocolo. Figura produzida usando BioRender.com. Por favor, clique aqui para ver uma versão maior desta figura.
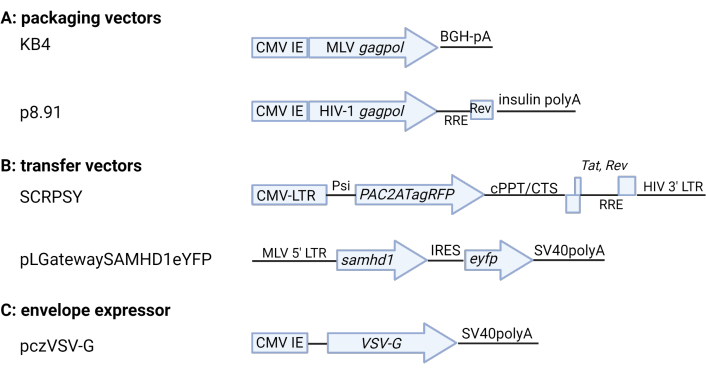
Figura 2: Esquema dos plasmídeos retrovirais . (A) Vetores de empacotamento (B) Vetores de transferência (C) Expresso de envelope VSV-G. A codificação chave e os elementos regulatórios são mostrados. Para obter detalhes, consulte a Tabela de Materiais. CMV IE: citomegalovírus promotor imediato-precoce, BGH: hormônio do crescimento bovino, pA: poliA, RRE: Rev Response Element, CMV-LTR: promotor composto CMV-HIV-1 LTR, Psi: sinal de embalagem HIV-1, cPPT/CTS: trato polipurino central/sequência de terminação central, SV40: vírus vacuolizante símio 40. Figura produzida usando BioRender.com. Por favor, clique aqui para ver uma versão maior desta figura.
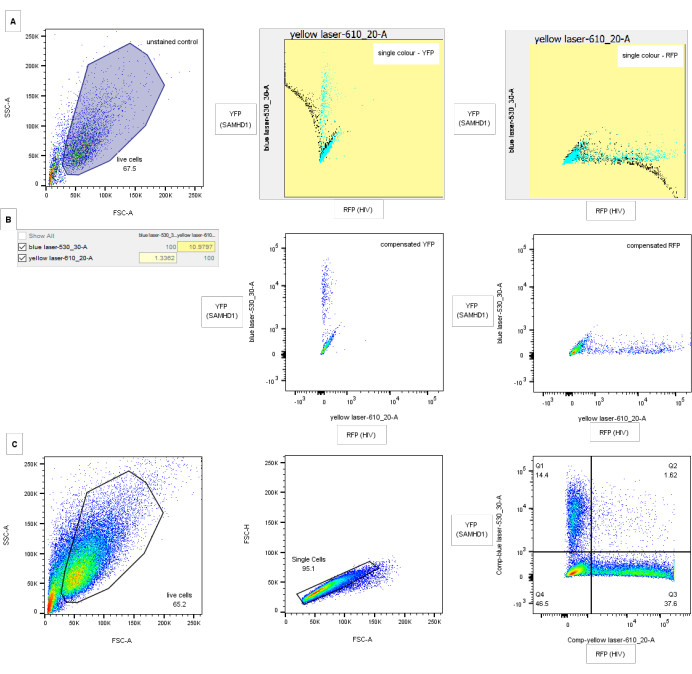
Figura 3: Estratégia de bloqueio para análise de citometria de fluxo. (A) Controles de compensação: o painel esquerdo mostra o controle FSC-A/SSC-A em células de tato para o controle não transduzido e não infectado. Os painéis central e direito mostram capturas de tela de controles de compensação de cor única para YFP (médio) e RFP (direita) com dados não compensados em preto e compensados em azul. (B) Matriz de compensação correspondente e gráficos para controles de compensação acima. (C) Estratégia de confinamento. Os detritos são eliminados através da análise de todas as células pelo FSC-A/SSC-A (painel esquerdo). Os dubletos são excluídos por gating na altura do FSC versus área (painel central). O painel direito mostra um exemplo de restrição do HIV-1 por SAMHD1 do tipo selvagem. Os eixos mostram fluorescência a laser azul e amarela compensada correspondente às células positivas para YFP (SAMHD1) e RFP (HIV), respectivamente. As portas do quadrante são desenhadas através da comparação de controles negativos e de cor única para RFP e YFP. Os números indicam a porcentagem da população dos pais. Os valores de compensação para YFP com GFP serão muito mais altos, mas é possível discriminar usando conjuntos de filtros apropriados. Por favor, clique aqui para ver uma versão maior desta figura.
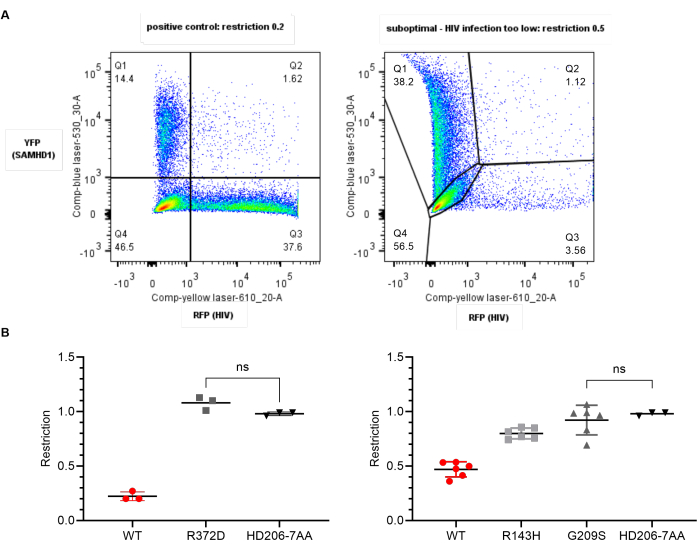
Figura 4: Resultados esperados: dados ideais versus subótimos. (A) Gráficos YFP/RFP representativos para dados ótimos (à esquerda) e subótimos (à direita). Os números indicam a porcentagem da população dos pais. No painel direito, a infecção pelo HIV é muito baixa, criando dificuldades com compensação e gating. A taxa de restrição é maior do que o esperado em 0,5. (B) Gráficos de razão de restrição para variantes de SAMHD1 em relação ao tipo selvagem (WT, vermelho) ou ao controle negativo (HD206-7AA, preto) gerado usando software estatístico. Cada ponto representa um valor replicado. A média e o desvio padrão são mostrados. Os testes t pareados entre cada grupo foram significativos em todos os casos esperados quando mostrados. Esquerda: Dados ideais - WT mostra a restrição esperada de aproximadamente 0,2, negativo mostra 1,0. A variante R372D (cinza) é significativamente diferente do WT, mas não significativa do controle negativo e, portanto, perdeu a capacidade de restringir. Direita: Dados subótimos. Aqui, o negativo se comporta como esperado, mas em todas as seis repetições o WT mostra apenas uma razão de restrição de 0,5, devido à baixa taxa de infecção. A baixa variância dentro dos grupos significa que R143H mostra um fenótipo intermediário estatisticamente diferente do WT e do negativo, enquanto o G209S não restringe; no entanto, isso deve ser repetido com células frescas, pois o controle positivo não deu a razão de restrição esperada. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Como discutido nas notas acima, os aspectos críticos do protocolo giram em torno da retenção do fenótipo celular correto para a produção de VLP e para a criação do ambiente apropriado para observar a restrição SAMHD1. Em primeiro lugar, a análise precisa da restrição por citometria de fluxo de duas cores depende de alcançar proporções apropriadas de células transduzidas e infectadas para que haja células suficientes em cada área do gráfico para análise. Como tal, o investigador deve visar um MOI inferior a 1 (ver Protocolo). As taxas de transdução e infecção que são muito altas ou muito baixas levam a problemas com a análise devido à falta de células não infectadas ou duplamente infectadas. Da mesma forma, uma taxa de transdução semelhante para vetores SAMHD1 a serem comparados é fundamental para permitir que a mesma matriz de compensação e gating sejam aplicados a todo o experimento, aumentando a confiança na análise subsequente.
Em segundo lugar, a idade das células U937 usadas é um fator-chave para saber se elas se diferenciam com sucesso. A diferenciação bem-sucedida pode ser monitorada através da observação da adesão, uma acidificação reduzida do meio ao longo do tempo após a diferenciação e restrição adequada pelo tipo selvagem de controle positivo no ensaio. A diferenciação de até 5 dias foi bem sucedida.
Uma das principais vantagens deste ensaio é a sua flexibilidade. Uma variedade de versões modificadas do SAMHD1 (domínios, aminoácidos, sequências de espécies) pode ser testada através de mutagênese simples dirigida ao local do vetor ou clonagem. Da mesma forma, variantes do vírus testador podem ser exploradas. O ensaio foi usado anteriormente para demonstrar que os mutantes da transcriptase reversa do HIV-1 com capacidade reduzida de se ligar ao dNTP são mais sensíveis à restrição da SAMHD1. O mesmo princípio pode ser usado para testar a restrição de outros vírus pelo SAMHD1. Além disso, condições de diferenciação variadas ou manipulação artificial das concentrações intracelulares de dNTP podem ser usadas para investigar ainda mais a interação entre as condições intracelulares e a atividade da SAMHD1, uma área de pesquisa ativa no laboratório Bishop. A interação da SAMHD1 com vários inibidores da transcriptase reversa de nucleosídeos também foi descrita, e o efeito da SAMHD1 demonstrado usando este ensaio modificado para uso em células primárias12,13,14,15.
A adaptação do protocolo para uso em células primárias supera a limitação colocada pelo exame de fenótipos metabólicos em células transformadas. No entanto, o formato existente permite um protocolo conveniente e menos tecnicamente desafiador para análise de alto rendimento, especialmente com o uso de um citômetro de fluxo com um amostrador de alto rendimento. Ao adaptar o protocolo, a suscetibilidade das células internamente não transduzidas a efeitos de espectador (por exemplo, sinalização imunológica) deve ser considerada.
Tal como acontece com muitos aspectos da biologia celular, é essencial que tais ensaios sejam usados como parte de uma abordagem holística para a compreensão de um determinado fenômeno. O uso paralelo de ensaios bioquímicos para a atividadeSAMHD1 16, a quantificação de pools intracelulares de dNTP e a observação de fenótipos mutantes SAMHD1 em humanos, ex vivo e em modelos animais (sendo realizados por laboratórios de todo o mundo, alguns descritos nesta edição) são fundamentais para a evolução da compreensão dessa proteína complexa.
Divulgações
Para fins de Acesso Aberto, os autores aplicaram uma licença de direitos autorais públicos CC BY a qualquer versão do Manuscrito Aceito pelo Autor decorrente desta submissão. As opiniões expressas são as do(s) autor(es) e não necessariamente as do NIHR ou do Departamento de Saúde e Assistência Social.
Agradecimentos
Este trabalho foi apoiado pelo Francis Crick Institute, que recebe seu financiamento principal da Cancer Research UK (FC001042 e FC001162), do Conselho de Pesquisa Médica do Reino Unido (FC001042 e FC001162) e do Wellcome Trust (FC001042 e FC001162) e por um Wellcome Trust Investigator Award para JPS (108012/Z/15/Z). O trabalho na Universidade de Cambridge foi co-financiado pelo NIHR Cambridge Biomedical Research Centre, The Evelyn Trust (16/21), The Rosetrees Trust (M590) e pelo Conselho de Pesquisa Médica do Reino Unido (MR / S009752/1). Este último prémio financiado pelo Reino Unido faz parte do programa EDCTP-2 apoiado pela União Europeia.
Materiais
| Name | Company | Catalog Number | Comments |
| 293T cells | ATCC | CRL-3216 | |
| 0.45 µm syringe filters | Sartorius | FCT122 | |
| 10 cm dishes | Corning | 430167 | virus preps can be scaled up through transfection in higher capacity plates/flasks - see transfection reagent guidance |
| 12 well plates | Greiner | 665180 | |
| 24 well plates | Greiner | 662160 | |
| BD LSRFortessa cell analyzer | BD Bioscience | 649225 | alternative analysers can be used as long as they can read RFP and YFP fluorescence |
| DMEM | Sigma | D6429 | ATCC recommends Dulbecco's Modified Eagle's Medium (DMEM) is modified to contain 4 mM L-glutamine, 4500 mg/L glucose, 1 mM sodium pyruvate, and 1500 mg/L sodium bicarbonate. |
| DMSO | Fisher | BP-231-100 | |
| fetal bovine serum | Gibco | 10500064 | |
| Flowjo | BD Bioscience | - | alternative analysis software can be used |
| light microscope | - | - | Any bright field light microscope |
| p8.91 | - | - | HIV GagPol expressor (PMID: 8602510) |
| paraformaldehyde (4 % in PBS) | Alfa Aesar | J61889 | |
| PBS | Sigma | D8537 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher | 15140122 | |
| phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| polybrene | Sigma | TR-1003 | |
| pKB4 | - | - | Murine leukaemia Virus GagPol expressor (PMID: 23035841) |
| pLGatewaySAMHD1eYFP | - | - | MLV packaging plasmid encoding wild-type human sequence. Details and cloning procedures Arnold et al 2015 (Ref 1). |
| pLGatewaySAMHD1HD206-7AAeY FP | - | - | As above, encodes amino acid substitutions at crucial active sites residues |
| Prism | Graphpad | - | https://www.graphpad.com/scientific-software/prism/ Other data representation software are also suitable |
| pVSV-G | - | - | VSV-G expressor (https://www.addgene.org/138479/), alternative: pMD2.G (https://www.addgene.org/12259/) |
| RPMI | ThermoFisher | 21875034 | |
| screw-cap tubes | StarLab | E1415-2231 | |
| SCRPSY | - | - | HIV packaging plasmid encoding RFP, Sam Wilson, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5026698/ |
| stripettes 10 mL | Corning | 10084450 | |
| stripettes 5 mL | Corning | 10420201 | |
| TrypLE express | Gibco | 12604021 | Trypsin will also be suitable |
| Turbofect | ThermoFisher | R0531 | alternative transfection reagents will also work well |
| U937 cells | ATCC | CRL-1593.2 |
Referências
- Sundström, C., Nilsson, K. Establishment and characterization of a human histiocytic lymphoma cell line (U-937). International Journal of Cancer. 17 (5), 565-577 (1976).
- Bock, M., Bishop, K. N., Towers, G., Stoye, J. P. Use of a transient assay for studying the genetic determinants of Fv1 restriction. Journal of Virology. 74 (16), 7422-7430 (2000).
- Yap, M. W., Nisole, S., Lynch, C., Stoye, J. P. Trim5alpha protein restricts both HIV-1 and murine leukemia virus. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10786-10791 (2004).
- Arnold, L. H., et al. Phospho-dependent regulation of SAMHD1 oligomerisation couples catalysis and restriction. PLoS Pathogens. 11 (10), 1005194 (2015).
- Groom, H. C. T., et al. Absence of xenotropic murine leukaemia virus-related virus in UK patients with chronic fatigue syndrome. Retrovirology. 7, 10 (2010).
- Mothes, W., Boerger, A. L., Narayan, S., Cunningham, J. M., Young, J. A. Retroviral entry mediated by receptor priming and low pH triggering of an envelope glycoprotein. Cell. 103 (4), 679-689 (2000).
- Pietschmann, T., et al. Foamy virus capsids require the cognate envelope protein for particle export. Journal of Virology. 73 (4), 2613-2621 (1999).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bainbridge, J. W., et al. In vivo gene transfer to the mouse eye using an HIV-based lentiviral vector; efficient long-term transduction of corneal endothelium and retinal pigment epithelium. Gene Therapy. 8 (21), 1665-1668 (2001).
- Kane, M., et al. Identification of interferon-stimulated genes with antiretroviral activity. Cell Host and Microbe. 20 (3), 392-405 (2016).
- Gao, Y., et al. Calculating HIV-1 infectious titre using a virtual TCID50 method. Methods in Molecular Biology. 485, 27-35 (2009).
- Ordonez, P., et al. SAMHD1 enhances nucleoside-analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824 (2017).
- Ballana, E., et al. SAMHD1 specifically affects the antiviral potency of thymidine analog HIV reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 58 (8), 4804-4813 (2014).
- Huber, A. D., et al. SAMHD1 has differential impact on the efficacies of HIV nucleoside reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 58 (8), 4915-4919 (2014).
- Amie, S. M., et al. Anti-HIV host factor SAMHD1 regulates viral sensitivity to nucleoside reverse transcriptase inhibitors via modulation of cellular deoxyribonucleoside triphosphate (dNTP) levels. The Journal of Biological Chemistry. 288 (28), 20683-20691 (2013).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados