Method Article
Анализ ограничения SAMHD1 с помощью проточной цитометрии в миелоидных клетках человека U937
В этой статье
Резюме
Здесь описан установленный метод определения степени ограничения ВИЧ-1 клеточным ингибирующим белком SAMHD1. Клетки миелоидной линии U937 человека трансдуцируются вектором экспрессии SAMHD1, коэкспрессирующим YFP, дифференцируются, а затем оспариваются ВИЧ-RFP. Уровень ограничения определяется анализом проточной цитометрии.
Аннотация
Стерильный α-мотив /гистидин-аспартат-домен-содержащий белок 1 (SAMHD1) ингибирует репликацию ВИЧ-1 в покоящихся миелоидных клетках. Клетки U937 широко используются в качестве удобной клеточной системы для анализа активности SAMHD1 из-за низкого уровня экспрессии РНК SAMHD1, что приводит к неопределяемой эндогенной экспрессии белка. Основываясь на аналогичных анализах, разработанных в лаборатории Стойе для характеристики других факторов ретровирусной рестрикции, лаборатория Бишопа разработала двухцветный рестрикционный анализ для анализа SAMHD1 в клетках U937. Вирус лейкемии мышей, экспрессирующие SAMHD1, наряду с YFP, экспрессируемым из IRES, используются для передачи клеток U937. Затем клетки обрабатывают форбол миристат ацетатом, чтобы индуцировать дифференцировку до фенотипа покоя. После дифференцировки клетки заражаются вирусоподобными частицами ВИЧ-1, экспрессирующими флуоресцентный репортер. Через 48 ч клетки собирают и анализируют методом проточной цитометрии. Доля ВИЧ-инфицированных клеток в популяции, экспрессирующей SAMHD1, сравнивается с долей в клетках внутреннего контроля, в которых отсутствует SAMHD1. Это сравнение выявляет коэффициент ограничений. Экспрессия SAMHD1 приводит к пятикратному снижению ВИЧ-инфекции, что соответствует коэффициенту ограничения 0,2. Наша недавняя замена RFP на оригинальный GFP в качестве репортерного гена для ВИЧ-инфекции облегчила анализ проточной цитометрии.
Этот анализ был успешно использован для характеристики влияния аминокислотных замен на ограничение SAMHD1 путем передачи вирусами, кодирующими измененные белки SAMHD1, полученные из сайт-направленного мутагенеза вектора экспрессии. Например, каталитические замещения сайта HD206-7AA показывают фенотип ограничения 1, что указывает на потерю рестрикционной активности. В равной степени можно определить восприимчивость различных вирусов тестеров. Анализ может быть дополнительно адаптирован для включения эффекта дифференцированного статуса, метаболического статуса и модификаторов SAMHD1, чтобы лучше понять взаимосвязь между SAMHD1, метаболическим состоянием клеток и вирусными ограничениями.
Введение
Стерильный α-мотив /гистидин-аспартат-домен-содержащий белок 1 (SAMHD1) препятствует репликации вируса иммунодефицита человека типа 1 (ВИЧ-1) в покоящихся клетках миелоидной линии. SAMHD1 блокирует репликацию через свою ферментативную активность в виде трифосфогидролазы dNTP, что приводит к снижению уровня внутриклеточных dNTP. В результате ВИЧ-1 не может эффективно выполнять процесс обратной транскрипции. За несколько лет, прошедших с момента этого первоначального наблюдения, был достигнут значительный прогресс, особенно в отношении вклада специфических доменов и аминокислот в противовирусную активность SAMHD1. Эти идеи были сделаны с использованием биохимических анализов, а также клеточных систем, имитирующих физиологически значимую миелоидную среду покоя. Клетки U9371 широко используются в качестве удобной миелоидной клеточной системы для анализа активности SAMHD1. Это связано с отсутствием эндогенной экспрессии SAMHD1, которая, как полагают, связана с низким уровнем РНК по сравнению с SAMHD1-экспрессирующими клетками (область текущих исследований). Здесь протокол описывает транзиторную трансдукцию клеток U937 вирусоподобными частицами, совместно экспрессирующими SAMHD1, и репортером желтого флуоресцентного белка (YFP) для изучения механизма ограничения SAMHD1 ВИЧ-1. Такие переходные двухцветные проточные цитометрические анализы для изучения ретровирусных ограничений были впервые разработаны в лабораторииStoye 2 и с тех пор были адаптированы для исследования других факторов рестрикции, включая белки трехстороннего мотива (TRIM)3. Вдохновленная этими анализами, лаборатория Бишопа разработала двухцветный анализ для анализа ограничения SAMHD1 в клетках U937.
Рабочий процесс эксперимента показан на рисунке 1. Частицы, подобные вирусу лейкемии мыши (MLV), содержащие бицистронное сообщение, кодирующее SAMHD1, наряду с YFP, экспрессируемым из IRES, используются для трансдукции клеток U937. Затем клетки обрабатывают форбол миристат ацетатом (PMA), чтобы индуцировать дифференцировку до фенотипа покоя. Затем клетки заражаются вирусоподобными частицами ВИЧ-1, экспрессирующими красный флуоресцентный белок (RFP). Через 48 ч клетки собирают и анализируют с помощью двухцветной проточной цитометрии. Этот анализ также используется с YFP и зеленым флуоресцентным белком (GFP), требующим менее стандартных комбинаций фильтров для анализа проточной цитометрии. Использование ВИЧ-RFP позволяет получить более простую компенсацию, и, таким образом, анализ более доступен для менее опытных пользователей проточной цитометрии и достижим с большинством цитометров.
Во время анализа сравнивается доля ВИЧ-инфицированных клеток между клетками, экспрессирующими SAMHD1, и клетками, в которых отсутствует SAMHD1 в одном колодце клеток. Это обеспечивает внутренний контроль в трубе цитометрии скважины / потока, что является ключевой особенностью. Сравнение уровней инфекции в трансдуцированных и нетрансдуцированных клетках выявляет соотношение ограничений. Соотношение 1,0 указывает на то, что трансдуцированный фактор не влияет на инфекционность. Экспрессия ДИКОГО ТИПА SAMHD1 приводит к пятикратному снижению ВИЧ-инфекции в этом анализе, что соответствует коэффициенту ограничения 0,2. Хотя этот эффект является скромным по сравнению с более классическими факторами ограничения, такими как TRIM5, эффект, тем не менее, воспроизводим и позволяет классифицировать модифицированные экспрессоры SAMHD1 на те, которые ограничивают эквивалентным образом белок дикого типа, те, которые не могут ограничивать, и те, которые имеют промежуточный фенотип.
Этот анализ был успешно использован для характеристики фенотипов домена SAMHD1 и рестрикционных мутантов аминокислот путем трансдукции вирусами, кодирующими мутантные последовательности SAMHD1. Например, каталитические замены сайта HD206-7AA не могут быть ограничены в этом анализе. В равной степени можно определить восприимчивость различных вирусов тестеров. Например, мутанты обратной транскриптазы ВИЧ-1 более восприимчивы к SAMHD1-опосредованному ограничению (например, 151V4). Этот протокол описывает детали производства вирусоподобных частиц (VLP), трансдукции U937 с векторами экспрессии SAMHD1, заражения ВИЧ с флуоресцентным репортером и последующего анализа с помощью проточной цитометрии. В этой статье обсуждается, какие данные ожидать и как избежать неоптимальных результатов. Наконец, изложены альтернативные варианты использования анализа, в дополнение к изучению различных вариантов SAMHD1, чтобы более тщательно понять взаимодействие между SAMHD1, уровнями dNTP и вирусной инфекцией. Учитывая роль SAMHD1 в центре клеточного метаболизма, с дополнительными связями с раком, это продолжает оставаться областью интенсивного интереса.
протокол
Этот протокол не содержит каких-либо исследований с участием животных или людей, выполненных кем-либо из авторов. Все этапы этого протокола были выполнены в соответствии с руководящими принципами и кодексами практики учреждений, в которых они осуществлялись.
1. Трансфекция 293T-клеток для производства VLP (как векторов экспрессии SAMHD1, так и частиц ВИЧ тестера)
ПРИМЕЧАНИЕ: Наиболее значительными факторами, способствующими успешному производству вирусных частиц, являются здоровье клеток-продуцентов 293T, конфузия при трансфекции и время сбора урожая. Лаборатории, как правило, имеют свои предпочтительные трансфекционные реагенты и протокол для производства ретровирусных частиц. Следующий протокол дает инфекционные частицы хорошего качества, но эквивалентные протоколы также подходят для этого применения. Чтобы поддерживать хорошее качество клеток 293T, проходите не менее трех раз в неделю для поддержания постоянного темпа роста. Клетки должны быть посеяны в логарифмической фазе роста для эффективной трансфекции.
- День 1: Посейте необходимое количество блюд размером 10 см с разделением 1/4 из почти сливающейся чашки с 293T-клетками, чтобы на следующий день получить около 60% слива (примерно 5 x 105 клеток / мл). Несколько плотностей, возможно, потребуется засеять для достижения соответствующей плотности для трансфекции на следующий день при работе с новым клеточным материалом.
- День 2 (утро): Проверьте примерно 60% сливание с помощью микроскопии и осторожно замените среду на клетках 10 мл свежей модифицированной орлиной среды Dulbecco (DMEM).
- День 2 (вторая половина дня, не менее 4 часов после смены носителя): Трансфект для производства VLP.
- Составьте смесь разбавления ДНК, содержащую по 3 мкг плазмиды экспрессора gag-pol , репортерную плазмиду, управляемую длинноконечным повторением (LTR), и экспрессорную плазмиду G-белка вируса везикулярного стоматита (VSV-G) (всего 9 мкг, см. ПРИМЕЧАНИЕ) в 600 мкл бессывороточного DMEM. Вихрь и центрифуга ненадолго (15 с, >500 х г).
- Добавьте 20 мкл трансфекционного реагента (см. Таблицу материалов), вихревой (не центрифугируйте) и инкубируйте при 20 °C в течение 15-20 мин. Добавьте трансфекционную смесь по каплям на тарелку, аккуратно закрутите, чтобы перемешать, и верните в инкубатор.
ПРИМЕЧАНИЕ: Для MLV VLP экспрессии SAMHD1 используйте KB4 5,6 (плазмида экспрессора gag-pol), pLGatewaySAMHD1IeYFP1 (LTR-управляемая репортерная плазмида) и pczVSV-G7. Для ВИЧ-RFP VLP используйте p8.91 8,9 (плазмида экспрессора gag-pol), SCRPSY10 (репортерная плазмида, управляемая LTR) и pczVSV-G. Альтернативы обсуждаются в Таблице материалов. Соотношения плазмид, возможно, потребуется оптимизировать для различных плазмидных/трансфекционных систем.
- День 3 (позднее утро): Осторожно удалите среду из клеток путем пипетирования, промыть 5 мл свежего DMEM и заменить 5 мл свежего DMEM.
- День 4 (утро): Соберите вирус, собрав супернатант из клеток и замените его 5 мл свежего DMEM. Пропустите VLP-содержащий супернатант через фильтр 0,45 нм, аликвот и передайте на -70 °C для хранения. Убедитесь, что аликвоты имеют размер, подходящий для запланированных экспериментов (250 мкл в качестве предположения), поскольку повторные циклы замораживания-оттаивания приведут к потере вирусного титра.
- День 5 (утро): Соберите вирус, как в 1,5, но выбросьте пластины после сбора супернатанта.
2. Титрование нового VLP перед использованием
- День 1: Семена 293T при 2 х 105 клетках на лунку 24-луночной пластины - 4 лунки на вирус, подлежащий титрованию, включая вирус известной инфекционной активности для каждой основы. Оптимизируйте плотность высева для данного клеточного материала.
- День 2: Понаблюдайте за плитой, чтобы проверить слияние (в идеале ~ 70%). Разморозьте вирусосодержащий супернатант на этапах 1.5 и 1.6. Добавьте 0, 10, 25 или 100 мкл к каждой лунке.
- День 4 (Утро): Соберите клетки для анализа с помощью проточной цитометрии.
- Удалите среду путем тщательного пипетирования или аспирации. Осторожно промыть клетки 250 мкл фосфатного буферного физиологического раствора (PBS). Извлеките ячейки из пластины путем пипетки вверх и вниз с 250 мкл PBS и переложите в микроцентрифужную трубку. Добавьте 250 мкл 4% параформальдегида (принимая конечную концентрацию до 2%).
ВНИМАНИЕ: Параформальдегид токсичен. Его не следует смешивать с дезинфицирующими средствами на основе хлора. - Гранулируйте клетки центрифугированием при 500 х г в течение 5 мин, отбрасывайте супернатант и повторно суспендируйте гранулу ячейки в 200 мкл PBS или альтернативного буфера проточной цитометрии. Анализ на RFP или YFP в зависимости от обстоятельств с помощью проточной цитометрии. Нормализовать инфекционность данного запаса вируса по отношению к значениям для запаса известной инфекционности.
ПРИМЕЧАНИЕ: VLP также может быть нормализован с помощью иммуноферментного анализа p24 (ИФА); однако это не обязательно является хорошим показателем инфекционности VLP, особенно в тех случаях, когда запасы VLP готовятся при различных трансфекциях. Опубликованные методы 11 средней культурытканей или кратность инфекции (TCID50/MOI) также могут обеспечить относительное количественное определение, хотя они не являются хорошо установленными для MLV. Относительная флуоресценция обеспечивает экономически эффективную альтернативу коммерческим методам ИФА с обратной транскриптазой.
- Удалите среду путем тщательного пипетирования или аспирации. Осторожно промыть клетки 250 мкл фосфатного буферного физиологического раствора (PBS). Извлеките ячейки из пластины путем пипетки вверх и вниз с 250 мкл PBS и переложите в микроцентрифужную трубку. Добавьте 250 мкл 4% параформальдегида (принимая конечную концентрацию до 2%).
3. Трансдукция U937 с VLP,экспрессирующим SAMHD1 и YFP
ПРИМЕЧАНИЕ: Шаги 3-6 представляют собой эксперимент по ограничению. Дни сочтены для удобства планирования.
- День 1 (вторая половина дня): Оттаивание VLP для трансдукции, включая MLV-Wild-type SAMHD1-YFP (положительный контроль), MLV-SAMHD1 (HD206-7AA)-YFP (отрицательный контроль) и вариант MLV-SAMHD1-YFP (экспериментальные образцы). Разбавьте нормализованный VLP до конечного объема 500 мкл с помощью среды Roswell Park Memorial Institute 1640 (RPMI) в микрофьюжной трубке, добавьте 0,5 мкл полибрена (10 мг / мл) и перемешайте путем щелчка.
- Если VLP не может быть титрован заранее, то в первую очередь используйте 100 мкл. Используйте максимальное соотношение VLP к RPMI 1:1 для ограничения токсичности, вызванной VLP. Стремитесь к примерно 30% трансдукции.
- Aliquot 5 x 105 клеток U937 в стерильную микрофьюжную трубку для каждого состояния трансдукции. Гранулы методом центрифугирования при 500 х г в течение 5 мин и удаляют супернатант (включают две дополнительные трубки в качестве нетрансдуцированных регуляторов для проточной цитометрии). Повторно суспендируют ячейку гранулы в 500 мкл разбавленного VLP (или RPMI для непереведенных элементов управления) и переносят в одну скважину из 24-луночной пластины.
- Спинокуляция в настольной центрифуге при 800 х г в течение 90 мин при 20 °C. Добавьте в скважину 1 мл 37 °C RPMI и дайте восстановиться в инкубаторе 37 °C в течение 3 дней.
4. Дифференциация трансдуцированных U937
- День 4 (утро): Повторно приостановить ячейки путем осторожной пипетки и переложить 350 мкл в каждую из 4 лунок 12-луночной пластины. Добавьте 700 мкл 37 °C RPMI, содержащего 150 нМ PMA, к каждой скважине, давая конечную концентрацию 100 нМ, и дайте дифференцировать в течение 3 дней.
ПРИМЕЧАНИЕ: PMA покупается в виде порошка и должна быть повторно суспендирована до 1 мМ в DMSO и храниться в темноте. Рабочий материал в 100 мкМ следует готовить путем разбавления ДМСО на 1/10 из запаса 1 мМ.
5. Заражение дифференцированного, SAMHD1-экспрессирующего U937 ВИЧ-RFP
- День 7: Наблюдение за клетками с помощью микроскопии. Убедитесь, что клетки являются адгезионными. Аспирируйте среду из всех скважин, добавьте 1 мл RPMI в скважину 1 из каждого набора из 4, что позволяет осуществлять нетрансдуцированный, неинфицированный контроль, а также одноцветные элементы управления. Добавьте обратно 0,5 мл RPMI, содержащего примерно 10 мкл ВИЧ-1-RFP (приблизительно 10 нг p24 в качестве ориентира), ко всем остальным скважинам. Стремитесь к примерно 50% инфекции.
- День 8 (утро): Добавьте 0,5 мл RPMI в каждую из зараженных скважин.
6. Анализ проточной цитометрии
ПРИМЕЧАНИЕ: Хорошей практикой является включение живого мертвого пятна в трубопроводы проточной цитометрии. Однако, если ячейки U937 имеют хорошее качество, этот шаг может быть опущен без негативных последствий для последующего анализа. Мягкое пипетирование трипсинизированных клеток должно легко привести к одноклеточной суспензии.
- День 10 (утро): Аспирировать средства массовой информации из колодцев и промыть один раз PBS. Добавьте 300 мкл фермента диссоциации клеток (или трипсина) в течение 5-10 мин. Добавьте дополнительные 300 мкл PBS, тщательно повторно суспендируйте, убедившись, что все клетки сошли с пластины, и перенесите в проточные трубки цитометрии.
- Добавьте 300 мкл 4% параформальдегида (принимая конечную концентрацию до 2%). Гранулируйте клетки центрифугированием при 500 х г в течение 5 мин, отбрасывайте супернатант и повторно суспендируйте гранулу ячейки в 200 мкл PBS или альтернативного буфера проточной цитометрии. Анализ методом проточной цитометрии.
ПРИМЕЧАНИЕ: Приведенные ниже шаги предназначены для анализатора Fortessa, но эквивалентный анализ может быть достигнут с использованием любого анализатора, способного считывать флуоресценцию RFP и YFP. Проконсультируйтесь с местной поддержкой проточной цитометрии или другим опытным исследователем, прежде чем настраивать какой-либо анализ проточной цитометрии. Когда необходимо одновременно просеивать много образцов, может быть целесообразным пробоотборник с высокой пропускной способностью. В этом случае рекомендуется увеличить количество и объем клеток.
7. Анализ проточной цитометрии
- Включите цитометр за 10 минут до того, как он потребуется, и включите компьютер. Убедитесь, что отходы пусты и что резервуар для оболочки заполнен.
- Войдите в систему и откройте программное обеспечение для анализа.
- Переместите кронштейн в сторону, снимите водяную трубку, установите скорость потока на Высокий и нажмите Prime. Подождите, пока погаснет свет, и повторите еще три раза.
- Снова включите воду и работайте на высоте в течение 3 минут, а затем переключитесь на низкий и нажмите «В режиме ожидания» до тех пор, пока не перейдете к приобретению.
- Тем временем настройте эксперимент внутри программного обеспечения:
- Выберите Эксперимент/Новый эксперимент (имя в соответствии с локальным руководством). В инспекторе удалите ненужные фторхромы, оставив Blue Laser 530/30 и Yellow Laser 610/20 или рекомендуемые комбинации лазеров и фильтров для YFP и RFP для машины.
- Щелкните правой кнопкой мыши эксперимент и выберите Настройки цитометра/Настройки приложения/Создать лист. На листе создайте точечную кляксу прямую точечную область рассеяния (FSC-A)/боковую область рассеяния (FSC-A) и гистограмму YFP, гистограмму RFP и точечную кляксу GFP/YFP, щелкнув соответствующий значок и изменив оси, щелкнув метку оси.
- Щелкните правой кнопкой мыши еще раз на Эксперимент и добавьте новый образец. При необходимости переименуйте. Откройте образец, щелкнув знак плюс, чтобы открыть новую трубку.
- Откройте панель мониторинга сбора из View, загрузите незараженный, непереведенный элемент управления и нажмите приобрести. Отрегулируйте напряжение FSC и SSC на приборной панели, чтобы расположить ячейки в нижнем левом квадранте (без ячеек на осях). Ворота вокруг этого населения Р1. Щелкните правой кнопкой мыши на других участках и выберите показать P1, чтобы удалить мусор из последующего анализа.
- Загрузите одноцветный элемент управления для YFP (только SAMHD1 подстановочного типа) и получите. Отрегулируйте напряжение YFP на приборной панели так, чтобы большинство флуоресцентных ячеек находились в пределах диапазона детектора (а не на краю оси). Повторите для одноцветного элемента управления RFP.
- Запустите автоматическую компенсацию с помощью непереведенных, незараженных и одноцветных элементов управления.
- Выберите «Экспериментировать > настройке компенсации» > «Создать элементы управления компенсацией » в меню, чтобы переключиться на обычный лист. Выберите незапятнанный обычный лист, нажмите кнопку Выполнить и приобретите для неиспорченного элемента управления.
- Нарисуйте ворота вокруг неповрежденных ячеек (P1) и запишите. Снимите трубку и переведите устройство в режим ожидания. Щелкните правой кнопкой мыши на P1, выберите Применить ко всем элементам управления компенсациями.
- Переключитесь на обычный лист RFP и нажмите кнопку Выполнить. Запишите одноцветный элемент управления RFP и переведите устройство в режим ожидания. Программное обеспечение должно автоматически выбирать положительную популяцию.
- Повторите для одноцветного элемента управления YFP. Выберите Эксперимент > Настройка компенсации > Рассчитать компенсацию > Связать и сохранить.
- Переключитесь на глобальный лист. Приобретите клетки, трансдуцированные диким типом SAMHD1, инфицированные ВИЧ-RFP, и проверьте, что в углах квадрантов можно увидеть четыре различные популяции, которые выровнены вертикально и горизонтально для YFP и RFP соответственно. Извлеките трубку и нажмите режим ожидания.
- Перезагрузите непереведенный, незараженный образец, нажмите Выполнить и записать 30 000 событий с P1 в качестве стоп-шлюза. Повторите для остальных образцов (включая другие элементы управления). Переименуйте образцы во время выполнения или после хранения. После экспорта файлы не могут быть переименованы.
- Экспортируйте данные в виде файлов .fcs и очистите флюидики в соответствии с локальными инструкциями.
8. Анализ данных
ПРИМЕЧАНИЕ: Следующие шаги соответствуют анализу в FlowJo v10; однако эквивалентные шаги могут быть легко выполнены в другом аналитическом программном обеспечении.
- Откройте программное обеспечение и перетащите все файлы .fcs на панель мониторинга. Выберите элементы управления компенсацией и перетащите их во вложенную папку компенсации. Откройте файл для непереведенной, неинфицированной трубки двойным щелчком мыши, который вызовет график FSC-A / SSC-A.
- Выберите инструмент «Полигон» и затвор на неповрежденной популяции ячеек, исключая мусор в левом нижнем углу. Присвойте этим ячейкам имя. Перетащите эти ворота на всю совокупность трубок на панели «Все образцы ». Прокрутите каждый отдельный образец с помощью горизонтальных кнопок со стрелками, чтобы убедиться, что затвор подходит для каждой трубки.
- Дважды щелкните популяцию ячеек для непереведенного, неинфицированного образца и отрегулируйте оси в соответствии с высотой FSC (H) и областью FSC (A). Выберите одинарную большую популяцию, используя прямоугольные ворота, чтобы исключить дублеты. Программное обеспечение автоматически предложит назвать эту single Cells.
- Перетащите этот затвор на все популяции ячеек и снова проверьте, подходит ли затвор для всех образцов. Выберите популяцию одиночных клеток для неинфицированного, непереведенного образца, измените оси на компенсированный синий лазер (y, YFP) по сравнению с компенсированным желтым лазером (x, RFP). Нажмите T на оси и выберите Биэкспоненциальная шкала для x и y.
- Выберите инструмент Quadrant Gating Tool и щелкните в правом верхнем углу отрицательной популяции клеток. Примените это предварительное измерение ко всем популяциям одиночных ячеек , перетащив их на панель «Все образцы ». В тех случаях, когда затворы квадранта не разделяют популяции удовлетворительно, может потребоваться охватить отдельные квадранты с помощью инструмента полигона, как показано на рисунке 2.
- Прокрутите до образца SAMHD1 только дикого типа (только YFP) и проверьте правильность разрыва между нетрансдуцированным (отрицательный YFP) и положительным YFP. Это может помочь переключиться на контурный вид, чтобы отличить негатив от тусклых клеток YFP. Если самые верхние ячейки YFP +ve широко распределены, отрегулируйте верхний вертикальный затвор вправо.
- Прокрутите все образцы и проверьте решетку на предмет позитивности YFP. Используйте наилучшее деление между отрицательным и положительным YFP, которое справедливо для всех образцов.
ПРИМЕЧАНИЕ: Компенсация будет рассчитана на основе уровня выражения SAMHD1 YFP дикого типа. Если уровни инфекции сильно различаются между различными трансдуцированными клетками SAMHD1-YFP, компенсацию, возможно, потребуется скорректировать. Поэтому предпочтительно, чтобы YFP VLP были нормализованы перед использованием. - Прокрутите до нетрансдуцированной, инфицированной ВИЧ-RFP трубки и проверьте, является ли правильный разрыв между неинфицированным RFP-отрицательным и инфицированным RFP-положительным. Отрегулируйте соответствующим образом, используя контурное представление, если это необходимо, и прокрутите оставшиеся образцы, чтобы убедиться, что решетка действительна для всех образцов.
- Каждый образец требует двойных отрицательных результатов (Q4: нижний левый, нетрансдуцированный, неинфицированный), YFP-положительный (Q1: верхний левый, экспрессирующий SAMHD1, неинфицированный), RFP-положительный (Q3: нижний правый, непереводимый, ВИЧ-инфицированный) и двойной положительный (Q2: верхний правый, SAMHD1 экспрессирующий ВИЧ-инфицированный). Откройте редактор таблиц, щелкнув по значку, и перетащите четыре квадрантных ворота на панель мониторинга. Выберите Экспорт Excel и нажмите «Создать таблицу». Сохраните созданную электронную таблицу в соответствии с локальными соглашениями об именах файлов.
- Чтобы экспортировать представления графиков и стратегий захвата, нажмите на значок редактора макетов . Выберите каждую популяцию и перетащите в редактор необходимые оси, метки и интервалы.
- Чтобы создать макет с одинаковыми графиками, показанными для всех образцов, выберите один столбец и нажмите кнопку Batch. Нажмите кнопку «Масштабировать по ширине», а затем «Избегать разрывов страниц». Сохраните в требуемом формате файла.
- В экспортируемой электронной таблице рассчитайте коэффициент ограничения, сгенерировав столбцы процентного RFP YFP-ves (RFP+ve/ (двойные отрицательные + RFP+ve)) и процентного RFP YFP+ves (двойные положительные значения / (двойные положительные + YFP+ve)), а затем последний столбец (%RFP YFP+ve / %RFP YFP-ve), см. Рисунок 1. Усредните реплицируемые данные для каждой конструкции SAMHD1 и рассчитайте, значительно ли значения ограничений для тестируемых вариантов SAMHD1 отличаются от диких типов и/или 206-7AA с помощью соответствующего программного обеспечения для анализа данных.
Результаты
Результаты приведенного выше анализа должны дать коэффициент ограничения 0,25 или ниже для положительного контроля SAMHD1 дикого типа и 1,0 для отрицательного контроля. Если эти две проверки контроля качества действительны, то учитывайте статистическую значимость результатов. Поэтому варианты SAMHD1, которые не показывают существенных отличий от дикого типа, несут замены, которые не влияют на ограничение SAMHD1 в этом контексте. Те, которые значительно отличаются от дикого типа, показывают нарушение ограничений. Если они существенно не отличаются от отрицательного элемента управления, то у них отсутствует возможность ограничения в данном контексте (рисунок 4 левых панелей).
Если значение ограничения SAMHD1 дикого типа больше 0,3, то результаты для вирусов-тестеров могут быть ориентировочными, но на них нельзя полагаться. Неэффективное ограничение белком дикого типа может быть результатом использования клеток U937 слишком рано после восстановления после восстановления (в течение 2 недель) или когда они слишком стары (>2-3 месяца). Эти параметры, возможно, потребуется эмпирически определить для данного клеточного запаса. Как правило, чем ниже проход, тем надежнее клетки дифференцируются и, следовательно, обеспечивают соответствующую среду для ограничения SAMHD1. Неадекватный уровень инфицирования либо SAMHD1-YFP, либо ВИЧ-RFP также может привести к трудностям как с компенсацией, так и с последующим определением коэффициента ограничения. Пример проиллюстрирован на правых панелях рисунка 4.
Если отрицательный контроль отклоняется от 1,0 (за пределами диапазона 0,9-1,2), это может указывать на проблему с анализом, либо пропорция инфицированных клеток, стратегия гатинга или здоровье клеток влияют на анализ. Обратитесь к ПРИМЕЧАНИЯМ выше.
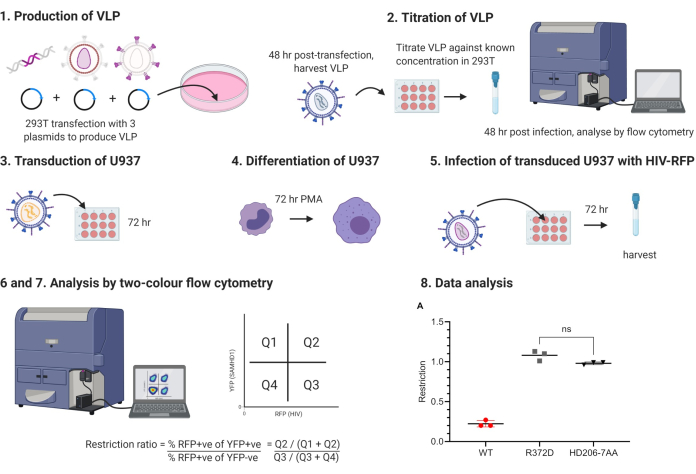
Рисунок 1: Схематический протокол структурирования. VLP, вирусоподобные частицы, PMA, форбол миристат ацетат. Пронумерованные этапы соответствуют этапам в протоколе. Рисунок, изготовленный с использованием BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
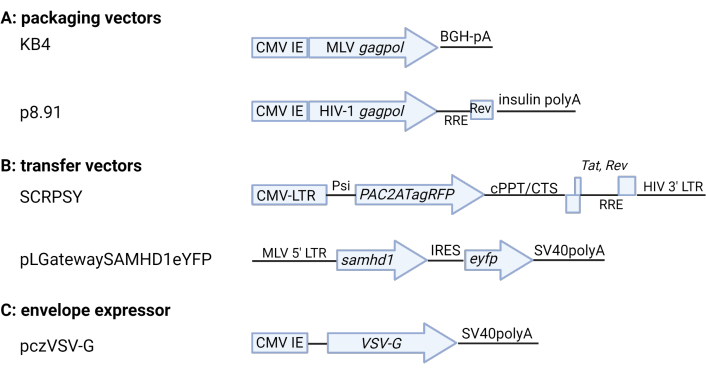
Рисунок 2: Схема ретровирусных плазмид. (A) Упаковка векторов (B) Векторы переноса (C) VSV-G конвертирующий экспрессор. Показаны ключевые кодирующие и нормативные элементы. Подробности см. в Таблице материалов. ЦМВ ИЭ: цитомегаловирус немедленный-ранний промотор, BGH: бычий гормон роста, pA: polyA, RRE: Rev Response Element, CMV-LTR: композитный промотор CMV-HIV-1 LTR, Psi: упаковочный сигнал ВИЧ-1, cPPT / CTS: центральный полипуриновый тракт / центральная терминальная последовательность, SV40: вирус вакуоляции обезьян 40. Рисунок, изготовленный с использованием BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
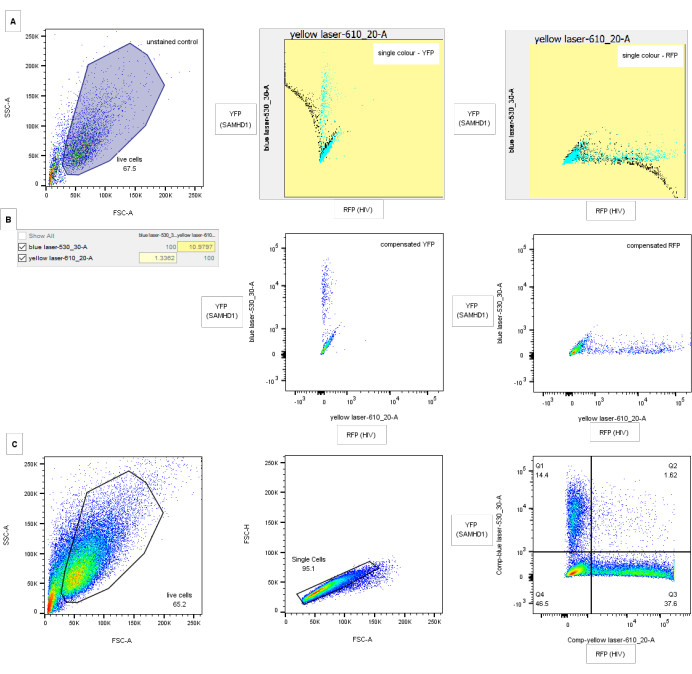
Рисунок 3: Стратегия гастинга для анализа проточной цитометрии. (A) Контроль компенсации: левая панель показывает FSC-A / SSC-A, наблюдающий на внутритактных клетках для нетрансдуцированного, неинфицированного контроля. Центральная и правая панели показывают скриншоты одноцветных элементов управления компенсацией для YFP (средний) и RFP (справа) с некомпенсированными данными черного цвета и компенсированными синим цветом. B) Соответствующая компенсационная матрица и графики для контроля за компенсацией выше. с) Стратегия определения границ. Мусор удаляется путем анализа всех клеток FSC-A/SSC-A (левая панель). Дублеты исключаются по высоте FSC по площади (центральная панель). На правой панели показан пример ограничения ВИЧ-1 диким типом SAMHD1. Оси показывают компенсированную синюю и желтую лазерную флуоресценцию, соответствующую YFP (SAMHD1) и RFP (ВИЧ)-положительным клеткам соответственно. Квадрантные затворы рисуются путем сравнения отрицательных и одноцветных элементов управления для RFP и YFP. Цифры указывают на процент родительского населения. Значения компенсации для YFP с GFP будут намного выше, но их можно дискриминировать с помощью соответствующих наборов фильтров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
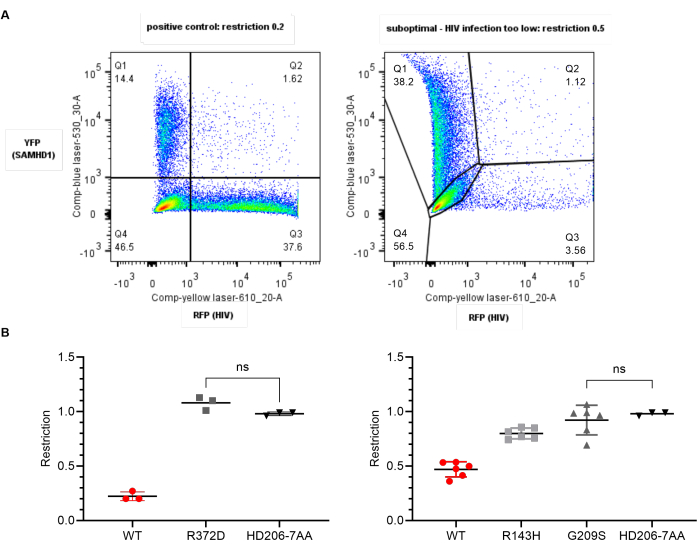
Рисунок 4: Ожидаемые результаты: идеальные и неоптимальные данные. (A) Репрезентативные графики YFP/RFP для оптимальных (слева) и субоптимальных (справа) данных. Цифры указывают на процент родительского населения. На правой панели ВИЧ-инфекция слишком низкая, что создает трудности с компенсацией и регулированием. Коэффициент ограничения выше, чем ожидалось, и составляет 0,5. (B) Графики коэффициента ограничения для вариантов SAMHD1 в отношении дикого типа (WT, красный) или отрицательного контрольного элемента (HD206-7AA, черный), полученные с использованием статистического программного обеспечения. Каждая точка представляет реплицированное значение. Показано среднее и стандартное отклонение. Парные t-тесты между каждой группой были значимыми во всех случаях, ожидаемых там, где это показано. Слева: Идеальные данные - WT показывает ожидаемое ограничение примерно 0,2, отрицательное показывает 1,0. Вариант R372D (серый) существенно отличается от WT, но не значителен от отрицательного контроля и, таким образом, утратил способность к ограничению. Справа: Неоптимальные данные. Здесь негатив ведет себя так, как ожидалось, но во всех шести репликах WT показывает только коэффициент ограничения 0,5 из-за низкого уровня заражения. Низкая дисперсия внутри групп означает, что R143H показывает промежуточный фенотип, статистически отличный от WT и отрицательный, в то время как G209S не ограничивает; однако это следует повторить со свежими клетками, поскольку положительный контроль не дал ожидаемого коэффициента ограничения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Как обсуждалось в примечаниях выше, критические аспекты протокола сосредоточены вокруг сохранения правильного фенотипа клеток для производства VLP и создания соответствующей среды для наблюдения за ограничением SAMHD1. Во-первых, точный анализ ограничения с помощью двухцветной проточной цитометрии опирается на достижение соответствующих пропорций трансдуцированных и инфицированных клеток, чтобы в каждой области участка было достаточно клеток для анализа. Таким образом, исследователь должен стремиться к MOI менее 1 (см. Протокол). Уровень трансдукции и инфицирования, которые либо слишком высоки, либо слишком низки, приводят к проблемам с анализом из-за отсутствия неинфицированных или дважды инфицированных клеток. Аналогичным образом, аналогичная скорость трансдукции для векторов SAMHD1, подлежащая сравнению, является ключом к тому, чтобы позволить применять одну и ту же матрицу компенсации и затвор ко всему эксперименту, повышая уверенность в последующем анализе.
Во-вторых, возраст используемых клеток U937 является ключевым фактором в том, успешно ли они дифференцируются. Успешная дифференциация может контролироваться путем наблюдения за адгезией, снижением подкисления сред с течением времени после дифференциации и адекватным ограничением положительным контролем дикого типа в анализе. Дифференциация до 5 дней была успешной.
Одним из ключевых преимуществ этого анализа является его гибкость. Различные модифицированные версии SAMHD1 (домены, аминокислоты, видовые последовательности) могут быть протестированы с помощью простого направленного на сайт мутагенеза вектора или клонирования. Точно так же можно исследовать варианты вируса тестера. Анализ использовался ранее, чтобы продемонстрировать, что мутанты обратной транскриптазы ВИЧ-1 с пониженной способностью связывать dNTP более чувствительны к ограничению SAMHD1. Тот же принцип может быть использован для тестирования ограничения других вирусов SAMHD1. Кроме того, различные условия дифференцировки или искусственные манипуляции с внутриклеточными концентрациями dNTP могут быть использованы для дальнейшего исследования взаимодействия между внутриклеточными условиями и активностью SAMHD1, областью активных исследований в лаборатории Бишопа. Также было описано взаимодействие SAMHD1 с различными нуклеозидными ингибиторами обратной транскриптазы, и эффект SAMHD1 показан с помощью этого анализа, модифицированного для использования в первичных клетках 12,13,14,15.
Адаптация протокола для использования в первичных клетках преодолевает ограничение, возникающее при изучении метаболических фенотипов в трансформированных клетках. Однако существующий формат позволяет создать удобный и менее технически сложный протокол для анализа высокой пропускной способности, особенно с использованием проточного цитометра с высокопроизводительным пробоотборником. При адаптации протокола следует учитывать восприимчивость внутренне нетрансдуцированных клеток к эффектам стороннего наблюдателя (например, иммунной сигнализации).
Как и во многих аспектах клеточной биологии, важно, чтобы такие анализы использовались как часть целостного подхода к пониманию данного явления. Параллельное использование биохимических анализов активности SAMHD116, количественная оценка внутриклеточных пулов dNTP и наблюдение мутантных фенотипов SAMHD1 у людей, ex vivo и на животных моделях (проводимых лабораториями по всему миру, некоторые из которых описаны в этом выпуске) являются ключевыми для развивающегося понимания этого сложного белка.
Раскрытие информации
Для целей открытого доступа авторы применили публичную лицензию CC BY на авторское право к любой версии принятой автором рукописи, вытекающей из этой заявки. Высказанные мнения принадлежат автору (авторам), а не обязательно NIHR или Департаменту здравоохранения и социального обеспечения.
Благодарности
Эта работа была поддержана Институтом Фрэнсиса Крика, который получает основное финансирование от Cancer Research UK (FC001042 и FC001162), Совета медицинских исследований Великобритании (FC001042 и FC001162) и Wellcome Trust (FC001042 и FC001162), а также премии Wellcome Trust Investigator Award для JPS (108012 / Z / 15 / Z). Работа в Кембриджском университете была совместно профинансирована Кембриджским биомедицинским исследовательским центром NIHR, The Evelyn Trust (16/21), The Rosetrees Trust (M590) и Советом медицинских исследований Великобритании (MR/S009752/1). Последняя премия, финансируемая Великобританией, является частью программы EDCTP2, поддерживаемой Европейским союзом.
Материалы
| Name | Company | Catalog Number | Comments |
| 293T cells | ATCC | CRL-3216 | |
| 0.45 µm syringe filters | Sartorius | FCT122 | |
| 10 cm dishes | Corning | 430167 | virus preps can be scaled up through transfection in higher capacity plates/flasks - see transfection reagent guidance |
| 12 well plates | Greiner | 665180 | |
| 24 well plates | Greiner | 662160 | |
| BD LSRFortessa cell analyzer | BD Bioscience | 649225 | alternative analysers can be used as long as they can read RFP and YFP fluorescence |
| DMEM | Sigma | D6429 | ATCC recommends Dulbecco's Modified Eagle's Medium (DMEM) is modified to contain 4 mM L-glutamine, 4500 mg/L glucose, 1 mM sodium pyruvate, and 1500 mg/L sodium bicarbonate. |
| DMSO | Fisher | BP-231-100 | |
| fetal bovine serum | Gibco | 10500064 | |
| Flowjo | BD Bioscience | - | alternative analysis software can be used |
| light microscope | - | - | Any bright field light microscope |
| p8.91 | - | - | HIV GagPol expressor (PMID: 8602510) |
| paraformaldehyde (4 % in PBS) | Alfa Aesar | J61889 | |
| PBS | Sigma | D8537 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher | 15140122 | |
| phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| polybrene | Sigma | TR-1003 | |
| pKB4 | - | - | Murine leukaemia Virus GagPol expressor (PMID: 23035841) |
| pLGatewaySAMHD1eYFP | - | - | MLV packaging plasmid encoding wild-type human sequence. Details and cloning procedures Arnold et al 2015 (Ref 1). |
| pLGatewaySAMHD1HD206-7AAeY FP | - | - | As above, encodes amino acid substitutions at crucial active sites residues |
| Prism | Graphpad | - | https://www.graphpad.com/scientific-software/prism/ Other data representation software are also suitable |
| pVSV-G | - | - | VSV-G expressor (https://www.addgene.org/138479/), alternative: pMD2.G (https://www.addgene.org/12259/) |
| RPMI | ThermoFisher | 21875034 | |
| screw-cap tubes | StarLab | E1415-2231 | |
| SCRPSY | - | - | HIV packaging plasmid encoding RFP, Sam Wilson, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5026698/ |
| stripettes 10 mL | Corning | 10084450 | |
| stripettes 5 mL | Corning | 10420201 | |
| TrypLE express | Gibco | 12604021 | Trypsin will also be suitable |
| Turbofect | ThermoFisher | R0531 | alternative transfection reagents will also work well |
| U937 cells | ATCC | CRL-1593.2 |
Ссылки
- Sundström, C., Nilsson, K. Establishment and characterization of a human histiocytic lymphoma cell line (U-937). International Journal of Cancer. 17 (5), 565-577 (1976).
- Bock, M., Bishop, K. N., Towers, G., Stoye, J. P. Use of a transient assay for studying the genetic determinants of Fv1 restriction. Journal of Virology. 74 (16), 7422-7430 (2000).
- Yap, M. W., Nisole, S., Lynch, C., Stoye, J. P. Trim5alpha protein restricts both HIV-1 and murine leukemia virus. Proceedings of the National Academy of Sciences of the United States of America. 101 (29), 10786-10791 (2004).
- Arnold, L. H., et al. Phospho-dependent regulation of SAMHD1 oligomerisation couples catalysis and restriction. PLoS Pathogens. 11 (10), 1005194 (2015).
- Groom, H. C. T., et al. Absence of xenotropic murine leukaemia virus-related virus in UK patients with chronic fatigue syndrome. Retrovirology. 7, 10 (2010).
- Mothes, W., Boerger, A. L., Narayan, S., Cunningham, J. M., Young, J. A. Retroviral entry mediated by receptor priming and low pH triggering of an envelope glycoprotein. Cell. 103 (4), 679-689 (2000).
- Pietschmann, T., et al. Foamy virus capsids require the cognate envelope protein for particle export. Journal of Virology. 73 (4), 2613-2621 (1999).
- Naldini, L., et al. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272 (5259), 263-267 (1996).
- Bainbridge, J. W., et al. In vivo gene transfer to the mouse eye using an HIV-based lentiviral vector; efficient long-term transduction of corneal endothelium and retinal pigment epithelium. Gene Therapy. 8 (21), 1665-1668 (2001).
- Kane, M., et al. Identification of interferon-stimulated genes with antiretroviral activity. Cell Host and Microbe. 20 (3), 392-405 (2016).
- Gao, Y., et al. Calculating HIV-1 infectious titre using a virtual TCID50 method. Methods in Molecular Biology. 485, 27-35 (2009).
- Ordonez, P., et al. SAMHD1 enhances nucleoside-analogue efficacy against HIV-1 in myeloid cells. Scientific Reports. 7, 42824 (2017).
- Ballana, E., et al. SAMHD1 specifically affects the antiviral potency of thymidine analog HIV reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 58 (8), 4804-4813 (2014).
- Huber, A. D., et al. SAMHD1 has differential impact on the efficacies of HIV nucleoside reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 58 (8), 4915-4919 (2014).
- Amie, S. M., et al. Anti-HIV host factor SAMHD1 regulates viral sensitivity to nucleoside reverse transcriptase inhibitors via modulation of cellular deoxyribonucleoside triphosphate (dNTP) levels. The Journal of Biological Chemistry. 288 (28), 20683-20691 (2013).
- Arnold, L. H., Kunzelmann, S., Webb, M. R., Taylor, I. A. A continuous enzyme-coupled assay for triphosphohydrolase activity of HIV-1 restriction factor SAMHD1. Antimicrobial Agents and Chemotherapy. 59 (1), 186-192 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены