É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaios de envelhecimento comportamental e expectativa de vida útil de alto rendimento usando a máquina de vida útil
Neste Artigo
Resumo
A plataforma de imagem "The Lifespan Machine" automatiza a observação ao longo da vida de grandes populações. Mostramos os passos necessários para realizar ensaios de expectativa de vida, resistência ao estresse, patogênese e envelhecimento comportamental. A qualidade e abrangência dos dados permitem estudar intervenções no envelhecimento, apesar da presença de variações biológicas e ambientais.
Resumo
Animais geneticamente idênticos mantidos em um ambiente constante apresentam uma ampla distribuição de tempo de vida, refletindo um grande aspecto estocástico não genético ao envelhecimento conservado em todos os organismos estudados. Esse componente estocástico significa que, para entender o envelhecimento e identificar intervenções bem-sucedidas que prolonguem a expectativa de vida ou melhorem a saúde, os pesquisadores devem monitorar grandes populações de animais experimentais simultaneamente. A pontuação manual tradicional de óbitos limita o rendimento e a escala necessários para testes de hipóteses em larga escala, levando ao desenvolvimento de métodos automatizados para ensaios de vida útil de alto rendimento. A Lifespan Machine (LSM) é uma plataforma de imagem de alto rendimento que combina scanners de mesa modificados com processamento de imagem personalizado e software de validação de dados para o rastreamento de nematoides ao longo da vida. A plataforma constitui um grande avanço técnico ao gerar dados de vida útil altamente resolvidos temporalmente a partir de grandes populações de animais em uma escala sem precedentes e com uma precisão estatística e precisão igual aos ensaios manuais realizados por pesquisadores experientes. Recentemente, o MSL tem sido desenvolvido para quantificar as alterações comportamentais e morfológicas observadas durante o envelhecimento e relacioná-las com o tempo de vida. Aqui, descrevemos como planejar, executar e analisar um experimento de vida útil automatizado usando o LSM. Destacamos ainda as etapas críticas necessárias para o sucesso da coleta de dados comportamentais e curvas de sobrevida de alta qualidade.
Introdução
O envelhecimento é um processo complexo, multifacetado, caracterizado pelo declínio da função fisiológica de um organismo, que leva ao aumento do risco de doença e morte ao longo do tempo1. O tempo de vida, medido como o tempo desde o nascimento ou o início da idade adulta até a morte, fornece um resultado inequívoco do envelhecimento2 e uma proxy indireta, mas rigorosamente quantitativa, para medir a taxa relativa de envelhecimento entre as populações3. Os estudos de envelhecimento geralmente dependem de medidas precisas da expectativa de vida, semelhantes aos ensaios clínicos, para comparar os desfechos entre uma população exposta a uma intervenção e um grupo controle não exposto. Infelizmente, problemas de reprodutibilidade permeiam a pesquisa sobre envelhecimento, às vezes devido a experimentos estatisticamente subpotentes4 e muitas vezes devido à sensibilidade inerente dos ensaios de expectativa de vida a variações sutis no ambiente5. Experimentos robustos requerem múltiplas réplicas de grandes populações, e esse processo se beneficia particularmente da escalabilidade experimental oferecida pela automação6.
As exigências rigorosas dos ensaios de longevidade têm origem na imprevisibilidade do próprio processo de envelhecimento. Indivíduos isogênicos alojados em ambientes idênticos apresentam diferentes tempos de morte e taxas de declínio fisiológico7, sugerindo que a expectativa de vida envolve um alto grau de estocástico 7,8. Portanto, grandes populações são necessárias para medir mudanças quantitativas no processo de envelhecimento, como mudanças na expectativa de vida média ou máxima, e para superar vieses decorrentes da variabilidade individual. Além disso, a capacidade de ensaios de alta longevidade é crucial para apoiar estudos de formas de curvas de sobrevivência e modelos da dinâmica do envelhecimento9.
O nematoide Caenorhabditis elegans é um modelo inestimável para a pesquisa do envelhecimento devido à sua curta vida útil, tratabilidade genética e rápido tempo de geração, o que ressalta sua adequação para ensaios de envelhecimento e expectativa de vida de alto rendimento. Tradicionalmente, a vida útil em C. Elegans foi medido seguindo uma população pequena e sincronizada de cerca de 50-100 animais ao longo do tempo em meios sólidos e anotando o tempo de mortes individuais. À medida que os animais envelhecem e perdem mobilidade, a pontuação manual dos tempos de morte requer cutucar individualmente os animais e verificar se há pequenos movimentos da cabeça ou cauda. Esse é geralmente um processo tedioso e trabalhoso, embora esforços tenham sido feitos para acelerá-lo 10,11,12. É importante ressaltar que tubulações experimentais lentas dificultam o progresso em nossa compreensão do envelhecimento e da eficácia das intervenções testadas.
Para atender às demandas de pesquisa em envelhecimento por dados quantitativos, muitas tecnologias têm sido desenvolvidas para automatizar a coleta de dados, incluindo uma notável variedade de abordagens, desde câmaras microfluídicas até scanners de mesa 13,14,15,16,17,18. O LSM diferencia-se de outros métodos por sua extensa otimização para a coleta de dados de vida útil altamente precisos e precisos, o que é alcançado através do desenvolvimento de protocolos cuidadosos de calibração de equipamentos combinados com um extenso pacote de software que permite aos usuários validar, corrigir e refinar análises automatizadas13. Embora o software possa, em princípio, ser aplicado a diversas modalidades de imagem, na prática, a maioria dos usuários utiliza scanners de mesa modificados para permitir um controle ajustado sobre a temperatura e a umidade ambientais - fatores de importância crítica devido ao seu grande efeito sobre a vida útil19. O LSM obtém imagens de nematoides a cada 20 min em intervalos que variam de dias a meses, dependendo das condições ambientais e do genótipo. Os dados produzidos são de resolução temporal muito maior em comparação com os dados de ensaios manuais, e as imagens coletadas fornecem um registro visual permanente da posição do nematoide ao longo da vida. Usando métodos de aprendizado de máquina, os tempos de morte são atribuídos automaticamente a cada indivíduo. Estes resultados podem ser rapidamente validados manualmente usando um software cliente chamado "Worm Browser". Como resultado de seu hardware e software, o LSM pode gerar curvas de sobrevida estatisticamente indistinguíveis do escore manual de óbitos nas mãos de pesquisadores experientes, com a vantagem adicional de menor carga de trabalho e maior escalabilidade13.
A versão mais recente do LSM também permite o estudo do envelhecimento comportamental, coletando dados morfológicos e comportamentais ao longo da vida do nematoide e relatando-os juntamente com o tempo de vida de cada indivíduo. Em particular, o LSM captura o tempo de cessação vigorosa do movimento (VMC) de cada animal, um marco frequentemente usado para quantificar o "tempo de saúde" de um indivíduo como distinto de seu tempo de vida. Ao coletar simultaneamente dados de expectativa de vida e envelhecimento comportamental, o LSM apoia o estudo de intervenções que podem ter efeitos diferenciais em diferentes desfechos fenotípicos do envelhecimento20. Uma variedade de fenótipos macroscopicamente observáveis pode ser usada para estudar o envelhecimento comportamental, como movimento corporal ou bombeamentofaríngeo21, integridade tecidual22 e velocidade de movimento ou giro induzido porestímulo17. Comparações entre diferentes fenótipos de envelhecimento podem subsidiar análises da estrutura causal dos processos de envelhecimento. Por exemplo, a comparação entre VMC e tempo de vida foi recentemente utilizada para caracterizar dois processos distintos de envelhecimento em C. elegans23.
Embora inicialmente desenvolvido para medir a expectativa de vida em C. elegans, o LSM suporta a coleta de dados de sobrevivência e comportamentais de uma variedade de espécies de nematoides, incluindo C. Briggsae, C.; tropicalis, C.; Japonica, C.; brenneri, e P. Pacífico23. A tecnologia facilita o estudo do efeito de intervenções biológicas e ambientais sobre o tempo de vida, resistência ao estresse e resistência a patógenos e pode ser acoplada a ferramentas experimentais como ensaios direcionados de interferência de RNA ou sistemas de degradação de proteínas induzíveis por auxina. Até o momento, tem sido utilizada na literatura científica para uma ampla gama de aplicações6,24,25,26,27,28,29,30.
Aqui, descrevemos um protocolo passo-a-passo para a realização de um experimento Lifespan Machine usando placas de ágar, desde os estágios iniciais do arranjo experimental até a saída das curvas de sobrevivência resultantes. Uma característica distintiva do LSM é que o esforço é altamente front-loaded, o que significa que a maior parte do tempo do pesquisador é gasto durante a montagem experimental e, em um pequeno grau, durante a aquisição pós-imagem. A coleta de dados é totalmente automatizada durante toda a duração do experimento e permite que o pesquisador tenha uma experiência "mãos-livres". As etapas descritas aqui são mantidas em comum entre muitos tipos diferentes de ensaios de sobrevivência - o mesmo arranjo experimental é realizado para ensaios de vida útil, termotolerância, estresse oxidativo e patogênese. Na seção de resultados representativos, discutimos um subconjunto de dados de um manuscrito publicado recentemente para ilustrar a eficácia do pipeline de análise e destacar as etapas mais importantes durante a análise de imagens23.
Protocolo
1. Requisitos de software e hardware
- Scanners de mesa: Em princípio, o LSM pode ser implementado usando uma variedade de dispositivos de imagem. Instruções detalhadas para modificações e focalização do scanner estão disponíveis em outra publicação13. O hardware LSM é mostrado na Figura Suplementar 1.
- Ferramentas de análise de dados: O software LSM tem três componentes de interação: um pacote de software de controle de scanner baseado em Linux, um pacote de gerenciamento de metadados baseado em navegador da Web e um pacote de software de análise de imagem de cliente Windows e Linux. Consulte as instruções para instalar ferramentas de software publicadas no repositório do GitHub (https://github.com/nstroustrup/lifespan).
- Software de visualização e validação de dados: Use o Worm Browser, um programa cliente, para agendar os experimentos, validar a análise de imagem, realizar anotação manual do movimento do nematoide e gerar os dados de sobrevivência. Os executáveis binários são fornecidos para o Worm Browser no Windows 7, Windows 8 e Windows 10, e o Worm Browser é compilado a partir do código-fonte no Linux ou Apple iOS. Um guia de instalação está disponível no repositório do GitHub mencionado acima.
Figura suplementar 1: Hardware da máquina de vida útil. Uma unidade de scanner de mesa com uma tampa aberta para mostrar as placas carregadas, que são colocadas viradas para baixo em 16 aberturas cortadas em uma esteira de borracha. O tapete de borracha é colocado na superfície de um scanner de vidro. Etiquetas para as condições são escritas nas laterais das placas para evitar problemas durante a análise de imagem. A marcação da fita com o número ("1") e/ou nome do dispositivo ("Jabba") facilita a verificação posterior da localização da amostra ao trabalhar com vários dispositivos de scanner. Mais detalhes sobre os componentes de hardware do LSM são encontrados em outra publicação13. Clique aqui para baixar este arquivo.
2. Configuração anterior ao dia do experimento
- Calibração da temperatura da incubadora: A temperatura ambiente é um dos principais determinantes de C. Elegans Vidaútil 19. Para produzir resultados precisos, realizar a aquisição de imagens a uma temperatura cuidadosamente calibrada, mantida constante durante todo o experimento. Para isso, alguns dias antes do início do experimento, meça e calibre a temperatura da superfície de cada scanner durante a operação. Use termopares de alta precisão, conforme descrito em outra parte31 (ver Tabela de Materiais).
- Layout da placa do scanner: Antes do início do experimento, planeje o layout ideal das placas de cultura para cada scanner.
NOTA: O objetivo é evitar a introdução de fatores de confusão resultantes da variação de temperatura entre os scanners e em toda a superfície de cada scanner. Os scanners diferem sutilmente em sua temperatura média de superfície e, além disso, exibem vieses sutis de temperatura em toda a sua superfície31.- Posição da placa do scanner: Para controlar esses efeitos térmicos na análise subsequente dos dados, randomize quaisquer covariáveis biológicas em relação à posição do scanner e padronize a localização da placa em todos os scanners.
- Número de amostras nos scanners: Ao usar o layout de 16 tapetes de borracha (consulte a Tabela de Materiais), coloque quatro placas por condição em cada scanner, com um total de pelo menos quatro scanners. Isso garante que cada condição seja distribuída em vários scanners, de modo que os efeitos de confusão da temperatura do scanner possam ser identificados e removidos durante a análise dos dados13. Para tornar essa análise mais direta, inclua uma condição de referência compartilhada (por exemplo, amostras do tipo selvagem) em cada scanner.
NOTA: Em geral, devido à colocação dos ventiladores do scanner, as placas no canto superior direito da esteira de borracha são mais propensas à dessecação. Deixe este local vazio, se necessário.
- Preparação de placas e amostras
- Derramamento das placas de cultura: Para uma secagem ideal das placas de cultura do scanner (consulte a Tabela de Materiais), despeje meio ágar 4 dias antes de carregar os nematoides. Embora o foco do scanner seja ajustável para permitir que diferentes volumes de ágar sejam adicionados às placas, o volume padrão da placa é de 8 mL.
NOTA: Pode ser útil despejar as placas com uma bomba peristáltica, especialmente para grandes experimentos. - Semeadura das placas: Semeando as placas com a cultura bacteriana desejada pelo menos 2 dias antes do início do experimento para permitir a secagem adequada e o crescimento do gramado bacteriano. Normalmente, 200 μL de cultura bacteriana são suficientes para formar um gramado que alimentará 40 nematoides por várias semanas.
NOTA: As placas normalmente usadas para geração de imagens são mais bem seladas do que as placas de Petri de cultura padrão; Portanto, é aconselhável semear e secar as placas dentro de uma coifa de laboratório, geralmente por cerca de 1 h ou até secar adequadamente.
- Derramamento das placas de cultura: Para uma secagem ideal das placas de cultura do scanner (consulte a Tabela de Materiais), despeje meio ágar 4 dias antes de carregar os nematoides. Embora o foco do scanner seja ajustável para permitir que diferentes volumes de ágar sejam adicionados às placas, o volume padrão da placa é de 8 mL.
- Manejo de nematoides
- Tamanho da população: O número de nematoides que podem ser obtidos de forma confiável em uma única placa depende do genótipo, da idade em que os nematoides são plaqueados e da quantidade de alimento adicionada a cada placa. Para experimentos de vida útil que começam no início da idade adulta, carregue aproximadamente 40 animais por placa. Esse número garante comida suficiente e evita aglomerações.
- Crescimento de grandes populações: Para se preparar para a expansão e sincronização populacional, comece com uma população de nematoides apropriada para o método de sincronização escolhido (veja abaixo). Visa realizar a sincronização nos animais em sua idade de produção máxima de ovos, que para animais selvagens N2 é o dia 2 da idade adulta32.
NOTA: Outra razão para sincronizar populações usando animais em seu segundo dia de idade adulta é remover a idade materna como um fator que contribui para a heterogeneidade populacional. A idade materna em C. Elegans foi mostrado para afetar várias características de aptidão na progênie, com o Dia 2 animais selvagens produzindo a progênie de "mais alta qualidade"33. - Realizando a sincronização de idade: Para obter resultados precisos, sincronize a idade dos animais com a maior precisão possível. Nesse protocolo, a sincronização da idade é realizada com o tratamento com hipoclorito modificado34. Outros métodos podem incluir sincronização por postura de ovos, por parada de larvas L1 ou por colheita manual de larvas L4.
NOTA: Para sincronização de idade por tratamento com hipoclorito, espere obter de três a quatro ovos de cada hermafrodita adulto. - Manter populações livres de progênies: Manter populações livres de progênies expondo nematoides durante o estágio L4 tardio a 5-fluoro-2'-desoxiuridina (FUdR)35.
NOTA: Em doses baixas, FuDR é letal para embriões em desenvolvimento sem produzir alterações macroscopicamente visíveis na linha germinativa ou alterar a taxa de produção de ovócitos. Outros métodos incluem o uso de mutantes estéreis à temperatura, o uso de construções de RNAi esterilizantes ou simplesmente esperar até a senescência pós-reprodutiva para transferir os nematoides para placas de imagem. - Transferência de populações: Ao transferir milhares de animais entre placas, o protocolo padrão envolvendo um fio de platina/irídio torna-se trabalhoso. Métodos envolvendo a suspensão líquida de nematoides facilitam as transferências e as tornam mais eficientes. Coletar os nematoides com tampão M9 + Mg (Na2HPO4 42,27 mM, KH2PO4 22,05 mM, NaCl 85,56 mM, MgSO4 1 mM), reduzir o volume total assim que os nematoides se acomodarem por gravidade e, em seguida, transferir rapidamente os nematoides para as placas usadas para aquisição de imagens.
NOTA: A transferência dos nematoides por suspensão líquida pode levar a uma variação no número de animais transferidos para cada placa. Tente ser consistente com o número de nematoides em cada placa para evitar variabilidade experimental. - Aplicação de intervenções: Parar e reiniciar a aquisição de imagens durante um experimento complica a análise da imagem (ver discussão). Portanto, inicie os experimentos de LSM somente após o término de todo o manuseio necessário do nematoide.
- Esterilização dos tapetes de borracha: Autoclave um grande número de tapetes simultaneamente, envolvendo-os individualmente em papel alumínio.
NOTA: Os tapetes de borracha devem ser esterilizados entre os usos para evitar o acúmulo de contaminantes fúngicos ou bacterianos. A maioria dos tipos de borracha normalmente utilizados são degradados pelo tratamento agressivo com etanol.
3. Configuração no dia do experimento
- Suporte de placa e preparação de vidro do scanner: Para simplificar o manuseio da placa, não carregue as placas de Petri diretamente na superfície do scanner, mas mantenha-as no lugar usando tapetes de borracha apoiados por painéis de vidro (consulte a Tabela de Materiais). As populações são fotografadas através deste vidro, por isso mantenha o vidro limpo e tratado com revestimento antiembaçante, hidrofóbico e esterilizante (consulte a Tabela de Materiais).
- Antes de carregar as placas na incubadora, limpe a superfície do vidro de suporte da placa em ambos os lados com limpador de vidro antiembaçante.
- Antes de carregar as placas em seu vidro de suporte, aplique um tratamento protetor de vidro hidrofóbico (consulte a Tabela de Materiais) para minimizar o embaçamento na lateral do vidro que estará em contato com a esteira de borracha. Espalhe bem este tratamento e deixe-o no copo por 5-10 minutos antes de prosseguir para a próxima etapa. Limpe vigorosamente após a aplicação para remover qualquer resíduo.
- Aplicar etanol 70% para desinfetar a superfície do vidro que ficará em contato com o fosco de borracha. Deixe agir por 1 min ou 2 min, e depois retire com um pano ou papel toalha.
- Carregando as placas nos scanners
- Primeiro, coloque os tapetes de borracha autoclavados sobre o vidro de suporte da placa tratada.
- Retire a tampa das placas usadas para obtenção de imagens com nematoides carregados e coloque-as em locais de tapete de borracha voltados para a superfície de vidro. Certifique-se de que o tapete de borracha esteja bem fechado ao redor de todas as placas, por exemplo, adicionando outra folha de vidro por cima e garantindo que ela fique plana ou batendo na parte superior de cada placa (placas soltas se moverão levemente e baterão no vidro, emitindo um som, enquanto as placas bem presas não se moverão quando batidas).
NOTA: É útil rotular individualmente cada folha de vidro de suporte de placa com fita de marcação com informações sobre o conteúdo da placa e o scanner pretendido. Esses dados podem ser usados após o experimento para resolver possíveis ambiguidades em relação à localização das placas. - Antes de carregar as placas nos scanners, desconecte os ventiladores do scanner para proteger os dedos do experimentador durante o carregamento da placa.
- Deslize suavemente as placas e a folha de vidro que as suporta sobre a superfície do scanner.
OBS: Evite aplicar pressão diretamente no tapete de borracha, pois isso faz com que o tapete deslize pelo vidro de suporte da placa. Quando os tapetes deslizam, as placas são muitas vezes soltas do tapete. - Reative os ventiladores do scanner e confirme visualmente se os ventiladores frontal e lateral estão ligados. Se os scanners estiverem desligados, ligue-os neste ponto.
4. Pré-aquisição da imagem
NOTA: Um fluxograma abrangente resumindo todas as etapas baseadas em software durante a aquisição de imagens é mostrado na Figura 1.
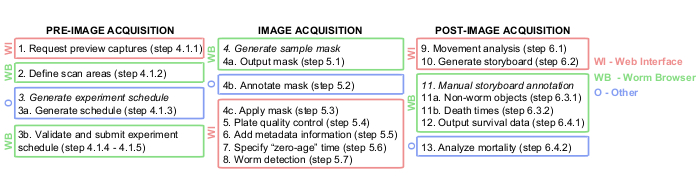
Figura 1: Visão geral gráfica do pipeline de análise de imagens da Lifespan Machine. As etapas de pré, durante e pós-aquisição de imagens são realizadas em grande parte na interface web (WI, em vermelho) e no Worm Browser (WB, em verde). Algumas etapas são executadas em outras plataformas (O, em azul), como documentos TXT na etapa 3a, Photoshop ou equivalente na etapa 4b e JMP ou equivalente na etapa 13. Clique aqui para ver uma versão maior desta figura.
- Configuração de aquisição de imagem: gere um arquivo que especifique o cronograma de experimentos e a localização das placas em cada scanner para configurar a aquisição de imagem.
Observação : esse arquivo inclui metadados importantes, como o título do experimento, a frequência de capturas de imagem e a duração total do experimento. Normalmente, esse arquivo não é gerado de novo para cada experimento, mas em vez disso, arquivos de experimentos de experimentos anteriores são reutilizados como modelos. Para o primeiro experimento de um usuário, um arquivo de modelo é fornecido (Arquivo Suplementar 1).- Solicitar capturas de visualização: Forneça a localização de todas as placas em cada scanner. Diversas ferramentas são disponibilizadas para agilizar esse processo. Primeiro, use o scanner para obter uma imagem de toda a superfície do scanner, chamada "Captura de visualização". Certifique-se de que as imagens de captura de visualização mostrem claramente toda a superfície de cada placa a ser fotografada (Figura 2A) sem estrias ou o recorte das bordas da placa.
- Usando a interface web, localize a seção Aquisição de imagens da página principal e siga o link chamado Dispositivos de captura e servidores de imagem. Nessa página, clique no botão marcado Procurar novos dispositivos (ou seja, scanners) na caixa Servidores de captura e processamento de imagens . Monitore o progresso do servidor na detecção de scanners clicando no link [log] ao lado do servidor.
NOTA: Verifique se os scanners desejados estão ligados e conectados ao servidor antes de executar esta etapa. - Na mesma página da interface da Web, verifique se cada scanner conectado ao servidor aparece na caixa Dispositivos de Captura de Imagem . Um rótulo "Ausente" em "Status atual" não será mais exibido se o dispositivo for detectado com êxito. Marque a caixa de seleção correspondente a cada scanner contendo placas recém-carregadas.
- Na parte inferior da seção Dispositivos de captura de imagem , clique no botão Solicitar captura de visualização . Dentro de 1 min ou 2 min, os scanners devem acender e iniciar a digitalização.
NOTA: A posição inicial das folhas de suporte de vidro deve ser frequentemente ajustada para trazer todas as placas para a faixa visível. As posições podem ser corrigidas inspecionando imagens de captura de visualização e fazendo ajustes na posição da placa e retomando novas imagens de captura de visualização. Se as varreduras continuarem extremamente lentas (vários minutos para uma varredura de captura) ou se as imagens de captura de visualização contiverem longas listras brancas, isso é um sinal de que uma placa, o tapete de borracha ou algum outro objeto está bloqueando a luz dentro da região de calibração do scanner (indicada por setas brancas na superfície do scanner). Todos os objetos devem ser reposicionados de forma que apenas o vidro suporte de vidro ocupe essa região.
- Usando a interface web, localize a seção Aquisição de imagens da página principal e siga o link chamado Dispositivos de captura e servidores de imagem. Nessa página, clique no botão marcado Procurar novos dispositivos (ou seja, scanners) na caixa Servidores de captura e processamento de imagens . Monitore o progresso do servidor na detecção de scanners clicando no link [log] ao lado do servidor.
- Defina as áreas de varredura: siga as próximas etapas no Worm Browser para analisar as imagens de captura de visualização e montá-las em uma única imagem composta, que é usada para especificar o local de cada placa para a análise de dados. Certifique-se de que a imagem resultante seja semelhante à Figura 2B.
- Primeiro, usando o Worm Browser, abra cada imagem de captura de visualização selecionando a opção de menu Arquivo > Abrir Imagem e escolha a imagem desejada.
- Em cada imagem, clique para selecionar as colunas para regiões com placas (se o tapete de borracha tiver 16 locais de placa, selecione 4 colunas).
Observação : as regiões de varredura devem ser especificadas como colunas altas (não linhas largas) como a captura do scanner é mais lenta para regiões mais largas, resultando em imagens borradas devido ao movimento do nematoide. - Depois que todas as imagens estiverem definidas, exporte as especificações da região para o disco selecionando o item de menu Aquisição de imagem > Definir áreas de varredura > Salvar áreas de varredura selecionadas no disco e escolhendo o local desejado.
- Gere o cronograma do experimento:
- Seguindo o formato do Arquivo Suplementar 1, monte um arquivo que contenha o nome do experimento, os locais físicos de cada coluna nos scanners (copiados do arquivo de áreas de varredura gerado na etapa 4.1.2.3), a duração total do experimento e a frequência de captura da imagem, e salve-o como um arquivo TXT e como um arquivo XML.
- Em seguida, no Worm Browser, clique em Image Acquisition > Submit Experiment Schedule e escolha o arquivo XML gerado. O Worm Browser perguntará se deseja gerar um resumo da programação ou executar o experimento. Clique em Gerar um arquivo de resumo.
- Validar o arquivo de resumo: Depois de enviar o cronograma de experimento, o Worm Browser exibirá um resumo do cronograma. Este resumo é mostrado na tela e gravado no disco. Leia-o e verifique as datas das capturas agendadas, bem como a localização, o nome e o número de scanners.
- Enviar o cronograma de experimento: Quando estiver satisfeito com o arquivo de resumo, carregue novamente o arquivo XML para o cronograma de experimento no Worm Browser selecionando a opção de menu Aquisição de imagem > Enviar cronograma de experimento. O Worm Browser solicitará uma segunda vez se deseja gerar um resumo da agenda ou executar o experimento. Desta vez clique em Executar! .
NOTA: Alguns minutos após o envio do experimento, é aconselhável usar a interface da Web para confirmar que o experimento foi enviado com sucesso e as varreduras estão sendo coletadas por todos os scanners. É comum que as primeiras varreduras sejam perdidas, especialmente em grandes experimentos. - Organize experimentos na interface da Web: um cluster de scanner ocupado pode produzir centenas de conjuntos de dados experimentais coletados por muitos usuários diferentes. Para organizar essa lista, atribua experimentos a grupos separados, por exemplo, correspondendo ao nome do usuário responsável pelo experimento.
- Crie um novo grupo ou modifique um existente: Crie novos grupos na interface da Web clicando em Gerenciar Grupos de Experimentos na caixa chamada Aquisição de Imagens. Na nova página que aparecerá, adicione o nome desejado em Criar Novo Grupo e clique em Criar. Para modificar o nome de um grupo existente, na mesma caixa, escolha o grupo desejado ao lado de Modificar Grupo Existente e selecione Modificar.
- Atribuir experimentos a um grupo: Para atribuir novos experimentos a um grupo específico, vá para a interface da Web e encontre o experimento desejado, que por padrão será atribuído ao grupo Sem Grupo na parte inferior da lista de experimentos. Clique no link para o lado direito da seção de experimento, onde diz Editar, e use a lista suspensa para selecionar o nome do grupo a ser usado. Em seguida, selecione Salvar.
- Cancelar um experimento:
NOTA: O LSM continuará a funcionar de forma autônoma até que as varreduras finais sejam especificadas no cronograma de experimentos. Depois que um cronograma experimental for concluído, o LSM continuará, por padrão, coletando varreduras, mas descartará imediatamente os dados da imagem em um processo chamado varredura automática. Essas varreduras automáticas são realizadas para evitar que os scanners desliguem e resfriem, e mantenham um perfil de temperatura padrão para que quaisquer outros experimentos em execução no mesmo espaço (mas de um experimento diferente) não sejam afetados pelo desligamento de outros scanners.- Parar varreduras automáticas: Para interromper as varreduras automáticas de um experimento em andamento na interface da Web, clique em Editar ao lado do experimento desejado, depois em Cancelar varreduras pendentes e selecione Cancelar capturas agendadas.
- Solicitar capturas de visualização: Forneça a localização de todas as placas em cada scanner. Diversas ferramentas são disponibilizadas para agilizar esse processo. Primeiro, use o scanner para obter uma imagem de toda a superfície do scanner, chamada "Captura de visualização". Certifique-se de que as imagens de captura de visualização mostrem claramente toda a superfície de cada placa a ser fotografada (Figura 2A) sem estrias ou o recorte das bordas da placa.
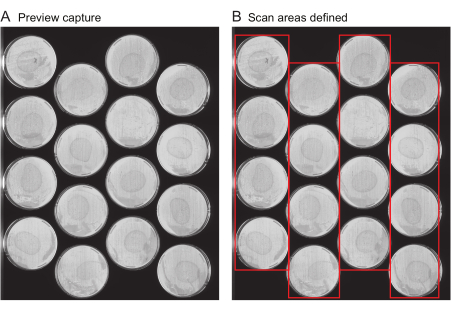
Figura 2: Visualizar a imagem de captura e a seleção da área de digitalização. (A) Para cada scanner no experimento, uma imagem de captura de visualização é gerada. (B) Seleção de uma fileira de placas por vez (caixas vermelhas), o que aumenta a velocidade de digitalização e evita o desfoque de movimento do worm como resultado de áreas de varredura muito largas. Clique aqui para ver uma versão maior desta figura.
5. Aquisição de imagens
Observação : as etapas a seguir podem ser executadas enquanto o experimento está em execução ou depois que ele terminou.
- Saída do arquivo de máscara do experimento: os dados brutos de imagem dos scanners contêm muitas áreas que não precisam ser processadas (áreas fora das placas). Para focar a análise em cada placa individualmente, é criada uma "máscara" que especifica a área ocupada por cada placa em cada scanner. Gere essa máscara desenhando a posição de cada placa como uma sobreposição sobre as imagens coletadas pelos scanners.
- Usando o Worm Browser, escolha o experimento desejado selecionando Arquivo > Selecionar Experiência Atual e clique no nome do experimento.
- Novamente no Worm Browser, selecione Image Acquisition > Define Sample Masks > Generate Experiment Mask Composite e salve a máscara no local desejado. Certifique-se de que o arquivo resultante seja semelhante à Figura 3A.

Figura 3: Especificação da localização das placas para cada scanner usando máscaras de amostra. Para garantir a análise independente das placas dentro das seleções de colunas mostradas na Figura 1, as placas individuais devem ser identificadas gerando um composto de máscara de imagem. (A) Uma captura das varreduras dos scanners é aberta com um software de manipulação de imagem (observe o nome do scanner "han" acima de uma seleção digitalizada, e "a-d" referindo-se a cada uma das colunas). (B) As etapas individuais de geração da máscara para marcar a localização de cada placa no composto de máscara exigem que o fundo seja definido como preto, (C) a remoção de bordas irregulares e bordas de placas não selecionadas pela expansão e, em seguida, encolhimento do fundo, e (D) selecionando as placas de primeiro plano e preenchendo as áreas inteiramente com pixels brancos. (E) Para que o LSM reconheça placas individuais nas linhas digitalizadas, cada região branca em uma fileira é preenchida com um tom diferente de cinza, geralmente em brilho crescente. (F) Neste estágio, a máscara é salva (compactação LZW sem camadas especificadas se gerada no Photoshop). A máscara é então digitalizada pelo Worm Browser, e uma visualização da máscara pelo software é gerada. Uma visualização correta da máscara deve exibir um quadrado definido por placa com uma pequena cruz no centro e uma cor diferente para cada linha. Clique aqui para ver uma versão maior desta figura.
- Anote a máscara do experimento: Abra o arquivo gerado na etapa anterior com um programa de manipulação de imagem (como Photoshop ou GIMP) para marcar a localização de cada placa na imagem. Uma visão geral de todas as etapas de edição de máscara usando o Photoshop é descrita abaixo.
- No Photoshop, selecione a ferramenta Preenchimento com a tolerância definida como zero, a opção contígua selecionada e a suavização de borda desmarcada. Clique no fundo cinza para defini-lo completamente para preto. Certifique-se de que a imagem resultante seja semelhante à Figura 3B.
- Use a ferramenta varinha mágica para selecionar o plano de fundo preto, com o aliasing definido como desativado, a tolerância definida como zero e a opção contígua selecionada. Para suavizar as bordas, expanda o plano de fundo selecionado em 30 pixels clicando em Selecionar > Modificar > Expandir. Em seguida, reduza a seleção em 20 pixels em Selecionar > Modificar > Contrato. Certifique-se de que a imagem resultante seja semelhante à Figura 3C.
- Preencha o plano de fundo suavizado inteiramente com pixels pretos, por exemplo, definindo a tolerância da ferramenta Preenchimento como 255 e preenchendo a região selecionada. Em seguida, clique em Selecionar > Inverso para inverter a seleção e selecione o primeiro plano. Preencha a nova região inteiramente com pixels brancos, por exemplo, definindo a tolerância da ferramenta de preenchimento para 255 e preenchendo a região com branco. Certifique-se de que a imagem resultante seja semelhante à Figura 3D.
- Para separar cada placa dentro de uma única região, preencha cada linha com um gradiente diferente de cinza em brilho crescente. Isso pode ser feito com a ferramenta Preenchimento e, em seguida, selecionando a cor desejada, com a tolerância definida como 0. Certifique-se de que a imagem resultante seja semelhante à Figura 3E. Salve-o em uma compactação LZW sem "Camadas" especificadas.
NOTA: A ordenação das placas é definida pela cor das regiões especificadas. Para nomear as chapas de 1 a 4 em uma ordem de cima para baixo, especifique as cores em brilho crescente para cada linha. - No Worm Browser, selecione Image Acquisition > Define Sample Masks > Analyze Plate Locations Drawn on Experiment Mask Composite e selecione o arquivo gerado na etapa anterior. O software agora levará alguns instantes para analisar a máscara enviada.
- O Worm Browser exibirá uma visualização de máscara. Inspecione a máscara em busca de possíveis erros no arquivo. Certifique-se de que cada fileira de placas seja preenchida com uma cor diferente e delineada por um retângulo colorido. Certifique-se de que a imagem resultante seja semelhante à Figura 3F.
Observação : se uma única placa mostra dois círculos ou mais, ou se dois círculos compartilham a mesma cor, volte para a etapa 5.2 para corrigir o arquivo de máscara e carregá-lo novamente no navegador de worm. - Depois de verificar se a visualização da máscara está correta, no Worm Browser, selecione Image Acquisition > Define Sample Masks > Submit Analyzed Experiment Mask Composite to Cluster. O servidor de análise de imagens agora analisará a localização de todas as placas no experimento.
- Aplicar a máscara: O LSM usa máscaras para dividir os dados brutos da imagem em placas individuais. Para iniciar esse processo, agende um trabalho de aplicativo de máscara usando a interface da Web.
- Antes de enviar o trabalho, verifique se todos os scanners identificaram regiões na máscara. Vá para a página principal da interface web, localize o nome do experimento e a coluna chamada Análise de Imagem e clique em Executar Análise. Verifique se todos os dispositivos em Amostras de experimento têm regiões identificadas.
- Para aplicar a máscara, na mesma interface, clique em Novo Trabalho para Todas as Amostras. Na caixa denominada Agendar um Trabalho para Imagens Individuais, selecione a caixa Aplicar Máscara e, em seguida, Salvar Trabalho.
OBS: A máscara será aplicada a todas as imagens já capturadas, bem como a quaisquer imagens capturadas no futuro.
- Realizar controle de qualidade da placa:
NOTA: Placas que sofrem de contaminação, dessecação ou nebulização são censuradas nesta etapa da análise de imagem. Um exemplo de placas contaminadas, dessecadas, embaçadas e ótimas é mostrado na Figura 4. Outras razões para censurar incluem fome, placas vazias ou larvas em populações estéreis. Placas inválidas geralmente contêm formas complexas que a máquina pretende interpretar como nematoides. É importante excluir placas inválidas nesta etapa, a fim de evitar longos tempos de processamento em etapas posteriores da análise da imagem.- Usando a interface web, exclua as placas a serem censuradas encontrando o experimento desejado e a coluna chamada Anotar informações da placa e selecionando Por imagem.
- Para inspecionar as placas, clique em Exibir imagens.
Observação : se a etapa para exibir imagens não estiver funcionando corretamente, o servidor Linux pode não estar configurado corretamente. Instruções sobre como fazer isso estão disponíveis no guia de instalação do software no repositório GitHub mencionado anteriormente. - Para excluir placas, marque a caixa Censor, selecione uma opção na caixa suspensa chamada Reason Censored e clique em Salvar para cada página.
- Adicionar informações de metadados: os metadados descrevem o conteúdo de cada placa em um experimento. Essas informações são então incluídas em todos os arquivos de dados estatísticos gerados posteriormente.
- Para adicionar informações de metadados relativos à cepa, genótipo, temperatura, alimento, etc., vá para a página principal da interface web, encontre o experimento desejado e a coluna chamada Anote informações da placa e selecione Por posição.
- Insira as etiquetas e selecione os scanners para os quais salvar os metadados clicando em Salvar em dispositivos no canto inferior esquerdo.
- Para reutilizar metadados entre scanners diferentes sem ter que reinserir todas as etiquetas novamente, vá para Carregar do dispositivo no canto superior direito, selecione o scanner do qual deseja reutilizar metadados e clique em Carregar do dispositivo.
- Especifique o tempo de "idade zero": Por padrão, o LSM mede o tempo em relação ao início da época UNIX. Isso raramente é conveniente, então a especificação de um tempo de referência é necessária (por exemplo, a data em que todos os indivíduos eclodiram ou atingiram a idade adulta).
- Para especificar as informações de tempo de idade zero, vá para a página principal da interface da Web, encontre o experimento desejado e a coluna chamada Análise de Imagem e selecione Executar Análise.
- Na nova página exibida, selecione Novo Trabalho para Todas as Regiões. Na caixa denominada Atualizar Informações da Região, selecione Hora em que os Animais tinham 0 Idade, adicione as informações e clique em Atualizar Campos Selecionados.
Observação : se todos os animais não compartilham o mesmo tempo de idade zero, selecione em vez disso Novo trabalho para tipos de animais específicos e repita as etapas acima para cada grupo.
- Programe a detecção do worm: O LSM pode automatizar a detecção de cada nematódeo com base em sua posição na placa.
- Para iniciar a detecção automatizada de nematoides para cada imagem, vá para a página principal da interface web, encontre o experimento desejado e a coluna chamada Análise de Imagem e selecione Executar Análise.
- Na nova página que aparecerá, clique em Novo Trabalho para Todas as Regiões, depois na caixa chamada Agendar um Trabalho para Imagens Individuais e selecione as caixas Filtro Mediano > Limite > Detecção de Worm > Salvar Trabalho. Esses trabalhos serão aplicados a todas as imagens passadas e futuras capturadas.
NOTA: Para agendar um trabalho apenas para uma tensão ou condição específica, clique em Trabalhos para tipos de animais específicos. A classificação de objetos é executada usando modelos SVM especificados como arquivos armazenados na subpasta Modelos do diretório de armazenamento de longo prazo do LSM. Os conjuntos de parâmetros de detecção de nematódeos V2.0 para o LSM podem ser baixados do repositório do GitHub.
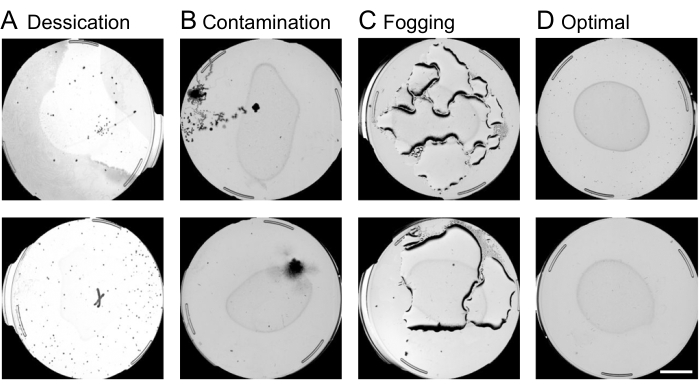
Figura 4: Controle de qualidade da placa utilizando a interface web. A censura de placas abaixo do ideal na interface da web antes da análise do movimento do worm é crucial para acelerar o pipeline de processamento de imagens. Exemplos de placas sujeitas a remoção incluem condições de (A) dessecação, (B) contaminação ou (C) nebulização, em oposição. (D) Placas ótimas a serem incluídas em análises posteriores. Uma barra de escala de 10 mm é sobreposta a uma imagem de captura de visualização. Clique aqui para ver uma versão maior desta figura.
6. Pós-aquisição da imagem
NOTA: Após a detecção do worm ser concluída, todos os dados coletados do experimento devem ser agregados ao longo do tempo para rastrear cada indivíduo ao longo de sua vida útil e identificar todos os tempos de morte dos indivíduos. Aguarde até que todos os animais do experimento tenham morrido e até que todos os trabalhos de detecção de vermes tenham sido concluídos e, em seguida, execute as seguintes etapas:
- Agende a análise de movimento:
- A análise do movimento integra todos os dados experimentais ao longo do tempo para estimar os tempos de morte. Para iniciar este trabalho, vá para a página principal da interface web e encontre o experimento desejado na coluna chamada Análise de Imagem. Selecione o link Executar análise.
- Na nova página exibida, clique no link Novo Trabalho para Todas as Regiões e, no menu suspenso, Agendar um Trabalho para uma Região Inteira, selecione Analisar Movimento do Worm e clique no botão Salvar Trabalho.
- O servidor de aquisição de imagens LSM começará automaticamente a analisar o movimento em todas as placas.
NOTA: A análise de movimento é o maior trabalho individual. Em um processador multi-core moderno, a análise de cada placa de um experimento de vida útil de 1 mês pode levar 20 minutos ou mais.
- Gerar um storyboard: Depois que a análise de movimento for concluída, o storyboard LSM permite que os usuários validem manualmente os resultados automatizados e garantam que o software esteja fazendo suposições corretas sobre a morfologia e o comportamento do nematoide.
- Na página principal da interface da Web, localize o experimento desejado e a coluna chamada Análise de Imagem e selecione Executar Análise. Na nova página exibida, clique em Novo Trabalho de Experiência. Em seguida, na seção Agendar um trabalho para uma região inteira, selecione Gerar storyboard de animais e clique em Salvar trabalho.
- Depois que o LSM terminar de gerar o storyboard, vá para o Worm Browser e selecione o experimento desejado. De volta ao menu principal, selecione Validação > Procurar todo o experimento > imediatamente após a morte de cada verme.
- Anote os storyboards no Worm Browser: um storyboard típico no Worm Browser deve se parecer com Figura 5.
- Anotar objetos "não-worm"
NOTA: Cada objeto detectado durante o movimento é mostrado no storyboard, ordenado pelo tempo estimado de morte. A menos que o usuário especifique o contrário, cada objeto será incluído nas curvas de sobrevivência resultantes. A classificação de objetos LSM é intencionalmente calibrada para ter uma alta taxa de falso-positivos, como um trade-off para minimizar o número de nematoides não detectados. A exclusão de objetos não-worm é importante para a obtenção de curvas de sobrevivência de alta qualidade (veja os resultados representativos). Um grande número de objetos não-worm são normalmente encontrados na primeira e na última páginas do storyboard, que podem ser rapidamente excluídos manualmente em massa.- Para excluir objetos não worm no storyboard, clique com o botão direito do mouse uma vez na imagem do objeto. O objeto excluído agora será delineado por uma caixa branca. Para excluir muitos objetos simultaneamente, mantenha pressionada a tecla de controle e clique com o botão direito do mouse uma vez em qualquer objeto, e todos os objetos na página de storyboard serão excluídos.
- Depois de excluir um objeto da análise, esse objeto pode ser reincluído clicando com o botão direito do mouse duas vezes novamente.
- Para salvar as anotações feitas durante a anotação do storyboard, clique no botão Salvar . Recomenda-se salvar o progresso com frequência durante a anotação.
- Anote os tempos de morte:
NOTA: Sem a intervenção do usuário, o LSM estima com precisão os tempos de morte para a maioria das populações. No entanto, recomenda-se confirmar rotineiramente a precisão dos resultados automatizados validando manualmente um subconjunto aleatório de indivíduos de cada experimento. Atenção extra deve ser dada aos indivíduos de vida mais curta e mais longa, pois quaisquer erros na análise automatizada tendem a se agrupar nesses grupos.- Clique com o botão esquerdo do mouse uma vez em qualquer objeto do storyboard para abrir uma nova janela que exibe informações detalhadas de séries temporais sobre esse objeto. Essa janela permite a inspeção de todas as imagens coletadas do objeto ao longo do experimento, bem como a quantificação da dinâmica e morfologia do movimento do objeto. Usando a mesma interface, anote manualmente os tempos de morte. A interface para anotação do tempo de óbito é mostrada na Figura 6.
- Para anotar manualmente os tempos de morte, clique com o botão esquerdo do mouse na barra inferior no ponto correspondente à hora da morte. Use a barra de espaço e as setas para a direita ou para a esquerda do teclado para percorrer os períodos de tempo ou clique diretamente na barra no período de tempo desejado.
NOTA: A visualização representa o estado de movimento dos animais ao longo do tempo, como um gráfico de barras horizontal com o tempo de marcação do eixo x. A seção rosa/roxa indica o período de tempo em que o objeto está se movendo vigorosamente, o amarelo indica movimento fraco, o vermelho indica animais não móveis e o verde indica o período de expansão associado à morte. Os nematoides apresentam eventos morfológicos característicos associados à morte: uma contração gradual do corpo que geralmente ocorre antes da morte, seguida por uma rápida expansão do corpo durante ou imediatamente após a morte (Figura 6B). Objetos não-vermes, como poeira ou sombras, não mostram essas dinâmicas no tamanho do corpo e, em vez disso, normalmente seguem uma mudança linear e gradual no tamanho e na intensidade ao longo do tempo. Essas diferentes dinâmicas de tamanho corporal fornecem um método rápido e direto para classificação rápida e exclusão manual. - Dependendo da abordagem de análise, o tempo de morte pode ser considerado como o tempo de cessação do movimento (o início da barra vermelha na visualização do movimento) ou como o tempo de expansão associada à morte (a barra verde na visualização do movimento). Para anotar manualmente eventos de contração e expansão, clique com o botão direito do mouse na barra inferior no período de tempo desejado.
- Algumas visualizações rudimentares de dados de mortalidade são fornecidas nativamente no cliente Worm Browser. Curvas de sobrevida e diagnósticos de tempo de óbito são mostrados para cada população presente no storyboard (Figura 7). Veja as curvas de sobrevivência do lado esquerdo e o gráfico de dispersão comparando o tempo de cessação do movimento vigoroso (VMC) com o momento da morte de cada indivíduo do lado direito do storyboard.
NOTA: É possível agrupar esses resultados de acordo com diferentes parâmetros experimentais sub-definindo na barra inferior para condições como cepas específicas, scanners ou placas. Os vermes individuais podem ser selecionados com base em seus tempos de morte clicando com o botão esquerdo do mouse em pontos individuais no gráfico VMC versus tempo de morte.
- Anotar objetos "não-worm"
- Gravando os dados de mortalidade no disco: O LSM produz dados de mortalidade na forma de arquivos CSV. Plote as curvas de sobrevivência geradas e analise-as em qualquer software estatístico, como R, SAS, STATA ou JMP.
- Para gerar esses arquivos, escolha o experimento no Worm Browser e, no menu, selecione Arquivos de Dados, Tempos de Morte e clique em Gerar Tempos de Morte para o Experimento Atual. O LSM gerará um arquivo de saída com os dados de sobrevivência do experimento, que serão salvos no diretório de resultados.
- Se anotações manuais tiverem sido executadas no storyboard, um prompt aparecerá no Worm Browser perguntando como lidar com anotações manuais. Clique em "Imediatamente" para incluir anotações à mão no arquivo de tempos de morte enviado.
Observação : arquivos de dados de mortalidade são gravados no diretório de resultados especificado no arquivo imageserver.ini. Uma variedade de arquivos são escritos, mas a versão mais comumente usada é "survival_simple/survival=machine_hand", que inclui todas as anotações manuais feitas usando o storyboard. - Analisar os dados de mortalidade no software estatístico de escolha.
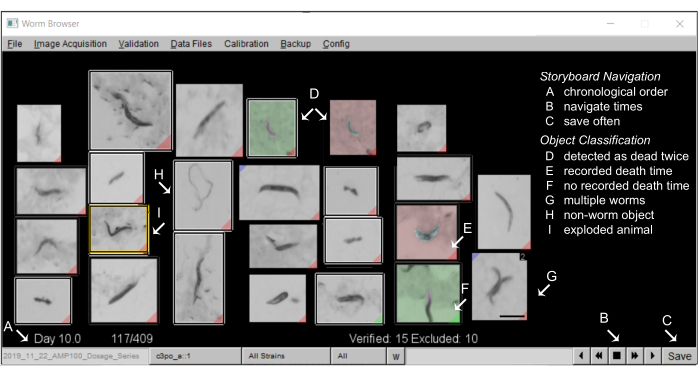
Figura 5: Storyboard de animais no Worm Browser. (A) Todos os vermes estacionários são mostrados em ordem cronológica de tempo de morte anotado por máquina. Para navegar no storyboard, pressione os botões no (B) canto inferior direito e (C) salve as anotações com frequência. (D) As imagens com um fundo não cinza retratam dois eventos de morte de vermes (morte precoce como verde, morte posterior como vermelho), que podem ocorrer quando dois vermes morrem próximos um do outro, ou quando vermes mortos são movidos por um verme que passa e, portanto, são detectados como mortos duas vezes. (E) Uma etiqueta vermelha no canto inferior de uma imagem identifica vermes com um tempo de morte detectado; (F) uma etiqueta verde indica onde um objeto não permaneceu imóvel por tempo suficiente para registrar um tempo de morte. (G) Vários worms no mesmo quadro podem ser sinalizados pressionando shift e clicando com o botão esquerdo. (H) Objetos não-worm são excluídos da análise por um clique com o botão direito do mouse. (I) Os vermes explodidos são censurados da análise clicando na imagem correspondente (uma janela de anotação manual se abre) e pressionando shift e clicando com o botão direito do mouse até que uma mensagem de "animal explodiu" apareça. Uma barra de escala de 0,5 mm e rótulos são sobrepostos na captura de tela de uma janela do Worm Browser. Clique aqui para ver uma versão maior desta figura.
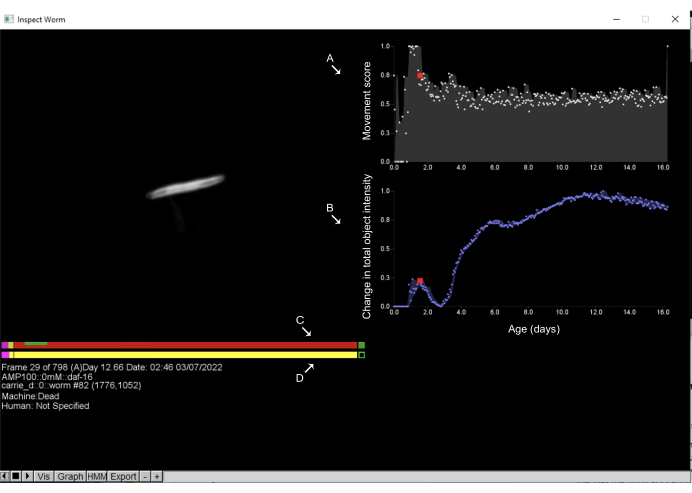
Figura 6: Inspecionando objetos e anotação dos tempos de morte no Worm Browser. Clicar com o botão esquerdo do mouse em qualquer objeto no storyboard do Worm Browser abre uma nova interface e permite que o usuário inspecione a dinâmica de movimento do objeto. No lado direito, é exibido o escore de movimento (A), que quantifica o movimento do objeto; isso é estimado pela mudança nas intensidades de pixel entre observações consecutivas. Além disso, no lado direito, (B) é exibida a mudança na intensidade total do objeto, o que quantifica as mudanças no tamanho do objeto. No lado esquerdo, a barra superior mostra a estimativa da máquina (C) do tempo de morte, enquanto a barra inferior é a anotação (D) humana à mão. Clicar em qualquer ponto das barras e pressionar a tecla de espaço permite que o usuário se mova pelos períodos de tempo em que o worm foi fotografado. Nessas barras, o rosa representa o tempo gasto em movimento vigoroso, o vermelho representa o tempo gasto na morte e o amarelo é tudo o que está no meio. O tempo gasto em expansão e contração após o tempo de morte é mostrado em verde. Os rótulos são sobrepostos na captura de tela de uma janela do Worm Browser. Clique aqui para ver uma versão maior desta figura.
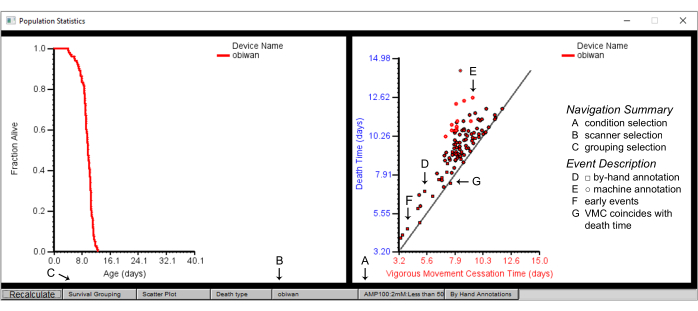
Figura 7: Estatísticas de resumo da população no navegador worm. Estatísticas populacionais para o dispositivo de scanner "obiwan", com um gráfico da sobrevivência (painel esquerdo) e um gráfico de dispersão do tempo de cessação do movimento vigoroso (VMC) versus o tempo de morte (painel direito). Os plotados são detalhes de (A) uma condição, obtidos de (B) um scanner obtido pela seleção primeiro (C) do agrupamento de sobrevivência por cepa. (D) As formas quadradas no gráfico de dispersão representam os eventos anotados à mão, enquanto (E) as formas circulares retratam os eventos anotados pela máquina. (F) A anotação manual é frequentemente necessária para eventos de morte que ocorrem precocemente ou (G) aqueles em que o tempo de cessação do movimento vigoroso coincide com o tempo de morte. Os rótulos são sobrepostos na captura de tela de uma janela do Worm Browser. Clique aqui para ver uma versão maior desta figura.
Resultados
A reprodutibilidade experimental em ensaios de vida útil é desafiadora e requer condições experimentais rigorosamente controladas e grandes populações para atingir resolução estatística suficiente 4,36. O LSM é exclusivamente adequado para o levantamento de grandes populações de animais em um ambiente constante com alta resolução temporal. Para demonstrar a capacidade do LSM, destacar as etapas cruciais da análise e ajudar os pesquisadores a priori...
Discussão
Aqui, fornecemos um protocolo detalhado e acessível para realizar um experimento usando a versão mais recente da Lifespan Machine. Mostramos que o passo crítico para a obtenção de curvas de sobrevida bem resolvidas é a exclusão manual de objetos não-worm durante a aquisição pós-imagem. A anotação manual do tempo de óbito tem um pequeno efeito sobre a forma global das curvas de sobrevida, demonstrando que a estimativa do tempo de óbito totalmente automatizada é eficiente mesmo sem anotação manual (
Divulgações
Os autores declaram não ter interesses concorrentes.
Agradecimentos
Agradecemos a Julian Ceron e Jeremy Vicencio (IDIBELL Barcelona) pela produção do alelo rpb-2(cer135). Este projeto foi financiado pelo Conselho Europeu de Investigação (ERC) no âmbito do programa de investigação e inovação Horizonte 2020 da União Europeia (Acordo de Subvenção n.º 852201), pelo Ministério da Economia, Indústria e Competitividade (MEIC) espanhol pela parceria EMBL, pelo Centro de Excelência Severo Ochoa (CEX2020-001049-S, MCIN/AEI /10.13039/501100011033), pelo Programa CERCA / Generalitat de Catalunya, pelo prémio MEIC Excelencia BFU2017-88615-P, e um prêmio da Glenn Foundation for Medical Research.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Naphtaleneacetic acid (Auxin) | Sigma | N0640 | Solubilize Auxin in 1M potassium hydroxide and add into molten agar |
| 5-fluoro-2-deoxyuridine (FUDR) | Sigma | F0503 | 27.5 μg/mL of FUDR was used to eliminate progeny from populations on UV-inactivated bacteria |
| Glass cleaner | Kristal-M | QB-KRISTAL-M125ml | |
| Hydrophobic anti-fog glass treatment | Rain-X Scheibenreiniger | C. 059140 | |
| Rubber matt | Local crafstman | Cut on a high-strength EPDM rubber sheet stock | |
| Scanner glass | Local hardware supplier | 9" x 11.5" inch glass sheet | |
| Scanner plates | Life Sciences | 351006 | 50 mm x 9 mm, polystyrene petri dish |
| USB Reference Thermometer | USB Brando | ULIFE055500 | For calibrating temperature of scanners |
Referências
- Harman, D. The aging process: Major risk factor for disease and death. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5360-5363 (1991).
- Vaupel, J. W. Biodemography of human ageing. Nature. 464 (7288), 536-542 (2010).
- Mair, W., Goymer, P., Pletcher, S. D., Partridge, L. Demography of dietary restriction and death in Drosophila. Science. 301 (5640), 1731-1733 (2003).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in Genetics. 8, 92 (2017).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nature Communications. 8 (1), 14256 (2017).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature. 419 (6909), 808-814 (2002).
- Kirkwood, T. B., et al. What accounts for the wide variation in life span of genetically identical organisms reared in a constant environment. Mechanisms of Ageing and Development. 126 (3), 439-443 (2005).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Cornwell, A. B., Llop, J. R., Salzman, P., Thakar, J., Samuelson, A. V. The replica set method: A high-throughput approach to quantitatively measure Caenorhabditis elegans lifespan. Journal of Visualized Experiments. (136), e57819 (2018).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: A quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Hulme, S. E., et al. Lifespan-on-a-chip: Microfluidic chambers for performing lifelong observation of C. elegans. Lab on a Chip. 10 (5), 589-597 (2010).
- Kerr, R. A., Roux, A. E., Goudeau, J. F., Kenyon, C. The C. elegans observatory: High-throughput exploration of behavioral aging. Frontiers in Aging. 3, 932696 (2022).
- Javer, A., Ripoll-Sánchez, L., Brown, A. E. Powerful and interpretable behavioural features for quantitative phenotyping of Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1758), 20170375 (2018).
- Miller, H., et al. Genetic interaction with temperature is an important determinant of nematode longevity. Aging Cell. 16 (6), 1425-1429 (2017).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), E277-E286 (2015).
- Huang, C., Xiong, C., Kornfeld, K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 101 (21), 8084-8089 (2004).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Oswal, N., Martin, O. M., Stroustrup, S., Bruckner, M. A. M., Stroustrup, N. A hierarchical process model links behavioral aging and lifespan in C. elegans. PLoS Computational Biology. 18 (9), 1010415 (2022).
- Sen, I., et al. DAF-16/FOXO requires protein phosphatase 4 to initiate transcription of stress resistance and longevity promoting genes. Nature Communications. 11 (1), 138 (2020).
- Schiffer, J. A., et al. et al.Caenorhabditis elegans processes sensory information to choose between freeloading and self-defense strategies. Elife. 9, 56186 (2020).
- Bazopoulou, D., et al. Developmental ROS individualizes organismal stress resistance and lifespan. Nature. 576 (7786), 301-305 (2019).
- Guerrero-Rubio, M. A., Hernández-García, S., García-Carmona, F., Gandía-Herrero, F. Extension of life-span using a RNAi model and in vivo antioxidant effect of Opuntia fruit extracts and pure betalains in Caenorhabditis elegans. Food Chemistry. 274, 840-847 (2019).
- Janssens, G. E., et al. Transcriptomics-based screening identifies pharmacological inhibition of Hsp90 as a means to defer aging. Cell Reports. 27 (2), 467-480 (2019).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. 8 (8), 2655-2662 (2018).
- Lin, X. -. X., et al. DAF-16/FOXO and HLH-30/TFEB function as combinatorial transcription factors to promote stress resistance and longevity. Nature Communications. 9 (1), 4400 (2018).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Byerly, L., Cassada, R., Russell, R. The life cycle of the nematode Caenorhabditis elegans: I. Wild-type growth and reproduction. Developmental Biology. 51 (1), 23-33 (1976).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Wilkinson, D. S., Taylor, R. C., Dillin, A. Analysis of aging in Caenorhabditis elegans. Methods in Cell Biology. 107, 353-381 (2012).
- Hosono, R. Sterilization and growth inhibition of Caenorhabditis elegans by 5-fluorodeoxyuridine. Experimental Gerontology. 13 (5), 369-373 (1978).
- Lithgow, G. J., Driscoll, M., Phillips, P. A long journey to reproducible results. Nature. 548 (7668), 387-388 (2017).
- Zhang, L., Ward, J. D., Cheng, Z., Dernburg, A. F. The auxin-inducible degradation (AID) system enables versatile conditional protein depletion in C. elegans. Development. 142 (24), 4374-4384 (2015).
- Baeriswyl, S., et al. Modulation of aging profiles in isogenic populations of Caenorhabditis elegans by bacteria causing different extrinsic mortality rates. Biogerontology. 11 (1), 53 (2010).
- Banse, S. A., Blue, B. W., Robinson, K. J., Jarrett, C. M., Phillips, P. C. The Stress-Chip: A microfluidic platform for stress analysis in Caenorhabditis elegans. PLoS One. 14 (5), e0216283 (2019).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Swindell, W. R. Accelerated failure time models provide a useful statistical framework for aging research. Experimental Gerontology. 44 (3), 190-200 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados