Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayos de envejecimiento conductual y vida útil de alto rendimiento con la máquina Lifespan
En este artículo
Resumen
La plataforma de imágenes "The Lifespan Machine" automatiza la observación de por vida de grandes poblaciones. Mostramos los pasos necesarios para realizar ensayos de esperanza de vida, resistencia al estrés, patogénesis y envejecimiento conductual. La calidad y el alcance de los datos permiten a los investigadores estudiar las intervenciones en el envejecimiento a pesar de la presencia de variaciones biológicas y ambientales.
Resumen
Los animales genéticamente idénticos mantenidos en un ambiente constante muestran una amplia distribución de la esperanza de vida, lo que refleja un gran aspecto estocástico no genético del envejecimiento conservado en todos los organismos estudiados. Este componente estocástico significa que para comprender el envejecimiento e identificar intervenciones exitosas que extiendan la vida útil o mejoren la salud, los investigadores deben monitorear grandes poblaciones de animales de experimentación simultáneamente. La puntuación manual tradicional de muertes limita el rendimiento y la escala necesarios para las pruebas de hipótesis a gran escala, lo que lleva al desarrollo de métodos automatizados para ensayos de vida útil de alto rendimiento. Lifespan Machine (LSM) es una plataforma de procesamiento de imágenes de alto rendimiento que combina escáneres planos modificados con software personalizado de procesamiento de imágenes y validación de datos para el seguimiento de nematodos durante toda la vida. La plataforma constituye un gran avance técnico al generar datos de vida útil altamente resueltos temporalmente de grandes poblaciones de animales a una escala sin precedentes y con una precisión estadística y exactitud igual a los ensayos manuales realizados por investigadores experimentados. Recientemente, el LSM se ha desarrollado aún más para cuantificar los cambios conductuales y morfológicos observados durante el envejecimiento y relacionarlos con la esperanza de vida. A continuación, describimos cómo planificar, ejecutar y analizar un experimento automatizado de vida útil mediante el LSM. Además, destacamos los pasos críticos necesarios para la recopilación exitosa de datos de comportamiento y curvas de supervivencia de alta calidad.
Introducción
El envejecimiento es un proceso complejo y multifacético caracterizado por una disminución de la función fisiológica de un organismo, lo que conduce a un aumento del riesgo de enfermedad y muerte a lo largo del tiempo1. La esperanza de vida, medida como el tiempo que transcurre desde el nacimiento o el inicio de la edad adulta hasta la muerte, proporciona un resultado inequívoco del envejecimiento2 y un indicador indirecto pero rigurosamente cuantitativo para medir la tasa relativa de envejecimiento entre poblaciones3. Los estudios sobre el envejecimiento a menudo dependen de mediciones precisas de la esperanza de vida, similares a los ensayos clínicos, para comparar los resultados entre una población expuesta a una intervención y un grupo de control no expuesto. Desafortunadamente, los problemas de reproducibilidad impregnan la investigación sobre el envejecimiento, a veces debido a experimentos estadísticamente poco potentes4 y, a menudo, debido a la sensibilidad inherente de los ensayos de vida útil a las variaciones sutiles en el medio ambiente5. Los experimentos robustos requieren múltiples réplicas de grandes poblaciones, y este proceso se beneficia particularmente de la escalabilidad experimental que ofrece la automatización6.
Las rigurosas exigencias de los ensayos de vida útil se originan en la imprevisibilidad del propio proceso de envejecimiento. Los individuos isogénicos alojados en ambientes idénticos muestran diferentes tiempos de muerte y tasas de deterioro fisiológico7, lo que sugiere que la esperanza de vida implica un alto grado de estocasticidad 7,8. Por lo tanto, se requiere que las grandes poblaciones midan los cambios cuantitativos en el proceso de envejecimiento, como los cambios en la esperanza de vida media o máxima, y que superen los sesgos derivados de la variabilidad individual. Además, la capacidad de realizar ensayos de vida útil de alto rendimiento es crucial para respaldar los estudios de las formas de las curvas de supervivencia y los modelos de la dinámica del envejecimiento9.
El nematodo Caenorhabditis elegans es un modelo invaluable para la investigación del envejecimiento debido a su corta vida útil, trazabilidad genética y rápido tiempo de generación, lo que subraya su idoneidad para ensayos de envejecimiento y vida útil de alto rendimiento. Tradicionalmente, la esperanza de vida en C. El elegans se ha medido siguiendo una pequeña población sincronizada de unos 50-100 animales a lo largo del tiempo en medios sólidos y anotando el tiempo de las muertes individuales. A medida que los animales envejecen y pierden movilidad, la puntuación manual de los tiempos de muerte requiere pinchar individualmente a los animales y comprobar si hay pequeños movimientos de la cabeza o la cola. Este suele ser un proceso tedioso y laborioso, aunque se han hecho esfuerzos para acelerarlo 10,11,12. Es importante destacar que la lentitud de los procesos experimentales dificulta el progreso en nuestra comprensión del envejecimiento y la eficacia de las intervenciones probadas.
Para satisfacer las demandas de datos cuantitativos de la investigación sobre el envejecimiento, se han desarrollado muchas tecnologías para automatizar la recopilación de datos, incluida una notable gama de enfoques, desde cámaras microfluídicas hasta escáneres planos 13,14,15,16,17,18. El LSM se diferencia de otros métodos en su amplia optimización para la recopilación de datos de vida útil altamente precisos y exactos, lo que se logra mediante el desarrollo de protocolos de calibración de equipos cuidadosos combinados con un amplio paquete de software que permite a los usuarios validar, corregir y refinar los análisis automatizados13. Aunque el software puede, en principio, aplicarse a diversas modalidades de obtención de imágenes, en la práctica, la mayoría de los usuarios utilizan escáneres planos modificados para permitir un control preciso de la temperatura y la humedad ambientales, factores de importancia crítica debido a su importante efecto en la vida útil19. El LSM toma imágenes de nematodos cada 20 minutos en intervalos que van desde días hasta meses, dependiendo de las condiciones ambientales y el genotipo. Los datos producidos tienen una resolución temporal mucho mayor en comparación con los datos de los ensayos manuales, y las imágenes recopiladas proporcionan un registro visual permanente de la posición del nematodo a lo largo de la vida. Utilizando métodos de aprendizaje automático, los tiempos de muerte se asignan automáticamente a cada individuo. Estos resultados se pueden validar rápida y manualmente utilizando un software cliente llamado "Worm Browser". Como resultado de su hardware y software, el LSM puede generar curvas de supervivencia que son estadísticamente indistinguibles de la puntuación manual de muertes a manos de investigadores experimentados, con la ventaja añadida de una menor carga de trabajo y una mayor escalabilidad13.
La última versión del LSM también permite el estudio del envejecimiento conductual mediante la recopilación de datos morfológicos y conductuales a lo largo de la vida del nematodo y su informe junto con la vida útil de cada individuo. En particular, el LSM captura el tiempo de cese de movimiento vigoroso (VMC) de cada animal, un punto de referencia que a menudo se usa para cuantificar la "duración de la salud" de un individuo a diferencia de su esperanza de vida. Al recopilar simultáneamente datos sobre la esperanza de vida y el envejecimiento conductual, el LSM apoya el estudio de intervenciones que pueden tener efectos diferenciales en diferentes resultados fenotípicos del envejecimiento20. Se puede utilizar una variedad de fenotipos macroscópicamente observables para estudiar el envejecimiento conductual, como el movimiento corporal o el bombeo faríngeo21, la integridad de los tejidos22 y la velocidad de movimiento o el giro inducido por estímulos17. Las comparaciones entre diferentes fenotipos de envejecimiento pueden apoyar el análisis de la estructura causal de los procesos de envejecimiento. Por ejemplo, la comparación entre VMC y la esperanza de vida se utilizó recientemente para caracterizar dos procesos de envejecimiento distintos en C. elegans23.
Si bien se desarrolló inicialmente para medir la esperanza de vida en C. elegans, el LSM apoya la recopilación de datos de supervivencia y comportamiento de una variedad de especies de nematodos, incluido C. briggsae, C. tropicalis, C. japonica, C. brenneri, y P. Pacífico23. La tecnología facilita el estudio del efecto de las intervenciones biológicas y ambientales en la esperanza de vida, la resistencia al estrés y la resistencia a patógenos, y puede acoplarse a herramientas experimentales como ensayos dirigidos de ARN de interferencia o sistemas de degradación de proteínas inducibles por auxinas. Hasta la fecha, se ha utilizado en la literatura científica para una amplia gama de aplicaciones 6,24,25,26,27,28,29,30.
Aquí, describimos un protocolo paso a paso para realizar un experimento de Lifespan Machine utilizando placas de agar, desde las etapas iniciales de la configuración experimental hasta la salida de las curvas de supervivencia resultantes. Una característica distintiva del LSM es que el esfuerzo se concentra en gran medida en la parte inicial, lo que significa que la mayor parte del tiempo del investigador se dedica a la configuración experimental y, en menor medida, durante la adquisición posterior a la imagen. La recopilación de datos está completamente automatizada durante toda la duración del experimento y permite al investigador tener una experiencia de "manos libres". Los pasos descritos aquí son comunes a muchos tipos diferentes de ensayos de supervivencia: se realiza la misma configuración experimental para los ensayos de esperanza de vida, termotolerancia, estrés oxidativo y patogénesis. En la sección de resultados representativos, discutimos un subconjunto de datos de un manuscrito publicado recientemente para ilustrar la efectividad de la canalización de análisis y resaltar los pasos más importantes durante el análisis de imágenes23.
Protocolo
1. Requisitos de software y hardware
- Escáneres planos: En principio, el LSM se puede implementar utilizando una variedad de dispositivos de imagen. Las instrucciones detalladas para las modificaciones y el enfoque del escáner están disponibles en otra parte13. El hardware LSM se muestra en la Figura complementaria 1.
- Herramientas de análisis de datos: el software LSM tiene tres componentes que interactúan: un paquete de software de control de escáner basado en Linux, un paquete de administración de metadatos basado en navegador web y un paquete de software de análisis de imágenes de cliente de Windows y Linux. Consulte las instrucciones para instalar herramientas de software publicadas en el repositorio de GitHub (https://github.com/nstroustrup/lifespan).
- Software de visualización y validación de datos: Utilice Worm Browser, un programa cliente, para programar los experimentos, validar el análisis de imágenes, realizar anotaciones manuales del movimiento del nematodo y generar los datos de supervivencia. Se proporcionan ejecutables binarios para el Worm Browser en Windows 7, Windows 8 y Windows 10, y el Worm Browser se compila a partir del código fuente en Linux o Apple iOS. Hay una guía de instalación disponible en el repositorio de GitHub mencionado anteriormente.
Figura complementaria 1: Vida útil del hardware de la máquina. Una unidad de escáner de superficie plana con una tapa abierta para mostrar las placas cargadas, que se colocan boca abajo en 16 aberturas cortadas sobre una alfombrilla de goma. La alfombrilla de goma se coloca sobre la superficie de un escáner de vidrio. Las etiquetas de las condiciones están escritas en los lados de las placas para evitar problemas durante el análisis de la imagen. La cinta de marcado con el número ("1") y/o el nombre del dispositivo ("Jabba") facilita la verificación posterior de la ubicación de la muestra cuando se trabaja con varios dispositivos de escáner. Encontrará más detalles sobre los componentes de hardware de LSM en otro lugar13. Haga clic aquí para descargar este archivo.
2. Configuración antes del día del experimento
- Calibración de la temperatura de la incubadora: La temperatura ambiental es un determinante importante del C. Esperanza de vida de los elegans 19. Para obtener resultados precisos, realice la adquisición de imágenes a una temperatura cuidadosamente calibrada, que se mantenga constante durante todo el experimento. Para lograr esto, unos días antes del inicio del experimento, mida y calibre la temperatura de la superficie de cada escáner durante la operación. Utilice termopares de alta precisión como se describe en otra parte31 (consulte la Tabla de materiales).
- Disposición de las placas del escáner: Antes del inicio del experimento, planifique la disposición óptima de las placas de cultivo para cada escáner.
NOTA: El propósito de esto es evitar la introducción de factores de confusión resultantes de la variación de temperatura entre los escáneres y a través de la superficie de cada escáner. Los escáneres difieren sutilmente en su temperatura superficial promedio y, además, exhiben sesgos sutiles de temperatura en su superficie31.- Posición de la placa del escáner: Para controlar estos efectos térmicos en el análisis de datos posterior, aleatorice cualquier covariable biológica con respecto a la posición del escáner y estandarice la ubicación de la placa en todos los escáneres.
- Número de muestras en los escáneres: Cuando utilice el diseño de 16 esteras de goma (consulte la Tabla de materiales), coloque cuatro placas por condición en cada escáner, con un total de al menos cuatro escáneres. Esto garantiza que cada condición se distribuya a través de múltiples escáneres, de modo que los efectos de confusión de la temperatura del escáner puedan identificarse y eliminarse durante el análisis de datos13. Para que este análisis sea más sencillo, incluya una condición de referencia compartida (por ejemplo, muestras de tipo salvaje) en cada escáner.
NOTA: En general, debido a la ubicación de los ventiladores del escáner, las placas en la esquina superior derecha de la alfombrilla de goma son más propensas a la desecación. Deje esta ubicación vacía si es necesario.
- Preparación de placas y muestras
- Vertido de las placas de cultivo: Para un secado óptimo de las placas de cultivo del escáner (consulte la Tabla de materiales), vierta el medio agar 4 días antes de cargar los nematodos. Aunque el enfoque del escáner es ajustable para permitir que se agreguen diferentes volúmenes de agar a las placas, el volumen estándar de la placa es de 8 ml.
NOTA: Puede ser útil verter las placas con una bomba peristáltica, especialmente para experimentos grandes. - Siembra de las placas: Siembre las placas con el cultivo bacteriano deseado al menos 2 días antes del inicio del experimento para permitir el secado y crecimiento adecuados del césped bacteriano. Por lo general, 200 μL de cultivo bacteriano son suficientes para formar un césped que alimentará a 40 nematodos durante varias semanas.
NOTA: Las placas que se utilizan normalmente para la obtención de imágenes están más selladas que las placas de Petri de cultivo estándar; Por lo tanto, se recomienda sembrar y secar las placas dentro de una campana de laboratorio, generalmente durante aproximadamente 1 h o hasta que se sequen correctamente.
- Vertido de las placas de cultivo: Para un secado óptimo de las placas de cultivo del escáner (consulte la Tabla de materiales), vierta el medio agar 4 días antes de cargar los nematodos. Aunque el enfoque del escáner es ajustable para permitir que se agreguen diferentes volúmenes de agar a las placas, el volumen estándar de la placa es de 8 ml.
- Manejo de nematodos
- Tamaño de la población: El número de nematodos que se pueden visualizar de forma fiable en una sola placa depende del genotipo, la edad a la que se colocan los nematodos y la cantidad de alimento que se añade a cada plato. Para los experimentos de vida útil que comienzan en la edad adulta temprana, cargue aproximadamente 40 animales por placa. Este número asegura suficiente comida y evita aglomeraciones.
- Crecimiento de grandes poblaciones: Para prepararse para la expansión y sincronización de la población, comience con una población de nematodos apropiada para el método de sincronización elegido (ver más abajo). Tratar de realizar la sincronización en los animales a su edad de máxima producción de huevos, que para los animales de tipo salvaje N2 es el día 2 de la edad adulta32.
NOTA: Otra razón para sincronizar las poblaciones mediante el uso de animales en su segundo día de edad adulta es eliminar la edad materna como un factor que contribuye a la heterogeneidad de la población. La edad materna en C. Se ha demostrado que elegans afecta a múltiples rasgos de aptitud en la progenie, siendo los animales de tipo salvaje del día 2 los que producen la progenie33 de "mayor calidad". - Realizar la sincronización de la edad: Para obtener resultados precisos, sincronice la edad de los animales con la mayor precisión posible. En este protocolo, la sincronización de la edad se realiza mediante un tratamiento con hipoclorito modificado34. Otros métodos pueden incluir la sincronización por puesta de huevos, por detención larvaria L1 o por selección manual de larvas L4.
NOTA: Para la sincronización de la edad mediante el tratamiento con hipoclorito, espere obtener de tres a cuatro óvulos de cada hermafrodita adulto. - Mantener poblaciones libres de progenie: Mantener poblaciones libres de progenie exponiendo a los nematodos durante su etapa L4 tardía a 5-fluoro-2'-desoxiuridina (FUdR)35.
NOTA: En dosis bajas, FuDR es letal para el desarrollo de embriones sin producir cambios macroscópicamente visibles en la línea germinal o alterar la tasa de producción de ovocitos. Otros métodos incluyen el uso de mutantes estériles a temperatura, el uso de construcciones de ARNi esterilizantes o simplemente esperar hasta la senescencia post-reproductiva para transferir los nematodos a placas para la obtención de imágenes. - Transferencia de poblaciones: Al transferir miles de animales entre placas, el protocolo estándar que involucra un alambre de platino/iridio se vuelve laborioso. Los métodos que involucran la suspensión líquida de nematodos facilitan las transferencias y las hacen más eficientes. Recoja los nematodos con tampón M9 + Mg (Na2HPO4 42.27 mM, KH2PO4 22.05 mM, NaCl 85.56 mM, MgSO4 1 mM), reduzca el volumen total una vez que los nematodos se asienten por gravedad y luego transfiera rápidamente los nematodos a las placas utilizadas para la obtención de imágenes.
NOTA: La transferencia de los nematodos por suspensión líquida puede dar lugar a variaciones en el número de animales transferidos a cada placa. Trate de ser consistente con el número de nematodos en cada placa para evitar la variabilidad experimental. - Aplicación de intervenciones: Detener y reiniciar la adquisición de imágenes durante un experimento complica el análisis de imágenes (ver discusión). Por lo tanto, inicie los experimentos de LSM solo después de que se haya completado todo el manejo necesario de los nematodos.
- Esterilización de las alfombrillas de goma: Autoclave una gran cantidad de alfombrillas simultáneamente, envolviéndolas individualmente en papel de aluminio.
NOTA: Las alfombrillas de goma deben esterilizarse entre usos para evitar la acumulación de contaminantes fúngicos o bacterianos. La mayoría de los tipos de caucho que se utilizan normalmente se degradan mediante un tratamiento agresivo con etanol.
3. Configuración el día del experimento
- Soporte de placas y preparación del cristal del escáner: Para simplificar la manipulación de las placas, no cargue las placas de Petri directamente sobre la superficie del escáner, sino que manténgalas en su lugar utilizando alfombrillas de goma sostenidas por paneles de vidrio (consulte la Tabla de materiales). Las poblaciones se visualizan a través de este vidrio, así que mantenga el vidrio limpio y tratado con un recubrimiento antivaho, hidrofóbico y esterilizante (consulte la Tabla de materiales).
- Antes de cargar las placas en la incubadora, limpie la superficie del vidrio de soporte de placas en ambos lados con un limpiador de vidrios antivaho.
- Antes de cargar las placas en su vidrio de soporte, aplique un tratamiento protector de vidrio hidrófobo (consulte la Tabla de materiales) para minimizar el empañamiento en el lado del vidrio que estará en contacto con la alfombra de goma. Extienda bien este tratamiento y déjelo en el vaso durante 5-10 minutos antes de continuar con el siguiente paso. Limpie vigorosamente después de la aplicación para eliminar cualquier residuo.
- Aplique etanol al 70% para desinfectar la superficie del vidrio que estará en contacto con el mate de goma. Dejar actuar durante 1 minuto o 2 minutos, y luego retirar con un paño o una toalla de papel.
- Carga de las placas en los escáneres
- Primero, coloque las alfombrillas de goma esterilizadas en autoclave sobre el vidrio de soporte de la placa tratada.
- Retire la tapa de las placas utilizadas para la obtención de imágenes con nematodos cargados y colóquelas en ubicaciones de tapete de goma frente a la superficie del vidrio. Asegúrese de que la alfombrilla de goma esté bien sellada alrededor de todas las placas, por ejemplo, agregando otra lámina de vidrio en la parte superior y asegurándose de que quede plana o golpeando la parte superior de cada placa (las placas sueltas se moverán ligeramente y golpearán el vidrio, haciendo un sonido, mientras que las placas bien aseguradas no se moverán cuando se golpeen).
NOTA: Es útil etiquetar individualmente cada hoja de vidrio de soporte de placa con cinta de marcado con información sobre el contenido de la placa y el escáner previsto. Estos datos se pueden utilizar después del experimento para resolver cualquier posible ambigüedad con respecto a la ubicación de las placas. - Antes de cargar las placas en los escáneres, desenchufe los ventiladores del escáner para proteger los dedos del experimentador durante la carga de las placas.
- Deslice suavemente las placas y la lámina de vidrio que las sostiene sobre la superficie del escáner.
NOTA: Evite aplicar presión directamente sobre la alfombrilla de goma, ya que esto hace que la alfombrilla se deslice por el vidrio de soporte de la placa. Cuando las alfombrillas se deslizan, las placas a menudo se sueltan de la alfombrilla. - Vuelva a activar los ventiladores del escáner y confirme visualmente que los ventiladores frontal y lateral están encendidos. Si los escáneres están apagados, enciéndalos en este punto.
4. Adquisición previa a la imagen
NOTA: En la Figura 1 se muestra un diagrama de flujo completo que resume todos los pasos basados en software durante la adquisición de imágenes.
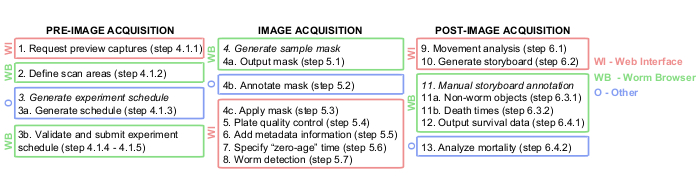
Figura 1: Descripción gráfica de la canalización de análisis de imágenes de Lifespan Machine. Los pasos previos, durante y posteriores a la adquisición de imágenes se realizan principalmente en la interfaz web (WI, en rojo) y en el navegador de gusanos (WB, en verde). Algunos pasos se realizan en otras plataformas (O, en azul), como documentos TXT en el paso 3a, Photoshop o equivalente en el paso 4b, y JMP o equivalente en el paso 13. Haga clic aquí para ver una versión más grande de esta figura.
- Configuración de adquisición de imágenes: genere un archivo que especifique el programa del experimento y la ubicación de las placas en cada escáner para configurar la adquisición de imágenes.
NOTA: Este archivo incluye metadatos importantes como el título del experimento, la frecuencia de las capturas de imágenes y la duración total del experimento. Normalmente, este archivo no se genera de novo para cada experimento, pero en su lugar, los archivos de experimentos anteriores se reutilizan como plantillas. Para el primer experimento de un usuario, se proporciona un archivo de plantilla (Expediente Complementario 1).- Solicitar capturas de vista previa: Proporcione la ubicación de todas las placas en cada escáner. Se proporcionan varias herramientas para acelerar este proceso. En primer lugar, utilice el escáner para obtener una imagen de toda la superficie del escáner, llamada "Vista previa de captura". Asegúrese de que las imágenes de captura de vista previa muestren claramente toda la superficie de cada placa que se va a fotografiar (Figura 2A) sin rayas ni recortes en los bordes de la placa.
- Usando la interfaz web, busque la sección Adquisición de imágenes de la página principal y siga el enlace llamado Dispositivos de captura y servidores de imágenes. En esa página, haga clic en el botón Buscar nuevos dispositivos (es decir, escáneres) en el cuadro Servidores de procesamiento y captura de imágenes . Supervise el progreso del servidor en la detección de escáneres haciendo clic en el enlace [registro] junto al servidor.
NOTA: Asegúrese de que los escáneres deseados estén "encendidos" y conectados al servidor antes de realizar este paso. - En la misma página de la interfaz web, asegúrese de que cada escáner conectado al servidor aparezca en el cuadro Dispositivos de captura de imágenes . La etiqueta "Faltante" en "Estado actual" ya no se muestra si el dispositivo se detecta correctamente. Seleccione la casilla de verificación correspondiente a cada escáner que contenga placas recién cargadas.
- En la parte inferior de la sección Dispositivos de captura de imágenes , haga clic en el botón Solicitar captura de vista previa . Dentro de 1 minuto o 2 minutos, los escáneres deberían iluminarse y comenzar a escanear.
NOTA: La posición inicial de las láminas de soporte de vidrio a menudo debe ajustarse para que todas las placas estén en el rango visible. Las posiciones se pueden corregir inspeccionando las imágenes de captura de vista previa y realizando ajustes en la posición de la placa y volviendo a tomar nuevas imágenes de captura de vista previa. Si los escaneos se realizan con extrema lentitud (varios minutos para un escaneo de captura) o si las imágenes de captura de vista previa contienen rayas blancas largas, esto es una señal de que una placa, la alfombrilla de goma o algún otro objeto está bloqueando la luz dentro de la región de calibración del escáner (indicada por flechas blancas en la superficie del escáner). Todos los objetos deben reposicionarse de manera que solo el vidrio de soporte ocupe esta región.
- Usando la interfaz web, busque la sección Adquisición de imágenes de la página principal y siga el enlace llamado Dispositivos de captura y servidores de imágenes. En esa página, haga clic en el botón Buscar nuevos dispositivos (es decir, escáneres) en el cuadro Servidores de procesamiento y captura de imágenes . Supervise el progreso del servidor en la detección de escáneres haciendo clic en el enlace [registro] junto al servidor.
- Defina las áreas de escaneo: Siga los siguientes pasos en el Worm Browser para analizar las imágenes de captura de vista previa y ensamblarlas en una sola imagen compuesta, que se utiliza para especificar la ubicación de cada placa para el análisis de datos. Asegúrese de que la imagen resultante tenga un aspecto similar al de la Figura 2B.
- Primero, usando el Navegador de gusanos, abra cada imagen de captura de vista previa seleccionando la opción de menú Archivo > Abrir imagen y elija la imagen deseada.
- En cada imagen, haga clic para seleccionar las columnas de las regiones con placas (si la alfombrilla de goma tiene 16 ubicaciones de placa, seleccione 4 columnas).
NOTA: Las regiones de escaneo deben especificarse como columnas altas (no filas anchas), ya que la captura del escáner es más lenta para regiones más anchas, lo que da como resultado imágenes borrosas debido al movimiento de los nematodos. - Una vez definidas todas las imágenes, exporte las especificaciones de la región al disco seleccionando la opción de menú Adquisición de imágenes > Definir áreas de escaneo > Guarde las áreas de escaneo seleccionadas en el disco y elija la ubicación deseada.
- Genere la programación del experimento:
- Siguiendo el formato del Archivo Suplementario 1, ensamble un archivo que contenga el nombre del experimento, las ubicaciones físicas de cada columna en los escáneres (copiadas del archivo de áreas de escaneo generado en el paso 4.1.2.3), la duración total del experimento y la frecuencia de captura de imágenes, y guárdelo como un archivo TXT y como un archivo XML.
- A continuación, en Worm Browser, haga clic en Adquisición de imágenes > en Enviar programa de experimentos y elija el archivo XML generado. El Worm Browser le preguntará si desea generar un resumen de la programación o ejecutar el experimento. Haga clic en Generar un archivo de resumen.
- Validar el archivo de resumen: Después de enviar la programación del experimento, el Worm Browser generará un resumen de la programación. Este resumen se muestra en pantalla y se escribe en el disco. Léalo y verifique las fechas de las capturas programadas, así como la ubicación, el nombre y el número de escáneres.
- Envíe el programa del experimento: Cuando esté satisfecho con el archivo de resumen, cargue de nuevo el archivo XML para el programa del experimento en el Navegador de gusanos seleccionando la opción de menú Adquisición de imágenes > Enviar programa del experimento. El Worm Browser le preguntará por segunda vez si desea generar un resumen de la programación o ejecutar el experimento. Esta vez haga clic en Ejecutar! .
NOTA: Unos minutos después de enviar el experimento, es aconsejable utilizar la interfaz web para confirmar que el experimento se ha enviado correctamente y que todos los escáneres están recopilando escaneos. Es habitual que se pierdan los primeros escaneos, especialmente en experimentos de gran envergadura. - Organizar experimentos en la interfaz web: un clúster de escáneres ocupado puede producir cientos de conjuntos de datos experimentales recopilados por muchos usuarios diferentes. Para organizar esta lista, asigne experimentos a grupos separados, por ejemplo, correspondientes al nombre del usuario responsable del experimento.
- Crear un nuevo grupo o modificar uno existente: Cree nuevos grupos en la interfaz web haciendo clic en Administrar grupos de experimentos en el cuadro llamado Adquisición de imágenes. En la nueva página que aparecerá, agregue el nombre deseado en Crear nuevo grupo y haga clic en Crear. Para modificar el nombre de un grupo existente, en el mismo cuadro, elija el grupo deseado junto a Modificar grupo existente y, a continuación, seleccione Modificar.
- Asignar experimentos a un grupo: para asignar nuevos experimentos a un grupo específico, vaya a la interfaz web y busque el experimento deseado, que de forma predeterminada se asignará al grupo Sin grupo en la parte inferior de la lista de experimentos. Haga clic en el enlace a la derecha de la sección del experimento donde dice Editar y use la lista desplegable para seleccionar el nombre del grupo que se va a usar. A continuación, seleccione Guardar.
- Cancelar un experimento:
NOTA: El LSM seguirá funcionando de forma autónoma hasta que se especifiquen los escaneos finales en el programa del experimento. Una vez completada una programación experimental, el LSM, de forma predeterminada, continuará recopilando exploraciones, pero descartará inmediatamente los datos de la imagen en un proceso denominado exploración automática. Estos escaneos automáticos se realizan para evitar que los escáneres se apaguen y se enfríen, y mantienen un perfil de temperatura estándar para que cualquier otro experimento que se ejecute en el mismo espacio (pero desde un experimento diferente) no se vea afectado por el apagado de otros escáneres.- Detener análisis automáticos: Para detener los análisis automáticos de un experimento en curso en la interfaz web, haga clic en Editar junto al experimento deseado, luego en Cancelar análisis pendientes y seleccione Cancelar capturas programadas.
- Solicitar capturas de vista previa: Proporcione la ubicación de todas las placas en cada escáner. Se proporcionan varias herramientas para acelerar este proceso. En primer lugar, utilice el escáner para obtener una imagen de toda la superficie del escáner, llamada "Vista previa de captura". Asegúrese de que las imágenes de captura de vista previa muestren claramente toda la superficie de cada placa que se va a fotografiar (Figura 2A) sin rayas ni recortes en los bordes de la placa.
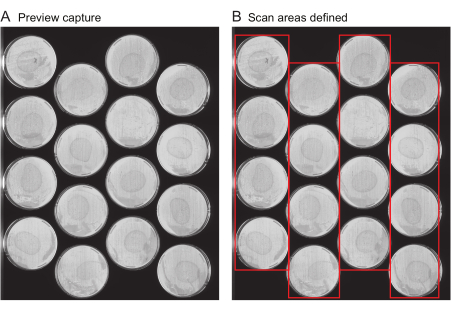
Figura 2: Vista previa de la imagen de captura y selección del área de escaneo. (A) Para cada escáner del experimento, se genera una imagen de captura de vista previa. (B) Selección de una fila de placas a la vez (cajas rojas), lo que aumenta la velocidad de escaneo y evita el desenfoque de movimiento de gusano como resultado de áreas de escaneo que son demasiado anchas. Haga clic aquí para ver una versión más grande de esta figura.
5. Adquisición de imágenes
NOTA: Los siguientes pasos se pueden realizar tanto mientras se ejecuta el experimento como después de que haya finalizado.
- Salida del archivo de máscara del experimento: los datos de imágenes sin procesar de los escáneres contienen muchas áreas que no necesitan ser procesadas (áreas fuera de las placas). Para enfocar el análisis en cada placa individualmente, se crea una "máscara" que especifica el área ocupada por cada placa en cada escáner. Genere esta máscara dibujando la posición de cada placa como una superposición en las imágenes recopiladas por los escáneres.
- Con el Navegador de gusanos, elija el experimento deseado seleccionando Archivo > Seleccionar experimento actual y, a continuación, haga clic en el nombre del experimento.
- De nuevo en el Worm Browser, seleccione Adquisición de imágenes > Definir máscaras de muestra > Generar composición de máscara de experimento y guarde la máscara en la ubicación deseada. Asegúrese de que el archivo resultante tenga un aspecto similar al de la figura 3A.

Figura 3: Especificación de las ubicaciones de las placas para cada escáner utilizando máscaras de muestra. Para garantizar el análisis independiente de las placas dentro de las selecciones de columnas que se muestran en la Figura 1, las placas individuales deben identificarse mediante la generación de una composición de máscara de imagen. (A) Se abre una captura de los escaneos de los escáneres con un software de manipulación de imágenes (tenga en cuenta el nombre del escáner "han" encima de una selección escaneada, y "a-d" refiriéndose a cada una de las columnas). (B) Los pasos individuales de la generación de máscaras para marcar la ubicación de cada placa en la composición de máscara requieren que el fondo se establezca en negro, (C) la eliminación de bordes dentados y bordes de placas no seleccionadas mediante la expansión y luego contracción del fondo, y (D) la selección de las placas en primer plano y el relleno completo de las áreas con píxeles blancos.) Para que el LSM reconozca placas individuales en las filas escaneadas, cada región blanca de una fila se rellena con un tono diferente de gris, normalmente con un brillo creciente. (F) En esta etapa, se guarda la máscara (compresión LZW sin capas especificadas si se genera en Photoshop). A continuación, el Worm Browser escanea la máscara y el software genera una visualización de la máscara. Una visualización correcta de la máscara debe mostrar un cuadrado definido por placa con una pequeña cruz en el centro y un color diferente para cada fila. Haga clic aquí para ver una versión más grande de esta figura.
- Anotar la máscara del experimento: Abra el archivo generado en el paso anterior con un programa de manipulación de imágenes (como Photoshop o GIMP) para marcar la ubicación de cada placa en la imagen. A continuación se describe una descripción general de todos los pasos de edición de máscaras con Photoshop.
- En Photoshop, seleccione la herramienta Relleno con la tolerancia establecida en cero, la opción contigua seleccionada y el suavizado sin seleccionar. Haga clic en el fondo gris para establecerlo completamente en negro. Asegúrese de que la imagen resultante sea similar a la de la Figura 3B.
- Utilice la herramienta Varita mágica para seleccionar el fondo negro, con el aliasing desactivado, la tolerancia establecida en cero y la opción contigua seleccionada. Para suavizar los bordes, expanda el fondo seleccionado en 30 píxeles haciendo clic en Seleccionar > Modificar > Expandir. A continuación, reduzca la selección en 20 píxeles en Seleccionar > Modificar > contrato. Asegúrese de que la imagen resultante sea similar a la de la Figura 3C.
- Rellena el fondo suavizado completamente con píxeles negros, por ejemplo, estableciendo la tolerancia de la herramienta Relleno en 255 y rellenando la región seleccionada. A continuación, haz clic en Seleccionar > invertir la selección y selecciona el primer plano. Por ejemplo, rellene la nueva región completamente con píxeles blancos, estableciendo la tolerancia de la herramienta de relleno en 255 y rellenando la región con blanco. Asegúrese de que la imagen resultante tenga un aspecto similar al de la figura 3D.
- Para separar cada placa dentro de una sola región, rellene cada fila con un degradado diferente de gris para aumentar el brillo. Esto se puede hacer con la herramienta Relleno y luego seleccionando el color deseado, con la tolerancia establecida en 0. Asegúrese de que la imagen resultante tenga un aspecto similar al de la Figura 3E. Guárdalo en una compresión LZW sin "Capas" especificadas.
NOTA: El orden de las placas se establece por el color de las regiones especificadas. Para nombrar las placas 1-4 en un orden de arriba a abajo, especifique los colores en brillo creciente para cada fila. - En el Navegador de gusanos, seleccione Adquisición de imágenes > Definir máscaras de muestra > Analizar ubicaciones de placas dibujadas en la composición de máscara de experimento y seleccione el archivo generado en el paso anterior. El software ahora se tomará unos minutos para analizar la máscara enviada.
- El Worm Browser mostrará una visualización de máscara. Inspeccione la máscara en busca de posibles errores en el archivo. Asegúrese de que cada fila de platos esté llena de un color diferente y delineada por un rectángulo de color. Asegúrese de que la imagen resultante tenga un aspecto similar al de la Figura 3F.
NOTA: Si una sola placa muestra dos círculos o más, o si dos círculos comparten el mismo color, vuelva al paso 5.2 para corregir el archivo de máscara y cárguelo de nuevo en el Worm Browser. - Después de verificar que la visualización de la máscara es correcta, en el Navegador de gusanos, seleccione Adquisición de imágenes > Definir máscaras de muestra > Enviar composición de máscara de experimento analizada a clúster. El servidor de análisis de imágenes analizará ahora la ubicación de todas las placas del experimento.
- Aplicar la máscara: el LSM utiliza máscaras para dividir los datos de la imagen sin procesar en placas individuales. Para iniciar este proceso, programe un trabajo de aplicación de máscara mediante la interfaz web.
- Antes de enviar el trabajo, compruebe que todos los escáneres tienen regiones identificadas en la máscara. Vaya a la página principal de la interfaz web, busque el nombre del experimento y la columna denominada Análisis de imágenes y haga clic en Ejecutar análisis. Compruebe que todos los dispositivos de Muestras de experimento tengan regiones identificadas.
- Para aplicar la máscara, en la misma interfaz, haga clic en Nuevo trabajo para todas las muestras. En el cuadro denominado Programar un trabajo para imágenes individuales, seleccione la casilla Aplicar máscara y, a continuación, Guardar trabajo.
NOTA: La máscara se aplicará a todas las imágenes ya capturadas, así como a cualquier imagen capturada en el futuro.
- Realizar el control de calidad de la placa:
NOTA: Las placas que sufren de contaminación, desecación o empañamiento se censuran en esta etapa del análisis de la imagen. En la Figura 4 se muestra un ejemplo de placas contaminadas, desecadas, empañadas y óptimas. Otras razones para censurar incluyen el hambre, los platos vacíos o las larvas en poblaciones estériles. Las placas no válidas a menudo contienen formas complejas que la máquina pretende interpretar como nematodos. Es importante excluir las placas no válidas en este paso para evitar largos tiempos de procesamiento en los pasos posteriores del análisis de imágenes.- Con la interfaz web, excluya las placas que se van a censurar buscando el experimento deseado y la columna denominada Anotar información de la placa y seleccionando Por imagen.
- Para inspeccionar las placas, haga clic en Mostrar imágenes.
NOTA: Si el paso para mostrar imágenes no funciona correctamente, es posible que el servidor Linux no esté configurado correctamente. Las instrucciones sobre cómo hacerlo están disponibles en la guía de instalación del software en el repositorio de GitHub antes mencionado. - Para excluir placas, marque la casilla Censurar, seleccione una opción en el cuadro desplegable denominada Motivo de censura y, a continuación, haga clic en Guardar para cada página.
- Agregar información de metadatos: los metadatos describen el contenido de cada placa de un experimento. Esta información se incluye en todos los ficheros de datos estadísticos que se generan posteriormente.
- Para agregar información de metadatos relativa a la cepa, genotipo, temperatura, alimento, etc., vaya a la página principal de la interfaz web, busque el experimento deseado y la columna llamada Anotar información de placa, y seleccione Por posición.
- Introduzca las etiquetas y seleccione los escáneres para los que desea guardar los metadatos haciendo clic en Guardar en dispositivos en la esquina inferior izquierda.
- Para reutilizar los metadatos entre diferentes escáneres sin tener que volver a introducir todas las etiquetas, vaya a Cargar desde el dispositivo en la esquina superior derecha, seleccione el escáner desde el que desea reutilizar los metadatos y haga clic en Cargar desde el dispositivo.
- Especifique el tiempo de "edad cero": De forma predeterminada, el LSM mide el tiempo en relación con el inicio de la época UNIX. Esto rara vez es conveniente, por lo que se requiere la especificación de un tiempo de referencia (por ejemplo, la fecha en que todos los individuos nacieron o alcanzaron la edad adulta).
- Para especificar la información de tiempo de edad cero, vaya a la página principal de la interfaz web, busque el experimento deseado y la columna denominada Análisis de imágenes, y seleccione Ejecutar análisis.
- En la nueva página que aparece, seleccione Nuevo trabajo para todas las regiones. En el cuadro denominado Actualizar información de región, seleccione Hora en la que los animales tenían 0 años, agregue la información y, a continuación, haga clic en Actualizar campos seleccionados.
NOTA: Si todos los animales no comparten el mismo tiempo de edad cero, seleccione en su lugar Nuevo trabajo para tipos de animales específicos y repita los pasos anteriores para cada grupo.
- Programar la detección de gusanos: El LSM puede automatizar la detección de cada nematodo en función de su posición en la placa.
- Para iniciar la detección automatizada de nematodos para cada imagen, vaya a la página principal de la interfaz web, busque el experimento deseado y la columna denominada Análisis de imágenes, y seleccione Ejecutar análisis.
- En la nueva página que aparecerá, haga clic en Nuevo trabajo para todas las regiones, luego en el cuadro denominado Programar un trabajo para imágenes individuales y seleccione las casillas Filtro mediano > Umbral > Detección de gusanos > Guardar trabajo. Estos trabajos se aplicarán a todas las imágenes capturadas pasadas y futuras.
NOTA: Para programar un trabajo solo para una cepa o condición específica, haga clic en Trabajos para tipos de animales específicos. La clasificación de objetos se realiza mediante modelos SVM que se especifican como archivos almacenados en la subcarpeta Models del directorio de almacenamiento a largo plazo de LSM. Los conjuntos de parámetros de detección de nematodos V2.0 para el LSM se pueden descargar desde el repositorio de GitHub.
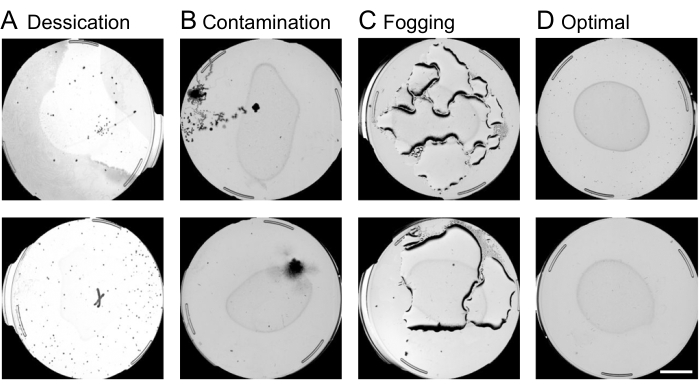
Figura 4: Control de calidad de la placa mediante la interfaz web. La censura de placas subóptimas en la interfaz web antes del análisis del movimiento del gusano es crucial para acelerar el proceso de procesamiento de imágenes. Ejemplos de placas sujetas a remoción incluyen condiciones de (A) desecación, (B) contaminación o (C) nebulización, según corresponda. (D) Placas óptimas que se incluirán en análisis posteriores. Se superpone una barra de escala de 10 mm a una imagen de captura de vista previa. Haga clic aquí para ver una versión más grande de esta figura.
6. Adquisición posterior a la imagen
NOTA: Una vez completada la detección de gusanos, todos los datos recopilados del experimento deben agregarse a lo largo del tiempo para realizar un seguimiento de cada individuo a lo largo de su vida e identificar los tiempos de muerte de todos los individuos. Espere hasta que todos los animales del experimento hayan muerto y hasta que se hayan completado todos los trabajos de detección de gusanos y, a continuación, realice los pasos siguientes:
- Programe el análisis de movimiento:
- El análisis del movimiento integra todos los datos experimentales a lo largo del tiempo para estimar los tiempos de muerte. Para iniciar este trabajo, vaya a la página principal de la interfaz web y busque el experimento deseado en la columna denominada Análisis de imágenes. Seleccione el enlace Ejecutar análisis.
- En la nueva página que aparece, haga clic en el enlace Nuevo trabajo para todas las regiones y, en el menú desplegable, Programar un trabajo para toda una región, seleccione Analizar el movimiento de gusanos y haga clic en el botón Guardar trabajo.
- El servidor de adquisición de imágenes LSM comenzará automáticamente a analizar el movimiento en todas las placas.
NOTA: El análisis de movimiento es el trabajo más grande. En un procesador multinúcleo moderno, el análisis de cada placa de un experimento de vida útil de 1 mes puede tardar 20 minutos o más.
- Generar un guión gráfico: Una vez completado el análisis de movimiento, el guión gráfico de LSM permite a los usuarios validar manualmente los resultados automatizados y asegurarse de que el software está haciendo suposiciones correctas sobre la morfología y el comportamiento del nematodo.
- En la página principal de la interfaz web, busque el experimento deseado y la columna denominada Análisis de imágenes y seleccione Ejecutar análisis. En la nueva página que aparece, haga clic en Nuevo trabajo de experimento. A continuación, en la sección Programar un trabajo para toda una región, seleccione Generar guión gráfico de animales y haga clic en Guardar trabajo.
- Una vez que el LSM haya terminado de generar el guión gráfico, vaya al Navegador de gusanos y seleccione el experimento deseado. De vuelta en el menú principal, seleccione Validación > Examinar todo el experimento > inmediatamente después de la muerte de cada gusano.
- Anotar los guiones gráficos en el Worm Browser: Un guión gráfico típico en el Worm Browser debería tener el siguiente aspecto: Figura 5.
- Anotar objetos "que no son gusanos"
NOTA: Cada objeto detectado durante el movimiento se muestra en el guión gráfico, ordenado por el tiempo de muerte estimado. A menos que el usuario especifique lo contrario, cada objeto se incluirá en las curvas de supervivencia resultantes. La clasificación de objetos LSM se calibra intencionadamente para tener una alta tasa de falsos positivos, como compensación para minimizar el número de nematodos no detectados. La exclusión de objetos que no son gusanos es importante para obtener curvas de supervivencia de alta calidad (ver los resultados representativos). Por lo general, se encuentra una gran cantidad de objetos que no son gusanos en la primera y la última página del guión gráfico, que se pueden excluir manualmente rápidamente de forma masiva.- Para excluir objetos que no sean gusanos en el guión gráfico, haga clic con el botón derecho una vez en la imagen del objeto. El objeto excluido ahora estará delineado por un cuadro blanco. Para excluir muchos objetos simultáneamente, mantenga presionada la tecla Control y haga clic con el botón derecho una vez en cualquier objeto, y se excluirán todos los objetos de la página del guión gráfico.
- Después de excluir un objeto del análisis, ese objeto se puede volver a incluir haciendo clic con el botón derecho dos veces más.
- Para guardar las anotaciones realizadas durante la anotación del guión gráfico, haga clic en el botón Guardar . Se recomienda guardar con frecuencia el progreso mientras se anota.
- Anota los tiempos de muerte:
NOTA: Sin la intervención del usuario, el LSM estima con precisión los tiempos de muerte para la mayoría de las poblaciones. Sin embargo, se recomienda confirmar rutinariamente la precisión de los resultados automatizados mediante la validación manual de un subconjunto aleatorio de individuos de cada experimento. Se debe prestar especial atención a los individuos más cortos y más longevos, ya que cualquier error en el análisis automatizado tiende a agruparse en estos grupos.- Haga clic con el botón izquierdo una vez en cualquier objeto del guión gráfico para abrir una nueva ventana que muestra información detallada de series temporales sobre ese objeto. Esta ventana permite la inspección de todas las imágenes recogidas del objeto a lo largo del experimento, así como la cuantificación de la dinámica de movimiento y la morfología del objeto. Usando la misma interfaz, anote manualmente los tiempos de muerte. La interfaz para la anotación de la hora de muerte se muestra en la Figura 6.
- Para anotar manualmente los tiempos de muerte, haga clic con el botón izquierdo en la barra inferior en el punto correspondiente a la hora de muerte. Utilice la barra espaciadora y las flechas derecha o izquierda del teclado para desplazarse por los marcos de tiempo, o haga clic directamente en la barra en el marco de tiempo deseado.
NOTA: La visualización representa el estado de movimiento de los animales a lo largo del tiempo, como un gráfico de barras horizontales con el tiempo de marcado del eje x. La sección rosa/púrpura indica el período de tiempo en el que el objeto se mueve vigorosamente, el amarillo indica un movimiento débil, el rojo indica animales inmóviles y el verde indica el período de expansión asociado a la muerte. Los nematodos muestran eventos morfológicos característicos asociados a la muerte: una contracción gradual del cuerpo que generalmente ocurre antes de la muerte, seguida de una rápida expansión del cuerpo durante o inmediatamente después de la muerte (Figura 6B). Los objetos que no son gusanos, como el polvo o las sombras, no muestran esta dinámica en el tamaño del cuerpo y, en cambio, suelen seguir un cambio lineal y gradual en el tamaño y la intensidad a lo largo del tiempo. Estas diferentes dinámicas de tamaño corporal proporcionan un método rápido y sencillo para la clasificación rápida y la exclusión manual. - Dependiendo del enfoque de análisis, el tiempo de muerte se puede considerar como el momento de cese del movimiento (el inicio de la barra roja en la visualización del movimiento) o como el tiempo de expansión asociada a la muerte (la barra verde en la visualización del movimiento). Para anotar manualmente los eventos de contracción y expansión, haga clic con el botón derecho en la barra inferior en el período de tiempo deseado.
- Algunas visualizaciones rudimentarias de datos de mortalidad se proporcionan de forma nativa en el cliente de Worm Browser. Las curvas de supervivencia y el diagnóstico del tiempo de muerte se muestran para cada población presente en el guión gráfico (Figura 7). Vea las curvas de supervivencia en el lado izquierdo y el diagrama de dispersión que compara el tiempo de cese del movimiento vigoroso (VMC) con el momento de la muerte de cada individuo en el lado derecho del guión gráfico.
NOTA: Es posible agrupar estos resultados de acuerdo con diferentes parámetros experimentales mediante un subajuste en la barra inferior para condiciones tales como cepas, escáneres o placas específicas. Los gusanos individuales se pueden seleccionar en función de sus tiempos de muerte haciendo clic con el botón izquierdo en puntos individuales en el gráfico VMC frente al tiempo de muerte.
- Anotar objetos "que no son gusanos"
- Escritura de los datos de mortalidad en el disco: el LSM produce datos de mortalidad en forma de archivos CSV. Trace las curvas de supervivencia generadas y analícelas en cualquier software estadístico como R, SAS, STATA o JMP.
- Para generar estos archivos, elija el experimento en el Navegador de gusanos y, en el menú, seleccione Archivos de datos, Tiempos de muerte y, a continuación, haga clic en Generar tiempos de muerte para el experimento actual. El LSM generará un archivo de salida con los datos de supervivencia del experimento, que se guardará en el directorio de resultados.
- Si se han realizado anotaciones manuales en el guión gráfico, aparecerá un mensaje en el Navegador de gusanos que le preguntará cómo manejar las anotaciones manuales. Haga clic en "Inmediatamente" para incluir anotaciones a mano en el archivo de tiempos de muerte emitido.
NOTA: Los archivos de datos de mortalidad se escriben en el directorio de resultados especificado en el archivo imageserver.ini. Se escriben una variedad de archivos, pero la versión más utilizada es "survival_simple/survival=machine_hand", que incluye todas las anotaciones manuales realizadas con el guión gráfico. - Analizar los datos de mortalidad en el software estadístico de su elección.
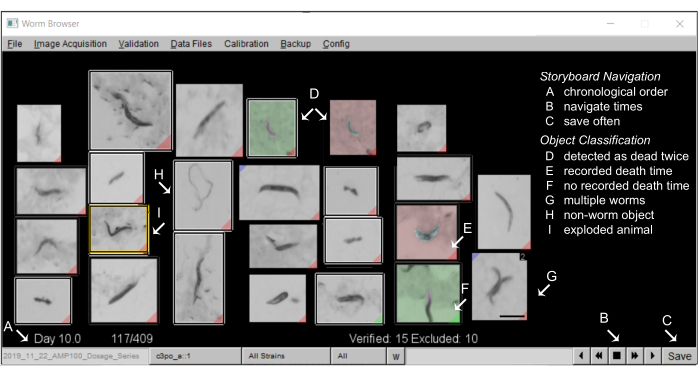
Figura 5: Guión gráfico de animales en el Worm Browser. (A) Todos los gusanos estacionarios se muestran en orden cronológico del tiempo de muerte anotado por la máquina. Para navegar por el guión gráfico, presione los botones de la esquina inferior derecha (B) y (C) guarde las anotaciones con frecuencia. (D) Las imágenes con un fondo no gris representan dos eventos de muerte de gusanos (muerte temprana como verde, muerte posterior como rojo), que pueden ocurrir cuando dos gusanos mueren cerca uno del otro, o cuando los gusanos muertos son movidos por un gusano que pasa y, por lo tanto, se detectan como muertos dos veces. (E) Una etiqueta roja en la esquina inferior de una imagen identifica a los gusanos con un tiempo de muerte detectado; (F) una etiqueta verde indica dónde un objeto no permaneció quieto el tiempo suficiente para registrar un tiempo de muerte. (G) Se pueden marcar varios gusanos en el mismo fotograma pulsando la tecla Mayús y haciendo clic con el botón izquierdo. (H) Los objetos que no son gusanos se excluyen del análisis haciendo clic con el botón derecho. (I) Los gusanos explotados se censuran del análisis haciendo clic en la imagen correspondiente (se abre una ventana de anotación manual) y pulsando Mayús y haciendo clic con el botón derecho hasta que aparezca un mensaje de "animal explotado". Una barra de escala de 0,5 mm y etiquetas se superponen en la captura de pantalla de una ventana de Worm Browser. Haga clic aquí para ver una versión más grande de esta figura.
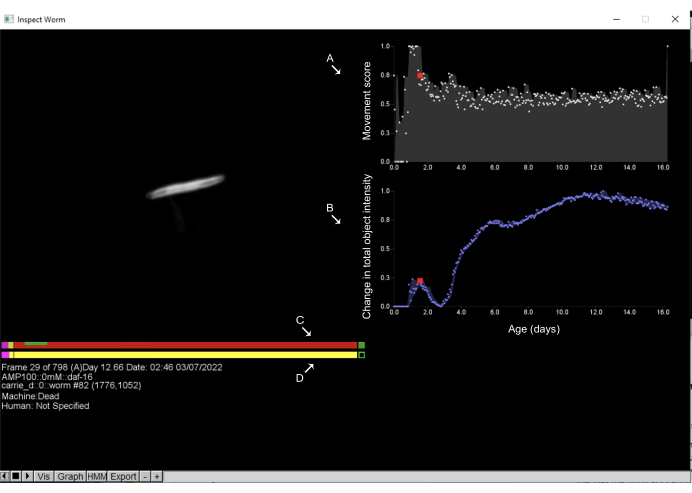
Figura 6: Inspección de objetos y anotación de tiempos de muerte en el Worm Browser. Al hacer clic con el botón izquierdo en cualquier objeto del guión gráfico del Navegador de gusanos, se abre una nueva interfaz y permite al usuario inspeccionar la dinámica de movimiento del objeto. En el lado derecho, se muestra la puntuación de movimiento (A), que cuantifica el movimiento del objeto; Esto se estima por el cambio en las intensidades de píxeles entre observaciones consecutivas. Además, en el lado derecho, (B) se muestra el cambio en la intensidad total del objeto, que cuantifica los cambios en el tamaño del objeto. En el lado izquierdo, la barra superior muestra la (C) estimación de la máquina del tiempo de muerte, mientras que la barra inferior es la (D) anotación humana a mano. Al hacer clic en cualquier punto de las barras y presionar la tecla de espacio permite al usuario moverse a través de los marcos de tiempo en los que se ha fotografiado el gusano. En estas barras, el rosa representa el tiempo que se pasa en un movimiento vigoroso, el rojo representa el tiempo que se pasa en la muerte y el amarillo es todo lo que hay en el medio. El tiempo empleado en expansión y contracción después del tiempo de muerte se muestra en verde. Las etiquetas se superponen en la captura de pantalla de una ventana de Worm Browser. Haga clic aquí para ver una versión más grande de esta figura.
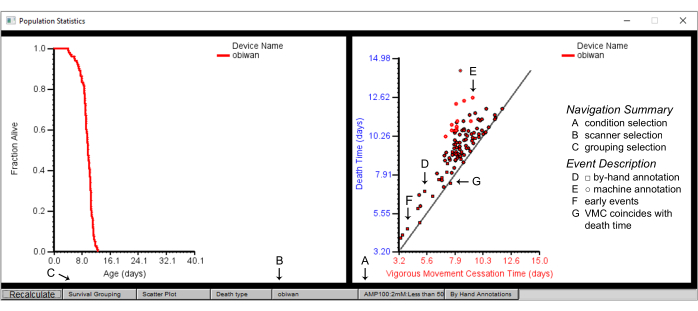
Figura 7: Estadísticas de resumen de población en el navegador de gusanos. Estadísticas de población para el dispositivo escáner "obiwan", con un gráfico de supervivencia (panel izquierdo) y un diagrama de dispersión del tiempo de cese del movimiento vigoroso (VMC) frente al tiempo de muerte (panel derecho). Los gráficos son detalles de (A) una condición, obtenida de (B) un escáner logrado seleccionando primero (C) la agrupación de supervivencia por cepa. (D) Las formas cuadradas en el diagrama de dispersión representan los eventos anotados a mano, mientras que (E) las formas circulares representan los eventos anotados por la máquina. (F) A menudo se requiere una anotación manual para eventos de muerte que ocurren temprano o (G) aquellos en los que el momento de cese del movimiento vigoroso coincide con el momento de la muerte. Las etiquetas se superponen en la captura de pantalla de una ventana de Worm Browser. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
La reproducibilidad experimental en los ensayos de esperanza de vida es un reto y requiere tanto condiciones experimentales estrictamente controladas como grandes poblaciones para lograr una resolución estadística suficiente 4,36. El LSM es especialmente adecuado para el estudio de grandes poblaciones de animales en un entorno constante con alta resolución temporal. Para demostrar la capacidad del LSM, resaltar los pasos cruciales del análisis y ayudar a los ...
Discusión
Aquí, proporcionamos un protocolo detallado y accesible para realizar un experimento utilizando la última versión de Lifespan Machine. Hemos demostrado que el paso crítico para lograr curvas de supervivencia bien resueltas es la exclusión manual de objetos que no sean gusanos durante la adquisición posterior a la imagen. La anotación manual del tiempo de muerte tiene un pequeño efecto en la forma general de las curvas de supervivencia, lo que demuestra que la estimación totalmente automatizada del tiempo de muer...
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Agradecemos a Julian Ceron y Jeremy Vicencio (IDIBELL Barcelona) por producir el alelo rpb-2(cer135). Este proyecto ha sido financiado por el Consejo Europeo de Investigación (ERC) en el marco del programa de investigación e innovación Horizonte 2020 de la Unión Europea (Acuerdo de Subvención n.º 852201), el Ministerio de Economía, Industria y Competitividad (MEIC) a la asociación EMBL, el Centro de Excelencia Severo Ochoa (CEX2020-001049-S, MCIN/AEI /10.13039/501100011033), el Programa CERCA/Generalitat de Catalunya, el premio MEIC Excelencia BFU2017-88615-P, y un premio de la Fundación Glenn para la Investigación Médica.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-Naphtaleneacetic acid (Auxin) | Sigma | N0640 | Solubilize Auxin in 1M potassium hydroxide and add into molten agar |
| 5-fluoro-2-deoxyuridine (FUDR) | Sigma | F0503 | 27.5 μg/mL of FUDR was used to eliminate progeny from populations on UV-inactivated bacteria |
| Glass cleaner | Kristal-M | QB-KRISTAL-M125ml | |
| Hydrophobic anti-fog glass treatment | Rain-X Scheibenreiniger | C. 059140 | |
| Rubber matt | Local crafstman | Cut on a high-strength EPDM rubber sheet stock | |
| Scanner glass | Local hardware supplier | 9" x 11.5" inch glass sheet | |
| Scanner plates | Life Sciences | 351006 | 50 mm x 9 mm, polystyrene petri dish |
| USB Reference Thermometer | USB Brando | ULIFE055500 | For calibrating temperature of scanners |
Referencias
- Harman, D. The aging process: Major risk factor for disease and death. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5360-5363 (1991).
- Vaupel, J. W. Biodemography of human ageing. Nature. 464 (7288), 536-542 (2010).
- Mair, W., Goymer, P., Pletcher, S. D., Partridge, L. Demography of dietary restriction and death in Drosophila. Science. 301 (5640), 1731-1733 (2003).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in Genetics. 8, 92 (2017).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nature Communications. 8 (1), 14256 (2017).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature. 419 (6909), 808-814 (2002).
- Kirkwood, T. B., et al. What accounts for the wide variation in life span of genetically identical organisms reared in a constant environment. Mechanisms of Ageing and Development. 126 (3), 439-443 (2005).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Cornwell, A. B., Llop, J. R., Salzman, P., Thakar, J., Samuelson, A. V. The replica set method: A high-throughput approach to quantitatively measure Caenorhabditis elegans lifespan. Journal of Visualized Experiments. (136), e57819 (2018).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: A quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Hulme, S. E., et al. Lifespan-on-a-chip: Microfluidic chambers for performing lifelong observation of C. elegans. Lab on a Chip. 10 (5), 589-597 (2010).
- Kerr, R. A., Roux, A. E., Goudeau, J. F., Kenyon, C. The C. elegans observatory: High-throughput exploration of behavioral aging. Frontiers in Aging. 3, 932696 (2022).
- Javer, A., Ripoll-Sánchez, L., Brown, A. E. Powerful and interpretable behavioural features for quantitative phenotyping of Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1758), 20170375 (2018).
- Miller, H., et al. Genetic interaction with temperature is an important determinant of nematode longevity. Aging Cell. 16 (6), 1425-1429 (2017).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), E277-E286 (2015).
- Huang, C., Xiong, C., Kornfeld, K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 101 (21), 8084-8089 (2004).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Oswal, N., Martin, O. M., Stroustrup, S., Bruckner, M. A. M., Stroustrup, N. A hierarchical process model links behavioral aging and lifespan in C. elegans. PLoS Computational Biology. 18 (9), 1010415 (2022).
- Sen, I., et al. DAF-16/FOXO requires protein phosphatase 4 to initiate transcription of stress resistance and longevity promoting genes. Nature Communications. 11 (1), 138 (2020).
- Schiffer, J. A., et al. et al.Caenorhabditis elegans processes sensory information to choose between freeloading and self-defense strategies. Elife. 9, 56186 (2020).
- Bazopoulou, D., et al. Developmental ROS individualizes organismal stress resistance and lifespan. Nature. 576 (7786), 301-305 (2019).
- Guerrero-Rubio, M. A., Hernández-García, S., García-Carmona, F., Gandía-Herrero, F. Extension of life-span using a RNAi model and in vivo antioxidant effect of Opuntia fruit extracts and pure betalains in Caenorhabditis elegans. Food Chemistry. 274, 840-847 (2019).
- Janssens, G. E., et al. Transcriptomics-based screening identifies pharmacological inhibition of Hsp90 as a means to defer aging. Cell Reports. 27 (2), 467-480 (2019).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. 8 (8), 2655-2662 (2018).
- Lin, X. -. X., et al. DAF-16/FOXO and HLH-30/TFEB function as combinatorial transcription factors to promote stress resistance and longevity. Nature Communications. 9 (1), 4400 (2018).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Byerly, L., Cassada, R., Russell, R. The life cycle of the nematode Caenorhabditis elegans: I. Wild-type growth and reproduction. Developmental Biology. 51 (1), 23-33 (1976).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Wilkinson, D. S., Taylor, R. C., Dillin, A. Analysis of aging in Caenorhabditis elegans. Methods in Cell Biology. 107, 353-381 (2012).
- Hosono, R. Sterilization and growth inhibition of Caenorhabditis elegans by 5-fluorodeoxyuridine. Experimental Gerontology. 13 (5), 369-373 (1978).
- Lithgow, G. J., Driscoll, M., Phillips, P. A long journey to reproducible results. Nature. 548 (7668), 387-388 (2017).
- Zhang, L., Ward, J. D., Cheng, Z., Dernburg, A. F. The auxin-inducible degradation (AID) system enables versatile conditional protein depletion in C. elegans. Development. 142 (24), 4374-4384 (2015).
- Baeriswyl, S., et al. Modulation of aging profiles in isogenic populations of Caenorhabditis elegans by bacteria causing different extrinsic mortality rates. Biogerontology. 11 (1), 53 (2010).
- Banse, S. A., Blue, B. W., Robinson, K. J., Jarrett, C. M., Phillips, P. C. The Stress-Chip: A microfluidic platform for stress analysis in Caenorhabditis elegans. PLoS One. 14 (5), e0216283 (2019).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Swindell, W. R. Accelerated failure time models provide a useful statistical framework for aging research. Experimental Gerontology. 44 (3), 190-200 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados