Soluções e Concentrações
Visão Geral
Fonte: Laboratório do Dr. Michael Evans — Instituto de Tecnologia da Geórgia
Uma solução é uma mistura homogênea contendo alguns componentes em pequenas quantidades, chamados solutos, e um componente em grande quantidade, chamado solvente. As soluções de líquido sólido contêm um ou mais solutos sólidos dissolvidos em um solvente líquido. As soluções são onipresentes em química: são usadas para armazenar e manusear pequenas quantidades de material, realizar reações químicas e desenvolver materiais com propriedades controláveis.
A densidade de um soluto em uma solução é conhecida como a concentração do soluto. A concentração pode ser expressa de várias formas, diferindo nas unidades utilizadas para transmitir as quantidades de soluto, solvente e solução.
Esta demonstração ilustra como preparar uma solução de sacarose com uma concentração de alvo usando técnicas analíticas precisas. Além disso, várias medidas da concentração dessa solução são apresentadas e explicadas.
Procedimento
1. Preparação de 100 mL de uma solução de sucrose de 0,0100 M
- Determinar o número de mols e massa de sacarose (C12H22O11) a ser dissolvido em 100 mL de solução.
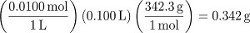
- Pese a massa de sacarose na balança. Primeiro coloque um barco de pesagem na balança e coloque o "peso tare". Em seguida, usando uma scoopula, transfira cuidadosamente soluto sólido da garrafa de reagente para o barco de pesagem até que a qua
Resultados
O procedimento passo 1 cria 100 mL de uma solução de sacarose de 0,0100 M. Para converter em medidas de concentração que não sejam molaridade, determine a massa de água utilizada para preparar a solução. Embora isso possa ser medido com precisão, na ausência de uma medição pode-se supor que o volume de partículas de solute dissolvidos é insignificante (ou seja, o volume de água utilizado foi de 100 mL). Usando a densidade da água...
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Aplicação e Resumo
Soluções de líquido sólido são onipresentes em química. A maioria das reações químicas são executadas em solução porque solutos dissolvidos são móveis o suficiente para se misturar rapidamente e esbarrar uns nos outros. As soluções também podem ser usadas para armazenar pequenas quantidades de solutos em volumes macroscópicos e de fácil manuseio. As soluções exibem algumas propriedades físicas interessantes chamadas propriedades colligativas que podem ser atribuídas aos efeitos entropicos de dissol...
Pular para...
Vídeos desta coleção:

Now Playing
Soluções e Concentrações
General Chemistry
275.3K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
658.9K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
556.9K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.8K Visualizações

Determinação da Fórmula Empírica
General Chemistry
183.8K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.6K Visualizações

Usando um medidor de pH
General Chemistry
346.9K Visualizações

Introdução à Titulação
General Chemistry
425.7K Visualizações

Lei dos gases ideais
General Chemistry
79.4K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.8K Visualizações

Princípio de Le Châtelier
General Chemistry
265.8K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.8K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
196.4K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.8K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados