Determinação das Leis de Velocidade e da Ordem de Reação
Visão Geral
Fonte: Laboratório do Dr. Neal Abrams — SUNY College of Environmental Science and Forestry
Todas as reações químicas têm uma taxa específica que define o progresso dos reagentes indo aos produtos. Essa taxa pode ser influenciada pela temperatura, concentração e as propriedades físicas dos reagentes. A taxa também inclui os intermediários e estados de transição que são formados, mas não são nem o reagente nem o produto. A lei de taxas define o papel de cada reagente em uma reação e pode ser usada para modelar matematicamente o tempo necessário para uma reação prosseguir. A forma geral de uma equação de taxa é mostrada abaixo:
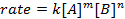
onde A e B são concentrações de diferentes espécies moleculares, m e n são ordens de reação, e k é a constante de taxa. A taxa de quase todas as reações muda ao longo do tempo à medida que os reagentes são esgotados, tornando as colisões eficazes menos propensas a ocorrer. A constante de taxa, no entanto, é fixada para qualquer reação única a uma determinada temperatura. A ordem de reação ilustra o número de espécies moleculares envolvidas em uma reação. É muito importante conhecer a lei da taxa, incluindo taxa constante e ordem de reação, que só pode ser determinada experimentalmente. Neste experimento, exploraremos um método para determinar a lei da taxa e a usaremos para entender o progresso de uma reação química.
Procedimento
1. Preparação de H2O2 Diluições
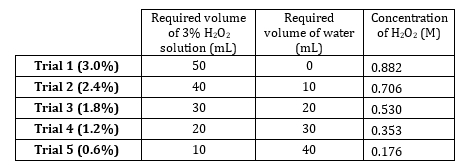
- Estoque 3% de peróxido de hidrogênio tem uma concentração de 0,882 M. Prepare 5 diluições que variam de 0,882 M a 0,176 M(Tabela 1). Prepare essas soluções volumosamente, mas prepare-as aditivamente, pois o soluto é muito diluído e os volumes de água são aditivos.
- Coloque as soluções em um banho de água de temperatura constante ou deixe-as na parte superior do banco para equilibrar à temperatura ambiente. Uma faixa de temperatura d
Resultados
Dados de evolução do oxigênio e taxas iniciais
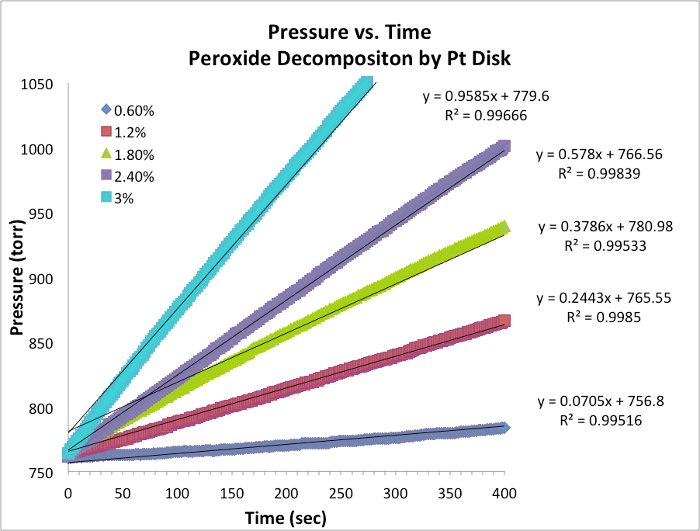
Figura 1. Dados de pressão versus tempo para cada ensaio em temperatura constante. A inclinação é equivalente à taxa instantânea da reação.
Ordem de Reação
- Os dados de cinco ensaios e gráficos com inclinação estão ...
Aplicação e Resumo
Embora a determinação das variáveis da lei de taxas possa ser envolvida matematicamente, os métodos são realmente bastante simples. Desde que o desaparecimento de um reagente ou aparência de um produto possa ser medido, parcelas de taxa podem ser usadas para calcular a taxa constante. Uma extensão deste método é frequentemente usada para determinar a energia de ativação de uma reação, Ea, medindo a taxa e calculando a constante taxa a uma variedade de temperaturas. Este método envolve o uso da eq...
Pular para...
Vídeos desta coleção:

Now Playing
Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
196.4K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
659.1K Visualizações

Soluções e Concentrações
General Chemistry
275.4K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
557.0K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.9K Visualizações

Determinação da Fórmula Empírica
General Chemistry
183.8K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.6K Visualizações

Usando um medidor de pH
General Chemistry
347.0K Visualizações

Introdução à Titulação
General Chemistry
425.8K Visualizações

Lei dos gases ideais
General Chemistry
79.4K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.9K Visualizações

Princípio de Le Châtelier
General Chemistry
265.8K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.8K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.8K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
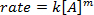 é. Tomar o logaritmo natural (ln) da equação produz uma equação linear
é. Tomar o logaritmo natural (ln) da equação produz uma equação linear 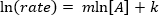 , onde m, a inclinação, é a ordem da reação.
, onde m, a inclinação, é a ordem da reação.