Introdução à Titulação
Visão Geral
Fonte: Laboratório do Dr. Yee Nee Tan — Agência de Ciência, Tecnologia e Pesquisa
Titulação é uma técnica comum usada para determinar quantitativamente a concentração desconhecida de um analito identificado. 1-4 Também é chamada de análise volumétrica, pois a medição dos volumes é fundamental na titulação. Existem muitos tipos de titulações baseadas nos tipos de reações que exploram. Os tipos mais comuns são titulações de base ácida e titulações de redox. 5-11
Em um processo típico de titulação, uma solução padrão de titulação em uma burette é gradualmente aplicada para reagir com um analito com uma concentração desconhecida em um frasco de Erlenmeyer. Para titulação ácido-base, um indicador de pH é geralmente adicionado na solução de analito para indicar o ponto final da titulação. 12 Em vez de adicionar indicadores de pH, o pH também pode ser monitorado usando um medidor de pH durante um processo de titulação e o ponto final é determinado graficamente a partir de uma curva de titulação de pH. O volume de titulação registrado no ponto final pode ser usado para calcular a concentração do analito com base na estoquimetria de reação.
Para a titulação ácido-base apresentada neste vídeo, o titrant é uma solução padronizada de hidróxido de sódio e o analito é vinagre doméstico. Vinagre é um líquido ácido que é frequentemente usado como um condimento culinário ou aromatizantes. O vinagre consiste principalmente de ácido acético (CH3COOH) e água. O teor de ácido acético do vinagre comercial pode variar muito e o objetivo deste experimento é determinar o teor de ácido acético do vinagre comercial por titulação.
Princípios
A determinação do ácido acético no vinagre baseia-se no princípio de um método de titulação ácido-base. A reação entre NaOH e CH3COOH é mostrada na Equação 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
A solução naOH padronizada é progressivamente adicionada ao vinagre com concentração de ácido acético desconhecido até que o ponto final seja alcançado. Durante a titulação ácido-base, o pH pode ser plotado em função do volume do titante adicionado. O ponto de inflexão na curva, o ponto em que há uma quantidade igual estoquiométrica igual de ácido e base em uma solução, é chamado de ponto de equivalência. A maioria dos ácidos e bases são incolores, sem reação visível ocorrendo no ponto de equivalência. Para observar quando o ponto de equivalência foi atingido, um indicador de pH é adicionado. O ponto final não é o ponto de equivalência, mas um ponto em que o indicador de pH muda de cor. É importante selecionar um indicador de pH adequado para que o ponto final esteja o mais próximo possível do ponto de equivalência da titulação.
No ponto final desta reação, a base conjugada NaCH3CO2 é ligeiramente básica. O indicador phenolphthalein tem uma faixa de pH de trabalho de 8,3-10,0, que é incolor em solução ácida e magenta acima do pH 8.2. Portanto, o fenolfthalein é um indicador preferido, pois mudará de incolor para rosa nesta condição. Ao realizar o experimento, é melhor manter a concentração do indicador de pH baixa porque os próprios indicadores de pH geralmente são ácidos fracos que reagem com base.
O volume de solução naOH padronizada adicionada no ponto final pode então ser usado para calcular as concentrações molares do ácido acético com base na estequiometria da equação acima. Neste experimento, o naoh titante é um alcalino forte e o ácido acético de análise é um ácido fraco.
Antes de realizar o experimento, é importante considerar a natureza higroscópica do NaOH. Esta propriedade requer que sua solução seja padronizada com um padrão primário estável, como o ftalato de hidrogênio de potássio (KHC8H4O4). A concentração molar exata da solução NaOH pode então ser determinada com precisão após a padronização. A reação entre o padrão de ácido primário e o NaOH é mostrada na Equação 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Um protocolo detalhado de titulação passo a passo é apresentado na seção a seguir.
Procedimento
1. Padronização de NaOH com Hidrogênio de Potássio (KHC8H4O4)
- Para começar, o titulante, hidróxido de sódio, deve ser padronizado. Prepare uma solução naOH de estoque dissolvendo cerca de 4 g de pelota NaOH em 100 mL de água desionizada. Observe que o NaOH é um produto químico perigoso que é corrosivo para a pele e irritante aos olhos, seja cauteloso e use equipamentos de proteção pessoal adequados (EPI) para evitar o contato com a pele ou o contato visual.
- Faça uma diluição de 1:10 da solução de hidróxido de sódio adicionando 25 mL da solução de hidróxido de sódio ao frasco de 500 mL. Hidróxido de sódio absorve dióxido de carbono. É importante evitar isso, certificando-se de usar água cozida e deionizada, uma garrafa seca no forno, e tampar a garrafa rapidamente. Faça a solução até 250 mL com a água deionizada e agite para misturar.
- Seque 4-5 g do ácido padrão primário, KHC8H4O4 a 110 °C por 4h em forno de secagem e depois esfrie o sólido em um dessecador por 1 h.
- Dissolva cerca de 4 g de KHC seco8H4O4 em 250 mL de água deionizada. Regisso da massa com precisão. Calcule a concentração molar da solução KHC8H4O4.
- Pipeta 25 mL de KHC8H4O4 em um frasco erlenmeyer limpo e seco. Adicione 2 gotas de fenolfthaleina, e gire suavemente para misturar bem. Note que o fenolfofino é tóxico e irritante, tenha cuidado para evitar o contato com a pele ou o contato visual.
- Limpe uma burette de 50 mL e um funil bem com detergente e água. Lave a burette com água e enxágue 3x com água deionizada. Enxágüe o burette com a solução NaOH diluída 3x, certificando-se de que o NaOH molhe toda a superfície interna e drene os resíduos através da ponta. Monte a burette lavada em um suporte de anéis com um grampo e certifique-se de que ela fique verticalmente.
- Encha o burete limpo com a solução NaOH diluída. Deve-se notar que a quantidade do NaOH diluído não precisa ser exatamente na marca zero, mas deve estar dentro da escala e suficiente para pelo menos uma titulação. Bolhas de ar podem afetar a precisão da leitura de volume. Verifique cuidadosamente as bolhas de ar da burette e bata suavemente no burete para libertá-las e abra a torneira para deixar alguns mL de titulante fluir e, ao mesmo tempo, liberar qualquer ar preso. Leia o volume visualizando a parte inferior do menisco após os 10 s. Registo o volume inicial. Preste atenção aos números significativos da leitura. Registo o valor para duas casas decimais em mL.
- Coloque o frasco de Erlenmeyer contendo ftalato de hidrogênio de potássio (KHC8H4O4) sob a burette e ajuste a altura da burette corretamente. Titule a solução KHC8H4O4 adicionando lentamente a solução NaOH em incrementos de 1 a 2 mL usando uma mão para controlar a taxa de fluxo ajustando a torneira, e a outra girando o frasco.
- Quando estiver perto do ponto final, comece a adicionar o titante gota a gota. O ponto final é alcançado quando a solução vira uma cor rosa fraca e persistente. Registo o volume final do NaOH diluído na burette.
- Repita a titulação pelo menos mais duas vezes para obter dados consistentes. Calcule a concentração molar da solução NaOH diluída.
2. Titulação de Vinagre com Solução padronizada de hidróxido de sódio
- A solução de hidróxido de sódio agora é padronizada e pode ser usada como um titulante para analisar o vinagre. Para reduzir o aroma pungente do vinagre, diluir 10 mL da solução de vinagre a ser testada em uma ração de 1:10 para um volume total de 100 mL.
- Pipeta 25 mL de analito, para um frasco erlenmeyer limpo e seco (anotado como VA). Adicione 2 gotas de fenolfthaleina.
- Encha o burette com a solução NaOH padronizada desde a primeira parte do Procedimento. Regisso volume inicial de titulante (V1).
- Adicione progressivamente a solução naOH padronizada ao vinagre. Quando o volume de titulante se aproximar do valor esperado, ajuste a torneira para adicionar a gota de titulação por gota. Continue girando o frasco com uma mão e mantenha a outra mão pronta para fechar a torneira. Uma vez que a solução de analito muda para a cor rosa clara, gire por alguns segundos para ver se a cor vai desaparecer. Se a cor persistir, a titulação chega ao ponto final. Registo o volume final de titulante (V1'). Se a cor da solução desaparecer, adicione mais uma gota de titulação. Lave a ponta inferior da burete usando a garrafa de lavagem. Colete a mistura lavada e observe a mudança de cor da solução de analito. Continue a titulação até o ponto final. Registo da quantidade de titulante necessário (Vt1 = V1' V1).
- Repita a titulação pelo menos duas vezes até que três valores concordantes que estão dentro de 0,1 mL um do outro sejam obtidos (Vt2 e Vt3).
- Calcule o valor médio do volume de titrant usando os três valores obtidos em três titulações diferentes: Vt = (Vt1 + Vt2 + Vt3)/3. A concentração molar de ácido acético no vinagre pode ser assim calculada usando a Equação 3.
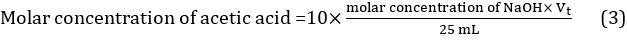
Resultados
| Unidade | Julgamento 1 | Julgamento 2 | Julgamento 3 | |||
| Volume de ácido vinagre diluído (VA) | Ml | 25.00 | ||||
| Concentração molar de NaOH (cNaOH) | mol/L | 0.09928 | ||||
| Leitura inicial de burette de NaOH | Ml | 0.10 | 0. 05 | 1.20 | ||
| Leitura final de burette de NaOH | Ml | 18.75 | 18.60 | 19.80 | ||
| Volume de NaOH dispensado | Ml | 18.65 | 18.55 | 18.60 | ||
| Volume médio de NaOH dispensado (Vt) | Ml | 18.60 | ||||
Mesa 1. Resultados de titulação.
Cálculos amostrais:
Massa de KC8H5O4 = 4,0754 g
Massa molar de KC8H5O4 = 204,22 g/mol
Número de mols de KC8H5O4 em solução padrão de 25,00 mL = 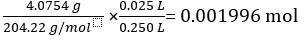
De acordo com a Equação 2,
Concentração da solução NaOH diluída = 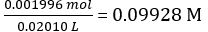
Mols de NaOH dispensado = concentração de NaOH × volume médio de NaOH dispensado = 0,09928 mol/L × 18,60 mL = 1,847 × 10-3 mol
De acordo com a Equação 1,
Número de mols de CH3COOH em 25,00 mL de vinagre diluído = 1.847 × 10-3 mol
Concentração de vinagre diluído = 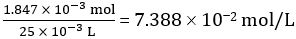
Assim, a concentração de vinagre não diluído = 10 × 7,388 102 mol/L = 0,7388 mol/L
As etapas acima são apresentadas para ilustrar o procedimento de cálculo; podemos simplesmente aplicar a Equação 3 para obter a concentração de vinagre não diluído em um passo.
Portanto, 1.000 L de vinagre não diluído contém 0,7388 mol de CH3COOH.
Volume de CH3COOH=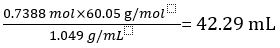
Volume percentual de vinagre =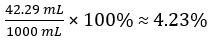
Aplicação e Resumo
A titulação é um importante método químico que é frequentemente aplicado na pesquisa química atual. Por exemplo, a titulação da base ácida é aplicada para determinar o valor de amina ou hidroxíl de uma amostra. O valor de amina é definido como o número de miligramas de KOH equivalente ao teor de amina em um grama de amostra. Para determinar o valor do hidroxila, o analito é primeiro acetilado usando anidrída acético e depois titulado com KOH. A massa em miligramas de KOH corresponde então a grupos de hidroxil em um grama de amostra. 13 Outro exemplo é o teste Winkler, um tipo específico de titulação de redox usado para determinar a concentração de oxigênio dissolvido na água para estudos de qualidade da água. O oxigênio dissolvido é reduzido usando sulfato de manganês(II), que reage com iodeto de potássio para produzir iodo. Uma vez que o iodo liberado é diretamente proporcional ao teor de oxigênio, a concentração de oxigênio é determinada pela titulação do iodo com tiosulfato usando um indicador de amido. 14
Além das aplicações em pesquisas químicas básicas, a titulação também tem sido amplamente adotada no uso industrial e cotidiano. Na indústria de biodiesel, o óleo vegetal residuais (WVO) deve primeiro ser neutralizado para remover ácidos graxos livres que normalmente reagiriam para fazer sabão indesejado. Uma parte do WVO é titulada com uma base para determinar a acidez da amostra, de modo que o resto do lote poderia ser devidamente neutralizado. 15 O método de Bento, um teste para quantificação do nível de glicose na urina, é outro exemplo que mostra a importância da titulação na saúde. Nesta titulação, íons cupéricos são reduzidos a íons cuprous por glicose, que então reagem com tiocianato de potássio para formar um precipitado branco, indicando o ponto final. 16
Referências
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Pular para...
Vídeos desta coleção:

Now Playing
Introdução à Titulação
General Chemistry
425.7K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
659.0K Visualizações

Soluções e Concentrações
General Chemistry
275.4K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
556.9K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.8K Visualizações

Determinação da Fórmula Empírica
General Chemistry
183.8K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.6K Visualizações

Usando um medidor de pH
General Chemistry
346.9K Visualizações

Lei dos gases ideais
General Chemistry
79.4K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.8K Visualizações

Princípio de Le Châtelier
General Chemistry
265.8K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.8K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
196.4K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.8K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados