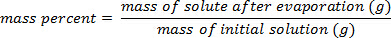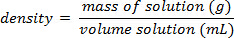Determinação de composição percentual em massa em uma solução aquosa
Visão Geral
Fonte: Laboratório do Dr. Neal Abrams — SUNY College of Environmental Science and Forestry
Determinar a composição de uma solução é uma importante técnica analítica e forense. Quando as soluções são feitas com água, elas são referidas como sendo aquosas, ou contendo água. O componente primário de uma solução é referido como solvente, e o componente menor dissolvido é chamado de soluto. O soluto é dissolvido no solvente para fazer uma solução. A água é o solvente mais comum na vida cotidiana, assim como quase todos os sistemas biológicos. Nos laboratórios de química, o solvente pode ser outro líquido, como acetona, éter ou álcool. O soluto pode ser um líquido ou um sólido, mas este experimento só aborda a determinação dos sólidos.
Procedimento
1. Por cento por Massa - Direto
- Coloque um pequeno volume de uma solução em um béquer limpo e seco no forno ou prato de cristalização.
- Depois de determinar com precisão a massa total precisa da solução, aqueça o béquer ou prato em uma placa quente ou em um forno para afastar a água. A evaporação lenta é o melhor método, pois a ebulição pode resultar em respingos da solução.
- Uma vez que o solvente tenha evaporado, esfrie o sólido restante (soluto) e determine a massa.
- Calcule a porc
Resultados
Utilizando o exemplo mostrado na Figura 1,foi elaborado um conjunto de padrões de cloreto de sódio com composições de massa por cento de 5.000%, 10,00%, 15,00%, 20,00% e 25,00% de soluto na solução. As densidades medidas foram de 1.025, 1.042, 1.060, 1.070 e 1.090 g/mL, respectivamente. Após a plotagem desses dados, uma linha de tendência linear é aplicada, encaixando a equação y = 3.446 x 10-3x + 1,0048, onde y é a densidade e x é a composição p...
Aplicação e Resumo
A porcentagem de açúcar em refrigerante poderia ser facilmente determinada a uso do princípio da composição por cento de massa. O procedimento para fazer este experimento seria medir a massa e o volume de refrigerante desgaseado (sem bolhas) e calcular a densidade da solução. Uma curva de calibração de densidade versus porcentagem por massa para várias soluções padrão de sacarose (açúcar) precisaria ser criada, e então essa calibração poderia ser usada para resolver para a porcentagem de sacarose no refrigerante. Uma suposi...
Pular para...
Vídeos desta coleção:

Now Playing
Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.9K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
659.1K Visualizações

Soluções e Concentrações
General Chemistry
275.4K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
557.0K Visualizações

Determinação da Fórmula Empírica
General Chemistry
183.8K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.6K Visualizações

Usando um medidor de pH
General Chemistry
347.0K Visualizações

Introdução à Titulação
General Chemistry
425.8K Visualizações

Lei dos gases ideais
General Chemistry
79.4K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.9K Visualizações

Princípio de Le Châtelier
General Chemistry
265.8K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.8K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
196.4K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.8K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados