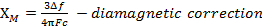O Método Evans
Fonte: Tamara M. Powers, Departamento de Química da Texas A&M University
Enquanto a maioria das moléculas orgânicas são diamagnéticas, onde todos os seus elétrons são emparelhados em ligações, muitos complexos metálicos de transição são paramagnéticos, que tem estados terrestres com elétrons não pagos. Lembre-se da regra de Hund, que afirma que para orbitais de energias semelhantes, os elétrons preencherão os orbitais para maximizar o número de elétrons não danificados antes de emparelhar. Metais de transição têm orbitais dparcialmente povoados cujas energias são perturbadas em diferentes extensões por coordenação de ligantes ao metal. Assim, os d-orbitais são semelhantes em energia uns aos outros, mas nem todos são degenerados. Isso permite que os complexos sejam diamagnéticos, com todos os elétrons emparelhados, ou paramagnéticos, com elétrons não pagos.
Conhecer o número de elétrons não recados em um complexo metálico pode fornecer pistas sobre o estado de oxidação e geometria do complexo metálico, bem como para a força do campo de ligante (campo cristalino) dos ligantes. Essas propriedades impactam muito a espectroscopia e a reatividade dos complexos metálicos de transição, e por isso são importantes de entender.
Uma maneira de contar o número de elétrons não analisados é medir a suscetibilidade magnética, χ,do composto de coordenação. Suscetibilidade magnética é a medida de magnetização de um material (ou composto) quando colocado em um campo magnético aplicado. Elétrons emparelhados são ligeiramente repelidos por um campo magnético aplicado, e essa repulsa aumenta linearmente à medida que a força do campo magnético aumenta. Por outro lado, elétrons não pagos são atraídos (em maior medida) para um campo magnético, e a atração aumenta linearmente com a força do campo magnético. Portanto, qualquer composto com elétrons não ressarcidos será atraído para um campo magnético. 1
Quando medimos a suscetibilidade magnética, obtemos informações sobre o número de elétrons não ressarrados a partir do momento magnético, μ. A suscetibilidade magnética está relacionada ao momento magnético, μ pela Equação 12:
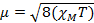 (1)
(1)
A constante  = [(3kB)/Nβ2)], onde β= ímã bohr do elétron (0,93 x 10-20 erg gauss-1), N = número de Avogadro, e kB = Boltzmann constante
= [(3kB)/Nβ2)], onde β= ímã bohr do elétron (0,93 x 10-20 erg gauss-1), N = número de Avogadro, e kB = Boltzmann constante
XM= suscetibilidade magnética molar (cm3/mol)
T = temperatura (K)
μ = momento magnético, medido em unidades de bohr magneton, μB = 9,27 x 10-24 JT-1
O momento magnético para complexos é dado pela Equação 21:
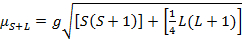 (2)
(2)
g = razão gyrommagnética = 2,00023 μB
S = número quântico de spin = ∑ms = [número de elétrons não pagos, n]/2
L = número quântico orbital = ∑ml
Esta equação tem contribuições orbitais e de rotação. Para complexos metálicos de transição de primeira linha, a contribuição orbital é pequena e, portanto, pode ser omitida, de modo que o momento magnético somente de spin é dado pela Equação 3:
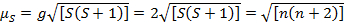 (3)
(3)
O momento magnético somente de spin pode, assim, dar diretamente o número de elétrons não verificados. Esta aproximação também pode ser feita para metais mais pesados, embora as contribuições orbitais possam ser significativas para metais de transição de segunda e terceira fileiras. Essa contribuição pode ser tão significativa que infla o momento magnético suficiente para que o composto pareça ter mais elétrons não pagos do que ele. Portanto, pode ser necessária uma caracterização adicional para esses complexos.
Neste experimento, a solução do momento magnético de tris (acetylacetonato)ferro(III) (Fe(acac)3) é determinada experimentalmente usando o método Evans em clorofórmio.
1. Preparação da Inserção Capilar
- Usando um isqueiro ou outra chama de gás, derreta a ponta de uma pipeta pasteur longa. Gire suavemente a ponta da pipeta na chama até formar uma pequena lâmpada. Deixe o vidro esfriar.
- Em um frasco de cintilação, prepare uma solução de 50:1 (volume) de clorofórmio deuterado:proteo. Pipeta 2 mL de solvente deuterado, e a este adicionar 40 μL de solvente proteo. Tampe o frasco.
- Adicione cuidadosamente algumas gotas da mistura de solvente à pipeta de vidro sela
Experimental Resultados
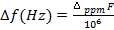 (5)
(5)