Method Article
Количественная оценка Белки Использование пептидов обогащению иммуноаффинной В сочетании с масс-спектрометрии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Стабильный Стандарты Изотопные и Capture Анти-пептидов Антитела (SISCAPA) пары близость обогащение пептиды со стабильной изотопного разбавления масс-спектрометрии (MRM-MS) для обеспечения количественного определения пептидов в качестве суррогатов для соответствующих белков. Здесь мы опишем протокол с использованием магнитных частиц в частично автоматизированные формате.
Аннотация
Существует большая потребность в количественных тестов при измерении белков. Традиционные иммунологические сэндвич, в значительной степени считается золотым стандартом в количественной, связаны с высокой стоимостью, долгое время свинца и чреваты недостатки (например, гетерофильных антител, аутоантител помех, "крюк-эффект») 1. Альтернативная методика является близость обогащения пептидов в сочетании с количественной масс-спектрометрии, как правило, называют SISCAPA (Стабильный Стандарты Изотопные и Capture Анти-пептидов Антитела) 2. В этой технике, близость обогащение пептиды со стабильной изотопного разбавления и обнаружения по отдельным / множественные реакции мониторинг масс-спектрометрии ( SRM / MRM-MS) обеспечивает количественное измерение пептидов в качестве суррогатов для соответствующих белков. SRM / MRM-МС хорошо установлена для точного количественного определения малых молекул, 3, 4 и совсем недавно был адаптирован для измерения концентрации белков в плазме крови и клеточных лизатов. 5-7 Для достижения количественного определения белков, эти крупные молекулы перевариваются до Компонент пептидов использованием ферментов, таких как трипсин. Один или несколько выбранных пептиды, последовательность является уникальным для целевого белка в том, что виды (например, "proteotypic" пептидов) затем обогащенный из примера с использованием анти-пептидных антител и измеряется как количественными суррогаты для стехиометрической концентрации белка в образце. Таким образом, в сочетании с стабильным изотопного разбавления (SID) методов (например, шипами в стабильный изотоп меченый пептид стандарт), SRM / MRM может быть использован для измерения концентрации proteotypic пептидов в качестве суррогатов для количественного определения белков в сложных биологических матриц. Методы имеют ряд преимуществ по сравнению с традиционными иммуноанализа. Реагенты сравнительно дешевле генерировать, специфичность для аналита отлично, анализы могут быть очень мультиплексированных, обогащение может быть выполнена с аккуратным плазмы (без истощения требуется), и техника поддается широкий спектр белков или модификации интересов. 8-13 В этом видео мы демонстрируем основной протокол, как адаптировать к магнитной бусины платформы.
протокол
Экспериментальные процедуры:
Анализ требует синтетические пептиды и анти-пептидных антител. Выбранный пептиды должны быть уникальными для белок, содержат от 8 до 22 аминокислот, и не известно пост-трансляционной модификации. Метионин остатков, как правило, избегали и пептиды, содержащие двухосновных аминокислот (например, KK, KR, РР) нежелательны. Для реализации этой технологии, она является общей для использования стабильных изотопов в качестве меченых пептидов внутренние стандарты, включая тяжелые (13 С и 15 N) меченых аминокислот на С-конце пептида (т.е. К или R помечены).
Следующий протокол описывает анализа разработана для измерения пептид GDSLAYGLR от Остеопонтин белка мыши, используя анти-пептидных антител, полученных от Epitomics Inc (Burlingame, CA) и синтетических пептидов из Новой Англии пептида (Гарднер, М. А.). Протокол состоит из трех основных этапов (рис. 1): 1) Трипсин переваривания сложную смесь белков, 2) Обогащение пептиды 3) Анализ масс-спектрометрии. Он будет продемонстрирован на человека образце плазмы с шипами белка остеопонтина мыши.
1. Трипсин ферментативного пищеварения и очистки
- Оттепель 10 мкл аккуратные аликвоты плазмы на льду.
- Определение общей концентрации белка с помощью анализа ДСС и центрифуги образец для удаления взвешенных твердых частиц.
- Внесите 10 мкл от его хранения трубки 1000 мкл пластины Дипуэлл и накрыть Pierce-в состоянии фильма.
- Добавьте 20 мкл свежей 9 месяцев мочевины / 30mm дитиотреитол (DTT) (конечная концентрация 6М мочевины / 20 мМ DTT) для каждого образца.
- Инкубировать 30 минут при 37 ° C.
- Добавить 3 мкл свежей 500 мМ iodoacetamide (окончательный IAM 50 мм) для каждого образца.
- Инкубируйте в течение 30 минут в темном месте при комнатной температуре.
- Добавить 257 мкл 100 мМ трис (рН 8) (разбавляет мочевины до ~ 0,6 М).
- Добавьте 10 мкл исходного раствора трипсина (1 мкг / мкл, для 1:50 фермент: субстрат отношение).
- Инкубируйте 37 ° С в течение ночи (12-16 часов).
- Добавить 3 мкл аккуратные муравьиной кислоты (конечной концентрации 1%).
- Добавить стабильный изотоп стандартных (множественные стандарты добавляется, если выполнение мультиплексный анализ, как правило, это около 10 мкл содержащего 50-100 фмоль стандартной изотопно меченного пептида).
- Промыть пластины Oasis картридж хорошо с 500 мкл 0,1% муравьиной кислоты в 80% ацетонитрила, отбрасывая проточные. Повторите это 3 раза.
- Равновесия картридж пластины, добавив 500 мкл 0,1% муравьиной кислоты в воде, и отбросить проточные. Повторите 4 раза.
- Нагрузка переварить образцы пластину картриджа и регулировать вакуум таким потоком идет очень медленно.
- Промыть 500 мкл 0,1% муравьиной кислоты в воде, и отбросить проточные. Повторите это 3 раза.
- Элюции пептидов, добавив 2 х 500 мкл 0,1% муравьиной кислоты в 80% ацетонитрила в 1000 мкл глубоких скважин пластины (не выбрасывайте проточные).
- Lyophilize (или speedvac) элюата досуха. (Лиофилизации является предпочтительным методом)
- Развести сухой пептидов добавлением 50 мкл PBS + 0,03% CHAPS.
2. Пептид иммуноаффинной обогащения
- Передача образца стандартных Kingfisher 96-луночных.
- Добавьте 1 мкг антител и 1,5 мкл белка-G покрытием магнитных гранул в год (это не является обязательным для сшивания антитела к бисера перед добавлением). Обеспечить бисер хорошо подвешен при встряхивании или вортексе.
- Обложка пластинки с пленкой.
- Инкубируйте ночь (12-16 часа) с нежным акробатика для обеспечения бисер приостановлено.
- Центрифуга пластины на 32 мкг в течение 5 секунд, чтобы удалить жидкость из поверхности фольги.
- Удалить фольгу крышку.
- Стиральные и элюирование бусины могут быть выполнены вручную или в автоматическом режиме. Эта процедура описывает шаги автоматизированы на Kingfisher платформы.
- Вымойте бисером 2 раза с 200 мкл PBS + 0,03% CHAPS (1 минута за мытье).
- Вымойте бисером 1 раз в 200 мкл 1:10 разбавление PBS + 0,03% CHAPS (1 минута).
- Пептиды элюировали в 25 мкл 5% уксусной кислоты + 0,03% CHAPS.
- Место элюирования пластину на магнит и передачи элюата в 96 ячейках, заботясь не передавать остатки бус.
- Обложка пластинки с уплотнением мат.
- Пластины, содержащей элюата доставляется тройной quadrapole масс-спектрометр для анализа.
3. Анализ по нескольким мониторинга реакции - масс-спектрометрии
- Переходы для SRM / MRM анализа могут быть выбраны и оптимизированы вливая 1 picomole на микролитр решение пептид стандарт в 30% acetonitrile/0.1% муравьиной кислоты в масс-спектрометр на 0,5 мкл / мин. После стабильного распыления получается, собирать MS / MS спектра.
- Переходы выбираются из MS / MS спектр путем выявления Автошоуэлектронной обильные ионов фрагмента в области спектра с небольшим шумом. Для многозарядных ионов пептид, у-ионные фрагменты обнаружены на т / г> предшественником т / г, как правило, лучше всего для SRM / MRM анализа развития. Рисунок 2 показывает, MS / MS спектр и отдельных ионов переходных 476,3> 508,3, 579,3 , 692,4 (переходы для тяжелого стабильного изотопа стандартных 481,3> 518,3, 589,3, 702,4 не показан) для пептида GDSLAYGLR.
- В зависимости от марки и модели использован масс-спектрометр, Есть несколько параметров, которые могут быть оптимизированы для каждого перехода. Здесь, мы оптимизировали столкновения энергия каждого выбранного перехода наращивает энергию столкновения и мониторинга уровня сигнала. Энергии столкновения в 25 был использован для каждого перехода.
- Одним словом, типичная конфигурация для SRM / MRM анализа выглядит следующим образом: Подвижная фаза () 0,1% муравьиной кислоты; (б) 90% ацетонитрил / 0,1% муравьиной кислоты, 0,3 х 5 мм C18 колонка ловушка, 75 мкм ID х 15 см C18 аналитическую колонку (Reprosil-Пур C18 AQ, 120 A ° поры). Инъекции объемом 10 мкл и образец загружается в течение 5 минут при 3% B на общую скорость потока 3 мкл / мин и элюировали линейным градиентом от 3 - 45% В при 300 - 400 Нл / мин в течение 10 мин. Условия на 4000 QTRAP (ABSCIEX, Foster City, CA) были брызги напряжения 2.3kV, ионная температура источника 150 ° С, GS1 12, и занавес газа 15.
- Образец проанализирован SRM / MRM путем введения 10 мкл образца. Пик областях интегрированы для легких и тяжелых пептидов с помощью программы Skyline. 14 Рассчитать пик соотношение площади (PAR) немеченого / меченого пептида в каждом примера с использованием наиболее распространенных перехода, который свободен от фонового шума, в данном случае, переход y5 (светло пептид 476,3> 579,3, тяжелые стандартных пептидных 481,3> 589,3).
4. Представитель Результаты:
Измеренные пик соотношения площади (свет эндогенных относительной пептид шипами тяжелых изотопно меченного пептида) обеспечивают количественную меру целевой пептид. Рисунок 3 показывает пример хроматограммы легких и тяжелых пептидов в SISCAPA обогащенного образца. Обратите внимание, что легкие и тяжелые пептидов элюируются в то же время и многочисленные переходы можно отслеживать для каждого пептида для подтверждения личности.
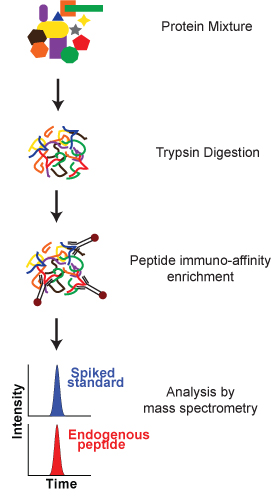
Рисунок 1. Схематический обзор процесса SISCAPA. Сложная смесь белка усваивается на пептиды. Целевые пептидных аналитов (эндогенные аналита и шипами стабильного изотопа меченных внутренний стандарт) обогащены с использованием анти-пептидных антител иммобилизованных на Protein G-покрытием магнитных частиц. После изоляции, целевые пептиды элюируют из магнитных частиц и проанализированы масс-спектрометрии для количественного относительно внутреннего стандарта.
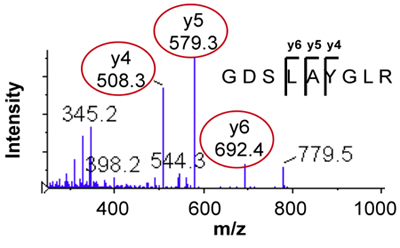
Рисунок 2. MS / MS спектр пептидных GDSLAYGLR показывает выбор из трех фрагментов для SRM / MRM переходами.
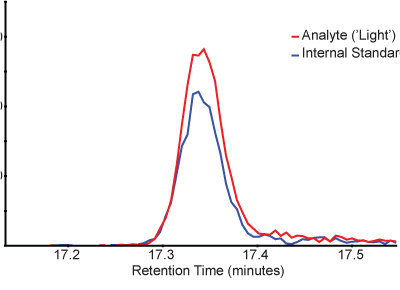
Рисунок 3. Пример хроматограммы показывает пик профиля свет анализируемого пептида (красный) и тяжелый стабильный изотоп меченных внутреннего стандарта (синий). Хроматограммы для y5 переход от света пептид (476,3> 579,3) и тяжелого стабильного изотопа помечены стандарт (481,3> 589,3) нанесены в течение долгого времени, как они элюируются из хроматографии системы.
Обсуждение
Наиболее важным шагом в протокол, как описано, является обеспечение бисером остаются хорошо перемешанных в течение инкубационного периода. Разрешение бисером осели на дно колодца / флакон приведет к увеличению изменчивости. Важно также, чтобы спин-вниз любой жидкости, которые могут остаться на вершине и / флакон следующие инкубационного периода. Воспроизводимые пищеварения трипсина также имеет важное значение. Процедуры для пищеварения, описанные здесь был использован широко в нашей лаборатории совместно с SISCAPA, однако, вполне вероятно, альтернативные методы пищеварения может быть оптимизирована для данного набора белков-мишеней 15 Элюирование свободных антител не мешает обнаружению. пептид, вероятно, потому что антитела, исключается из столбца или элюируется позднее пептидов, но антитела могут быть сшиты с гранулами Protein G до близости обогащения в крупных экспериментов или при наличии свободных антител становится проблемой. Кроме того, мы сочли целесообразным поместить магнит ниже образец пластина на автосамплером а также стирку ловушку колонки в обратном направлении потока (по сравнению с загрузкой), чтобы удалить остатки бисера или частиц. В дополнение к магнитной бусины подход, описанный, метод также может быть адаптирована к колонке формате (т.е. аффинная хроматография). 12, 16
После того как пользователь комфортно с общим протоколом, техника также поддаются несколько модификаций, которые повышают общий анализ. 11-первых, это возможность анализировать несколько аналитов в одном анализе, комбинируя антитела в обогащении шаг (т.е. мультиплексирование). Масс-спектрометр, способный одновременно анализировать большое количество аналитов. Во-вторых, увеличение объема исходного образца повышает чувствительность анализа.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась NCI Клинические протеомных технологии Assessment Center (CPTAC) гранта (# U24 CA126476), а также грант от индустрии развлечений Foundation (РКРП) и Cancer Research EIF Женский фонд для биомаркеров груди Консорциум Discovery Рака, и щедрые подарки от фонда Кека, Канарские Фонда и Пол Г. Аллен Фонд семьи.
Материалы
| Name | Company | Catalog Number | Comments |
| Название материала | Компания | Номер в каталоге | |
|---|---|---|---|
| 1000ul глубоких скважин 96-луночных | Эппендорф | 951032786 | |
| Oasis HLB 1 мл картридж плиты, сентябрь-пак, 40 мг 96 ячейках | Воды | 186003966 | |
| Kingfisher 96 ячейках | Thermo Fisher Scientific | 97002540 | |
| Открытый 96 лунок, белая пластина стене | Bio-Rad | HSP9601 | |
| Фольга крышки для 96-луночного планшета | Excelscientific | 12-169 | |
| Axymat Уплотнительная коврик для 96-луночного планшета | Axygen | 521-01-151 | |
| X пробить фильм | Sigma-Aldrich | Z722502 | |
| Kingfisher магнитной бусины процессор с головой магнит ПЦР | Thermo Fisher Scientific | HSP 9601 |
Таблица 1: Материалы
| Название материала | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Мочевина | Sigma Aldrich | U6031 | |
| Trizma базы | Sigma Aldrich | T1503 | |
| Дитиотреитол (DTT) | Проколоть | 20291 | "Нет-весить дитиотреитол" |
| Iodoacetamide (IAM) | Sigma Aldrich | I1149 | |
| Трипсин золото | Promega | V5280 | |
| Protein G магнитных бус, 2.8um | Invitrogen | 10004D | |
| Фосфат-солевом буфере (PBS) | Thermo Fisher Scientific | L5401 | |
| CHAPS | Thermo Fisher Scientific | 28300 | |
| Муравьиная кислота | EMD | 11670 | |
| Ацетонитрил | Thermo Fisher Scientific | A998-1 | |
| Уксусная кислота | Sigma Aldrich | 242853 |
Таблица 2: Реагенты
| Решение | Комментарии (необязательно) |
|---|---|
| 100 мМ Трис рН 8 | |
| 9 M мочевины / 30 мМ DTT в 100 мМ Трис (рН 8) | должен быть готов каждый раз свежее |
| 500 мМ IAM в 100 мМ Трис (рН 8) | должен быть готов каждый раз свежее |
| Трипсин 1mg/mL в 100 мМ Трис рН 8 | |
| Ингибитор трипсина 1mg/mL в 100 мМ Трис рН 8 | |
| Стабильный изотоп стандартных Mastermix | |
| Анти-пептид антител Mastermix |
Таблица 3: решения должны быть подготовлены
Ссылки
- Hoofnagle, A. N., Wener, M. H. The fundamental flaws of immunoassays and potential solutions using tandem mass spectrometry. J. Immunol. Methods. 347, 3-11 (2009).
- Anderson, N. L. Mass spectrometric quantitation of peptides and proteins using Stable Isotope Standards and Capture by Anti-Peptide Antibodies (SISCAPA). J Proteome Res. 3, 235-244 (2004).
- Chace, D. H., Kalas, T. A. A biochemical perspective on the use of tandem mass spectrometry for newborn screening and clinical testing. Clin Biochem. 38, 296-309 (2005).
- Want, E. J., Cravatt, B. F., Siuzdak, G. The expanding role of mass spectrometry in metabolite profiling and characterization. Chembiochem. 6, 1941-1951 (2005).
- Barr, J. R. Isotope dilution--mass spectrometric quantification of specific proteins: model application with apolipoprotein A-I. Clin Chem. 42, 1676-1682 (1996).
- Gerber, S. A., Rush, J., Stemman, O., Kirschner, M. W., Gygi, S. P. Absolute quantification of proteins and phosphoproteins from cell lysates by tandem MS. Proc Natl Acad Sci U S A. 100, 6940-6945 (2003).
- Kuhn, E. Quantification of C-reactive protein in the serum of patients with rheumatoid arthritis using multiple reaction monitoring mass spectrometry and 13C-labeled peptide standards. Proteomics. 4, 1175-1186 (2004).
- Whiteaker, J. R. Antibody-based enrichment of peptides on magnetic beads for mass-spectrometry-based quantification of serum biomarkers. Anal Biochem. 362, 44-54 (2007).
- Hoofnagle, A. N., Becker, J. O., Wener, M. H., Heinecke, J. W. Quantification of thyroglobulin, a low-abundance serum protein, by immunoaffinity peptide enrichment and tandem mass spectrometry. Clin Chem. 54, 1796-1804 (2008).
- Kuhn, E. Developing Multiplexed Assays for Troponin I and Interleukin-33 in Plasma by Peptide Immunoaffinity Enrichment and Targeted Mass Spectrometry. Clin Chem. 55, 1108-1117 (2009).
- Whiteaker, J. R., Zhao, L., Anderson, L., Paulovich, A. G. An automated and multiplexed method for high throughput peptide immunoaffinity enrichment and multiple reaction monitoring mass spectrometry-based quantification of protein biomarkers. Mol. Cell. Proteomics. 9, 184-196 (2010).
- Neubert, H., Gale, J., Muirhead, D. Online high-flow peptide immunoaffinity enrichment and nanoflow LC-MS/MS: assay development for total salivary pepsin/pepsinogen. Clin. Chem. 56, 1413-1423 (2010).
- Ackermann, B. L., Berna, M. J. Coupling immunoaffinity techniques with MS for quantitative analysis of low-abundance protein biomarkers. Expert Rev. Proteomics. 4, 175-186 (2007).
- MacLean, B. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26, 966-968 (2010).
- Proc, J. L. A quantitative study of the effects of chaotropic agents, surfactants, and solvents on the digestion efficiency of human plasma proteins by trypsin. J. Proteome Res. 9, 5422-5437 (2010).
- Berna, M. Online immunoaffinity liquid chromatography/tandem mass spectrometry determination of a type II collagen peptide biomarker in rat urine: Investigation of the impact of collision-induced dissociation fluctuation on peptide quantitation. Anal. Biochem. 356, 235-243 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены