Method Article
Культура ткани модель эстроген производителей первичного говядину гранулезы ячейки
В этой статье
Резюме
Описывается модель долгосрочного культуры клеток гранулезы говядину сыворотки свободных условиях. Эта модель позволяет исследователям для изучения влияния различных факторов и условий как плотности различных покрытий на характеристики эстроген производителей клетки гранулезы говядину.
Аннотация
Клетки гранулезы яичников (GC) являются основным источником эстрадиола синтеза. Индуцированные перенапряжения preovulatory лютеинизирующего гормона (ЛГ), клеток теки и, в частности, слоя клеток гранулезы глубоко изменить их морфологические, физиологические и молекулярные характеристики и сформировать корпус прогестерон производство желтое тело, которое отвечает за ведение беременности. Модели культуры клеток являются важнейшими инструментами для изучения основных регулирующих механизмов, участвующих в folliculo лютеиновой трансформации. Представленные протокол фокусируется на процедуры изоляции и криоконсервацию говядину GC от малых до средних размеров фолликулов (< 6 мм). С помощью этого метода можно получить почти чисто населения GC. Процедура криоконсервация значительно облегчает время управления культуры клеток работать независимо от подачи ткани (яичники) прямой первичной. Этот протокол описывает модель культуры сыворотки свободных клеток, которая имитирует эстрадиол активный статус крупного рогатого скота GC. Важные условия, которые необходимы для успешного стероид активной клеточной культуры, обсуждаются на протяжении всего протокола. Доказано, что увеличение плотности покрытия клеток вызывает конкретный ответ как указано измененный ген выражение профиль и гормон производства. Кроме того эта модель обеспечивает основу для дальнейших исследований на GC дифференциации и других приложений.
Введение
Успешный овуляции и luteinization зависят от тонко настроены и хорошо спланированных молекулярные изменения в типах различных соматических фолликулярных клеток. Поскольку детали этих процессов развития пока еще полностью не поняты, дальнейших разъяснений не требуется. В естественных условиях подходы являются сложной и дорогостоящей и, в частности, не адрес конкретные молекулярные механизмы, которые происходят во время фолликулогенез. Таким образом упрощенное в vitro модели Кроме того, необходимо обеспечить проницательность в клеточном и молекулярном детали. Различные исследования описывают культуру всего фолликулов в контексте в пробирке оплодотворение методы1,2,3. Потому что ученые заинтересованы в механизмы дифференцировки, многие исследования сосредоточены на фолликулярную GC. Эти клетки, непосредственно связанные с ооцитов, являются основными источниками эстрогена производства и, таким образом, играть важную роль на протяжении фолликулогенез и luteinization4.
Увековечен клеток линии GC были разработаны из разных видов. Большинство из них, однако, не показывают достаточно стероидных гормонов производства5. Пока только одну ячейку строки говядину, GC был создан6, но эта линия потерял свою стероидогенных деятельность после нескольких проходов7. Таким образом начиная с стероидогенеза и, в частности, производство Эстрадиол является важнейшей особенностью GC функциональность, целесообразно изучить эти аспекты в модели культуры главной ячейки. В предыдущих исследованиях было продемонстрировано, что производство значительные эстрадиола может наблюдаться только под сыворотки свободной культуры условий8,9. Далее, предшественником синтеза Эстрадиол является еще одной предпосылкой, как GC не выразить необходимого фермента, который может конвертировать прогестерона в андростендион10. Кроме того синергетический эффект ФСГ и IGF-1 добавок в vitro показали оптимизированный активность ароматазы, ключевого фермента эстрадиола синтез11. В настоящем Протоколе также описываются другие важные факторы, оказывающие существенное влияние на модели культуры GC. В частности клетка, покрытие плотность имеет огромное воздействие на результаты эксперимента12. Кроме того может быть создана методика криоконсервирования говядину GC, который не вмешиваться GC физиологии в культуре значительно. Эта техника помогает улучшить организацию работы культуры клеток и оптимизации плотности предпочтительным покрытие.
протокол
Примечание: Говядину яичники были получены из коммерческих бойни. Коллекция скотобойни побочные продукты не требуют этического одобрения согласно немецкому закону.
1. условия труда и подготовки
- Для обеспечения стерильности, выполняют все средства массовой информации и подготовка тканей, а также все культуры работы в специализированных клеток культуры лаборатории с использованием скамейке ламинарного потока.
- Подготовка 1 x фосфатный буфер (PBS, рН 7,4) дополняется 100 МЕ пенициллин, стрептомицин 0,1 мг/мл и 0,5 мкг/мкл амфотерицин для перевозки яичников.
Примечание: Максимальная продолжительность между получением яичников и изолировать GC-2 h в этой настройке.
2. изоляция клетки гранулезы говяжьи
-
Вымойте яичников в однократном ПБС (с 100 МЕ пенициллин, стрептомицин 0,1 мг/мл и 0,5 мкг/мкл амфотерицин) несколько раз для удаления любых крови от поверхности до начала процедуры изоляции. Используйте стакан, место яичников внутри, заполнить его с ПБС и отбросить PBS снова.
- Повторите этот шаг Стиральная x 3 – 4, пока не яичников очищаются от любых оставшихся крови.
- Протрите один яичник, используя уничтожить лаборатории, пропитанной 70% спирта, для сведения к минимуму возможных загрязнений.
- С 3 мл шприц и игла 18 G, аспирационная GC, проколов малого среднего размера фолликулов (< 6 мм, измерить линейкой) и бассейн фолликулярной жидкости в одной центрифуги Тюбик 50 мл.
Примечание: Смочить шприц, взять небольшое количество ПБС (с 100 МЕ пенициллин, стрептомицин 0,1 мг/мл и 0,5 мкг/мкл амфотерицин). Это помогает собрать небольшое количество фолликулярной жидкости и предотвращает прилипание внутри шприца клетки. - После прокола нескольких фолликулов, промойте шприц и игла с ПБС для промежуточной очистки.
3. криоконсервирования клеток
-
Использование Трипановый синий окрашивание и подсчитать количество ячеек под Горяева.
- Чтобы подсчитать количество жизнеспособных клеток, подготовьте трубка с 1,5 мкл раствора 0,25% Трипановый синий.
Примечание: Живые клетки останется безупречная, потому что Трипановый синий можно получить доступ только к барьер клеток мертвых клеток, которые затем появляются синие. - 15 мкл суспензии клеток гранулезы к решению Трипановый синий и осторожно перемешать.
- Поместите смесь в обеих палатах Горяева. Подсчитать количество жизни (например, безупречная) клетки в один большой площади на камеру.
Примечание: Хотя можно увидеть некоторые клетки крови, могут быть распознаны по их очень маленький размер. - Рассчитать количество живых клеток с среднего обоих квадратов камеры согласно общим руководящим принципам; доля живых клеток яичников, могут различаться, но должна превышать 60%13.
- Чтобы подсчитать количество жизнеспособных клеток, подготовьте трубка с 1,5 мкл раствора 0,25% Трипановый синий.
-
Взять образец из пула клеток гранулезы свежевыделенных как отправной точкой для дальнейшего анализа.
- В зависимости от клеток количество изолированной GC отложите соответствующее количество клеток как образцов для РНК, ДНК или белка подготовка.
Примечание: Для изоляции РНК и последующей оценки экспрессии генов, 1 x 105 клетки являются достаточно, тогда как другие последующие анализы могут потребовать номера разные, как правило, выше ячейки. - Место в трубу свежие аликвоты один или несколько ссылочных ячеек и центрифуги за 1 мин при комнатной температуре и максимальная скорость (12000 x g) для получения гранул ячейки. Выбросите супернатант.
- Сразу же шок замораживание образцов в жидком азоте. Магазин образец-80 ° c.
- В зависимости от клеток количество изолированной GC отложите соответствующее количество клеток как образцов для РНК, ДНК или белка подготовка.
-
Выполняйте криоконсервации.
- Подготовьте замораживание среднего с использованием 80% плода телячьей сыворотки (FCS) и 20% диметилсульфоксида (ДМСО).
- Для того чтобы нежно pellet GC, центрифуга GC для 3 мин при комнатной температуре и 500 x g.
- Тщательно удалить супернатант и нежно ресуспензируйте клетки в 100% FCS (например, 1 мл) до не более клеток сгустки являются видимыми.
- Добавьте 1 тома (например, 1 мл) подготовленный замораживания среды суспензию клеток и передача смеси криогенных флакона.
Примечание: Конечная концентрация крио защита средств массовой информации будет 90% FCS и 10% ДМСО. - Место криогенных флакона в специализированных (коммерчески доступных) замораживание контейнер, который предотвращает быстрое замораживание. Скорость охлаждения образцов не должно превышать передачи контейнере замораживания в морозильной камере-80 ° C для по крайней мере 4 h-1 ° C/мин.
- Для более длительного хранения место криогенных флаконов в контейнерах ультра-низкой температуры (например, контейнеры азота жидкой фазы).
Примечание: Протокол может быть остановлено здесь, как криоконсервация позволяет более длительного хранения.
4. подготовка средств массовой информации и культуры пластин для культуры клетки
-
Слой клеток культуры пластин с 0,02% коллагена р.
Примечание: Коллаген R известно быть существенно важное значение для улучшения насадку GC в культуре.- Приготовляют раствор 0,02% коллагена R с очищенной водой для клеточной культуры.
- 150 мкл в колодец в пластине 24-ну (= 2 см2/а) и убедитесь, что вся поверхность культуры хорошо покрыта раствором коллагена R.
- Пусть решение сухой с крышкой, открытой на несколько часов или на ночь в Ламинарный шкаф.
- Когда культура пластин полностью сухой, облучить их с УФ-излучения для 10 – 15 минут, чтобы свести к минимуму загрязнение.
- При необходимости Храните пластины на 4 ° C на срок до 2 месяцев.
- Подготовка средств массовой информации и добавки для культуры работы под капотом ламинарного потока. Для успешного восстановления GC они должны быть обработаны сразу после оттаивания.
-
Подготовьте следующие средства массовой информации.
- Дополнить α-минимальным необходимым среднего (α-MEM) с 2 мм L-глютамином, 0,084% бикарбоната натрия, 0.1% бычьим сывороточным альбумином (БСА), 20 мм HEPES, селенит натрия 4 нг/мл, 5 мкг/мл трансферрин, 10 нг/мл инсулина и 1 мм несущественные аминокислот.
- Кроме того добавьте 100 МЕ пенициллин и 0,1 мг/мл стрептомицина средств массовой информации.
Примечание: Антибиотики, однажды утепленные, являются стабильными для около 48 часов. Таким образом аликвота необходимое количество средств массовой информации для настройки культуры и планируемых обмен. Предварительно теплой только СМИ аликвоты до 37 ° C на водяной бане. Подготовленных средствами массовой информации можно хранить при 4 ° C не более 3 месяцев. - Чтобы побудить стероидных деятельность в культивированный говядину GC, дополнение α-MEM дополнительно с 20 нг/мл фолликулостимулирующего гормона (ФСГ), 50 нг/мл R3 ИФР-1 и 2 мкм андростендион.
Примечание: Всегда дополняют эти компоненты незадолго до начала обмена культуры или СМИ. Избегайте повторные циклы замораживания оттаивания для фондовых решения ФСГ и IGF-1, как это может подорвать действие стероидов.
5. клетки культуры работы
- Оттепель клетки быстро в водяной бане при 37 ° C для 3-4 мин и передачи суспензию клеток в подогретым α-MEM 37 ° C (без вкладыша гормон). Для центрифугирования рекомендуется окончательный объём 10 мл.
- Центрифуга GC для 3 мин при комнатной температуре и на 500 x g. Выбросите супернатант. Добавьте подогретым и дополнениями α-MEM и Ресуспензируйте тщательно клетки.
- Семя GC на плотности 1 х 105 или 1 х 106 клеток на хорошо в окончательном объеме 500 мкл. включают в себя технические реплицирует по крайней мере три культуры скважин в состояние.
- Инкубации клеточной культуры в инкубаторе при 37 ° C с 5% CO2 для 8 d.
- Выполните обмен средств массовой информации каждый день. Замените только две трети культуры средств массовой информации для уменьшения стресса и облегчить адаптацию клеток свежим средствам массовой информации.
Примечание: GC образуют типичный фенотип фибробластоподобных через несколько дней в культуре и склонны кластера вместе. В культуре высокая плотность клеток большие кластеры находятся более часто по сравнению с нормальной густоты GC культуры (рис. 1, левая против правой панели).
6. последующий анализ клетки культивировали гранулезы
- Для выполнения анализа стероидных гормонов, собирать средства массовой информации и заморозить ее при-20 ° C. Используйте соответствующие методы для анализа концентрации эстрадиола и прогестерона в провел СМИ [например, радиоиммуноанализ (РИА)]14.
- Для последующего анализа различных целевых молекул (РНК, ДНК, белки, и т.д.) Лизируйте клетки непосредственно в культуры блюдо с соответствующей лизировать агентом как рекомендованный поставщик.
Примечание: Для большинства процедур изоляции, это можно остановить протокол здесь, как лизированных клетки могут храниться при температуре-20 ° C до 1 недели. Для более длительного хранения клетки должны храниться при температуре-80 ° C. - Чтобы определить изобилие стенограмма, синтеза cDNA и измерения конкретных стенограммы количественных реального времени полимеразной цепной реакции (ПЦР) методы15. Статистическая оценка должна включать по меньшей мере три параллельные мероприятия различных клеточных культур, возникла из различных клеточных препаратов (биологические репликация).
Результаты
GC покрытием в 1 х 105 клеток/хорошо дисплей типичный вид фибробластоподобных как они формируют расширением клетки, сопоставимы с фибробластов и, как правило, для создания кластеров (рис. 1a и 1 c). Увеличение плотности покрытия в 10 раз до 1 x 10-6 клеток/хорошо не изменить морфологию но больше кластеры клеток может наблюдаться (рис. 1b и 1 d, стрелки). Как уже показано в предыдущей публикации коллаген покрытие культуры блюд во многом улучшить вложение клетки13.
Первоначальный криоконсервирования значительно не изменять физиологические характеристики клеток в культуре по сравнению с тех, кто непосредственно культивированный свежевыделенных образцов. Это показано на рисунке 2 как изобилие Стенограмма (измеряется ПЦР) несколько маркера, что гены не отличается при сравнении культивируемых клеток производных от замороженных или свежевыделенных бассейнов.
Рисунок 3 показывает представитель результаты анализа стероидных гормонов (измеряется RIA) в бычий GC, культивируемых в нормальной против высокой плотности. Концентрации эстрадиола в высокой плотности культуре, по сравнению с нормальной плотности культуры, заметно снизилась, в то время как производство прогестерона, как правило, выше.
Сравнительный анализ нескольких генов (измеряется ПЦР) в высоко - против нормальной плотности культур показали значительный эффект (рис. 4). CYP19A1, кодирование ключевого фермента ароматазы биосинтез эстрадиола, а также гонадотропин рецепторов FSHR, значительно вниз регулировались. В отличие от генов RGS2 и VNN2 показали значительные вверх регулирование. Эти результаты ясно показывают, что конкретные процессы клеточной дифференцировки индуцированной путем увеличения покрытия плотность клеток.
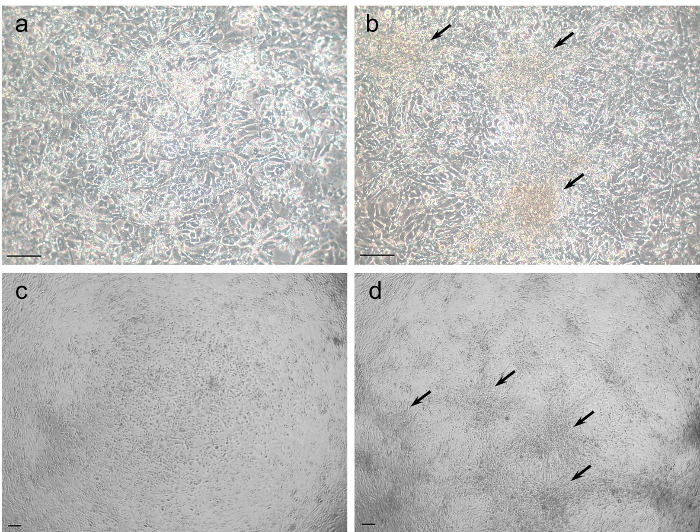
Рисунок 1: культивированный клетки гранулезы говядину в нормальной (левой панели) и плотность высокая клеток (правой панели). ( c) клетки и культивировали на плотности 1 х 105 клеток/хорошо отображается типичный фибробластоподобных фенотип. (b и d) GC, культивируемых на высокой обшивка плотности (1 х 106 клеток/а), как правило, в форме больших клеток кластеры (стрелки) более часто по сравнению с клетки под нормальной густоты (левая панель). Масштаб баров = 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: сравнение клетки культивировали непосредственно после изоляции и после криоконсервирования. Клетки были культивированный на плотности 1 х 105 клеток на хорошо. Выражение гена нескольких маркер стенограммы оценивалась и показали никакой разницы между культивируемых клеток с или без первоначального криоконсервирования. Boxplot показывает средний n = 3. Два-Стьюдента t-теста, p-значения включены. Эта цифра воспроизводится от Baufeld и Vanselow16. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
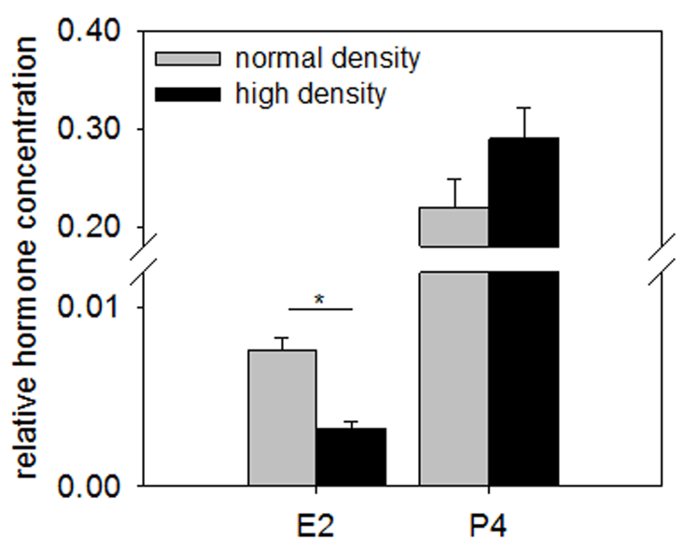
Рисунок 3: концентрация стероидных гормонов в клетках гранулезы, культивируемых на покрытие различных плотностей. Концентрации эстрадиола (Е2) значительно сократилось, когда GC были культивированный на плотность высокой клеток, тогда как концентрация прогестерона (P4) только, как правило, выше. Концентрация гормона был исправлен для содержание ДНК для нормализации для числа различных клеток. Среднее и SEM n = 3 отображаются. p > 0,05, два-Стьюдента t-теста. Эта цифра воспроизводится от Baufeld и др. 15. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
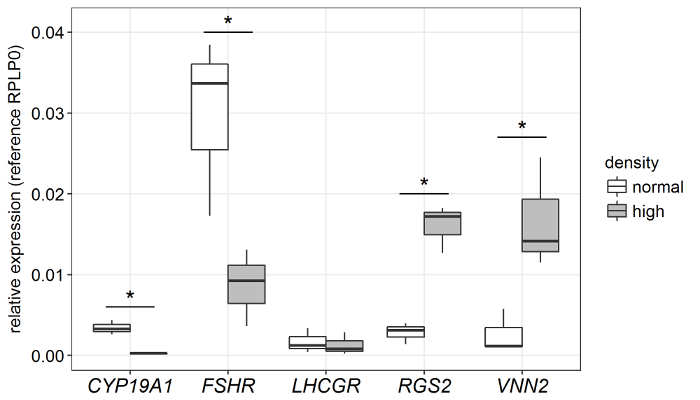
Рисунок 4: Обилие функциональных ключей стенограммы в клетки гранулезы культивировали в нормальной против высокой обшивка плотность. Говядину GC, культивированный сыворотки свободных условиях для 8 d выявили конкретные правила нескольких выбранных маркерных генов. Boxplot отображает средний n = 3 отдельных реплицирует. p < 0,05, два-Стьюдента t-теста. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Представлена ячеечная модель культуры предоставляет инструмент для анализа клеток гранулезы дифференциации в пробирке. Несколько исследований показали, что сыворотка бесплатно выращивание предпосылкой для поддержания стероидных деятельность в культивированный говядину GC или GC другие виды8,9. Кроме того покрытие культуры блюдо с компонентов внеклеточного матрикса (например, коллагеновая R)13, значительно улучшились вложение клеток. Еще одной важной особенностью является период длительного культуры. Недавно было продемонстрировано, что долгосрочные культуры необходимо получить достаточно стероидогенных активности и сбалансированных выражение гранулезы ячейки личность маркеры17. Похоже, что GC требуется время, чтобы оправиться от физического стресса во время процедуры изоляции.
Средства массовой информации добавки, ФСГ, IGF-1 и андростендион известны побудить активность ароматазы в культивированный GC. Особенно добавки с андростендион является абсолютно необходимым, как GC нужно прекурсором для синтеза эстрадиола. Это был ранее опубликован11,18 и, таким образом, далее не изучалось в ходе настоящего исследования. Однако адаптация ФСГ, IGF-1 и андростендион концентрации может быть необходимым для других экспериментальных установок.
Криоконсервация метод, описанный здесь может помочь улучшить организацию экспериментов культуры ткани, делая их более независимыми от различной питания с яичников. По данным предыдущих испытаний, криоконсервация не влияет на GC фенотип или стероидов производства в культуре. Кроме того обилие маркер стенограммы в культивируемых клеток не выявило значительные различия, сравнения образцов, приготовленных из свежевыделенных клеток с теми, кто ранее подвергался криоконсервирования16.
Важным параметром для нынешней модели культуры GC является покрытие плотности. Как показали Результаты представитель, увеличение плотности покрытия индуцированной значительные изменения физиологических и молекулярных характеристик. Некоторые гены регулируются определенным образом, напоминающие изменений, вызванных стимуляции LH в естественных условиях4,19. Тот факт, что увеличение плотность ячеек можно доехать дифференциация подобных процессов искусственного говядину GC должна тщательно рассматриваться в этой GC в vitro модели, чтобы избежать противоречивых результатов между реплицирует. Таким образом противоречивые результаты других исследований могут быть отнесены к плотности различных клеток и следует изучить более внимательно.
Культура модели, описанной здесь выявлено не реагировать на LH, как стенограммы рецептора LHCGR являются близко к пределу обнаружения. Таким образом имитирует ЛГ всплеск так ситуацию в естественных условиях удалось побудить дифференциация13. Тем не менее эта модель обеспечивает полезный инструмент для изучения эстрадиол активные GC в первичной культуре, в частности, не функциональные говядину GC линии существуют в настоящее время.
Различные клинические протоколы могут испытываться в нынешней модели культуры GC, которые помогут разгадать механизмы регулирования стероидов производства или GC дифференциации. Кроме того, один факторы, которые вовлечены в процессы развития могут анализироваться отдельно. Таким образом эта культура модель обеспечивает основу для множества различных приложений.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим Вероника Шрейтер за ее превосходную техническую помощь и полезные изменения установленных криоконсервирования техника и мобильные модели культуры. Кроме того мы хотели бы поблагодарить Maren Андерс и Swanhild Родевальд за их прекрасную техническую помощь в и последующего анализа.
Материалы
| Name | Company | Catalog Number | Comments |
| PBS Instamed w/o Ca2+, Mg2+ | Merck-Millipore | L 182-05 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| penicillin / streptomycin (10,000 IU / 10,000 µg/ml) | Merck-Millipore | A 2213 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| amphotericin (250 µg/ml) | Merck-Millipore | A 2612 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| 3 ml syringe (Omnifix Luer) | Braun | 4616025V | |
| 18 G needle | Roth | C724.1 | |
| fetal calf serum | Merck-Millipore | S 0115 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| cryo-preservation vials (2 ml) | TPP Faust | TPP 89020 | |
| CoolCell LX cell freezing container | Corning | 432004 | |
| culture dish, 24-well, flat bottom | TPP Faust | TPP 92424 | |
| collagen R (0.2 %) | Serva | 47254 | |
| α-MEM | Merck-Millipore | F 0915 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| L-Glutamin (200 mM) | Merck-Millipore | K 0282 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| sodium bicarbonate | Merck-Millipore | L 1713 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| BSA | Sigma | A3311 | |
| HEPES | Merck-Millipore | L 1603 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| sodium selenite | Sigma | S9133 | dissolved in sterile water |
| transferrin | Sigma | T1283 | dissolved in sterile water |
| insulin (10 mg/ml) | Sigma | I0516 | dissolved in 1x PBS |
| NEA | Merck-Millipore | K 0293 | originally purchased at Biochrom AG that is now part of the Merck-Millipore Company; the Cat.-No of Biochrom still exists |
| FSH | Sigma | F4021 | we prefer to use a stock solution of 2 µg/ml, diluted in 0.9 % NaCl |
| LR3-IGF-1 | Sigma | I1146 | we use a stock solution of 2 µg/ml, dissolved in 10 mM HCl and 1x PBS with 1 mg/ml BSA |
| androstenedione | Sigma | 46033 | we use a stock solution of 10 mM, diluted in 100 % ethanol |
Ссылки
- Gutierrez, C. G., Ralph, J. H., Telfer, E. E., Wilmut, I., Webb, R. Growth and antrum formation of bovine preantral follicles in long-term culture in vitro. Biology of Reproduction. 62 (5), 1322-1328 (2000).
- Cortvrindt, R., Hu, Y., Smitz, J. Recombinant luteinizing hormone as a survival and differentiation factor increases oocyte maturation in recombinant follicle stimulating hormone-supplemented mouse preantral follicle culture. Human Reproduction. 13 (5), 1292-1302 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Christenson, L. K., et al. Research resource: preovulatory LH surge effects on follicular theca and granulosa transcriptomes. Molecular Endocrinology. 27 (7), 1153-1171 (2013).
- Havelock, J. C., Rainey, W. E., Carr, B. R. Ovarian granulosa cell lines. Molecular and Cellular Endocrinology. 228 (1-2), 67-78 (2004).
- Bernath, V. A., et al. Cyclic AMP inhibits fibronectin gene expression in a newly developed granulosa cell line by a mechanism that suppresses cAMP-responsive element-dependent transcriptional activation. The Journal of Biological Chemistry. 265 (30), 18219-18226 (1990).
- Lerner, A. A., Salamone, D. F., Chiappe, M. E., Baranao, J. L. Comparative studies between freshly isolated and spontaneously immortalized bovine granulosa cells: protein secretion, steroid metabolism, and responsiveness to growth factors. Journal of Cellular Physiology. 164 (2), 395-403 (1995).
- Gutierrez, C. G., Campbell, B. K., Webb, R. Development of a long-term bovine granulosa cell culture system: induction and maintenance of estradiol production, response to follicle- stimulating hormone, and morphological characteristics. Biology of Reproduction. 56 (3), 608-616 (1997).
- Campbell, B. K., Scaramuzzi, R. J., Webb, R. Induction and maintenance of oestradiol and immunoreactive inhibin production with FSH by ovine granulosa cells cultured in serum-free media. Journal of Reproduction and Fertility. 106 (1), 7-16 (1996).
- Hillier, S. G., Whitelaw, P. F., Smyth, C. D. Follicular Oestrogen Synthesis - The Two-Cell, Two- Gonadotrophin Model Revisited. Molecular and Cellular Endocrinology. 100, 51-54 (1994).
- Silva, J. M., Price, C. A. Effect of follicle-stimulating hormone on steroid secretion and messenger ribonucleic acids encoding cytochromes P450 aromatase and cholesterol side-chain cleavage in bovine granulosa cells in vitro. Biology of Reproduction. 62 (1), 186-191 (2000).
- Portela, V. M., Zamberlam, G., Price, C. A. Cell plating density alters the ratio of estrogenic to progestagenic enzyme gene expression in cultured granulosa cells. Fertility and Sterility. 93 (6), 2050-2055 (2010).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354, 869-880 (2013).
- Schneider, F., Brüssow, K. P. Effects of a preovulatory administered depot gonadotrophin-releasing hormone agonist on reproductive hormone levels and pregnancy outcome in gilts. Reproduction, Fertility and Development. 18 (8), 857-866 (2006).
- Baufeld, A., Koczan, D., Vanselow, J. Induction of altered gene expression profiles in cultured bovine granulosa cells at high cell density. Reproductive Biology and Endocrinology. 15 (1), (2017).
- Baufeld, A., Vanselow, J. Lactate promotes specific differentiation in bovine granulosa cells depending on lactate uptake thus mimicking an early post-LH stage. Reproductive Biology and Endocrinology. 16 (1), 15 (2018).
- Yenuganti, V. R., Vanselow, J. Cultured bovine granulosa cells rapidly lose important features of their identity and functionality but partially recover under long-term culture conditions. Cell and Tissue Research. 368 (2), 397-403 (2017).
- Hamel, M., Vanselow, J., Nicola, E. S., Price, C. A. Androstenedione Increases Cytochrome P450 Aromatase Messenger Ribonucleic Acid Transcripts in Non-Luteinizing Bovine Granulosa Cells. Molecular Reproduction and Development. 70, 175-183 (2005).
- Gilbert, I., Robert, C., Dieleman, S., Blondin, P., Sirard, M. A. Transcriptional effect of the LH surge in bovine granulosa cells during the peri-ovulation period. Reproduction. 141 (2), 193-205 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены