Method Article
Высокая пропускная способность Количественный RT-PCR в одиночных и массовых C. elegans образцы с использованием нанофлюидных технологий
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье описан протокол высокой пропускной способности для быстрого и надежного определения уровней экспрессии генов в отдельных или объемных образцах C. elegans. Этот протокол не требует изоляции РНК и производит кДНК непосредственно из образцов. Он может быть использован вместе с высокой пропускной способностью мультиплексных нанофлюидных платформ в режиме реального времени qPCR.
Аннотация
В настоящем документе представлена высокая пропускная способность обратной транскрипции количественных ПЦР (RT-qPCR) анализ для Caenorhabditis elegans, который является быстрым, надежным и очень чувствительным. Этот протокол получает точные измерения экспрессии генов от одиночных червей или от навалочных образцов. Представленный здесь протокол предусматривает новую адаптацию существующих методов комплементарной подготовки ДНК (кДНК) в сочетании с нанофлюидной платформой RT-qPCR. Первая часть этого протокола, названная "Worm-to-CT", позволяет кДНА производство непосредственно из нематод без необходимости предварительной изоляции мРНК. Это увеличивает экспериментальную пропускную способность, позволяя подготовку cDNA от 96 червей в 3,5 ч. Вторая часть протокола использует существующую нанофлюидную технологию для запуска высокой пропускной способности RT-qPCR на cDNA. В настоящем документе оцениваются два различных нанофлюидных чипа: первый выполняет 96 образцов и 96 целей, в результате чего 9216 реакций примерно за 1,5 дня работы скамейки. Второй тип чипа состоит из шести массивов 12 x 12, что приводит к 864 реакциям. Здесь метод Worm-to-CT демонстрируется количественной оценкой уровней мРНК генов, кодирующих белки теплового шока от одиночных червей и от объемных образцов. При условии, обширный список грунтовки предназначены для усиления обработанных РНК для большинства генов кодирования в геноме C. elegans.
Введение
Оптимизация одноклеточного секвенирования РНК и qPCR показала, что транскрипционные импульсы или всплески могут привести к массовым изменениям в количестве молекул РНК наклетку 1. Кроме того, эти технологии выявили существенную неоднородность клеток, ранее пропущенную стандартными объемными транскрипционными измерениями. В зависимости от контекста, некоторая одноклеточная транскрипционная изменчивость вызвана смешанным клеточным составом тканей. Однако даже в изогенных популяциях клеток, выращенных в одной среде, широко распространена транскрипционнаянеоднородность 2,3. Эта «биологическая изменчивость» все чаще идентифицируется как повсеместное свойство клеточных сетей, от бактерий до человека. В некоторых случаях, он может иметь фенотипические последствия в развитии, прогрессирование рака, задержка ВИЧ, и ответна химиотерапию 4,5.
Нематод Caenorhabditis elegans является уникальной моделью организма с идеальными характеристиками для изучения причин и последствий биологической изменчивости между людьми. Эти нематоды являются простой моделью организма, состоящего из 959 клеток, и их прозрачная кутикула делает их податливой для in vivo изображенийисследований 6. C. elegans — гермафродитический вид, который размножается преимущественно путем самообогащения; это привело к изогенным лабораторным штаммам. Несмотря на изогенность и контролируемые культурные условия, многие фенотипы и стенограммы являются переменными между людьми, предполагая, что стохастические или микропрофронные различия способствуют неоднородности междулюдьми 7,8. Такая изменчивость экспрессии генов имеет многочисленные фитнес-последствия, в том числе изменчивость в переизбытке мутаций, выживаемость, сроки развития иплодовитость 7,8,9. Благодаря этим особенностям исследования с одним червем предоставляют беспрецедентную возможность для изучения биологической изменчивости всего организма.
В этой области существует основополагающую потребность в разработке и оптимизации технологий точного обнаружения стенограмм на уровне одного червя. Новые технологии, такие как одновой червь РНКсеквенирования 10, РНК секвенированияиз изолированных тканей 11, и одноклеточногосеквенирования 12 теперь доступны для C. elegans. Однако основная проблема остается: при мониторинге межиндивидуальности слабо выраженные гены часто опадают ниже обнаруживаемыхуровней 13. Это особенно актуально для редких стенограмм, изолированных от небольших количеств исходного материала, так как существует устоявшаяся обратная связь между средним выражением и технической дисперсией, часто вызывая редкие стенограммы, чтобы упасть ниже статистических отсечки13. Оптимизация высокой пропускной способности мультиплексных технологий qPCR оказалась полезной для млекопитающих одноклеточных исследований, в частности при изученииэкспрессии редких транскриптов 14,15. Эта технология также может быть использована для бенчмаркинга и проверки других технологий с одним червем.
Worm-to-CT — это быстрый и надежный метод, адаптированный из набора, используемого в исследованиях клеточной биологии, для подготовки к кДНА с одним червем. cDNA, полученный этим методом в сочетании с мультиплексной нанофлюидной технологией qPCR, был выбран потому, что он обеспечивает более высокую экспериментальную пропускную способность, более широкий динамический диапазон обнаружения и был проверен для одноклеточныхцелей 14,15. Описанная подготовка кДНА также применима для использования со стандартными технологиями ПЦР. Пропускная способность увеличивается двумя способами: во-первых, препарат cDNA быстрее и надежнее, чем традиционный гуанидий тиоцианат-фенол-хлороформ, потому что черви непосредственно добавляются в буфер лиза, пропуская прямую изоляцию легко разлагаемой РНК. Во-вторых, использование нанофлюидных технологий значительно увеличивает количество образцов и целей, которые могут быть запущены одновременно. В этой работе сравниваются две фишки: чип с одной массивом и многослойный чип. Одно массивный чип может работать 96 одиночных червей и 96 наборов грунтовок, в результате чего 9216 реакций за эксперимент. Для достижения аналогичной пропускной способности с использованием стандартных технологий qPCR потребуется 96 отдельных экспериментов qPCR, используя 96 пластин. Меньший и более гибкий многослойный чип состоит из шести массивов 12 x 12, что приводит к 864 реакциям. Превосходная надежность и чувствительность метода повышаются с помощью нанофлюидной технологии и введения шага предварительной упрощения. Метод, представленный в настоящем документе, предназначен для использования вместе с самым новым статистическим алгоритмом для извлечения биологической дисперсии. В этой статье представлен протокол для быстрого приготовления кДНК и высокой пропускной способности qPCR как для одного червя, так и для образцов пакетных червей; алгоритм будет опубликован в другом месте. Для этого протокола организация каждого чипа должна быть подготовлена до начала эксперимента. В таблице 1 и таблице 2 приведены примеры этих планов для многофункциональных и однослойных чипов соответственно. Есть также обзоры протокола Worm-to-CT, подробно описанного на рисунке 1, и запуск микросхем с мульти-массивом и одним массивом на рисунке 2.
протокол
ПРИМЕЧАНИЕ: На протяжении всего этого протокола Caenorhabditis elegans называется "червь" или "черви". Разнообразие штаммов C. elegans можно заказать через онлайн-базы данных или путем прямого контакта с лабораториями, которые используют модель организма. Часть I этого протокола (разделы 1–3) описывает подготовку к DNA через протокол Worm-to-CT. Часть II этого протокола (разделы 4–13) описывает запуск высокой пропускной способности RT-qPCR с использованием нанофлюиды, адаптированный из протокола, разработанного Fluidigm16. Этот протокол применяется к использованию двух типов нанофлюидных чипов, определенных ранее, чипа с одной массивом, который может контролировать 96 целей в 96 образцах (всего 9216 реакций RT-qPCR), или многопрофийного чипа, который функционирует как подразделение 12 целевых х 12 образцов. Каждый многофункциональный чип содержит шесть независимых массивов, которые могут быть запущены вместе или отдельно. Например, с помощью целого многослойного чипа можно контролировать 72 цели x 12 образцов (или наоборот), или 36 целей x 24 образцов (или наоборот). Для получения дополнительной информации о любом из материалов, используемых в этом протоколе, обратитесь к таблице материалов.
1. Проверка праймера RT-qPCR
ПРИМЕЧАНИЕ: Праймеры в реальном времени были разработаны на основе рекомендуемых свойств, первоначально выпущенных руководящими принципамиМЮИК 17. Чтобы сделать грунтовки специфичны для обработанной РНК, продукты были разработаны таким образом, что две грунтовки связаны с обеих сторон, по крайней мере один перекресток сращивания. Требования к подходящим грунтовки включали содержание гуанина и цитозина в 20%-80%, температуру плавления 58–60 градусов по Цельсию, разницу в температуре плавления между грунтово сборными ≤0,5 градусов по Цельсию и длину продукта 70–120 б.п. Последовательность сгенерированных грунтовок можно найти в дополнительной таблице 1. Код с открытым исходным кодом для скриптов, используемых для создания праймеров, можно найти https://github.com/s-andrews/wormrtpcr. Праймер пары для стенограммы с сращиванием сайтов были разработаны таким образом, что они лежат в двух экзонов фланговых интрона, но не были разработаны, чтобы быть сращивания вариант конкретных, используя NCBI Primer Доменнаяпрограммное обеспечение 18. Для этого изучения, комплекты грунтовки были взорваны против генома C. elegans для того чтобы испытать для любой вне цели комплементарности.
- Извлекните праймеры из базы данных праймеров RT-qPCR(Дополнительная таблица 1). Кроме того, дизайн qPCR грунтовки пар с использованием онлайн-инструментов, таких как NCBI Primer Blast18.
- Выполните стандартную кривую qPCR для мониторинга специфичности и эффективности ПЦР для каждой пары грунтовок с использованием стандартных методов кЗРКР19 и следуя рекомендациямМЦВЕ 17,20.
ПРИМЕЧАНИЕ: Следует использовать только грунтово-пара с R2 и 0,98 и эффективностью ПЦР от 85% до 115%. Последовательность, эффективность ПЦР и R2 для грунтовок, используемых в данном исследовании, подробно описаны в таблице 3.
2. Червь лиза через червь к КТ
- Выберите червей из их бактериальной лужайке на свежие, несеяные NGM пластины и позволяют червей передвигаться по пластине в течение 5 минут, чтобы удалить большую часть бактерий из червя через его движение.
ПРИМЕЧАНИЕ: Бактериальный газон и условия выращивания будут отличаться в зависимости от экспериментального дизайна. Эксперименты, представленные здесь требуют 6 см NGM пластин, посеянных с OP50 Escherichia coli с червями интерес вырос до стадии L4.9 в инкубаторе 20 градусов по Цельсию. - В капоте без RNase подготовьте мастер-микс, состоящий из 12,5 МКЛ буфера 2x RT, 1,25 МКЛ 20-х ферментного буфера RT и 0,25 МКЛ без нуклеазы воды на образец. Добавьте 14 МКЛ мастер-микса к 11 КЛ каждого образца из шага 2.8.
- Поместите крышку полосы ПЦР вверх дном на платформу вскрытого прицела и добавьте 10 МКЛ смеси лиза в куполообразные крышки ПЦР-трубки под составным микроскопом.
ПРИМЕЧАНИЕ: С только один или два образца, лучше использовать ПЦР полоса, содержащая по крайней мере четыре трубки, так как это снижает риск шапки взрывных открыть в последующих замораживания оттепели шаги. Кроме того, резинки могут быть использованы для проведения шапки на месте. В этом случае убедитесь, что колпачки должным образом закрыты каждый раз, когда трубы передаются. - Выберите червей из пластины в каждый слот крышки, содержащей смесь лиза, "черпая" их (т.е. ловить червей под с забрать), чтобы избежать бактериального загрязнения. Закройте трубки и спина их вниз в течение 5 с использованием столешницы микроцентрифуг (Таблица материалов), прежде чем поместить их в колбу Dewar заполнены жидким азотом.
ПРИМЕЧАНИЕ: От 15 до 30 червей должны быть использованы для массовых экспериментов и 1 червь для одного червя измерений.
ВНИМАНИЕ: При обработке жидкого азота носить Cryo-перчатки, а также защитные очки и придерживаться стандартных правил одежды, потому что контакт с кожей или глазами может привести к серьезным травмам обморожения. - Заморозить-оттепель ПЦР труб 10x, передавая их между жидким азотом и водяной баней в размере 40 градусов по Цельсию. Оставьте трубки в жидком азоте минимум на 5 с, чтобы убедиться, что образцы полностью заморожены. Оставьте трубки на водяной бане до тех пор, пока образцы не оттаяют. Не оставляйте в течение более длительного периода, так как это приводит к деградации РНК.
ПРИМЕЧАНИЕ: Трубы могут быть оставлены в жидком азоте в течение длительного периода времени, так как образцы заморожены примерно до -200 градусов по Цельсию, уменьшая деградацию РНК. Однако это не должно быть точкой остановки протокола, поскольку жидкий азот быстро испаряется. - Смешайте образцы на термальной смеситель(Таблица материалов), установленный на 4 кк в течение 20-30 мин вращающейся на 1800 об / мин.
- Пока пробы смешиваются, оттаивать стоп-раствор на льду.
- Спин образцов вниз с помощью столешницы микроцентрифуг (Таблица материалов) и добавить 1 йл стоп-решения для каждой трубки.
ПРИМЕЧАНИЕ: Образцы можно оставить при -80 градусов по Цельсию на срок до 1 недели до обратного транскрибирования РНК (раздел 3).
3. Обратная транскрипция
ПРИМЕЧАНИЕ: Для обратной транскрипции одиночных червей результаты, показанные здесь, были получены с использованием реагентов, обеспеченных нанофлюидными чипами (вариант 2 на рисунке 1). Реагенты, выделенные в варианте 2 рисунка 1, также использовались для обратной транскрипции слитых образцов. Любой метод работает взаимозаменяемо для различных типов образцов.
- Обратная транскрипция одиночных червей
- В капоте без RNase добавьте 1,25 МКЛ смеси обратной транскрипции(Таблица материалов)в свежую трубку ПЦР.
ПРИМЕЧАНИЕ: 96 хорошо ПЦР пластины и автоматической пипетки могут быть использованы, если Есть много образцов. В протоколе производителя говорится, что на один образец можно использовать 1 МКЛ. - Возьмите 5 мкл раствора лиза и остановите смесь раствора из шага 2.8 и добавьте его в свежую трубку ПЦР, содержащую смесь обратной транскрипции.
ПРИМЕЧАНИЕ: В протоколе производителя говорится, что за реакцию можно использовать 1 МКЛ РНК (2,5 пг/йл-250 нг/йл). Отрицательный контроль RT на тарелку может быть добавлен путем замены смеси обратной транскрипции на 5 МКЛ лизированного образца и 1,25 МЛ воды, свободной от РНК. - Вы запустите образцы с помощью следующей программы обратной транскрипции на термоциклере: 25 градусов по Цельсию в течение 5 минут, 42 градусов по Цельсию в течение 30 минут, 85 градусов по Цельсию в течение 5 минут и 4 градусов по Цельсию ∞.
ПРИМЕЧАНИЕ: Произведенный cDNA может храниться при -20 градусов по Цельсию, прежде чем приступить к усилению и сбору данных с использованием высокой пропускной способности qPCR.
- В капоте без RNase добавьте 1,25 МКЛ смеси обратной транскрипции(Таблица материалов)в свежую трубку ПЦР.
- Обратная транскрипция для объемных образцов (15–30 червей)
- В капоте без RNase подготовьте мастер-микс, состоящий из 12,5 МКЛ буфера 2x RT, 1,25 МКЛ 20-х ферментного буфера RT и 0,25 МКЛ без нуклеазы воды на образец. Добавьте 14 мкл мастер-микса в 11 мкл раствора лиза и остановите смесь раствора от шага 2.8.
ПРИМЕЧАНИЕ: При работе с большим количеством образцов это может быть выполнено в 96 пластин хорошо. - Запустите образцы через термоциклер, используя следующую программу обратной транскрипции: 37 градусов по Цельсию в течение 60 минут, 95 градусов по Цельсию в течение 5 минут и 4 градуса по Цельсию ∞.
- Разбавить произведенный cDNA 1:4 в нуклеазной воде.
ПРИМЕЧАНИЕ: Как правило, продукты приходят к окончательному объему 25 йл, и в этом случае 75 МКЛ должны быть добавлены. Однако из-за конденсации конечный объем может варьироваться. Таким образом, настроить соответствующим образом, чтобы сделать соотношение 1:4 в окончательном решении. Этот шаг разбавления не применяется при выполнении qPCR на одиночных червях. Производимая кДНА может храниться при -20 градусов по Цельсию, прежде чем приступить к усилению и сбору данных с использованием высокой пропускной способности qPCR.
- В капоте без RNase подготовьте мастер-микс, состоящий из 12,5 МКЛ буфера 2x RT, 1,25 МКЛ 20-х ферментного буфера RT и 0,25 МКЛ без нуклеазы воды на образец. Добавьте 14 мкл мастер-микса в 11 мкл раствора лиза и остановите смесь раствора от шага 2.8.
4. Подготовка мультиплекса грунтовка смесь
- Подготовь вперед/обратно (F/R) грунтовку для каждой пары грунтовок при конечной концентрации 50 МКМ. Смешайте один и тот же объем форвардных и обратных грунтовок по 100 МКМ каждый.
- Объедините 1 МКЛ из 50 МКМ F / R грунтовка для каждой грунтовой пары, которые будут протестированы. Добавьте буфер подвески ДНК до общего объема в 100 мл.
ПРИМЕЧАНИЕ: Концентрации грунтовки здесь отличаются от тех, которые описаны впротоколе производителя 16, но сохраняют ту же окончательную концентрацию 500 нМ.
5. Целевое конкретное предварительное упрощение
- Подготовь мастер-микс, содержащий 1 МКЛ мастермикса preamplification(Таблицаматериалов), 0,5 мл смеси спложенной грунтовой (шаг 4.2) и 2,25 МЛ воды без нуклеазы на реакцию с общим объемом излишков 10%.
- В пластине из 96 скважин алицит 3,75 МКЛ мастер-микса в столько скважин, сколько требуется для гораздо большего количества проб.
- Добавьте 1,25 МЛ процентных решений cDNA, генерируемых на этапе 3.1.3 или 3.2.3 к каждой колодец.
- Обложка пластины с 96 хорошо уплотнения ленты, кратко вихрь, и центрифуга с столешницей пластины спиннер. Перенесите на термоциклер и запустите следующую программу: 95 градусов по Цельсию в течение 2 минут, 15 циклов денатурации при 95 градусов по Цельсию на 15 градусов, аннеализация/расширение при 60 градусов по Цельсию в течение 4 минут и 4 градуса по Цельсию для ∞.
ПРИМЕЧАНИЕ: Производитель рекомендует от 10 до 20 циклов для предварительной реакции16. Этот протокол рекомендует 10 или 15 циклов в зависимости от уровня экспрессии генов-мишеней.
6. Лечение экзонуклеазы I
ПРИМЕЧАНИЕ: Это для удаления неинкорпорированных грунтовки из preamplification.
- Подготовь экзонуклезу I смесь, содержащую 0,2 МКЛ буфера реакции экзонуклезы I(Таблицаматериалов), 0,4 МКЛ экзонуклеазы I на 20 U/L (Таблица материалов), и 1,4 йл нуклеазы свободной воды на образец. Храните все реагенты на льду, особенно экзонуклеазу I.
- Снимите пластину 96 хорошо (шаг 5.4) с термоциклера, центрифугу со спиннером столешницы и аккуратно удалите уплотнение. Добавьте 2 МКЛ экзонуклеазы, которую я смешиваю с каждой реакцией предварительного усиления. Reseal, центрифуга, и поместите 96 хорошо пластины обратно в термоциклер с помощью следующей программы: 37 градусов по Цельсию в течение 30 минут, 80 градусов по Цельсию в течение 15 минут, и 4 КК для ∞.
- Возьмите образцы из термоциклера и разбавить их 1:5, добавив 18 йл буфера 1x Tris EDTA(Таблица материалов).
ПРИМЕЧАНИЕ: Можно сохранить образцы cDNA на -20 C для более длительного использования. Протокол производителя предполагает потенциальное разбавление 5x, 10x, или 20x наданном этапе 16, в зависимости от уровня выражения целей, представляющих интерес.
7. Подготовка смесей анализа
ПРИМЕЧАНИЕ: Смеси assay могут быть подготовлены в 384 пластин скважины, так как скважины имеют тот же интервал, как нанофлюидные чипы, что делает загрузку легче.
- Подготовка смесей анализа для многослойного чипа
- Подготовь мастер-микс, состоящий из 2 МКЛ 2x анализа нагрузки реагента (Таблицаматериалов ) и 1,6 мл буфера подвески ДНК(Таблица материалов) для каждой хорошо в соответствии с подготовленным планом. Aliquot 3.6 йл этого мастера смесь на хорошо в 384 хорошо пластины.
- Добавьте 0,4 МКЛ из 50 МКМ F/R грунтового запаса, подготовленного в шаге 4,1 к соответствующим скважинам в соответствии с подготовленным планом.
ПРИМЕЧАНИЕ: Это обеспечивает в общей сложности 4 МКЛ анализа смеси на колодец, с избытком 1 йл.
- Подготовка смесей анализа для чипа с одним массивом
- Подготовь мастер-микс, состоящий из 3 МКЛ 2x анализа нагрузки реагента и 2,4 мл буфера подвески ДНК для каждой хорошо в соответствии с подготовленным планом. Aliquot 5.4 йл этой мастер смеси на хорошо в отмеченные 384 хорошо пластины.
- Добавьте 0,6 мкл из 50 МКМ F/R грунтового запаса к соответствующим скважинам в соответствии с подготовленным планом.
ПРИМЕЧАНИЕ: Это обеспечивает в общей сложности 6 МКЛ анализа смеси на колодец, с избытком 1 йл.
8. Подготовка образцовых смесей
ПРИМЕЧАНИЕ: Образец смеси могут быть подготовлены до 1 дня заранее и храниться при 4 градусов по Цельсию.
- Подготовка образцов для многослойного чипа
- Подготовь образец мастер-микс, состоящий из 2 мл 2x флуоресцентного зонда supermix с низким ROX (Таблицаматериалов ) и 0,2 МКЛ образца реагента (Таблица материалов) на образец. Выпределите 2,2 мл этой смеси в отмеченную пластину 384 хорошо.
ПРИМЕЧАНИЕ: Производитель рекомендует не вихревой образец реагента16. - Pipette 1.8 l каждого preamplified, exonuclease я обработал образец от шага 3.2.3 в соотвествуя скважины согласно подготовленному плану.
ПРИМЕЧАНИЕ: Это дает в общей сложности 4 КЛ, с избытком 1 КЛ.
- Подготовь образец мастер-микс, состоящий из 2 мл 2x флуоресцентного зонда supermix с низким ROX (Таблицаматериалов ) и 0,2 МКЛ образца реагента (Таблица материалов) на образец. Выпределите 2,2 мл этой смеси в отмеченную пластину 384 хорошо.
- Подготовка образцов для чипа с одним массивом
- Подготовь образец мастер-микс, состоящий из 3 МКЛ 2x флуоресцентный зондсупермиксс низким ROX ( Таблица материалов ) и 0,3 МЛ 20x ДНК-связывающий образец красителя загрузки реагента ( Таблицаматериалов) на образец. Выпределите 3,3 мл этой смеси в отмеченную пластину 384 хорошо.
- Pipette 2.7 L каждого preamplified и exonuclease я обработал образец от шага 6.3 в соотвествуя скважины согласно подготовленному плану.
ПРИМЕЧАНИЕ: Это дает в общей сложности 6 КЛ, с избытком 1 КЛ. Если есть какие-либо скважины, которые будут работать без образца они должны быть загружены с образцом мастер смеси и 2,7 мл воды вместо cDNA. Это рекомендуется для обоих типов чипов. Машина нуждается в низком ROX в каждом входе для того, чтобы обнаружить сетку чипа.
9. Грунт нанофлюидный чип
ПРИМЕЧАНИЕ: Многофункциональный чип нужно только загрунтовыть на первом запуске. При последующих запуске одного и того же чипа этот этап можно пропустить. Эти шаги одинаковы для обоих типов чипов.
- Медленно и осторожно, введать полный 150 йл жидкости контрольной линии из шприцев, включенных в аккумуляторы чипа. Убедитесь, что жидкость управления не касается чипа, удерживая чип под углом 45 градусов и удерживая кончик шприца, чтобы избежать разлива.
- Удалите синюю защитную пленку из нижней части чипа.
- Поместите чип в нанофлюиды PCR грунтовки машины (Таблица материалов), со штрих-кодом наружу. Вы запуститесценарий 'Prime (153x),который занимает 15-20 мин.
ПРИМЕЧАНИЕ: Включите термоциклер нанофлюиды(Таблицаматериалов ) на данном этапе, потому что камера занимает около 10 минут, чтобы остыть ниже 0 градусов по Цельсию.
10. Загрузка нанофлюидного чипа
- Удалите барьерные пробки последовательно по мере загрузки. Это снижает вероятность неправильной загрузки скважин.
- Передача либо 3 йл для многослойного чипа или 5 йл для однослойного чипа каждого грунтового анализа смесей и образцов с соответствующими входами нанофлюидного чипа в соответствии с подготовленным планом. Убедитесь в том, чтобы не вводить пузырьки, которые могут привести к тому, что общий объем переданных будет меньше, чем хотелось бы.
ПРИМЕЧАНИЕ: Если есть какие-либо скважины, которые будут работать без грунтовки важно для них, чтобы быть загружены с мастер-микс, заменив грунтовки объем с водой. Это относится к обоим типам чипов. На этом этапе может быть проще разместить чип на темной поверхности, что позволит легче увидеть скважины.
11. Запуск нанофлюидного чипа
ПРИМЕЧАНИЕ: Впервые запуск многослойного чипа, настройка файла отслеживания путем выбора инструментов | Flex Шесть Отслеживание использования, нажмите Новый, введите имя файла, и выбрать место, прежде чем нажать Готово.
- Откройте программное обеспечение для сбора данных. Нажмите Кнопку Начать Новый Запуск. Поместите загруженный чип в термоциклер нанофлюиды со штрих-кодом наружу.
- Выберите параметр проекта, если это применимо, а затем нажмите На следующий | Нагрузка. При загрузке многослойного чипа выберите разделы (arrays), которые будут запущены.
- Выберите справочные зондыприложения, затем измените тип приложения на Gene Expressionи измените пассивную ссылку на ROX. Выберите единый зонд анализа,изменить тип зонда на ЕваГрин , и нажмите Далее.
- Выберите протокол теплового велоспорта GE FLEX шесть Быстрый PCR-Melt v1 для запуска многослойного чипа, или протокол GE 96.96 Быстрый PCR-Melt v2 для запуска чипа с одним массивом.
- Подтвердите, что выбрана автоматическая экспозиция, и нажмите кнопку Start Run.
12. Почтовый чип перспективе
ПРИМЕЧАНИЕ: Этот раздел необходим только для многофункциональных чипов, когда не использует весь чип.
- Возьмите чип из термоциклера нанофлюиды и загрузите в нанофлюиды PCR грунтовки машины и запустить Post Run (153x) сценарий, который длится 5 минут.
- Наклеить этикетку на вилки, используемые для личной справки.
ПРИМЕЧАНИЕ: Чип теперь может храниться при комнатной температуре, а остальные массивы на чипе могут быть запущены в течение 2 месяцев.
13. Очистка и анализ данных
- Откройте данные в программном обеспечении PCR Analysis врежиме реальноговремени(Таблица материалов). Проверьте температуру плавления пик для каждой грунтовки пары испытания. Исключите результаты, демонстрировали более одного пика температуры плавления, для данной грунтовки.
ПРИМЕЧАНИЕ: Несколько пиков появляются только время от времени, предположительно, когда грунтовки пары формирует димеры, или от взаимодействия целевых грунтовки с другими грунтовки в объединились грунтовки смеси. - Экспорт данных в качестве файла электронной таблицы 'heatmap' и устранение неудачных образцов или грунтовок.
- Анализируйте данные с помощью стандартного метода Delta-Ct21. Для статистической оценки выполняется одноразовая ANOVA на относительных уровнях экспрессии.
Результаты
Проверка червя к КТ в качестве метода подготовки кДНА
Чтобы проверить, является ли протокол Worm-to-CT действительным методом извлечения кДНК, его сравнивали со стандартными методами извлечения гуанидия тиоцианат-фенол-хлороформ. Результаты показаны на рисунке 3, где cDNA был подготовлен из в среднем 1000 червей с использованием стандартных гуанидий тиоцианат-фенол-хлороформметоды извлечения 22 и от 30 червей с использованием метода Червь к КТ. Образцы были теплового шока одновременно (30 мин при температуре 34 градусов по Цельсию). Во всем мире уровни экспрессии hsp-70 mRNA на 100 нг общей РНК были сопоставимы с использованием обоих методов. Однако в случае наивысшего экспрессии hsp-70 (т.е. в N2 после теплового удара) уровни экспрессии были выше с помощью метода Worm-to-CT, что свидетельствует об улучшении чувствительности.
Чтобы определить, если ожидаемое снижение экспрессии hsp в hsf-1 (sy441)23, мутации в основной транскрипционныйрегулятор молекулярных сопровождающего 23,24, может быть воспроизведена, транскрипционные индукции сопровождающего после краткого теплового шока был сравнен. С помощью обоих методов снижение индукции hsp-70 было обнаружено у животных hsf-1 (sy441). Это было ожидаемо, потому что мутант hsf-1 (sy441) животные демонстрируют снижение способности вызывать сопровождающие из-за усечения в области трансактивации HSF-1. Для гуанидия тиоцианат-фенол-хлороформ экстракции hsp70 снизился на 82,7% по сравнению с контролем и 92,3% для червя к КТ по сравнению с дикими животными типа(рисунок 3). Результаты были сопоставимы между обоими методами и сопоставимы с предыдущимидокладами 23. Эти результаты показывают, что метод Worm-to-CT является действительной альтернативой стандартным методам синтеза кДНК.
Проверка платформы ПЦР нанофлюиды, используемой для усиления целей мРНК
Для проверки согласованности результатов с использованием нанофлюидного qPCR для усиления транскрипта результаты ПЦР, полученные с помощью метода «Червь-КТ», сравнивались как со стандартной системой qPCR(Таблица материалов),так и с помощью нанофлюидной системы qPCR с использованием многослойного чипа. Изменение створки в экспрессии трех различных генов, sma-3 (Рисунок 4A), sma-10 (рисунок 4B), и dnj-26, был проверен (Рисунок 4C) у животных, несущих нулевой аллель в dbl-1 (dbl-1(nk3))25 по сравнению с дикими коллегами типа. Dbl-1 кодирует единственный лиганд сигнального пути костного морфогенетического белка (БМП). sma-3 и sma-10 — это гены, кодирующие ортологи SMAD, ключевые компоненты сигнального каскада БМП. Dnj-26 кодирует молекулярную сопровождающего, цель сигнализации БМП. Эти результаты практически не показывают разницы в изменении складок, сравнивая результаты двух методов, в результате чего не значительные P-значения на 0,3113, 0,2635, и 0,3481 для sma-3, sma-10, и dnj-26, соответственно. В целом, эти результаты показывают, что метод Worm-to-CT, применяемый к навалочных образцам, является эффективным и быстрым способом извлечения РНК из нескольких червей и предоставляет надежные данные в сочетании либо со стандартными ПЦР-системами, либо с высокой пропускной способностью нанофлюидных платформ qPCR.
Сравнение уровней экспрессии, полученных объемных выборок, со средними данными, полученными от одиночных червей
Относительные уровни экспрессии были рассчитаны с использованием либо кДНК, полученной из объемных образцов (25 червей), либо в среднем из 36 образцов одного червя(рисунок 5). Оба cDNAs были получены с использованием метода Worm-to-CT и усилены с использованием технологии ПЦР нанофлюиды. Как отмечается на рисунке 5A-C, для всех проверенных сопровождающие (т.е. hsp16.1, F44E5.4, hsp-70), методы обнаружили сопоставимые уровни выражения. Эти результаты показывают, что параметры, полученные от одиночных червей являются надежными.
Применение технологии Worm-to-CT в сочетании с технологией нанофлюиды для оценки параметров экспрессии генов с одним червем
Поскольку одноразовый чип позволяет контролировать до 96 целевых транскриптов на 96 отдельных образцах, поэтому он хорошо подходит для мониторинга индивидуальной изменчивости экспрессии транскрипта между одиночными червями. Рисунок 6A представляет собой репрезентативный результат, показывающий среднее выражение нескольких стенограмм hsp от одиночных червей после короткого теплового удара. Как отмечается на рисунке, изменчивость экспрессии транскриптов резко различалась между различными генами(рисунок 6A). Чтобы получить дальнейшее понимание, коэффициент вариации (CV) был рассчитан путем деления стандартного отклонения на среднее уровнявыражения 26 (рисунок 6B). Были проверены три гена, значения резюме которых ранее оценивались альтернативными методами (неопубликованные данные). Две стабильные стенограммы(ife-1 и Y45F10D.4)и однапеременная (nlp-2927) показали ожидаемую изменчивость. На графике также четко показана известная обратная связь между значениями изменчивости и уровнямивыражения 26 (рисунок 6B).
Технические репликации имеют первостепенное значение для обеспечения воспроизводимости при использовании объемных образцов. Однако это не обязательно относится к одноклеточных экспериментам14,15,28. Чтобы определить, необходимо ли использовать технические репликации для оценки параметров при использовании образцов одного червя, было собрано 28 отдельных червей после короткого теплового удара и обработано с использованием технических трипликатов. Значения CV, рассчитанные на основе данных одного червя, полученных в тройном (синие точки на рисунке 7, техническое резюме) по сравнению с данными для каждой стенограммы, полученной от отдельных червей (красные точки на рисунке 7, биологическая изменчивость) были сопоставлены. Для каждой испытанной стенограммы технические резюме были ниже биологических резюме, что указывает на то, что технические трипликаты не требуются для оценки параметров. Тот факт, что технические репликации не требуются, увеличивает пропускную способность эксперимента без ущерба для качества.

Рисунок 1: Обзор протокола «Червь к КТ».
Эта цифра показывает краткий обзор различных шагов, необходимых для запуска червей через протокол Worm-to-CT. Для шага обратной транскрипции отображаются два дополнительных метода; это взаимозаменяемые методы для любого типа чипа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Обзор подготовки и запуска нанофлюидных qPCR.
Эта цифра изображает подготовку к запуску нанофлюидной системы qPCR с использованием многослойного чипа и чипа с одним массивом. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
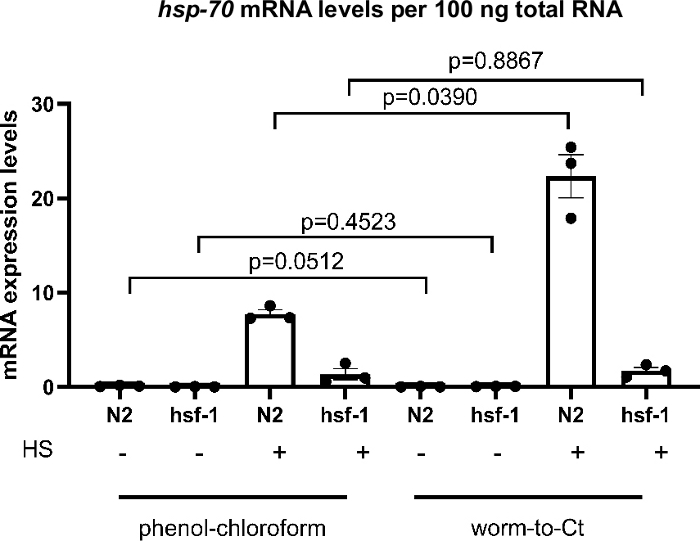
Рисунок 3: Протокол «Червь к КТ» по навалочных пробам дал достоверные результаты.
Сравнение протокола «Червь-КТ» с обычным гуанидием тиоцианат-фенол-хлороформнаяэкстракция 22 на оптовых образцах. В соответствии с предыдущими выводами, в hsf-1 (sy441)мутантов 23, уровни hsp стенограммы в ответ на тепловой удар снизился. Вышеупомянутые гистограммы изображают индукцию hsp-70 при отсутствии (-), или после (я) короткого теплового удара 30 мин при температуре 34 градусов по Цельсию. CDNA был получен с использованием гуанидия тиоцианат-фенол-хлороформ экстракции применяется к 1000 червей (слева) или с помощью метода Worm-to-CT применяется к 30 объединились червей (справа). Были сопоставлены уровни экспрессии hsp-70 на 100 нг общей РНК, полученной каждым методом. Как и ожидалось, в hsf-1 (sy441) транскрипционная индукция hsp-70 в ответ на тепловой шок значительно снизилась на 82,7% с использованием гуанидия тиоцианат-фенол-хлороформ и на 92,3% с использованием метода Worm-to-CT. Уровни мРНК от генов-мишеней были нормализовывались по отношению к среднему из трех генов домашнего хозяйства cdc-42, pmp-3и ire-1. Каждая точка представляет собой биологическую репликацию. Данные преобразуются для статистического анализа, поскольку они не соответствуют конвенциям, необходимым для параметрического анализа. Статистический анализ проводился с использованием RM-One-way ANOVA с использованием многократного теста сидака. Дикий тип N2, hsf-1 и hsf-1 (sy441). Бары обозначают стандартную погрешность среднего. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
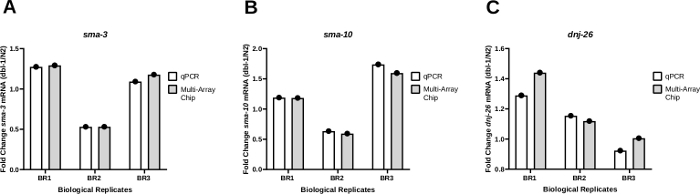
Рисунок 4: Модели выражения согласуются между стандартными кЗКПЧ и нанофлюидными системами qPCR.
(A) Уровень экспрессии sma-3 (A), sma-10 (B) или dnj-26 (C) мРНК определялся с помощью регулярных qPCR и нанофлюидных qPCR (многослойный чип) из трех биологических репликаций cDNA, генерируемых через Worm-to CT из штамма дикого типа (N2) и dbl-1(nk3) нокаутирующий штамм 25. Относительные уровни экспрессии мРНК были определены для каждого штамма с использованием метода Delta-Ct21. Затем изменение сложи было определено путем деления уровней экспрессии, полученных у червей dbl-1(nk3), на соответствующие уровни мРНК в штамме N2. Как показано в панели А, модели были последовательными для обоих методов в каждой отдельной биологической репликации. (B)и(C)такие же,как( A ) для уровней sma-10 и dnj-26 mRNA, соответственно. Целевые уровни мРНК были нормализовыны в отношении генов домашнего хозяйства cdc-42 и pmp-3. Статистический анализ был рассчитан для каждого гена с помощью парного t-теста, сравнивая результаты трех биологических репликаций, полученных с помощью стандартного qPCR, и тех, которые генерируются с помощью нанофлюидного qPCR. P-значения этих сравнений были 0.3113, 0.2635, и 0.3481 для sma-3, sma-10, и dnj-26,соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Использование метода Worm-to-CT на массовых образцах или на одиночных червях обеспечивает аналогичные уровни экспрессии при нормализации на одного червя.
Уровни экспрессии (A) hsp-16.1/11, (B) F44E5.4, и ( C ) hsp-70 (C12C8.1) были проанализированы у молодых взрослых животных при отсутствии теплового удара либо путем выполнения Worm-to-CT на основных 25 животных, или на 36 одиноких особей. Когда данные нормализовались на одного червя, не было существенной разницы между уровнями, полученными на червя для каждого транскрипта с использованием обоих методов. Уровни мРНК от генов-мишеней были нормализовывались по отношению к среднему из трех генов домашнего хозяйства cdc-42, pmp-3 и ire-1. Бары представляют собой стандартную погрешность среднего. Статистика - парный t-тест. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
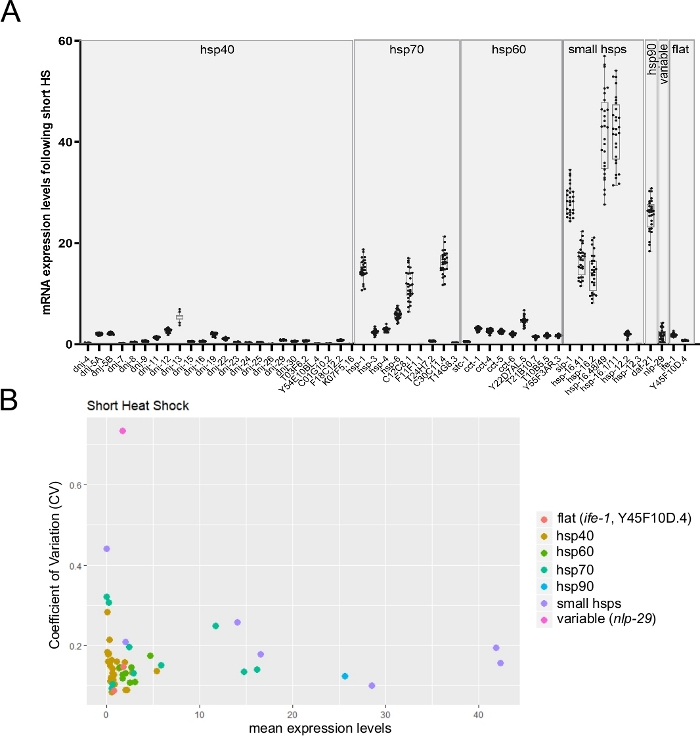
Рисунок 6: Высокая пропускная способность RT-qPCR на одиночных червей с использованием метода Worm-to-CT может контролировать меж индивидуальную изменчивость экспрессии генов.
(A) Средний уровень экспрессии для 53 стенограмм, полученных при воздействии короткого теплового удара (30 мин при температуре 34 градусов по Цельсию). Боксплоты представляют собой распределение среднего экспрессии мРНК от отдельных червей (на одного червя было использовано в среднем три технических репликации). Точки представляют уровни выражения в 28 отдельных червей. Уровни мРНК от генов-мишеней были нормализовывались по отношению к среднему из трех генов домашнего хозяйства cdc-42, pmp-3 и ire-1. (B)Коэффициент вариации26 (CV) как функция среднего экспрессии мРНК для 53 транскриптов после воздействия короткого теплового удара был рассчитан из 28 отдельных животных (сырые данные, показанные в панели B). Набор стенограмм включает в себя переменную nlp-29 стенограмму 27 и две стабильные стенограммы(ife-1 и Y45F10D.4; неопубликованные данные). Резюме – это отношение стандартного отклонения к среднему. Это резюме было использовано для оценки межим индивидуальной изменчивости экспрессии транскрипта между отдельными червями. Как и ожидалось, меж индивидуальная изменчивость масштабируется со снижением средних уровней выражения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
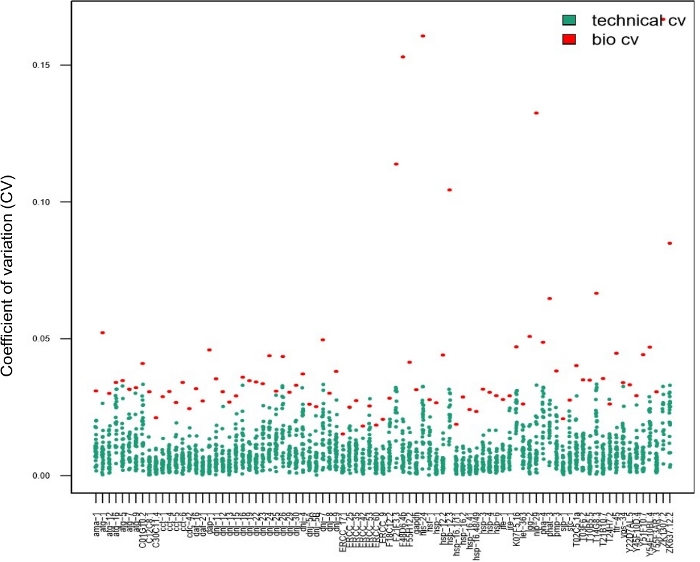
Рисунок 7: Технические репликации не были необходимы при анализе межличностной изменчивости экспрессии генов с помощью нанофлюидного чипа.
Данные, представленные на этом графике, были получены у 28 отдельных червей после короткого теплового удара (30 мин при температуре 34 градусов по Цельсию). Каждая красная точка представляет собой коэффициент изменения (CV) средних уровней экспрессии транскрипта для одной стенограммы, анализированной между 28 отдельными червями (био резюме). Каждая синяя точка представляет собой резюме уровней экспрессии между тремя техническими репликациями, полученными от одного червя, в соответствии с анализом стенограммы (техническое резюме). Этот график показывает, что техническая изменчивость (между техническими репликациями) была намного ниже биологической изменчивости (между отдельными червями), предполагая, что нет необходимости выполнять технические репликации на нанофлюидном массиве экспрессии генов при анализе экспрессии генов у одиночных червей, подобно одноклеточнымисследованиям 14,15,28. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Таблица 1: План макета для многофункционального чипа. В таблице выше показан простой макет, который может быть использован при планировании запуска многослойного чипа. Слева находятся пространства, которые должны быть заполнены грунтовки целей, представляющих интерес и справа пространства, которые должны быть заполнены образцами интереса. Каждый анализ и выборка массива в паре номер-мудрый через чип. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: План макета для чипа с одним массивом. В таблице выше показан простой макет, который может быть использован при планировании запуска чипа с одним массивом. Слева находятся пространства, которые должны быть заполнены грунтовки целей, представляющих интерес и справа пространства, которые должны быть заполнены образцы интереса. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3: Список праймеров RT-qPCR, используемых в данном исследовании. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительная таблица 1: Праймеры из базы данных праймеров RT-qPCR. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
В этой статье, Червь к КТ протокол показан как быстрый и эффективный метод для извлечения РНК из одиночных червей или небольшой бассейн червей. Высокая пропускная способность, предлагаемая нанофлюидной системой, делает ее идеальной для количественной оценки межидеозных измерений изменчивости. Кроме того, высокая чувствительность этого метода позволяет обнаруживать гены, выраженные на низких уровнях, которые падают ниже обнаружения при использовании технологий РНК-сек9 одного червя.
При рассмотрении выбора метода подготовки кДНА от одиночных червей. Ly et al.29 оптимизировали протокол, который опирается на протеиназу K для пищеварения кутикулы. Кутикула является основным препятствием для изоляции молекул от червей и протеиназа K обеспечивает эффективный метод, чтобы сломать его. Тем не менее, протеиназа K должна быть тепловой инактивированной, чтобы иметь возможность использовать ферменты для обратной транскрипции. В то время как Ly et al. использовали 10-минутное воздействие 96 градусов по Цельсию, этого шага удалось избежать в этом протоколе, потому что РНК легко разлагается. Вместо того, чтобы использовать протеиназу K, для разрыва кутикулы использовались повторные циклы замораживания оттепели. Замораживание оттепели является эффективным методом, чтобы сломать кутикулу, потому что больше РНК может быть изолирована на червя. Ly et al. сообщают, что общая РНК, извлеченная на червя, составляет 35 нг с использованием протеиназы K, в то время как этот протокол получает 51,75 нг ± 6,74 SEM от общей РНК на червя. Избежание теплового воздействия в сочетании с шагами по предварительной упрощения, по-видимому, расширяет динамический диапазон обнаружения Worm-to-CT по сравнению со стандартными протоколами. Ly et al. сообщают абсолютные значения Ct 21.1 ± 0.15 для hsp-16.2 и 22.8 ± 0.17 для hsp-70 после теплового удара. Используя те же условия теплового удара (1 ч при температуре 30 градусов по Цельсию), этот протокол получает абсолютные значения Ct 17,93 ± 0,57 для hsp-16.2 и 21.13 ±0.33 для hsp-70. Это указывает на то, что метод лиза замораживания оттепели обеспечивает более высокие урожаи РНК и более подходит для низко выраженных стенограмм.
Нанофлюидные системы идеально подходят при расследовании данного набора целевых стенограмм и использовании либо меньшего (многослойного чипа), либо большего (однослойного чипа) количества образцов, позволяющих адаптироваться к масштабу эксперимента. Чтобы получить объективную картину всех стенограмм, выраженных в одном черве, очевидным выбором является использование РНК-секвенирования. Если, однако, в центре внимания эксперимента меньше, но все еще относительно большой набор целевых генов, это более экономически эффективным, чтобы использовать этот протокол, при условии, что исследователь имеет доступ к нанофлюиды ПЦР машины. Стоимость реагентов нанофлюидной системы и чипа с одним массивом оценивается примерно в 13 фунтов стерлингов за червя, в то время как затраты на реагенты для секвенирования одного червя соцдемов составить около 60 фунтов стерлингов за червя, не считая затрат на секвенирование.
При рассмотрении того, что ПЦР-платформа для использования, Червь к КТ метод в сочетании с нанофлюидной qPCR предлагает преимущества в отношении времени и пропускной способности. За примерно 2 дня работы можно получить 9216 результатов RT-qPCR, в то время как усиление такого же количества целей с помощью стандартной платформы qPCR займет около 5 рабочих недель с использованием анализа пластин 96 хорошо, запуская четыре пластины в день. Однако, если количество целей, которые будут протестированы меньше, то более экономически эффективным является использование Worm-to-CT в сочетании со стандартной машиной qPCR. Одно массивные чипы не могут быть повторно запущены, поэтому запуск пустых скважин снижает эффективность затрат.
Одним из ограничений метода является потенциальное образование грунтовки-праймеров димеров во время мультиплексирования, но это происходит менее чем в 1% случаев. Хотя протокол Worm-to-CT эффективен и обеспечивает надежные результаты при применении к одиночным червям, во время уборки около 5%, что, вероятно, соответствует случаям, когда червь остается в ловушке крышки или верхней части трубки.
В совокупности этот универсальный и надежный метод обеспечивает повышенную пропускную способность и чувствительность по сравнению с более стандартными методами. Этот метод может быть очень полезен для проверки высокой пропускной способности экранов и является отличным выбором для мониторинга или проверки уровня экспрессии генов одного червя. Этот метод может быть применен к другим сложным методам, таким как количественная экспрессия генов из изолированных тканей. Например, изоляция полных тканей, таких как кишечник, гонады или клетки, изолированные FACs, обеспечивает достаточно материала для выполнения экспериментов по секвенированию РНК. Однако ограниченное количество материала часто приводит к дублированию считывания, что исключает количественную оценку редких стенограмм. В этом сценарии использование технологии на основе нанофлюиды должно обеспечить дополнительную чувствительность к экспериментам и повысить эффективность затрат, если исследователям необходимо контролировать только подмножество всех транскриптов в этих тканях или клетках.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим Шарлин Мердок и учреждения Института Бэррахэма за их поддержку. JLP была поддержана Wellcome Trust (093970//10/) и OC поддерживается ERC 638426 и BBSRC «BBS/E/B000C0426».
Материалы
| Name | Company | Catalog Number | Comments |
| 100µM stock primers for genes of interest. | |||
| 20X DNA Binding Dye | Fluidigm | 100-7609 | for 96.96 chip (Single-Array Chip) |
| 2X Assay Loading Reagent | Fluidigm | 100-7611 | |
| 384 well plates | |||
| 8-strip PCR tubes | |||
| 96 well ice block | |||
| 96 well plates | |||
| 96.96 Dynamic Array IFC | Fluidigm | BMK-M-96.96 | Referenced throughout the manuscript as "Single-Array Chip" |
| 96-well sealing tape | |||
| BioMark & EP1 Software | Fluidigm | 101-6793 | Contains: Biomark HD Data Collection software, Real-Time PCR Analysis software, SNP Genotyping Analysis software, Digital PCR Analysis software, Melt Curve Analysis software |
| BioMark or BioMark HD system | Fluidigm | 100-2451 K1 | Referenced throughout the manuscript as "nanofluidics thermocycler" |
| Control Line Fluid Kit for 96.96 and FlexSix IFCs | Fluidigm | 89000021 | Referenced throughout manuscript as "control line fluid" |
| DNA Suspension buffer | TEKnova | T0021 | |
| domed PCR caps | |||
| Exonuclease I | New England BioLabs | M0293L | |
| Exonuclease I reaction buffer | New England BioLabs | B0293S | |
| FLEXsix DELTAgene Sample Reagent | Fluidigm | 100-7673 | referenced throughout manuscript as "sample reagent" |
| FLEXsix Gene Expression IFC | Fluidigm | 100-6308 | referenced throughout manuscript as "Multi-Array Chip" |
| Fluidigm Real-Time PCR Analysis User Guide | Fluidigm | 68000088 | This is the protocol used as a basis for section 2 of the protocol, referenced within the manuscript. |
| IFC Controller MX | Fluidigm | 68000112 I1 | Referenced throughout the manuscript as "nanofluidics PCR priming machine" |
| IFC Controllers SOFTWEAR | Fluidigm | 100-2297 | Contains all softwear and scripts required for running the IFC controller MX |
| liquid nitrogen in dewar | |||
| Microcentrifuge | StarLab | C1301B-230V | Used to spin down PCR tube strips in the protocol. |
| Nuclease Free Water | |||
| plate spinner | Labnet | K4050725 | mini plate spinner, mps 1000. referenced through the protocol as "tabletop plate spinner" |
| Power SYBR Green Cells-to-Ct kit | invitrogen | 4402955 | This kit is that which is adapted for use in nematodes in the Worm-to-CT protocol. Contense: Store Stop Solution, DNase I and 20X RT Enzyme Mix at -20°C. Store Lysis Solution, 2X SYBR RT Buffer (referenced throughout the manuscript as RT buffer), and Power SYBR®Green PCR Master Mix (refferenced througout the manuscript as PCR Master Mix). This Kit is for 400 reactions, kits also available for 40 and 100 reactions. |
| PreAmp Master Mix | Fluidigm | 100-5580, 100-5581 | |
| Reverse Transcription Master Mix—480 reactions | Fluidigm | 100-6299 | One tube also available for 96 reactions (PN100-6298) |
| Rnase Free water | |||
| SsoFast EvaGreen Supermix with Low ROX | Bio-Rad Laboratories | 172-5211 | referenced throughout the manuscript as "fluorescent probe supermix" |
| Standard 96 and 384-well Thermal Cycler | |||
| TE Buffer (10mM Tris, pH8.0, 1.0mM EDTA | TEKnova | T0224 | Referenced throughout the manuscript as Tris-EDTA buffer |
| ThermoMixer C | Eppendorf | 5382000031 | Referenced throughout the text as "thermal mixer" |
| Trizol | Thermo-Fisher | 15596026 | Referenced through the protocol as "guanidium thiocyanate-phenol-chloroform" |
| Warm water bath |
Ссылки
- Raj, A., Peskin, C. S., Tranchina, D., Vargas, D. Y., Tyagi, S. Stochastic mRNA Synthesis in Mammalian Cells. PLoS Biology. 4 (10), 309(2006).
- Semrau, S., van Oudenaarden, A. Study lineage decision-making in vitro: emerging concepts and novel tools. Annual Review of Cell Developmental Biology. 31, 317-345 (2015).
- Kelsey, G., Stegle, O., Reik, W. Single-cell epigenomics: Recording the past and predicting the future. Science. 358 (6359), 69-75 (2017).
- Eling, N., Morgan, M. D., Marioni, J. C. Challenges in measuring and understanding biological noise. Nature Review Genetics. 20 (9), 536-548 (2019).
- Kaufmann, B. B., van Oudenaarden, A. Stochastic gene expression: from single molecules to the proteome. Current Opinion in Genetics & Development. 17 (2), 107-112 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , Edited by The C. elegans Research Community (2015).
- Casanueva, M. O., Burga, A., Lehner, B. Fitness trade-offs and environmentally induced mutation buffering in isogenic C. elegans. Science. 335 (6064), 82-85 (2012).
- Raj, A., Rifkin, A. A., Andersen, E., van Oudenaarden, A. Variability in gene expression underlies incomplete penetrance. Nature. 463 (7283), 913-918 (2010).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Serra, L., et al. Adapting the Smart-seq2 Protocol for Robust Single Worm RNA-seq. Bio-protocol. 8 (4), 2729(2018).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Biology. 14 (8), 1007559(2018).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Stegle, O., Teichmann, S. A., Marioni, J. C. Computational and analytical challenges in single-cell transcriptomics. Nature Review Genetics. 16 (3), 133-145 (2015).
- Ståhlberg, A., Kubista, M. The workflow of single-cell expression profiling using quantitative real-time PCR. Expert Review of Molecular Diagnostics. 14 (3), 323-331 (2014).
- Livak, K. J., et al. Methods for qPCR gene expression profiling applied to 1440 lymphoblastoid single cells. Methods. 59 (1), 71-79 (2013).
- Fluidigm. Real-Time PCR Analysis User Guide. , https://www.fluidigm.com/binaries/content/documents/fluidigm/resources/real-time-pcr-analysis-ug-68000088/real-time-pcr-analysis-ug-68000088/fluidigm%3Afile (2018).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- U. S. National Library of Reference. Primer Blast. , Available from: https://www.ncbi.nlm.nih.gov/tools/primer-blast/ (2020).
- Bustin, S. A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. Journal of Molecular Endocrinology. 29 (1), 23-39 (2002).
- Nolan, T., Huggett, J., Sanchez, E. Good Practice guide for the application of quantitative PCR (qPCR), LGC. , (2013).
- Yuan, J. S., Reed, A., Chen, F., Stewart, C. N. Jr Statistical analysis of real-time PCR data. BMC Bioinformatics. 22 (7), 85(2006).
- He, F. Total RNA Extraction from C. elegans. Bio-protocol. Bio-101. 47, (2011).
- Hajdu-Cronin, Y. M., Chen, W. J., Sternberg, P. W. The L-Type Cyclin CYL-1 and the Heat-Shock-Factor HSF-1 Are Required for Heat-Shock-Induced Protein Expression in Caenorhabditis elegans. Genetics. 168 (8), 1937-1949 (2004).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Zhang, X., Zhang, Y. Dbl-1 a TGF-beta is essential for C. elegans aversive olfactory learning. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 17081-17086 (2012).
- Sørensen, J. B. The Use and Misuse of the Coefficient of Variation in Organizational Demography Research. Sociological Methods & Research. 30 (4), 475-491 (2002).
- Pujol, N. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Current Biology. 18 (7), 481-489 (2008).
- Brennecke, P., et al. Accounting for technical noise in single-cell RNA-seq experiments. Nature Methods. 10 (11), 1093-1095 (2013).
- Ly, K., Reid, S. J., Snell, R. J. Rapid RNA analysis of individual Caenorhabditis elegans. MethodsX. 7 (2), 59-63 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены