Method Article
Quantitative RT-PCR mit hohem Durchsatz in Einzel- und Bulk-C. elegans Proben mit Nanofluidic-Technologie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Artikel wird ein Hochdurchsatzprotokoll zur schnellen und zuverlässigen Bestimmung der Genexpressionsniveaus in einzelnen oder massenhaften C. elegans Proben beschrieben. Dieses Protokoll erfordert keine RNA-Isolierung und erzeugt cDNA direkt aus Proben. Es kann zusammen mit hochdurchsatzigen multiplexed nanofluidischen Echtzeit-qPCR-Plattformen verwendet werden.
Zusammenfassung
Dieses Papier stellt einen quantitativen PCR-Assay (RT-qPCR) mit hohem Durchsatz für Caenorhabditis elegans vor, der schnell, robust und hochsensibel ist. Dieses Protokoll erhält präzise Messungen der Genexpression von einzelnen Würmern oder massenhaften Proben. Das hier vorgestellte Protokoll bietet eine neuartige Anpassung bestehender Methoden zur komplementären DNA-Vorbereitung (cDNA) gekoppelt an eine nanofluidische RT-qPCR-Plattform. Der erste Teil dieses Protokolls mit dem Namen "Worm-to-CT" ermöglicht die cDNA-Produktion direkt aus Nematoden, ohne dass eine vorherige mRNA-Isolierung erforderlich ist. Es erhöht den experimentellen Durchsatz, indem es die Herstellung von cDNA aus 96 Würmern in 3,5 h ermöglicht. Der zweite Teil des Protokolls verwendet vorhandene nanofluidische Technologie, um RT-qPCR mit hohem Durchsatz auf der cDNA auszuführen. Dieses Papier bewertet zwei verschiedene nanofluidische Chips: die erste läuft 96 Proben und 96 Targets, was zu 9.216 Reaktionen in etwa 1,5 Tagen Bankarbeit führt. Der zweite Chiptyp besteht aus sechs 12 x 12 Arrays, was zu 864 Reaktionen führt. Hier wird die Worm-to-CT-Methode durch Quantifizierung des mRNA-Spiegels von Genen demonstriert, die Wärmeschockproteine aus einzelnen Würmern und massenhaften Proben kodieren. Zur Verfügung gestellt ist eine umfangreiche Liste von Primern, die entwickelt wurden, um verarbeitete RNA für die Mehrheit der kodierenden Gene innerhalb des C. elegans Genoms zu verstärken.
Einleitung
Die Optimierung der einzelligen RNA-Sequenzierung und qPCR ergab, dass Transkriptionsimpulse oder -bursts zu massiven Schwankungen in der Anzahl der RNA-Moleküle pro Zelle1führen können. Darüber hinaus deckten diese Technologien eine erhebliche zelluläre Heterogenität auf, die zuvor bei Standard-Massen-Transkriptomikmessungen übersehen wurde. Je nach Kontext wird eine gewisse singlezellige transkriptionelle Variabilität durch gemischte zelluläre Zusammensetzung von Geweben verursacht. Aber auch bei isogenen Zellpopulationen, die unter der gleichen Umgebung angebaut werden, gibt es eine weit verbreitete Transkriptionsheterogenität2,3. Diese "biologische Variabilität" wird zunehmend als allgegenwärtige Eigenschaft von Mobilfunknetzen identifiziert, von Bakterien bis zum Menschen. In einigen Fällen kann es phänotypische Folgen in der Entwicklung, Krebsprogression, HIV-Latenz und Reaktion auf Chemotherapie4,5haben.
Die Nematode Caenorhabditis elegans ist ein einzigartiger Modellorganismus mit idealen Eigenschaften für die Untersuchung der Ursachen und Folgen der biologischen Variabilität zwischen Individuen. Diese Nematoden sind ein einfacher Modellorganismus, der aus 959 Zellen besteht, und ihre transparente Nagelhaut macht sie für in vivo bildgebende Studien zugänglich6. C. elegans ist eine hermaphroditische Art, die sich überwiegend durch Selbstbefruchtung reproduziert; dies führte zu isogenen Laborstämmen. Trotz Isogenität und kontrollierten Kulturbedingungen sind viele Phänotypen und Transkripte individuell variabel, was darauf hindeutet, dass stochastische oder mikroökologische Unterschiede zur Heterogenität bei Individuen beitragen7,8. Eine solche Variabilität in der Genexpression hat mehrere Fitness-Folgen, einschließlich Variabilität in der Penetranz von Mutationen, Überleben, Entwicklungszeitpunkt, und Fecundity7,8,9. Aufgrund dieser Merkmale bieten Einzelwurmstudien die beispiellose Möglichkeit, biologische Variabilität in einem ganzen Organismus zu untersuchen.
Vor Ort besteht ein grundlegender Bedarf an der Entwicklung und Optimierung von Technologien zur genauen Erkennung von Transkripten auf einer Ebene mit einem einzigen Wurm. Neue Technologien wie die Sequenzierung von Einwurm-RNA10, die RNA-Sequenzierung aus isolierten Geweben11und die einzellige Sequenzierung12 sind jetzt für C. elegansverfügbar. Eine große Herausforderung bleibt jedoch: Bei der Überwachung der Interindividualität fallen schwach exprimierte Gene oft unter den nachweisbaren Niveau13. Dies ist besonders relevant für seltene Transkripte, die aus kleinen Mengen an Ausgangsmaterial isoliert sind, da es eine gut etablierte, umgekehrte Beziehung zwischen mittlerer Expression und technischer Varianz gibt, was häufig dazu führt, dass seltene Transkripte unter die statistischen Cutoffsfallen 13. Die Optimierung von multiplexed qPCR-Technologien mit hohem Durchsatz hat sich für einzelzellige Säugetierstudien als nützlich erwiesen, insbesondere bei der Untersuchung der Expression seltener Transkripte14,15. Diese Technologie kann auch für Benchmarking- und Validierungszwecke anderer Einzelschneckentechnologien verwendet werden.
Worm-to-CT ist eine schnelle, robuste Methode, die von einem Kit angepasst wird, das in zellbiologischen Studien zur Herstellung von CDNA-Präparationen mit einem Einzigen-Wurm verwendet wird. cDNA, die mit dieser Methode in Verbindung mit der multiplexierten nanofluidischen qPCR-Technologie gewonnen wurde, wurde ausgewählt, weil sie einen höheren experimentellen Durchsatz, einen breiteren dynamischen Erfassungsbereich bietet und für einzellige Zwecke14,15validiert wurde. Die beschriebene cDNA-Präparation ist auch für den Einsatz mit Standard-PCR-Technologien geeignet. Der Durchsatz wird auf zwei Arten erhöht: Erstens ist die cDNA-Präparation schneller und zuverlässiger als die herkömmliche Guanidium-Thiocyanat-Phenol-Chloroform-Extraktion, da Würmer direkt zum Lysepuffer hinzugefügt werden, wodurch die direkte Isolierung leicht abbaubarer RNA übersprungen wird. Zweitens erhöht die Verwendung nanofluidischer Technologien die Anzahl der Proben und Targets, die gleichzeitig ausgeführt werden können, erheblich. In diesem Papier werden zwei Chips verglichen: ein Single-Array-Chip und ein Multi-Array-Chip. Ein Single-Array-Chip kann 96 einzelne Würmer und 96 Primer-Sets ausführen, was zu 9.216 Reaktionen pro Experiment führt. Um einen ähnlichen Durchsatz mit Standard-qPCR-Technologien zu erreichen, wären 96 separate qPCR-Experimente mit 96 Well-Platten erforderlich. Der kleinere und flexiblere Multi-Array-Chip besteht aus sechs 12 x 12 Arrays, was zu 864 Reaktionen führt. Die überlegene Zuverlässigkeit und Empfindlichkeit der Methode wird durch die nanofluidische Technologie und die Einführung eines Vorverstärkungsschritts verstärkt. Die in diesem Beitrag vorgestellte Methode soll zusammen mit einem hochmodernen statistischen Algorithmus zur Extraktion biologischer Varianz verwendet werden. Dieser Artikel stellt das Protokoll für die schnelle cDNA-Vorbereitung und qPCR mit hohem Durchsatz für Einzel-Wurm- und Batch-Wurmproben vor. der Algorithmus wird an anderer Stelle veröffentlicht. Für dieses Protokoll sollte die Organisation der einzelnen Chips vor dem Experiment vorbereitet werden. Tabelle 1 und Tabelle 2 zeigen Beispiele für diese Pläne für einen Multi-Array- bzw. Single-Array-Chip. Es gibt auch Übersichten über das Worm-to-CT-Protokoll, das in Abbildung 1 beschrieben ist und die Multi-Array- und Single-Array-Chips in Abbildung 2ausführt.
Protokoll
HINWEIS: Während dieses Protokolls wird Caenorhabditis elegans als "Wurm" oder "Würmer" bezeichnet. Eine Vielzahl von C. elegans Stämmen kann über Online-Datenbanken oder durch direkte Kontaktaufnahme mit Labors bestellt werden, die den Modellorganismus verwenden. Teil I dieses Protokolls (Abschnitte 1-3) beschreibt die cDNA-Vorbereitung durch das Worm-to-CT-Protokoll. Teil II dieses Protokolls (Abschnitte 4-13) beschreibt den Betrieb von RT-qPCR mit hohem Durchsatz mit Nanofluidik, angepasst an ein von Fluidigm16entwickeltes Protokoll. Dieses Protokoll gilt für die Verwendung der beiden zuvor definierten Arten von nanofluidischen Chips, dem Single-Array-Chip, der 96 Targets in 96 Samples (9.216 RT-qPCR-Reaktionen insgesamt) überwachen kann, oder dem Multi-Array-Chip, der als Untereinheiten von 12 Ziel x 12 Proben fungiert. Jeder Multi-Array-Chip enthält sechs unabhängige Arrays, die zusammen oder separat ausgeführt werden können. Beispielsweise kann die Verwendung eines ganzen Multi-Array-Chips 72 Targets x 12 Samples (oder umgekehrt) oder 36 Ziele x 24 Samples (oder umgekehrt) überwachen. Weitere Informationen zu den in diesem Protokoll verwendeten Materialien finden Sie im Materialverzeichnis.
1. RT-qPCR Primer-Validierung
HINWEIS: Echtzeit-Primer wurden auf der Grundlage der empfohlenen Eigenschaften entwickelt, die ursprünglich von den MIQUE-Richtlinien17ausgegeben wurden. Um Primer spezifisch für verarbeitete RNA zu machen, wurden die Produkte so konzipiert, dass die beiden Primer an beide Seiten von mindestens einer Spleißkreuzung gebunden sind. Zu den Anforderungen an geeignete Primer gehörten ein Guanin- und Cytosingehalt von 20 % 80 %, eine Schmelztemperatur von 58 bis 60 °C, ein Unterschied in der Schmelztemperatur zwischen Primerpaaren von ≤0,5 °C und einer Produktlänge von 70–120 bp. Die Reihenfolge der erzeugten Primer finden Sie in Der Ergänzenden Tabelle 1. Open-Source-Code für die Skripte, die zum Generieren der Primer verwendet werden, finden Sie unter https://github.com/s-andrews/wormrtpcr. Primerpaare für Transkripte mit Spleißstellen wurden so konzipiert, dass sie in zwei Exons liegen, die ein Intron flankieren, aber nicht so konzipiert sind, dass sie spleißvariantespezifisch sind, mit der NCBI Primer Blast Software18. Für diese Studie wurden die Primer-Sets gegen das C. elegans Genom gesprengt, um auf jede Off-Target-Komplementarität zu testen.
- Primer aus der Datenbank der RT-qPCR-Primer abrufen (Ergänzende Tabelle 1). Alternativ können Sie qPCR Primer-Paare mit Online-Tools wie NCBI Primer Blast18entwerfen.
- Führen Sie eine qPCR-Standardkurve durch, um die Spezifität und PCR-Effizienz für jedes Primerpaar mit Standard-Massen-qPCR-Techniken19 und nach den MIQUE-Richtlinien17,20zu überwachen.
HINWEIS: Es sollten nur Primerpaare mit R2 > 0,98 und PCR-Effizienz zwischen 85 % und 115 % verwendet werden. Die Reihenfolge, die PCR-Effizienz und R2 für die in dieser Studie verwendeten Primer sind in Tabelle 3aufgeführt.
2. Wurmlyse durch Wurm-zu-CT
- Wählen Sie die Würmer von ihrem bakteriellen Rasen auf eine frische, ungesättigte NGM-Platte und lassen Sie die Würmer sich 5 min lang um die Platte bewegen, um die meisten Bakterien durch ihre Bewegung aus dem Wurm zu entfernen.
HINWEIS: Der bakterielle Rasen und die Wachstumsbedingungen unterscheiden sich je nach Versuchsdesign. Die hier vorgestellten Experimente erfordern 6 cm NGM-Platten, die mit OP50 Escherichia coli gesät sind, mit Würmern von Interesse, die in einem 20 °C-Inkubator auf Stufe L4.9 angebaut werden. - In einer RNase-freien Haube können Sie einen Master-Mix vorbereiten, der aus 12,5 l 2x RT-Puffer, 1,25 l 20x RT-Enzympuffer und 0,25 l nukleasefreiem Wasser pro Probe besteht. Fügen Sie 14 L Master-Mix zu 11 l jeder Probe ab Schritt 2.8 hinzu.
- Legen Sie den Deckel eines PCR-Streifens kopfüber auf die Plattform des Sezierens, und fügen Sie 10 L des Lyse-Mixes unter einem zusammengesetzten Mikroskop zu gewölbten PCR-Rohrkappen hinzu.
HINWEIS: Bei nur einer oder zwei Proben ist es besser, einen PCR-Streifen mit mindestens vier Rohren zu verwenden, da dies das Risiko verringert, dass die Kappen in den nachfolgenden Freeze-Tau-Schritten geöffnet werden. Alternativ können Gummibänder verwendet werden, um die Kappen an Ort und Stelle zu halten. In diesem Fall stellen Sie sicher, dass die Kappen bei jeder Übertragung der Rohre ordnungsgemäß geschlossen werden. - Wählen Sie die Würmer von der Platte in jeden Schlitz des Deckels, der die Lysemischung enthält, indem Sie sie "schaufeln" (d. h. die Würmer darunter mit dem Pick fangen), um eine bakterielle Kontamination zu vermeiden. Schließen Sie die Rohre und drehen Sie sie für 5 s mit einer Tischplatte Mikrozentrifuge (Tabelle der Materialien) bevor Sie sie in einem Dewar-Kolben mit flüssigem Stickstoff gefüllt.
HINWEIS: Zwischen 15 und 30 Würmer sollten für Massenexperimente und 1 Wurm für Einzelschneckenmessungen verwendet werden.
VORSICHT: Beim Umgang mit flüssigem Stickstoff tragen Cryo-Handschuhe sowie Schutzbrillen und halten sich an die üblichen Bekleidungsvorschriften, da der Kontakt mit der Haut oder den Augen schwere Erfrierungsverletzungen verursachen kann. - Die PCR-Rohre 10x einfrieren, indem man sie zwischen flüssigem Stickstoff und einem Wasserbad von 40 °C überträgt. Lassen Sie die Rohre im flüssigen Stickstoff für mindestens 5 s, um sicherzustellen, dass die Proben vollständig gefroren sind. Lassen Sie die Schläuche im Wasserbad, bis die Proben auftauen. Lassen Sie nicht für einen längeren Zeitraum in, da dies zu RNA-Abbau führt.
HINWEIS: Rohre können über einen längeren Zeitraum in flüssigem Stickstoff gelassen werden, da Proben auf ca. -200 °C eingefroren werden, wodurch der RNA-Abbau reduziert wird. Dies sollte jedoch kein Protokollstopppunkt sein, da flüssiger Stickstoff schnell verdunstet. - Mischen Sie die Proben auf einem thermischen Mischer (Tabelle der Materialien) auf 4 °C für 20 bis 30 min Rotieren bei 1.800 Umdrehungen pro Minute eingestellt.
- Während die Proben gemischt werden, tauen Sie die Stop-Lösung auf Eis auf.
- Drehen Sie die Proben mit einer Tisch-Mikrozentrifuge (Materialtabelle) nach unten und fügen Sie jedem Rohr 1 L Stop-Lösung hinzu.
HINWEIS: Die Proben können bis zu 1 Woche bei -80 °C gelassen werden, bevor die RNA umgekehrt transkribiert wird (Abschnitt 3).
3. Umgekehrte Transkription
ANMERKUNG: Für die umgekehrte Transkription einzelner Würmer wurden die hier gezeigten Ergebnisse mit den mit den nanofluidischen Chips gelieferten Reagenzien erzeugt (Option 2 in Abbildung 1). Die in Option 2 der Abbildung 1 hervorgehobenen Reagenzien wurden auch für die umgekehrte Transkription von gepoolten Proben verwendet. Beide Methoden funktionieren austauschbar für die verschiedenen Beispieltypen.
- Umgekehrte Transkription einzelner Würmer
- In einer RNase-freien Haube, fügen Sie 1,25 l Reverse-Transkriptions-Mix (Tabelle der Materialien) zu einem frischen PCR-Rohr.
HINWEIS: Eine 96 Well PCR Platte und eine automatische Pipette können verwendet werden, wenn es viele Proben gibt. Das Protokoll des Herstellers besagt, dass pro Probe 1 L verwendet werden kann. - Nehmen Sie 5 l der Lyse-Lösung und stoppen Sie die Lösungsmischung aus Schritt 2.8 und fügen Sie sie dem frischen PCR-Rohr hinzu, das den umgekehrten Transkriptionsmix enthält.
HINWEIS: Das Protokoll des Herstellers besagt, dass pro Reaktion 1 l RNA (2,5 pg/l–250 ng/l) verwendet werden kann. Eine negative RT-Steuerung pro Platte kann hinzugefügt werden, indem der Reverse-Transkriptionsmix durch 5 l Lysed-Probe und 1,25 l RNAse-freies Wasser ersetzt wird. - Führen Sie die Proben mit dem folgenden Reverse-Transkriptionsprogramm auf einem Thermocycler: 25 °C für 5 min, 42 °C für 30 min, 85 °C für 5 min und 4 °C für ∞.
HINWEIS: Die hergestellte cDNA kann bei -20 °C gelagert werden, bevor die Amplifikation und Datenerfassung mit qPCR mit hohem Durchsatz fortgesetzt wird.
- In einer RNase-freien Haube, fügen Sie 1,25 l Reverse-Transkriptions-Mix (Tabelle der Materialien) zu einem frischen PCR-Rohr.
- Reverse Transkription für Massenproben (15 bis 30 Würmer)
- In einer RNase-freien Haube können Sie einen Master-Mix vorbereiten, der aus 12,5 l 2x RT-Puffer, 1,25 l 20x RT-Enzympuffer und 0,25 l nukleasefreiem Wasser pro Probe besteht. Fügen Sie 14 L Master-Mix zu 11 L Lyse-Lösung und Stop-Lösung-Mix von Schritt 2.8.
HINWEIS: Bei einer großen Anzahl von Proben kann dies in 96 Brunnenplatten durchgeführt werden. - Führen Sie die Proben durch einen Thermocycler mit dem folgenden Reverse-Transkriptionsprogramm: 37 °C für 60 min, 95 °C für 5 min und 4 °C für ∞.
- Die produzierte cDNA 1:4 in nukleasefreiem Wasser verdünnen.
ANMERKUNG: Im Allgemeinen haben die Produkte ein Endvolumen von 25 l, in diesem Fall sollten 75 l zugegeben werden. Aufgrund von Kondensation kann das Endvolumen jedoch variieren. Passen Sie sich daher entsprechend an, um in der ein Verhältnis von 1:4 zu erzielen. Dieser Verdünnungsschritt gilt nicht, wenn qPCR für einzelne Würmer ausgeführt wird. Die hergestellte cDNA kann bei -20 °C gelagert werden, bevor die Amplifikation und Datenerfassung mit qPCR mit hohem Durchsatz fortgesetzt wird.
- In einer RNase-freien Haube können Sie einen Master-Mix vorbereiten, der aus 12,5 l 2x RT-Puffer, 1,25 l 20x RT-Enzympuffer und 0,25 l nukleasefreiem Wasser pro Probe besteht. Fügen Sie 14 L Master-Mix zu 11 L Lyse-Lösung und Stop-Lösung-Mix von Schritt 2.8.
4. Vorbereiten des Multiplex-Primer-Mix
- Bereiten Sie einen Vorwärts-/Rückwärtsgrundlager (F/R) für jedes Paar Primer bei einer Endkonzentration von 50 m vor. Mischen Sie das gleiche Volumen an Vorwärts- und Rückwärtsgrundierungen bei jeweils 100 M.
- Kombinieren Sie für jedes zu prüfende Primerpaar 1 L von 50 °C F/R Grundierung. Fügen Sie den DNA-Suspensionspuffer bis zu einem Gesamtvolumen von 100 l hinzu.
HINWEIS: Die Lagergrundkonzentrationen unterscheiden sich hier von den im Herstellerprotokoll16 beschriebenen Konzentrationen, behalten jedoch die gleiche Endkonzentration von 500 nM bei.
5. Gezielte vorverstärkte Vorverstärkung
- Bereiten Sie einen Master-Mix vor, der 1 ,L Vorverstärkungs-Mastermix (Materialtabelle),0,5 l des gepoolten Primermixes (Schritt 4.2) und 2,25 l Nukleasefreies Wasser pro Reaktion mit einem Gesamtüberschussvolumen von 10 % enthält.
- In einer 96-Well-Platte, aliquot 3,75 l des Master-Mix in so viele Brunnen, wie für die Anzahl der Proben ausgeführt werden muss.
- Fügen Sie 1,25 L der cDNA-Lösungen hinzu, die in Schritt 3.1.3 oder 3.2.3 zu jedem Brunnen generiert wurden.
- Bedecken Sie die Platte mit 96 Well-Dichtungsband, kurz Wirbel und Zentrifuge mit einem Tischplatte Spinner. Auf einen Thermocycler übertragen und folgendes Programm ausführen: 95 °C für 2 min, 15 Denaturierungszyklen bei 95 °C für 15 s, Glühen/Verlängerung bei 60 °C für 4 min und 4 °C für ∞.
HINWEIS: Der Hersteller empfiehlt von 10 bis 20 Zyklen für die Vorverstärkungsreaktion16. Dieses Protokoll empfiehlt 10 oder 15 Zyklen, abhängig von den Expressionsniveaus der Zielgene.
6. Exonuklease I Behandlung
HINWEIS: Dadurch sollen grundierte, die nicht inkorporierte Grundierungen aus der Vorverstärkung entfernt werden.
- Bereiten Sie eine Exonuklease-I-Mischung vor, die 0,2 l Exonuklease-I-Reaktionspuffer (Materialtabelle),0,4 l Exonuklease I bei 20 U/L(Materialtabelle)und 1,4 l Nuklease-freies Wasser pro Probe enthält. Halten Sie alle Reagenzien auf Eis, vor allem die Exonuklease I.
- Entfernen Sie die 96-Wellplatte (Schritt 5.4) aus dem Thermocycler, Zentrifuge mit dem Tischplattenspinner, und entfernen Sie vorsichtig die Dichtung. Fügen Sie jeder Vorverstärkungsreaktion 2 l des Exonukleases hinzu. Reseal, Zentrifuge und legen Sie die 96 WellPlatte wieder in den Thermocycler mit dem folgenden Programm: 37 °C für 30 min, 80 °C für 15 min und 4 °C für ∞.
- Nehmen Sie die Proben aus dem Thermocycler und verdünnen Sie sie 1:5, indem Sie 18 l 1x Tris EDTA Puffer (Tabelle der Materialien) hinzufügen.
HINWEIS: Es ist möglich, die cDNA-Proben für die spätere Verwendung bei -20 °C zu halten. Das Herstellerprotokoll schlägt mögliche Verdünnungen von 5x, 10x oder 20x in dieser Phase16vor, abhängig von der Ausdrucksebene der Interessenziele.
7. Vorbereitung der Assay-Mischungen
HINWEIS: Assay-Mischungen können in 384 Brunnenplatten hergestellt werden, da die Brunnen den gleichen Abstand wie die nanofluidischen Chips haben, was das Laden erleichtert.
- Vorbereiten von Assay-Mischungen für einen Multi-Array-Chip
- Bereiten Sie für jeden Brunnen gemäß dem vorbereiteten Plan einen Master-Mix vor, der aus 2 l 2x 2x Assay-Ladereagenz (Materialtabelle) und 1,6 l DNA-Suspensionspuffer(Materialtabelle) besteht. Aliquot 3,6 l dieser Master-Mischung pro Gut in eine 384-Well-Platte.
- Fügen Sie 0,4 l des in Schritt 4.1 vorbereiteten 50-M-F/R-Primerbestands gemäß dem vorbereiteten Plan in die entsprechenden Bohrungen ein.
ANMERKUNG: Dies ergibt eine Gesamtmenge von 4 l Assay-Mix pro Bohrung, mit einem Überschuss von 1 l.
- Vorbereiten von Assay-Mischungen für einen Single-Array-Chip
- Bereiten Sie für jeden Brunnen gemäß dem vorbereiteten Plan einen Master-Mix vor, der aus 3 l 2x 2x Assay-Ladereagenz und 2,4 l DNA-Suspensionspuffer besteht. Aliquot 5,4 l dieser Master-Mischung pro Gut in eine markierte 384-Well-Platte.
- Fügen Sie den entsprechenden Bohrgutgemäßen nach dem vorbereiteten Plan 0,6 l des 50-Mm-F/R-Primer-Lagers hinzu.
ANMERKUNG: Dies ergibt eine Gesamtmenge von 6 l Assay-Mix pro Bohrung, mit einem Überschuss von 1 l.
8. Vorbereitung der Probenmischungen
HINWEIS: Probenmischungen können bis zu 1 Tag im Voraus zubereitet und bei 4 °C gelagert werden.
- Vorbereiten von Proben für einen Multi-Array-Chip
- Bereiten Sie einen Probenstammmix vor, der aus 2 l 2x Fluoreszenz-Sonden-Supermix mit niedrigem ROX (Materialtabelle) und 0,2 l Probenreagenz (Materialtabelle) pro Probe besteht. Geben Sie 2,2 l dieser Mischung in die markierte 384-Well-Platte.
HINWEIS: Der Hersteller empfiehlt, das Probenreagenz16nicht zu verwirbeln. - Pipette 1,8 l jeder vorverstärkten Exonuklease behandelte ich Probe von Schritt 3.2.3 in die entsprechenden Brunnen nach dem vorbereiteten Plan.
ANMERKUNG: Dies ergibt insgesamt 4 l, mit einem Überschuss von 1 l.
- Bereiten Sie einen Probenstammmix vor, der aus 2 l 2x Fluoreszenz-Sonden-Supermix mit niedrigem ROX (Materialtabelle) und 0,2 l Probenreagenz (Materialtabelle) pro Probe besteht. Geben Sie 2,2 l dieser Mischung in die markierte 384-Well-Platte.
- Vorbereiten von Proben für einen Single-Array-Chip
- Bereiten Sie einen Proben-Master-Mix vor, der aus 3 l 2x Fluoreszenz-Sonden-Supermix mit niedrigem ROX (Materialtabelle) und 0,3 l 20x DNA-bindendem Farbstoff-Proben-Ladereage (Materialtabelle) pro Probe besteht. Geben Sie 3,3 l dieser Mischung in die markierte 384-Well-Platte.
- Pipette 2,7 l jeder vorverstärkten und Exonuklease behandelte Ich Probe von Schritt 6.3 in die entsprechenden Brunnen nach dem vorbereiteten Plan.
ANMERKUNG: Dies ergibt insgesamt 6 l, mit einem Überschuss von 1 l. Wenn es Brunnen gibt, die ohne Probe betrieben werden sollen, müssen diese mit Sample Master Mix und 2,7 l Wasser anstelle von cDNA geladen werden. Dies wird für beide Chiptypen empfohlen. Die Maschine benötigt niedrige ROX in jedem Einlass, um das Raster des Chips zu erkennen.
9. Grundierung des nanofluidischen Chips
HINWEIS: Ein Multi-Array-Chip muss nur beim ersten Durchlauf grundiert werden. Wenn es nachfolgende Durchläufe desselben Chips gibt, kann diese Phase übersprungen werden. Diese Schritte sind für beide Chiptypen identisch.
- Injizieren Sie langsam und vorsichtig die vollen 150 l der Steuerleitungsflüssigkeit aus den mitgelieferten Spritzen in die Akkumulatoren des Chips. Stellen Sie sicher, dass keine Steuerflüssigkeit den Chip berührt, indem Sie den Chip in einem 45°-Winkel halten und die Spitze der Spritze weghalten, um verschütten zu können.
- Entfernen Sie den blauen Schutzfilm von der Unterseite des Chips.
- Legen Sie den Chip in die Nanofluidics PCR-Grundiermaschine (Tabelle der Materialien), mit dem Barcode nach außen gerichtet. Führen Sie das 'Prime (153x)' Skript aus, das 15–20 min dauert.
HINWEIS: Schalten Sie den Nanofluidics Thermocycler (Tabelle der Materialien) in diesem Stadium ein, da die Kamera etwa 10 min braucht, um auf unter 0 °C abzukühlen.
10. Laden des nanofluidischen Chips
- Entfernen Sie die Barrierestecker sequenziell, wenn das Laden erfolgt. Dies verringert die Wahrscheinlichkeit, dass Brunnen falsch belastet werden.
- Übertragen Sie entweder 3 l für einen Multi-Array-Chip oder 5 l für einen Single-Array-Chip jeder Primer-Assay-Mischung und Probenmischungen gemäß dem vorbereiteten Plan auf die entsprechenden Einlässe des nanofluidischen Chips. Stellen Sie sicher, dass keine Blasen eingeführt werden, was dazu führen kann, dass das übertragene Gesamtvolumen kleiner als gewünscht ist.
HINWEIS: Wenn es Brunnen gibt, die ohne Primer laufen, ist es wichtig, dass diese mit Master-Mix geladen werden, das Primervolumen durch Wasser ersetzen. Dies gilt für beide Chiptypen. In diesem Stadium kann es einfacher sein, den Chip auf einer dunklen Oberfläche zu platzieren, wodurch die Brunnen leichter zu sehen sind.
11. Betrieb des nanofluidischen Chips
HINWEIS: Beim ersten Ausführen eines Multi-Array-Chips richten Sie die Tracking-Datei ein, indem Sie Tools | Flex Six Usage Tracking, klicken Sie auf Neu, geben Sie einen Dateinamen ein, und wählen Sie einen Speicherort aus, bevor Sie auf Fertigklicken.
- Öffnen Sie die Datenerfassungssoftware. Klicken Sie auf Neue Ausführung starten. Legen Sie den geladenen Chip in den Nanofluidics Thermocycler mit dem Barcode nach außen gerichtet.
- Wählen Sie ggf. die Projekteinstellung aus, und klicken Sie dann auf Weiter | Laden. Wenn Sie einen Multi-Array-Chip laden, wählen Sie die Partitionen (Arrays) aus, die ausgeführt werden sollen.
- Wählen Sie die Anwendungsreferenzsondenaus , ändern Sie dann den Anwendungstyp in Gene Expression, und ändern Sie den passiven Verweis in ROX. Wählen Sie den Einzelprüfpunkt aus, ändern Sie den Prüfpunkttyp in Eva Green, und klicken Sie auf Weiter.
- Wählen Sie das Thermozyklusprotokoll GE FLEX six Fast PCR+Melt v1 zum Ausführen eines Multi-Array-Chips oder das Protokoll GE 96.96 Fast PCR+Melt v2 zum Ausführen eines Single-Array-Chips.
- Vergewissern Sie sich, dass die automatische Belichtung ausgewählt ist, und klicken Sie auf Ausführen starten.
12. Post-Chip-Run
HINWEIS: Dieser Abschnitt ist nur für Multi-Array-Chips erforderlich, wenn nicht der gesamte Chip verwendet wird.
- Nehmen Sie den Chip aus dem Nanofluidics Thermocycler und laden Sie in die Nanofluidics PCR Grundiermaschine und führen Sie die Post Run (153x) Skript, die 5 min dauert.
- Beschriften Sie die Stecker, die als persönliche Referenz verwendet werden.
HINWEIS: Der Chip kann nun bei Raumtemperatur gelagert werden und die restlichen Arrays auf dem Chip können innerhalb von 2 Monaten ausgeführt werden.
13. Datenbereinigung und -analyse
- Öffnen Sie die Daten in der Software 'Real-Time PCR Analysis' (Tabelle der Materialien). Überprüfen Sie die Schmelzspitzentemperatur für jedes getestete Primerpaar. Eliminieren Sie Ergebnisse mit mehr als einer Schmelztemperaturspitze für ein bestimmtes Primerpaar.
HINWEIS: Mehrere Spitzen treten nur gelegentlich auf, vermutlich wenn Primerpaare Dimer bilden, oder aus Interaktionen von Zielprimern mit anderen Primern im gepoolten Primer-Mix. - Exportieren Sie die Daten als "Heatmap"-Tabellendatei und eliminieren Sie fehlerhafte Stichproben oder Primer.
- Analysieren Sie Daten mit der Delta-Ct-Standardmethode21. Führen Sie für die statistische Auswertung eine einseitige ANOVA auf relativen Ausdrucksebenen durch.
Ergebnisse
Validierung von Worm-to-CT als cDNA-Vorbereitungsmethode
Um zu testen, ob das Worm-to-CT-Protokoll eine gültige cDNA-Extraktionsmethode ist, wurde es mit Standard-Guanidium-Thiocyanat-Phenol-Chloroform-Extraktionsmethoden verglichen. Die Ergebnisse sind in Abbildung 3dargestellt, in der cDNA aus durchschnittlich 1.000 Würmern mit Standard-Guanidium-Thiocyanat-Phenol-Chloroform-Extraktionstechniken22 und von 30 Würmern mit der Worm-to-CT-Methode hergestellt wurde. Die Proben wurden gleichzeitig hitzegeschockt (30 min bei 34 °C). Weltweit waren hsp-70 mRNA-Expressionsniveaus pro 100 ng der gesamten RNA mit beiden Methoden vergleichbar. Bei der höchsten hsp-70-Expression (d. h. in N2 nach Hitzeschock) waren die Expressionswerte jedoch mit der Worm-to-CT-Methode höher, was auf eine verbesserte Empfindlichkeit hindeutet.
Um festzustellen, ob eine erwartete Abnahme der hsp-Expression in hsf-1(sy441)23, eine Mutation im Haupttranskriptionsregulator der molekularen Chaperone23,24, reproduziert werden konnte, wurde transkriptionelle Chaperoninduktion nach einem kurzen Hitzeschock verglichen. Mit beiden Methoden wurde bei hsf-1(sy441) Tieren eine Abnahme der hsp-70-Induktion festgestellt. Dies wurde erwartet, da mutierte hsf-1(sy441) Tiere eine verminderte Fähigkeit aufweisen, Chaperones aufgrund einer Kürzung in der Transaktivierungsdomäne von HSF-1 zu induzieren. Bei Guanidium Thiocyanat-Phenol-Chloroform-Extraktion verringerte sich hsp70 im Vergleich zu Kontrollen um 82,7 % und bei Wurm-zu-CT um 92,3 % im Vergleich zu Wildtieren(Abbildung 3). Die Ergebnisse waren vergleichbar zwischen beiden Methoden und vergleichbar mit früheren Berichten23. Diese Ergebnisse deuten darauf hin, dass die Worm-to-CT-Methode eine gültige Alternative zu Standard-cDNA-Synthesetechniken ist.
Validierung der Nanofluidics PCR-Plattform zur Verstärkung von mRNA-Zielen
Um die Konsistenz der Ergebnisse mit nanofluidischer qPCR für die Transkriptverstärkung zu testen, wurden die PCR-Ergebnisse aus der Worm-to-CT-Massenmethode sowohl auf einem Standard-qPCR-System(Materialtabelle)als auch auf einem nanofluidischen qPCR-System mit einem Multi-Array-Chip verglichen. Die Faltenveränderung in der Expression von drei verschiedenen Genen, sma-3 (Abbildung 4A), sma-10 (Abbildung 4B) und dnj-26, wurde bei Tieren, die ein Nullallel in dbl-1 (dbl-1(nk3))25 im Vergleich zu wilden Typ-Gegenstücken tragen, überwacht (Abbildung 4C). Dbl-1 kodiert den alleinigen Liganden des Bone Morphogenetic Protein (BMP) Signalwegs. sma-3 und sma-10 sind Gene, die SMAD-Orthologe kodieren, Schlüsselkomponenten der BMP-Signalkaskade. Dnj-26 kodiert ein molekulares Chaperon, ein Ziel der BMP-Signalisierung. Diese Ergebnisse zeigen wenig bis keinen Unterschied in der Faltänderung, die die Ergebnisse der beiden Methoden vergleicht, was zu nicht signifikanten P-Werten bei 0,3113, 0,2635 und 0,3481 für sma-3, sma-10bzw. dnj-26führt. Insgesamt zeigen diese Ergebnisse, dass die Auf bulk-to-CT-Methode angewendete Worm-to-CT-Methode eine effiziente und schnelle Möglichkeit ist, RNA aus wenigen Würmern zu extrahieren, und liefert zuverlässige Daten, wenn sie entweder mit Standard-PCR-Systemen oder nanofluidischen Hochdurchsatz-Plattformen auf Basis von Nanofluidik gekoppelt sind.
Vergleich der Expressionswerte, die durch Massenproben ermittelt werden, mit Durchschnittswerten aus einzelnen Würmern
Die relativen Expressionswerte wurden entweder anhand von cDNA berechnet, die aus Massenproben (25 Würmer) gewonnen wurde, oder anhand eines Durchschnitts von 36 Einzelschneckenproben (Abbildung 5). Beide cDNAs wurden mit der Worm-to-CT-Methode erhalten und mit der Nanofluidics PCR-Technologie verstärkt. Wie in Abbildung 5A-Cbeobachtet, wurden bei allen getesteten Chaperones (d. hsp16.1, F44E5.4, hsp-70) vergleichbare Expressionsniveaus festgestellt. Diese Ergebnisse deuten darauf hin, dass Parameter, die von einzelnen Würmern erhalten werden, zuverlässig sind.
Anwendung von Worm-to-CT gekoppelt an Nanofluidics-Technologie zur Schätzung von Parametern für die Genexpression von Einschneckengenen
Da der Single-Array-Chip die Überwachung von bis zu 96 Zieltranskripten auf 96 Einzelproben ermöglicht, ist er daher gut geeignet, um die individuelle Variabilität der Transkriptexpression zwischen einzelnen Würmern zu überwachen. Abbildung 6A zeigt ein repräsentatives Ergebnis, das den mittleren Ausdruck mehrerer hsp-Transkripte von einzelnen Würmern nach einem kurzen Hitzeschock zeigt. Wie in der Abbildung beobachtet, unterschied sich die Variabilität in der Expression von Transkripten dramatisch zwischen den verschiedenen Genen(Abbildung 6A). Um weitere Erkenntnisse zu gewinnen, wurde der Variationskoeffizient (CV) berechnet, indem die Standardabweichung durch den Mittelwert der Expressionsstufen26 dividiert wurde (Abbildung 6B). Drei Gene, deren CV-Werte zuvor mit alternativen Methoden geschätzt wurden, wurden überwacht (unveröffentlichte Daten). Zwei stabile Transkripte (ife-1 und Y45F10D.4) und eine Variable (nlp-2927) zeigten ihre erwartete Variabilität. Das Diagramm zeigt auch deutlich die bekannte umgekehrte Beziehung zwischen Variabilitätswerten und Expressionsstufen26 (Abbildung 6B).
Technische Replikationen sind von größter Bedeutung, um die Reproduzierbarkeit bei der Verwendung von Massenproben zu gewährleisten. Dies gilt jedoch nicht unbedingt für einzellige Experimente14,15,28. Um festzustellen, ob die Verwendung technischer Replikationen für die Parameterabschätzung bei verwendung von Einzelschneckenproben erforderlich ist, wurden 28 einzelne Würmer nach einem kurzen Hitzeschock geerntet und mit technischen Triplicaten verarbeitet. Die CV-Werte, die aus Dreiwurmdaten berechnet wurden ( blaue Punkte in Abbildung 7, technischer Lebenslauf) im Vergleich zu den Werten für jedes Transkript, das aus einzelnen Würmern gewonnen wurde (rote Punkte in Abbildung 7, biologische Variabilität), wurden verglichen. Für jedes getestete Transkript waren die technischen Lebensläufe niedriger als die biologischen Lebensläufe, was darauf hindeutet, dass technische Triplizen für die Parameterabschätzung nicht erforderlich waren. Die Tatsache, dass technische Repliken nicht erforderlich sind, erhöht den Durchsatz des Experiments, ohne die Qualität zu beeinträchtigen.

Abbildung 1: Übersicht über das Worm-to-CT-Protokoll.
Diese Abbildung zeigt einen kurzen Überblick über die verschiedenen Schritte, die zum Ausführen von Würmern durch das Worm-to-CT-Protokoll erforderlich sind. Für den Umgekehrten Transkriptionsschritt werden zwei optionale Methoden angezeigt. Dies sind austauschbare Methoden für beide Chiptypen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Überblick über die Vorbereitung und den Betrieb von nanofluidischem qPCR.
Diese Abbildung zeigt Vorbereitungen für den Betrieb des nanofluidischen qPCR-Systems mit einem Multi-Array-Chip und einem Single-Array-Chip. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
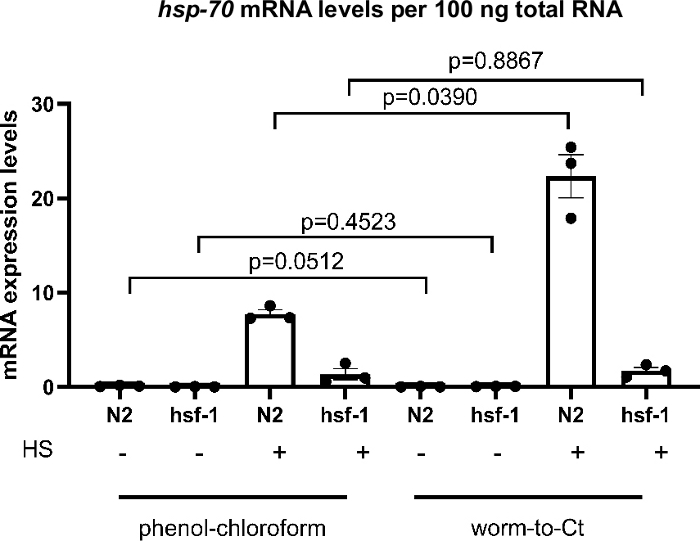
Abbildung 3: Das Worm-to-CT-Protokoll auf Massenproben lieferte zuverlässige Ergebnisse.
Vergleich des Worm-to-CT-Protokolls mit der regulären Guanidium-Thiocyanat-Phenol-Chloroform-Extraktion22 auf Massenproben. In Übereinstimmung mit früheren Befunden verringerten sich bei hsf-1(sy441) Mutanten23die Konzentrationen von hsp-Transkripten als Reaktion auf Hitzeschock. Die obigen Histogramme zeigen die Induktion von hsp-70 in Abwesenheit von (-) oder nach (+) einem kurzen Hitzeschock von 30 min bei 34 °C. Die cDNA wurde mit Guanidium-Thiocyanat-Phenol-Chloroform-Extraktion auf 1.000 Würmer (links) oder mit der Worm-to-CT-Methode auf 30 gepoolte Würmer (rechts) angewendet. Die Expressionswerte von hsp-70 pro 100 ng der gesamten RNA, die mit jeder Methode erhalten wurden, wurden verglichen. Wie erwartet, ging bei hsf-1(sy441) die transkriptionelle Induktion von hsp-70 als Reaktion auf Hitzeschock signifikant um 82,7 % mit Guanidiumthiocyanat-Phenol-Chloroform und um 92,3 % mit der Worm-to-CT-Methode zurück. Die mRNA-Spiegel von Zielgenen wurden gegen den Durchschnitt der drei Haushaltsgene cdc-42, pmp-3und ire-1normalisiert. Jeder Punkt stellt eine biologische Replikation dar. Die Daten wurden für statistische Analysen protokolliert, da sie nicht den für die parametrische Analyse erforderlichen Konventionen entsprachen. Die statistische Analyse wurde mit einer RM-One-way ANOVA mit Sidaks Mehrfachvergleichstest durchgeführt. Wildtyp = N2, hsf-1 = hsf-1(sy441). Balken bezeichnen den Standardfehler des Mittelwerts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
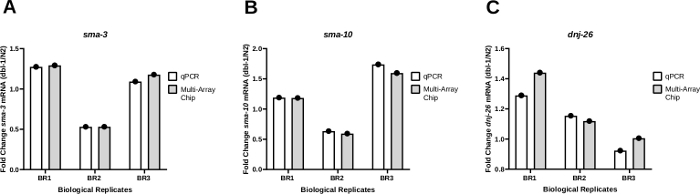
Abbildung 4: Die Expressionsmuster waren zwischen Standard-qPCR- und nanofluidischen qPCR-Systemen konsistent.
(A) Der Expressionsgrad von sma-3 (A), sma-10 (B) oder dnj-26 (C) mRNA wurde durch regelmäßige qPCR und nanofluidische qPCR (Multi-Array-Chip) aus drei biologischen Replikationen von cDNA bestimmt, die durch Wurm-zu-CT aus dem Wildtypstamm (N2) und dem dbl-1(nk3) Knockout-Stamm25erzeugt wurden. Relative mRNA-Expressionsniveaus wurden für jeden Stamm mit der Delta-Ct-Methode21bestimmt. Die Faltenveränderung wurde dann bestimmt, indem die in dbl-1(nk3)-Würmern erhaltenen Expressionsniveaus durch die entsprechenden mRNA-Werte im N2-Stamm dividiert wurden. Wie in Panel Agezeigt, waren die Muster für beide Methoden in jeder einzelnen biologischen Replikation konsistent. (B) und (C) sind die gleichen wie (A) für sma-10 bzw. dnj-26 mRNA-Ebenen. Die Ziel-mRNA-Werte wurden gegen die Haushaltsgene cdc-42 und pmp-3normalisiert. Die statistische Analyse wurde für jedes Gen anhand eines gepaarten t-Tests berechnet, in dem die Ergebnisse der drei biologischen Replikationen, die durch Standard-qPCR erzeugt wurden, und der ergebnisse, die durch nanofluidische qPCR erzeugt wurden, verglichen wurden. Die P-Werte dieser Vergleiche waren 0,3113, 0,2635 bzw. 0,3481 für sma-3, sma-10und dnj-26. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Die Verwendung der Worm-to-CT-Methode auf Massenproben oder bei einzelnen Würmern bot ähnliche Ausdrucksebenen, wenn sie pro Wurm normalisiert wurden.
Die Expressionswerte von (A) hsp-16.1/11, (B) F44E5.4 und (C) hsp-70 (C12C8.1) wurden bei jungen erwachsenen Tieren ohne Hitzeschock entweder durch Die Durchführung von Worm-to-CT an einem Großteil von 25 Tieren oder bei 36 Einzelpersonen analysiert. Wenn die Daten pro Wurm normalisiert wurden, gab es keinen signifikanten Unterschied zwischen den Pro-Wurm-Werten für jedes Transkript mit beiden Methoden. Die mRNA-Spiegel von Zielgenen wurden gegen den Durchschnitt der drei Haushaltsgene cdc-42, pmp-3und ire-1normalisiert. Balken stellen den Standardfehler des Mittelwerts dar. Statistik = gekoppelter t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
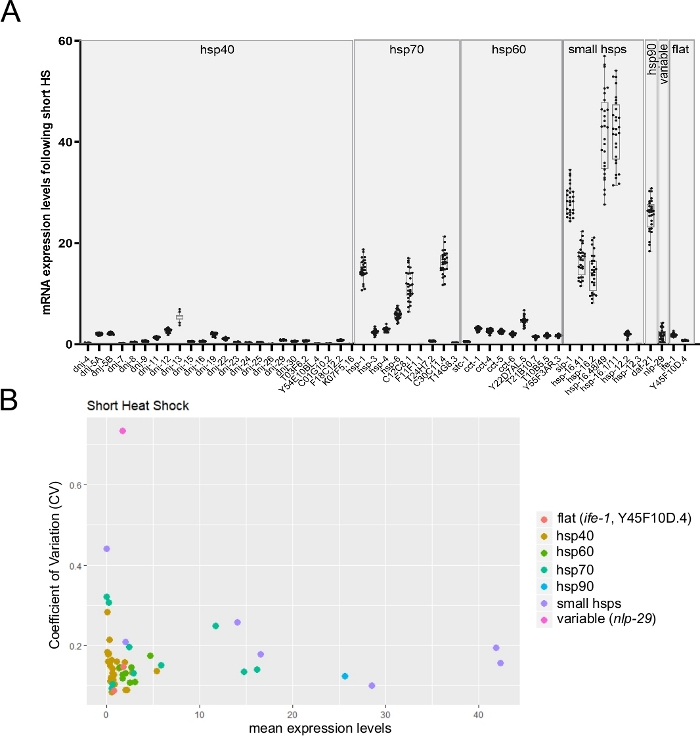
Abbildung 6: Rt-qPCR mit hohem Durchsatz bei einzelnen Würmern mit der Worm-to-CT-Methode könnte die interindividuelle Variabilität der Genexpression überwachen.
(A) Die mittleren Expressionswerte für 53 Transkripte, die bei Exposition gegenüber einem kurzen Hitzeschock (30 min bei 34 °C) erhalten werden. Boxplots stellen die Verteilung der mittleren mRNA-Expression von einzelnen Würmern dar (pro einzelnen Wurm wurden durchschnittlich drei technische Repliken verwendet). Die Punkte stellen Ausdrucksebenen in 28 einzelnen Würmern dar. Die mRNA-Spiegel von Zielgenen wurden gegen den Durchschnitt der drei Haushaltsgene cdc-42, pmp-3und ire-1normalisiert. (B) Der Variationskoeffizient26 (CV) in Abhängigkeit von der mittleren mRNA-Expression für 53 Transkripte nach der Exposition gegenüber einem kurzen Hitzeschock wurde von 28 Einzeltieren berechnet (Rohdaten in Tafel B). Der Satz von Transkripten enthält die Variable nlp-29 Transkript27 und zwei stabile Transkripte(ife-1 und Y45F10D.4; unveröffentlichte Daten). Der CV ist das Verhältnis der Standardabweichung zum Mittelwert. Dieser Lebenslauf wurde verwendet, um die interindividuelle Variabilität im Transkriptexpression zwischen einzelnen Würmern zu schätzen. Wie erwartet, skalierte die interindividuelle Variabilität mit verringerten mittleren Expressionswerten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
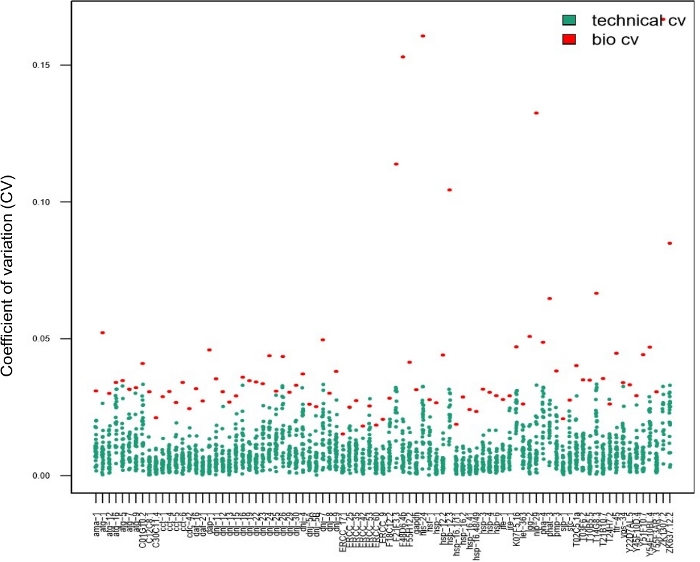
Abbildung 7: Technische Replikationen waren bei der Analyse der interindividuellen Variabilität der Genexpression mit einem nanofluidischen Chip nicht erforderlich.
Die in dieser Grafik dargestellten Daten wurden in 28 einzelnen Würmern nach einem kurzen Hitzeschock (30 min bei 34 °C) ermittelt. Jeder rote Punkt stellt den Variationskoeffizienten (CV) der mittleren Transkriptexpressionsebenen für eine Transkription dar, die zwischen 28 einzelnen Würmern (Bio CV) gemessen wird. Jeder blaue Punkt stellt den Lebenslauf der Expressionsstufen zwischen drei technischen Replikationen dar, die aus einem einzelnen Wurm pro Transkript sproduziert wurden (technischer CV). Diese Grafik zeigt, dass die technische Variabilität (zwischen technischen Replikationen) viel geringer war als die biologische Variabilität (zwischen einzelnen Würmern), was darauf hindeutet, dass es unnötig ist, technische Replikationen auf einem nanofluidischen Genexpressionsarray durchzuführen, wenn die Genexpression in einzelnen Würmern untersucht wird, ähnlich wie bei einzelzelligen Studien14,15,28. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Planlayout für einen Multi-Array-Chip. Die obige Tabelle zeigt ein einfaches Layout, das bei der Planung eines Multi-Array-Chiplaufs verwendet werden kann. Auf der linken Seite befinden sich die Räume, die mit den Primer-Zielen von Interesse gefüllt werden sollten, und auf der rechten Seite sind Räume, die mit den Mustern von Interesse gefüllt werden sollten. Jedes Assay- und Sample-Array wird zahlenmäßig durch den Chip gepaart. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Planlayout für einen Single-Array-Chip. Die obige Tabelle zeigt ein einfaches Layout, das bei der Planung eines Chiplaufs mit einem Array verwendet werden kann. Auf der linken Seite befinden sich Räume, die mit Primerzielen von Interesse gefüllt werden sollten, und auf der rechten Seite sind Räume, die mit den Mustern von Interesse gefüllt werden sollten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Liste der in dieser Studie verwendeten RT-qPCR-Primer. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 1: Primer aus der Datenbank der RT-qPCR Primer. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
In diesem Beitrag wird gezeigt, dass das Worm-to-CT-Protokoll eine schnelle und effiziente Methode ist, um RNA aus einzelnen Würmern oder einem kleinen Pool von Würmern zu extrahieren. Der hohe Durchsatz des nanofluidischen Systems macht es ideal für die Quantifizierung von interindividuellen Variabilitätsmessungen. Darüber hinaus ermöglicht die hohe Empfindlichkeit dieser Methode den Nachweis von Genen, die auf niedrigen Konzentrationen exprimiert werden, die unter den Nachweis fallen, wenn sie Single-Worm-RNA-seq-Technologien9verwenden.
Bei der Prüfung der Wahl der Methode zur Herstellung von cDNA aus einzelnen Würmern. Ly et al.29 optimierte ein Protokoll, das auf Proteinase K für die Nagelhautverdauung beruht. Die Nagelhaut ist eine große Hürde für die Isolierung von Molekülen von Würmern und Proteinase K bietet eine effektive Methode, um es zu brechen. Proteinase K muss jedoch wärmeinaktiviert werden, um Enzyme zur Umgekehrten Transkription verwenden zu können. Während Ly et al. eine 10 min Exposition bei 96 °C einsetzte, wurde dieser Schritt in diesem Protokoll vermieden, da RNA leicht abbaubar ist. Anstatt Proteinase K zu verwenden, wurden wiederholte Frost-Tau-Zyklen verwendet, um die Nagelhaut zu brechen. Das Frosttau ist eine effektive Methode, um die Nagelhaut zu brechen, da mehr RNA pro Wurm isoliert werden kann. Ly et al. berichten, dass die gesamte RNA pro Wurm 35 ng mit Proteinase K beträgt, während dieses Protokoll 51,75 ng ± 6,74 SEM der gesamten RNA pro Wurm erhält. Die Vermeidung von Wärmeexposition in Verbindung mit Vorverstärkungsschritten erweitert den Dynamikbereich von Worm-to-CT im Vergleich zu Standardprotokollen. Ly et al. melden absolute Ct-Werte von 21,1 ± 0,15 für hsp-16.2 und 22,8 ± 0,17 für hsp-70 nach Hitzeschock. Unter Verwendung der gleichen Hitzeschockbedingungen (1 h bei 30 °C) erhält dieses Protokoll absolute Ct-Werte von 17,93 ± 0,57 für hsp-16.2 und 21.13 ±0.33 für hsp-70. Dies deutet darauf hin, dass die Freeze-Tau-Lyse-Methode höhere RNA-Erträge liefert und für niedrig ausgedrückte Transkripte besser geeignet ist.
Nanofluidische Systeme sind ideal, wenn sie einen bestimmten Satz von Zieltranskripten und die Verwendung einer kleineren (Multi-Array-Chip) oder größeren (Single-Array-Chip) Anzahl von Samples untersuchen, die eine Anpassung an den Umfang des Experiments ermöglichen. Um ein unvoreingenommenes Bild aller Transkripte zu erhalten, die in einem einzigen Wurm ausgedrückt werden, besteht die offensichtliche Wahl darin, die RNA-Sequenzierung zu verwenden. Wenn jedoch der Fokus des Experiments auf einem kleineren, aber immer noch relativ großen Satz von Zielgenen liegt, ist es kostengünstiger, dieses Protokoll zu nutzen, vorausgesetzt, der Forscher hat Zugang zu einer Nanofluidik-PCR-Maschine. Die Kosten für die nanofluidischen Systemreagenzien und einen Single-Array-Chip werden auf etwa 13 USD pro Wurm geschätzt, während die Kosten der Reagenzien für die Sequenzierung von Einschnecken etwa 60 USD pro Wurm betragen würden, ohne die Sequenzierungskosten.
Bei der Betrachtung, welche PCR-Plattform verwendet werden soll, bietet die Mit-Wurm-zu-CT-Methode, die an nanofluidische qPCR gekoppelt ist, Vorteile in Bezug auf Zeit und Durchsatz. Es ist möglich, 9.216 RT-qPCR Ergebnisse in ca. 2 Tagen Arbeit zu erhalten, während die Verstärkung der gleichen Anzahl von Zielen mit einer Standard-qPCR-Plattform etwa 5 Arbeitswochen mit 96 Well-Platten-Assays in Anspruch nehmen würde, wobei vier Platten pro Tag laufen würden. Wenn jedoch die Anzahl der zu testenden Ziele kleiner ist, ist es kostengünstiger, Worm-to-CT in Verbindung mit einer Standard-qPCR-Maschine zu verwenden. Die Single-Array-Chips können nicht erneut ausgeführt werden, sodass leerstehende Brunnen die Kosteneffizienz verringern.
Eine Einschränkung der Methode ist die mögliche Bildung von Primer-Primer-Dimern während des Multiplexing-Schritts, aber dies tritt in weniger als 1% der Fälle auf. Obwohl das Worm-to-CT-Protokoll effizient ist und zuverlässige Ergebnisse liefert, wenn es auf einzelne Würmer angewendet wird, gibt es eine Ausfallrate von etwa 5%, was wahrscheinlich den Fällen entspricht, in denen der Wurm während des Ernteschritts in der Kappe oder der Oberseite des Rohres gefangen bleibt.
Zusammen bietet diese vielseitige und zuverlässige Methode einen höheren Durchsatz und eine höhere Empfindlichkeit im Vergleich zu Standardtechniken. Diese Methode kann sehr nützlich für die Validierung von Bildschirmen mit hohem Durchsatz sein und ist eine ausgezeichnete Wahl, um die Expressionsniveaus von Single-Worm-Genen zu überwachen oder zu validieren. Diese Methode kann auf andere anspruchsvolle Techniken angewendet werden, wie die Quantifizierung der Genexpression aus isolierten Geweben. Beispielsweise bietet die Isolierung von vollwertigem Gewebe, wie Darm, Gonaden oder zellen, die durch FACs isoliert wurden, genügend Material, um RNA-Sequenzierungsexperimente durchzuführen. Allerdings führen begrenzte Mengen an Material oft zu doppelten Lesevorgängen, was die Quantifizierung seltener Transkripte ausschließt. In diesem Szenario sollte die Verwendung von Nanofluidics-basierter Technologie eine zusätzliche Empfindlichkeit für die Experimente bieten und die Kosteneffizienz erhöhen, wenn die Forscher nur eine Teilmenge aller Transkripte in diesen Geweben oder Zellen überwachen müssen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Sharlene Murdoch und dem Babraham Institute Facilities für ihre Unterstützung. JLP wurde vom Wellcome Trust (093970/Z/10/Z) und OC wird von ERC 638426 und BBSRC [BBS/E/B000C0426] unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100µM stock primers for genes of interest. | |||
| 20X DNA Binding Dye | Fluidigm | 100-7609 | for 96.96 chip (Single-Array Chip) |
| 2X Assay Loading Reagent | Fluidigm | 100-7611 | |
| 384 well plates | |||
| 8-strip PCR tubes | |||
| 96 well ice block | |||
| 96 well plates | |||
| 96.96 Dynamic Array IFC | Fluidigm | BMK-M-96.96 | Referenced throughout the manuscript as "Single-Array Chip" |
| 96-well sealing tape | |||
| BioMark & EP1 Software | Fluidigm | 101-6793 | Contains: Biomark HD Data Collection software, Real-Time PCR Analysis software, SNP Genotyping Analysis software, Digital PCR Analysis software, Melt Curve Analysis software |
| BioMark or BioMark HD system | Fluidigm | 100-2451 K1 | Referenced throughout the manuscript as "nanofluidics thermocycler" |
| Control Line Fluid Kit for 96.96 and FlexSix IFCs | Fluidigm | 89000021 | Referenced throughout manuscript as "control line fluid" |
| DNA Suspension buffer | TEKnova | T0021 | |
| domed PCR caps | |||
| Exonuclease I | New England BioLabs | M0293L | |
| Exonuclease I reaction buffer | New England BioLabs | B0293S | |
| FLEXsix DELTAgene Sample Reagent | Fluidigm | 100-7673 | referenced throughout manuscript as "sample reagent" |
| FLEXsix Gene Expression IFC | Fluidigm | 100-6308 | referenced throughout manuscript as "Multi-Array Chip" |
| Fluidigm Real-Time PCR Analysis User Guide | Fluidigm | 68000088 | This is the protocol used as a basis for section 2 of the protocol, referenced within the manuscript. |
| IFC Controller MX | Fluidigm | 68000112 I1 | Referenced throughout the manuscript as "nanofluidics PCR priming machine" |
| IFC Controllers SOFTWEAR | Fluidigm | 100-2297 | Contains all softwear and scripts required for running the IFC controller MX |
| liquid nitrogen in dewar | |||
| Microcentrifuge | StarLab | C1301B-230V | Used to spin down PCR tube strips in the protocol. |
| Nuclease Free Water | |||
| plate spinner | Labnet | K4050725 | mini plate spinner, mps 1000. referenced through the protocol as "tabletop plate spinner" |
| Power SYBR Green Cells-to-Ct kit | invitrogen | 4402955 | This kit is that which is adapted for use in nematodes in the Worm-to-CT protocol. Contense: Store Stop Solution, DNase I and 20X RT Enzyme Mix at -20°C. Store Lysis Solution, 2X SYBR RT Buffer (referenced throughout the manuscript as RT buffer), and Power SYBR®Green PCR Master Mix (refferenced througout the manuscript as PCR Master Mix). This Kit is for 400 reactions, kits also available for 40 and 100 reactions. |
| PreAmp Master Mix | Fluidigm | 100-5580, 100-5581 | |
| Reverse Transcription Master Mix—480 reactions | Fluidigm | 100-6299 | One tube also available for 96 reactions (PN100-6298) |
| Rnase Free water | |||
| SsoFast EvaGreen Supermix with Low ROX | Bio-Rad Laboratories | 172-5211 | referenced throughout the manuscript as "fluorescent probe supermix" |
| Standard 96 and 384-well Thermal Cycler | |||
| TE Buffer (10mM Tris, pH8.0, 1.0mM EDTA | TEKnova | T0224 | Referenced throughout the manuscript as Tris-EDTA buffer |
| ThermoMixer C | Eppendorf | 5382000031 | Referenced throughout the text as "thermal mixer" |
| Trizol | Thermo-Fisher | 15596026 | Referenced through the protocol as "guanidium thiocyanate-phenol-chloroform" |
| Warm water bath |
Referenzen
- Raj, A., Peskin, C. S., Tranchina, D., Vargas, D. Y., Tyagi, S. Stochastic mRNA Synthesis in Mammalian Cells. PLoS Biology. 4 (10), 309 (2006).
- Semrau, S., van Oudenaarden, A. Study lineage decision-making in vitro: emerging concepts and novel tools. Annual Review of Cell Developmental Biology. 31, 317-345 (2015).
- Kelsey, G., Stegle, O., Reik, W. Single-cell epigenomics: Recording the past and predicting the future. Science. 358 (6359), 69-75 (2017).
- Eling, N., Morgan, M. D., Marioni, J. C. Challenges in measuring and understanding biological noise. Nature Review Genetics. 20 (9), 536-548 (2019).
- Kaufmann, B. B., van Oudenaarden, A. Stochastic gene expression: from single molecules to the proteome. Current Opinion in Genetics & Development. 17 (2), 107-112 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , (2015).
- Casanueva, M. O., Burga, A., Lehner, B. Fitness trade-offs and environmentally induced mutation buffering in isogenic C. elegans. Science. 335 (6064), 82-85 (2012).
- Raj, A., Rifkin, A. A., Andersen, E., van Oudenaarden, A. Variability in gene expression underlies incomplete penetrance. Nature. 463 (7283), 913-918 (2010).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Serra, L., et al. Adapting the Smart-seq2 Protocol for Robust Single Worm RNA-seq. Bio-protocol. 8 (4), 2729 (2018).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Biology. 14 (8), 1007559 (2018).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Stegle, O., Teichmann, S. A., Marioni, J. C. Computational and analytical challenges in single-cell transcriptomics. Nature Review Genetics. 16 (3), 133-145 (2015).
- Ståhlberg, A., Kubista, M. The workflow of single-cell expression profiling using quantitative real-time PCR. Expert Review of Molecular Diagnostics. 14 (3), 323-331 (2014).
- Livak, K. J., et al. Methods for qPCR gene expression profiling applied to 1440 lymphoblastoid single cells. Methods. 59 (1), 71-79 (2013).
- Fluidigm. . Real-Time PCR Analysis User Guide. , (2018).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- . U. S. National Library of Reference. Primer Blast Available from: https://www.ncbi.nlm.nih.gov/tools/primer-blast/ (2020)
- Bustin, S. A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. Journal of Molecular Endocrinology. 29 (1), 23-39 (2002).
- Nolan, T., Huggett, J., Sanchez, E. . Good Practice guide for the application of quantitative PCR (qPCR), LGC. , (2013).
- Yuan, J. S., Reed, A., Chen, F., Stewart, C. N. Statistical analysis of real-time PCR data. BMC Bioinformatics. 22 (7), 85 (2006).
- He, F. Total RNA Extraction from C. elegans. Bio-protocol. Bio-101. 47, (2011).
- Hajdu-Cronin, Y. M., Chen, W. J., Sternberg, P. W. The L-Type Cyclin CYL-1 and the Heat-Shock-Factor HSF-1 Are Required for Heat-Shock-Induced Protein Expression in Caenorhabditis elegans. Genetics. 168 (8), 1937-1949 (2004).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Zhang, X., Zhang, Y. Dbl-1 a TGF-beta is essential for C. elegans aversive olfactory learning. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 17081-17086 (2012).
- Sørensen, J. B. The Use and Misuse of the Coefficient of Variation in Organizational Demography Research. Sociological Methods & Research. 30 (4), 475-491 (2002).
- Pujol, N. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Current Biology. 18 (7), 481-489 (2008).
- Brennecke, P., et al. Accounting for technical noise in single-cell RNA-seq experiments. Nature Methods. 10 (11), 1093-1095 (2013).
- Ly, K., Reid, S. J., Snell, R. J. Rapid RNA analysis of individual Caenorhabditis elegans. MethodsX. 7 (2), 59-63 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten