Method Article
RT-PCR quantitativo de alta produtividade em amostras de elegans C. single e bulk usando tecnologia nanofluidica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste artigo é descrito um protocolo de alto rendimento para determinação rápida e confiável dos níveis de expressão genética em amostras de C. elegans única ou a granel. Este protocolo não requer isolamento de RNA e produz cDNA diretamente a partir de amostras. Ele pode ser usado em conjunto com plataformas qPCR nanofluidas nanofluidas de alto rendimento.
Resumo
Este artigo apresenta um ensaio de pcr quantitativo de transcrição reversa de alta taxa de transferência (RT-qPCR) para elegans caenorhabditis que é rápido, robusto e altamente sensível. Este protocolo obtém medições precisas da expressão genética de vermes únicos ou de amostras em massa. O protocolo aqui apresentado fornece uma nova adaptação dos métodos existentes para a preparação de DNA complementar (cDNA) acoplado a uma plataforma RT-qPCR nanofluida. A primeira parte deste protocolo, chamada 'Worm-to-CT', permite a produção de cDNA diretamente de nematoides sem a necessidade de isolamento prévio do mRNA. Ele aumenta o rendimento experimental permitindo a preparação de cDNA de 96 worms em 3,5 h. A segunda parte do protocolo usa a tecnologia nanofluida existente para executar RT-qPCR de alto rendimento no cDNA. Este artigo avalia dois chips nanofluidos diferentes: o primeiro executa 96 amostras e 96 alvos, resultando em 9.216 reações em aproximadamente 1,5 dias de trabalho de bancada. O segundo tipo de chip consiste em seis matrizes 12 x 12, resultando em 864 reações. Aqui, o método Worm-to-CT é demonstrado quantificando os níveis de mRNA de genes codificando proteínas de choque térmico de vermes únicos e de amostras em massa. Providenciado é uma extensa lista de primers projetados para amplificar o RNA processado para a maioria dos genes de codificação dentro do genoma C. elegans.
Introdução
A otimização do sequenciamento de RNA unicelular e do qPCR revelou que pulsos ou rajadas transcricionais podem levar a uma variação maciça no número de moléculas de RNA por célula1. Além disso, essas tecnologias descobriram heterogeneidade celular substancial anteriormente perdida por medições transcriômicas em massa padrão. Dependendo do contexto, alguma variabilidade transcricional unicelular é causada pela composição celular mista dos tecidos. No entanto, mesmo em populações de células isogênicas cultivadas sob o mesmo ambiente há heterogeneidade transcricional generalizada2,3. Essa "variabilidade biológica" é cada vez mais identificada como uma propriedade onipresente das redes celulares, de bactérias ao homem. Em alguns casos, pode ter consequências fenotípicas no desenvolvimento, progressão do câncer, latência do HIV e resposta à quimioterapia4,5.
O nematode Caenorhabditis elegans é um organismo modelo único com características ideais para estudar as causas e consequências da variabilidade biológica entre os indivíduos. Estes nematoides são um organismo modelo simples composto por 959 células, e sua cutícula transparente as torna favoráveis para estudos de imagem in vivo6. C. elegans é uma espécie hermafrodita que se reproduz predominantemente através da auto-fertilização; isso resultou em cepas de laboratório isogênicas. Apesar da isogenicidade e das condições de cultura controladas, muitos fenótipos e transcrições são variáveis entre os indivíduos, sugerindo que diferenças estocásticas ou microambientais contribuem para a heterogeneidade entre indivíduos7,8. Tal variabilidade na expressão genética tem múltiplas consequências de aptidão, incluindo variabilidade na penetração de mutações, sobrevivência, tempo de desenvolvimento e fecundidade7,8,9. Devido a essas características, estudos de verme único proporcionam a oportunidade sem precedentes de estudar a variabilidade biológica em todo um organismo.
Há uma necessidade fundamental no campo de desenvolver e otimizar tecnologias para detecção precisa de transcrições em um nível de um único worm. Novas tecnologias, como sequenciamento de RNA de um único verme10,sequenciamento de RNA de tecidos isolados11e sequenciamento unicelular12 estão agora disponíveis para C. elegans. No entanto, um dos principais desafios permanece: ao monitorar a interindividualidade, genes fracamente expressos geralmente ficam abaixo dos níveis detectáveis13. Isso é particularmente relevante para transcrições raras isoladas de pequenas quantidades de material inicial, pois há uma relação bem estabelecida e inversa entre expressão média e variância técnica, muitas vezes fazendo com que transcrições raras fiquem abaixo dos cortes estatísticos13. A otimização de tecnologias qPCR multiplexed de alto rendimento tem se mostrado útil para estudos de células únicas de mamíferos, em particular ao estudar a expressão de transcrições raras14,15. Esta tecnologia também pode ser usada para fins de benchmarking e validação de outras tecnologias de um único worm.
Worm-to-CT é um método rápido e robusto adaptado de um kit usado em estudos de biologia celular, para preparação de cDNA de um único verme. cDNA obtido por este método juntamente com a tecnologia qPCR nanofluidica multiplexada foi escolhida porque fornece maior throughput experimental, uma gama dinâmica mais ampla de detecção e foi validada para fins unicelulares14,15. A preparação cDNA descrita também é aplicável para uso com tecnologias pcr padrão. O rendimento é aumentado de duas maneiras: Primeiro, a preparação do CDNA é mais rápida e confiável do que a tradicional extração de tiocianato-fenol-clorofônio de guanidium, porque os vermes são diretamente adicionados ao tampão de lise, pulando o isolamento direto do RNA facilmente degradável. Em segundo lugar, a utilização de tecnologias nanofluidas aumenta significativamente o número de amostras e alvos que podem ser executados simultaneamente. Neste papel, dois chips são comparados: um chip de matriz única e um chip multi array. Um chip de matriz única pode executar 96 worms únicos e 96 conjuntos de primer, resultando em 9.216 reações por experimento. Para realizar um throughput semelhante usando tecnologias padrão qPCR seria necessário 96 experimentos qPCR separados, usando 96 placas de poço. O chip multi array menor e flexível consiste em seis matrizes 12 x 12, resultando em 864 reações. A confiabilidade e sensibilidade superiores do método são impulsionadas pela tecnologia nanofluida e pela introdução de uma etapa de pré-amplificação. O método apresentado neste artigo deve ser utilizado em conjunto com um algoritmo estatístico de última geração para extrair variância biológica. Este artigo apresenta o protocolo para preparação rápida de CDNA e qPCR de alto rendimento para amostras de vermes de um único verme e lote; o algoritmo será publicado em outro lugar. Para este protocolo, a organização de cada chip deve ser preparada antes do experimento. A Tabela 1 e a Tabela 2 mostram exemplos desses planos para um chip multi array e single array, respectivamente. Há também visões gerais do protocolo Worm-to-CT detalhadas na Figura 1 e executando os chips multi array e single-array na Figura 2.
Protocolo
NOTA: Ao longo deste protocolo, a Caenorhabditis elegans é referida como "verme" ou "vermes". Uma variedade de cepas de C. elegans pode ser encomendada através de bancos de dados on-line ou entrando em contato direto com laboratórios que usam o organismo modelo. A parte I deste protocolo (seções 1-3) descreve a preparação do CDNA através do protocolo Worm-to-CT. A parte II deste protocolo (seções 4-13) descreve a execução do RT-qPCR de alto rendimento usando nanofluidos, adaptado a partir de um protocolo desenvolvido por Fluidigm16. Este protocolo se aplica ao uso dos dois tipos de chips nanofluidos definidos anteriormente, o chip de matriz única, que pode monitorar 96 alvos em 96 amostras (9.216 reações RT-qPCR total), ou o chip multi array, que funciona como subunidades de 12 amostras de alvo x 12. Cada chip multi array contém seis matrizes independentes que podem ser executadas juntas ou separadamente. Por exemplo, o uso de um chip multi array inteiro pode monitorar 72 alvos x 12 amostras (ou vice-versa), ou 36 alvos x 24 amostras (ou vice-versa). Para obter mais informações sobre qualquer um dos materiais utilizados neste protocolo, consulte a Tabela de Materiais.
1. Validação do primer RT-qPCR
NOTA: Os primers em tempo real foram projetados com base nas propriedades recomendadas originalmente emitidas pelas diretrizes do MIQUE17. Para tornar os primers específicos para RNA processado, os produtos foram projetados de tal forma que os dois primers vinculados a ambos os lados de pelo menos uma junção de emenda. Os requisitos para primers adequados incluíam 20%-80% de teor de guanina e citosina, uma temperatura de fusão de 58-60 °C, uma diferença na temperatura de fusão entre pares de primer de ≤0,5 °C e um comprimento do produto de 70-120 bp. A sequência dos primers gerados pode ser encontrada na Tabela Suplementar 1. Código-fonte aberto para os scripts usados para gerar os primers pode ser encontrado em https://github.com/s-andrews/wormrtpcr. Os pares primer para transcrições com sites de emenda foram projetados para que eles estejam em dois exons flanqueando um intron, mas não foram projetados para serem específicos de variantes de emenda, usando o software NCBI Primer Blast18. Para este estudo, os conjuntos de primer foram explodidos contra o genoma C. elegans para testar qualquer complementaridade fora do alvo.
- Recuperar primers do banco de dados de primers RT-qPCR(Tabela Suplementar 1). Alternativamente, projete pares de primer qPCR usando ferramentas online como NCBI Primer Blast18.
- Realize uma curva padrão qPCR para monitorar a especificidade e a eficiência do PCR para cada par de primers usando técnicas padrão de qPCR a granel19 e seguindo as diretrizes do MIQUE17,20.
NOTA: Apenas pares de primer com R2 > 0,98 e eficiência PCR entre 85% e 115% devem ser usados. A sequência, eficiência pcr e R2 para os primers utilizados neste estudo são detalhadas na Tabela 3.
2. Lise de vermes através de Worm-to-CT
- Escolha os vermes de seu gramado bacteriano em uma placa ngm fresca e não semeada e permita que os vermes se movam ao redor da placa por 5 minutos para remover a maioria das bactérias do verme através de seu movimento.
NOTA: O gramado bacteriano e as condições de cultivo diferem dependendo do design experimental. Os experimentos aqui apresentados requerem placas de GNL de 6 cm semeadas com OP50 Escherichia coli com vermes de interesse cultivados para o estágio L4.9 em uma incubadora de 20 °C. - Em um capô sem RNase, prepare uma mistura mestre composta por 12,5 μL de tampão 2x RT, 1,25 μL de tampão de enzima RT de 20x e 0,25 μL de água sem nuclease por amostra. Adicione 14 μL de mistura mestre a 11 μL de cada amostra a partir da etapa 2.8.
- Coloque a tampa de uma tira PCR de cabeça para baixo na plataforma do escopo de dissecação e adicione 10 μL da mistura de lise às tampas do tubo PCR demed sob um microscópio composto.
NOTA: Com apenas uma ou duas amostras, é melhor usar uma tira PCR contendo pelo menos quatro tubos, pois isso reduz o risco de as tampas se abrirem nas etapas subsequentes de congelamento. Alternativamente, os elásticos podem ser usados para manter as tampas no lugar. Nesse caso, certifique-se de que as tampas estejam devidamente fechadas toda vez que os tubos forem transferidos. - Escolha os vermes da placa em cada ranhura da tampa contendo a mistura de lise "colher" eles (ou seja, pegar os vermes por baixo com a picareta) para evitar contaminação bacteriana. Feche os tubos e gire-os para baixo por 5 s usando uma microcentrifuge de mesa(Tabela de Materiais) antes de colocá-los em um frasco de Dewar cheio de nitrogênio líquido.
NOTA: Entre 15 e 30 vermes devem ser usados para experimentos em massa e 1 worm para medições de um único verme.
ATENÇÃO: Ao manusear nitrogênio líquido use Luvas crio-luvas, bem como óculos protetores e adere às normas padrão de vestuário, pois o contato com a pele ou os olhos pode causar ferimentos graves de queimadura de gelo. - Descongele os tubos PCR 10x transferindo-os entre nitrogênio líquido e um banho de água de ~40 °C. Deixe os tubos no nitrogênio líquido por um mínimo de 5 s para garantir que as amostras estejam completamente congeladas. Deixe os tubos no banho de água até que as amostras descongelem. Não deixe por um período mais longo, pois isso leva à degradação do RNA.
NOTA: Os tubos podem ser deixados em nitrogênio líquido por um longo período de tempo, uma vez que as amostras são congeladas a aproximadamente -200 °C, reduzindo a degradação do RNA. Este não deve, no entanto, ser um ponto de parada do protocolo, porque o nitrogênio líquido evapora rapidamente. - Misture as amostras em uma batedeira térmica(Tabela de Materiais) fixada a 4 °C por 20-30 min girando a ~1.800 rpm.
- Enquanto as amostras estão sendo misturadas, descongele a solução stop no gelo.
- Gire as amostras para baixo usando um microcentrifuge de mesa(Tabela de Materiais) e adicione 1 μL de solução de parada a cada tubo.
NOTA: As amostras podem ser deixadas a -80 °C por até 1 semana antes de transcrever inversa o RNA (seção 3).
3. Transcrição reversa
NOTA: Para transcrição reversa de worms únicos, os resultados aqui mostrados foram gerados utilizando-se os reagentes fornecidos com os chips nanofluidos (opção 2 na Figura 1). Os reagentes destacados na opção 2 da Figura 1 também foram utilizados para transcrição reversa de amostras agrupadas. Qualquer método funciona intercambiavelmente para os diferentes tipos de amostra.
- Transcrição reversa de worms únicos
- Em um capô sem RNase, adicione 1,25 μL de mistura de transcrição reversa(Tabela de Materiais) a um tubo PCR fresco.
NOTA: Uma placa PCR de 96 poços e uma pipeta automática podem ser usadas se houver muitas amostras. O protocolo do fabricante estabelece que 1 μL pode ser usado por amostra. - Pegue 5 μL da solução de lise e pare o mix de solução da etapa 2.8 e adicione-o ao tubo PCR fresco contendo a mistura de transcrição reversa.
NOTA: O protocolo do fabricante estabelece que 1 μL de RNA (2,5 pg/μL-250 ng/μL) pode ser usado por reação. Um controle rt negativo por placa pode ser adicionado substituindo a mistura de transcrição reversa por 5 μL de amostra lysed e 1,25 μL de água livre de RNAse. - Execute as amostras utilizando o seguinte programa de transcrição reversa em um termociclador: 25 °C para 5 min, 42 °C para 30 min, 85 °C para 5 min e 4 °C para ∞.
NOTA: O cDNA produzido pode ser armazenado a -20 °C antes de prosseguir para amplificação e coleta de dados usando qPCR de alta produtividade.
- Em um capô sem RNase, adicione 1,25 μL de mistura de transcrição reversa(Tabela de Materiais) a um tubo PCR fresco.
- Transcrição reversa para amostras em massa (15-30 worms)
- Em um capô sem RNase, prepare uma mistura mestre composta por 12,5 μL de tampão 2x RT, 1,25 μL de tampão de enzima RT de 20x e 0,25 μL de água sem nuclease por amostra. Adicione 14 μL de mix mestre a 11 μL de solução de lise e pare o mix de soluções a partir da etapa 2.8.
NOTA: Ao lidar com um grande número de amostras, isso pode ser realizado em 96 placas de poço. - Execute as amostras através de um termociclador usando o seguinte programa de transcrição reversa: 37 °C para 60 min, 95 °C para 5 min e 4 °C para ∞.
- Diluir o cDNA produzido 1:4 em água sem nuclease.
NOTA: Geralmente, os produtos chegam a um volume final de 25 μL, nesse caso devem ser adicionados 75 μL. No entanto, devido à condensação, o volume final pode variar. Portanto, ajuste de acordo para fazer uma relação 1:4 na solução final. Esta etapa de diluição não se aplica se realizar qPCR em worms únicos. O cDNA produzido pode ser armazenado a -20 °C antes de prosseguir para amplificação e coleta de dados usando qPCR de alta taxa de rendimento.
- Em um capô sem RNase, prepare uma mistura mestre composta por 12,5 μL de tampão 2x RT, 1,25 μL de tampão de enzima RT de 20x e 0,25 μL de água sem nuclease por amostra. Adicione 14 μL de mix mestre a 11 μL de solução de lise e pare o mix de soluções a partir da etapa 2.8.
4. Preparando a mistura de primer multiplex
- Prepare um estoque de primer para frente/reverso (F/R) para cada par de primers a 50 μM de concentração final. Misture o mesmo volume de primers dianteiros e invertidos a 100 μM cada.
- Combine 1 μL de 50 μM F/R primer stock para cada par de primer a ser testado. Adicione o buffer de suspensão de DNA até um volume total de 100 μL.
NOTA: As concentrações de primer de ações aqui diferem das descritas no protocolo16 do fabricante, mas mantêm a mesma concentração final de 500 nM.
5. Pré-amplificação específica do alvo
- Prepare uma mistura mestre contendo 1 μL de mastermix de pré-amplificação (Tabela de Materiais),0,5 μL do mix de primer agrupado (passo 4.2) e 2,25 μL de água livre de nuclease por reação com um volume excedente global de 10%.
- Em uma placa de 96 poços, alíquota de 3,75 μL da mistura mestre em tantos poços quanto necessário para que o número de amostras seja executado.
- Adicione 1,25 μL das soluções cDNA de interesse geradas na etapa 3.1.3 ou 3.2.3 para cada poço.
- Cubra a placa com 96 fitas de vedação de poço, brevemente vórtice e centrífuga com um rotador de placa de mesa. Transfira para um termociclador e execute o seguinte programa: 95 °C para 2 min, 15 ciclos de desinaturação a 95 °C para 15 s, ressarem/prorrogação a 60 °C por 4 min e 4 °C para ∞.
NOTA: O fabricante recomenda de 10 a 20 ciclos para a reação de pré-amplificação16. Este protocolo recomenda 10 ou 15 ciclos dependendo dos níveis de expressão dos genes alvo.
6. Tratamento exonuclease I
NOTA: Isto é para remover primers não incorporados da pré-amplificação.
- Prepare uma mistura exonuclease I contendo 0,2 μL de tampão de reação exonuclease I(Tabela de Materiais),0,4 μL de exonuclease I a 20 U/μL(Tabela de Materiais)e 1,4 μL de água sem nuclease por amostra. Mantenha todos os reagentes no gelo, especialmente a exonuclease I.
- Retire a placa de 96 poços (passo 5.4) do termociclador, centrífugas com o rotador da placa de mesa e remova cuidadosamente a vedação. Adicione 2 μL da exonuclease que misturo a cada reação de pré-amplificação. Reseal, centrífuga e coloque a placa de 96 poços de volta no termociclador usando o seguinte programa: 37 °C para 30 min, 80 °C para 15 min e 4 °C para ∞.
- Tire as amostras do termociclador e dilua-as 1:5 adicionando 18 μL de tampão EDTA Tris 1x(Tabela de Materiais).
NOTA: É possível manter as amostras de cDNA a -20 °C para uso posterior. O protocolo do fabricante sugere potenciais diluições de 5x, 10x ou 20x nesta fase16,dependendo do nível de expressão das metas de interesse.
7. Preparando as misturas de ensaio
NOTA: As misturas de ensaios podem ser preparadas em 384 placas de poço, já que os poços têm o mesmo espaçamento que os chips nanofluidos, facilitando o carregamento.
- Preparando misturas de ensaio para um chip multi array
- Prepare uma mistura mestre composta por 2 μL de reagente de carregamento de ensaio de 2x(Tabela de Materiais) e 1,6 μL de tampão de suspensão de DNA(Tabela de Materiais) para cada poço de acordo com o plano preparado. Alíquota de 3,6 μL desta mistura mestre por poço em uma placa de 384 poços.
- Adicione 0,4 μL do estoque de 50 μM F/R preparado na etapa 4.1 aos poços apropriados de acordo com o plano preparado.
NOTA: Isso fornece um total de 4 μL de mistura de ensaio por poço, com um excedente de 1 μL.
- Preparando misturas de ensaio para um chip de matriz única
- Prepare uma mistura mestre composta por 3 μL de reagente de carregamento de ensaio 2x e 2,4 μL de tampão de suspensão de DNA para cada poço de acordo com o plano preparado. Aliquot 5.4 μL desta mistura mestre por bem em uma placa de 384 bem marcada.
- Adicione 0,6 μL do estoque de 50 μM F/R aos poços apropriados de acordo com o plano preparado.
NOTA: Isso fornece um total de 6 μL de mistura de ensaio por poço, com um excedente de 1 μL.
8. Preparando as misturas de amostras
NOTA: As misturas de amostras podem ser preparadas com até 1 dia de antecedência e armazenadas a 4 °C.
- Preparando amostras para um chip multi array
- Prepare uma mistura mestre de amostra composta por 2 μL de supermix de sonda fluorescente 2x com ROX baixo (Tabela de Materiais) e 0,2 μL de reagente de amostra(Tabela de Materiais) por amostra. Dispense 2,2 μL desta mistura na placa de 384 bem marcada.
NOTA: O fabricante recomenda não vórtice do reagente amostral16. - Pipeta 1,8 μL de cada amostra pré-amplificada e exonuclease T tratei da etapa 3.2.3 para os poços apropriados de acordo com o plano preparado.
NOTA: Isso dá um total de 4 μL, com um excedente de 1 μL.
- Prepare uma mistura mestre de amostra composta por 2 μL de supermix de sonda fluorescente 2x com ROX baixo (Tabela de Materiais) e 0,2 μL de reagente de amostra(Tabela de Materiais) por amostra. Dispense 2,2 μL desta mistura na placa de 384 bem marcada.
- Preparando amostras para um chip de matriz única
- Prepare uma mistura mestre de amostra composta por 3 μL de supermix de sonda fluorescente 2x com ROX baixo (Tabela de Materiais) e 0,3 μL de reagente de amostra de corante de ligação de DNA de 20x(Tabela de Materiais) por amostra. Dispense 3,3 μL desta mistura na placa de 384 bem marcada.
- Pipeta 2,7 μL de cada amostra pré-amplificada e exonuclease Tratei amostra da etapa 6.3 para os poços apropriados de acordo com o plano preparado.
NOTA: Isso dá um total de 6 μL, com um excedente de 1 μL. Se houver algum poço a ser executado sem uma amostra, estes devem ser carregados com mix mestre de amostra e 2,7 μL de água em vez de cDNA. Isso é recomendado para ambos os tipos de chip. A máquina precisa de ROX baixo em cada entrada para detectar a grade do chip.
9. Priming o chip nanofluido
NOTA: Um chip multi array só precisa ser preparado na primeira corrida. Se houver corridas subsequentes do mesmo chip, esta etapa pode ser ignorada. Estes passos são os mesmos para ambos os tipos de chip.
- Devagar e cuidadosamente, injete os 150 μL completos do fluido da linha de controle das seringas incluídas nos acumuladores do chip. Certifique-se de que nenhum líquido de controle toque o chip segurando o chip em um ângulo de 45° e segurando a ponta da seringa para evitar derramamento.
- Remova a película protetora azul da parte inferior do chip.
- Coloque o chip na máquina de escoramento PCR nanofluida(Tabela de Materiais),com o código de barras voltado para fora. Execute o script 'Prime (153x),que leva ~15-20 min.
NOTA: Ligue o termociclista nanofluido(Tabela de Materiais)nesta fase, pois a câmera leva cerca de 10 minutos para esfriar até abaixo de 0 °C.
10. Carregando o chip nanofluido
- Remova os plugues de barreira seqüentemente à medida que o carregamento ocorre. Isso reduz a chance de carregar mal os poços.
- Transfira 3 μL para um chip multi array ou 5 μL para um chip de matriz única de cada ensaio de primer e misturas de amostras para as entradas correspondentes do chip nanofluidic de acordo com o plano preparado. Certifique-se de não introduzir bolhas, o que pode fazer com que o volume total transferido seja menor do que o desejado.
NOTA: Se houver algum poço que será executado sem um primer é importante que estes sejam carregados com mix mestre, substituindo o volume do primer por água. Isso se aplica a ambos os tipos de chip. Nesta fase, pode ser mais fácil colocar o chip em uma superfície escura, o que permitirá que os poços sejam vistos com mais facilidade.
11. Executando o chip nanofluido
NOTA: A primeira vez executando um chip de várias arrays, configure o arquivo de rastreamento selecionando ferramentas | Flex Six Use Tracking, clique em Novo,digite um nome de arquivo e selecione um local antes de clicar em "Feito".
- Abra o software de coleta de dados. Clique em Iniciar nova execução. Coloque o chip carregado no termociclista nanofluido com o código de barras voltado para fora.
- Escolha a configuração do projeto, se aplicável, clique em Próxima | Carga. Se estiver carregando um chip de várias matrizes, selecione as partições (arrays) a serem executadas.
- Selecione os testes de referênciado aplicativo, altere o tipo de aplicativo para Expressão genéticae altere a referência passiva para ROX. Selecione o ensaio do teste único,altere o tipo de sonda para Eva Greene clique em Next.
- Selecione o protocolo de ciclismo térmico GE FLEX seis Fast PCR+Melt v1 para executar um chip multi array, ou o protocolo GE 96.96 Fast PCR+Melt v2 para executar um chip de matriz única.
- Confirme se a exposição automática está selecionada e clique em Iniciar Execução.
12. Execução de post chip
NOTA: Esta seção só é necessária para chips multi array quando não estiver usando todo o chip.
- Tire o chip do termociclista nanofluido e carregue na máquina de escoramento PCR nanofluida e execute o script Post Run (153x), que dura 5 min.
- Rotule os plugues usados para referência pessoal.
NOTA: O chip agora pode ser armazenado à temperatura ambiente e as demais matrizes do chip podem ser executadas dentro de 2 meses.
13. Limpeza e análise de dados
- Abra os dados no software 'Análise pcrem tempo real '(Tabela de Materiais). Verifique a temperatura máxima de fusão para cada par de primer testado. Elimine os resultados que exibem mais de um pico de temperatura de fusão, para um determinado par de primer.
NOTA: Vários picos só aparecem ocasionalmente, presumivelmente quando os pares de primer formam dimers, ou de interações de primers de destino com outros primers na mistura de primer agrupada. - Exporte os dados como um arquivo de planilha 'heatmap' e elimine amostras ou primers com falha.
- Analisar os dados usando o método Delta-Ct padrão21. Para avaliação estatística, realize ANOVA unidirecional em níveis relativos de expressão.
Resultados
Validação do Worm-to-CT como método de preparação cDNA
Para testar se o protocolo Worm-to-CT é um método válido de extração de cDNA, foi comparado aos métodos padrão de extração guanidium tiocianato-fenol-clorofórmio. Os resultados são mostrados na Figura 3,onde o CDNA foi preparado a partir de uma média de ~1.000 vermes usando técnicas padrão de extração guanidium tiocianato-fenol-clorofóide22 e de 30 vermes usando o método Worm-to-CT. As amostras foram chocadas simultaneamente (30 min a 34 °C). Globalmente, os níveis de expressão hsp-70 mRNA por 100 ng do RNA total foram comparáveis usando ambos os métodos. No entanto, no caso da expressão hsp-70 mais alta (ou seja, em N2 após choque térmico) os níveis de expressão foram mais elevados com o método Worm-to-CT, indicando melhor sensibilidade.
Para determinar se uma redução esperada na expressão hsp em hsf-1(sy441)23, uma mutação no principal regulador transcricional dos acompanhantes moleculares23,24, poderia ser reproduzida, a indução de acompanhante transcricional após um breve choque térmico foi comparada. Com ambos os métodos foi detectada uma diminuição na indução hsp-70 em animais hsf-1(sy441). Isso era esperado, pois os animais mutantes hsf-1(sy441) exibem uma capacidade reduzida de induzir acompanhantes devido a uma truncação no domínio de transativação do HSF-1. Para a extração guanidium tiocianato-fenol-clorofórmio hsp70 diminuiu 82,7% em relação aos controles e 92,3% para Worm-to-CT em comparação com animais do tipo selvagem(Figura 3). Os resultados foram comparáveis entre ambos os métodos e comparáveis aos relatórios anteriores23. Esses resultados indicam que o método Worm-to-CT é uma alternativa válida às técnicas de síntese cDNA padrão.
Validação da plataforma PCR nanofluidics usada para amplificar metas de mRNA
Para testar a consistência dos resultados utilizando qPCR nanofluidic para amplificação da transcrição, os resultados do PCR obtidos a partir do método de volume Worm-to-CT foram comparados tanto em um sistema qPCR padrão (Tabela de Materiais) quanto em um sistema qPCR nanofluidic usando um chip multi array. A mudança da dobra na expressão de três genes diferentes, sma-3 (Figura 4A), sma-10 (Figura 4B), e dnj-26, foi monitorada(Figura 4C) em animais portadores de alelo nulo em dbl-1 (dbl-1(nk3)25 em comparação com contrapartes do tipo selvagem. O DBL-1 codifica o único ligante da via de sinalização da Proteína Morfogenética Óssea (BMP). sma-3 e sma-10 são genes codificando ortologias SMAD, componentes-chave da cascata de sinalização BMP. O DNJ-26 codifica um acompanhante molecular, alvo de sinalização BMP. Esses resultados mostram pouca ou nenhuma diferença na variação da dobra comparando os resultados dos dois métodos, resultando em valores P não significativos em 0,3113, 0,2635 e 0,3481 para sma-3, sma-10e dnj-26, respectivamente. Ao todo, esses resultados mostram que o método Worm-to-CT aplicado a amostras em massa é uma maneira eficiente e rápida de extrair RNA de poucos worms e fornece dados confiáveis quando juntamente com sistemas PCR padrão ou plataformas qPCR baseadas em nanofluidos de alto rendimento.
Comparação entre os níveis de expressão obtidos por amostras a granel com médias obtidas de vermes únicos
Os níveis relativos de expressão foram calculados utilizando-se o cDNA obtido a partir de amostras a granel (25 vermes) ou de uma média de 36 amostras de vermes únicos(Figura 5). Ambos os cDNAs foram obtidos usando o método Worm-to-CT e amplificados usando a tecnologia PCR nanofluida. Conforme observado na Figura 5A-C, para todos os acompanhantes testados (ou seja, hsp16.1, F44E5.4, hsp-70), os métodos detectaram níveis de expressão comparáveis. Esses resultados indicam que os parâmetros obtidos a partir de vermes únicos são confiáveis.
Aplicação de Worm-to-CT acoplado à tecnologia de nanofluidos para estimar parâmetros de expressão genética de um único verme
Como o chip de matriz única permite o monitoramento de até 96 transcrições de destino em 96 amostras individuais, é, portanto, adequado para monitorar a variabilidade individual na expressão da transcrição entre worms únicos. A Figura 6A apresenta um resultado representativo mostrando a expressão média de transcrições de múltiplos hsp de vermes únicos após um curto choque térmico. Como observado na figura, a variabilidade na expressão das transcrições diferiu dramaticamente entre diferentes genes(Figura 6A). Para se ter mais discernimento, o coeficiente de variação (CV) foi calculado dividindo o desvio padrão pela média dos níveis de expressão26 (Figura 6B). Três genes cujos valores de CV foram previamente estimados por métodos alternativos foram monitorados (dados não publicados). Duas transcrições estáveis (ife-1 e Y45F10D.4) e uma variável (nlp-2927) mostraram sua variabilidade esperada. O gráfico também retrata claramente a conhecida relação inversa entre valores de variabilidade e níveis de expressão26 (Figura 6B).
As réplicas técnicas são de suma importância para garantir a reprodutibilidade ao usar amostras em massa. No entanto, este não é necessariamente o caso para experimentos unicelulares14,15,28. Para determinar se o uso de réplicas técnicas é necessário para a estimativa dos parâmetros ao usar amostras de vermes únicos, 28 vermes individuais foram colhidos, após um curto choque térmico, e processados usando triplicados técnicos. Foram comparados os valores cv calculados a partir de dados de um único verme obtidos em triplicado (pontos azuis na Figura 7, CV técnico) versus os de cada transcrição obtida a partir de vermes individuais (pontos vermelhos na Figura 7, variabilidade biológica). Para cada transcrição testada, os CVs técnicos eram inferiores aos CVs biológicos, indicando que os triplicados técnicos não eram necessários para a estimativa dos parâmetros. O fato de que as réplicas técnicas não são necessárias aumenta o throughput do experimento sem comprometer a qualidade.

Figura 1: Visão geral do Protocolo Worm-to-CT.
Esta figura mostra uma breve visão geral das diferentes etapas necessárias para executar worms através do protocolo Worm-to-CT. Dois métodos opcionais são mostrados para a etapa de transcrição reversa; estes são métodos intercambiáveis para qualquer tipo de chip. Clique aqui para ver uma versão maior desta figura.

Figura 2: Visão geral da preparação e execução do qPCR nanofluido.
Esta figura retrata os preparativos para executar o sistema qPCR nanofluidic usando um chip multi array e um chip de matriz única. Clique aqui para ver uma versão maior desta figura.
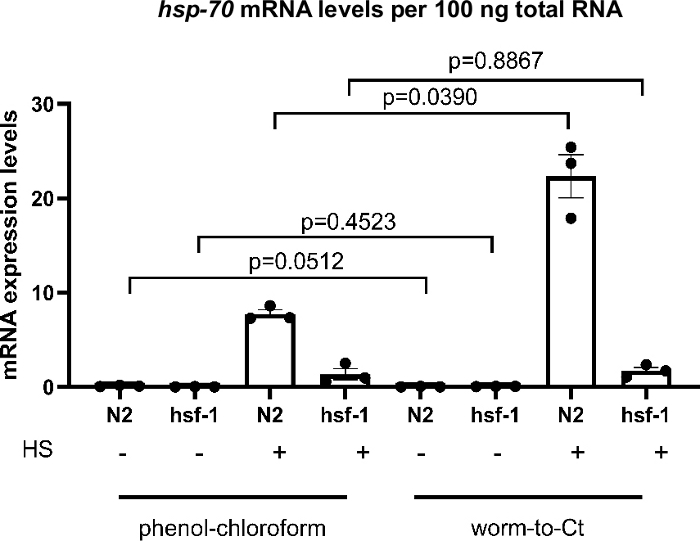
Figura 3: Protocolo worm-to-CT em amostras a granel forneceu resultados confiáveis.
Comparação do protocolo Worm-to-CT versus extração regular de tiocianato-fenol-clorofórmio22 em amostras a granel. Consistente com os achados anteriores, nos mutantes hsf-1(sy441), osníveisde transcrições do HSP em resposta ao choque térmico diminuíram. Os histogramas acima retratam a indução de hsp-70 na ausência de (-), ou seguindo (+) um choque térmico curto de 30 min a 34 °C. O cDNA foi obtido usando extração de tiocianato-cloro-cloro-cloro de guanidium aplicado a 1.000 vermes (esquerda) ou usando o método Worm-to-CT aplicado a 30 vermes agrupados (à direita). Foram comparados os níveis de expressão de hsp-70 por 100 ng do total de RNA obtidos por cada método. Como esperado, em hsf-1(sy441) a indução transcricional de hsp-70 em resposta ao choque térmico diminuiu significativamente em 82,7% usando guanidium tioocyanato-fenool-clorofórmio e em 92,3% usando o método Worm-to-CT. Os níveis de mRNA dos genes alvo foram normalizados em relação à média dos três genes de limpeza CDC-42, PMP-3e Ira-1. Cada ponto representa uma réplica biológica. Os dados foram transformados em log para análise estatística, pois não atenderam às convenções necessárias à análise paramétrica. A análise estatística foi feita utilizando um RM-One-way ANOVA usando o teste de múltiplas comparações de Sidak. Tipo selvagem = N2, hsf-1 = hsf-1(sy441). As barras denotam o erro padrão da média. Clique aqui para ver uma versão maior desta figura.
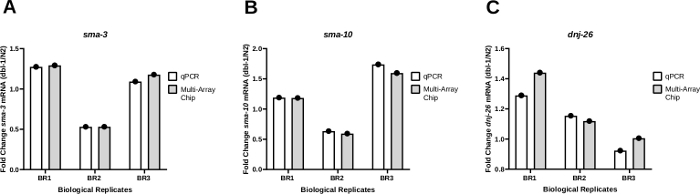
Figura 4: Os padrões de expressão foram consistentes entre os sistemas qPCR padrão e nanofluidic qPCR.
(A) O nível de expressão de sma-3 (A), sma-10 (B) ou dnj-26 (C) mRNA foi determinado através de qPCR regular e qPCR nanofluidic (chip multi-array) a partir de três réplicas biológicas de cDNA geradas através de Worm-to CT a partir da cepa tipo selvagem (N2) e da tensão de nocaute dbl-1(nk3) 25. Os níveis relativos de expressão de mRNA foram determinados para cada cepa utilizando o método Delta-Ct21. A mudança do fold foi então determinada dividindo os níveis de expressão obtidos em worms dbl-1(nk3) pelos níveis de mRNA correspondentes na cepa N2. Como mostrado no painel A,os padrões foram consistentes para ambos os métodos em cada réplica biológica individual. (B) e (C) são os mesmosdosníveis SMA-10 e DNJ-26 mRNA, respectivamente. Os níveis de mRNA alvo foram normalizados em relação aos genes de limpeza CDC-42 e PMP-3. A análise estatística foi calculada para cada gene utilizando um teste t emparelhado comparando os resultados das três réplicas biológicas produzidas através do qPCR padrão e aquelas geradas através de qPCR nanofluidic. Os valores P dessas comparações foram de 0,3113, 0,2635 e 0,3481 para sma-3, sma-10e dnj-26, respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 5: O uso do método Worm-to-CT em amostras a granel ou em worms únicos forneceu níveis semelhantes de expressão quando normalizados por verme.
Os níveis de expressão de (A) hsp-16.1/11,(B) F44E5.4, e (C) hsp-70 (C12C8.1) foram analisados em animais adultos jovens na ausência de choque térmico, seja realizando Worm-to-CT em uma maior parte de 25 animais, ou em 36 indivíduos solteiros. Quando os dados foram normalizados por worm, não houve diferença significativa entre os níveis obtidos por worm para cada transcrição usando ambos os métodos. Os níveis de mRNA dos genes alvo foram normalizados em relação à média dos três genes de limpeza CDC-42, PMP-3e Ira-1. As barras representam o erro padrão da média. Estatísticas = teste t emparelhado. Clique aqui para ver uma versão maior desta figura.
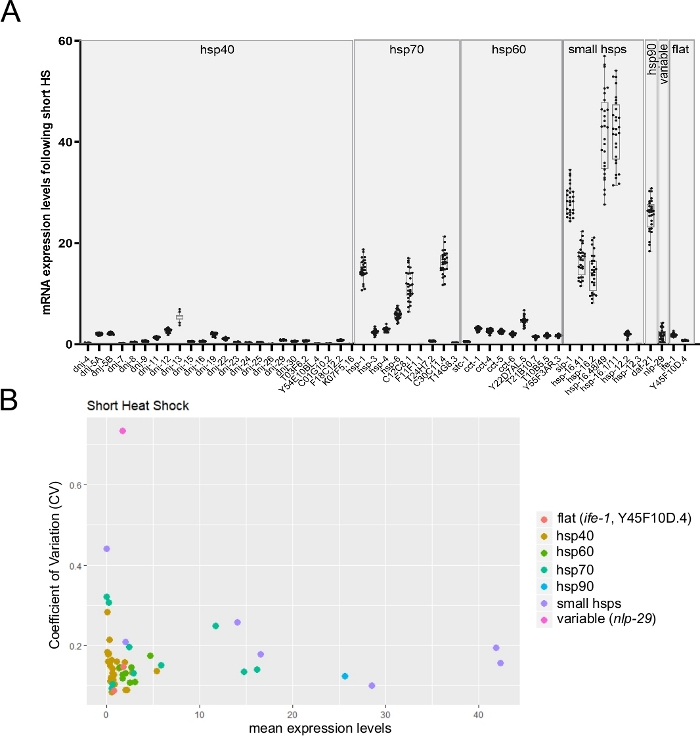
Figura 6: RT-qPCR de alto rendimento em worms únicos usando o método Worm-to-CT poderia monitorar a variabilidade inter-individual na expressão genética.
(A) Os níveis médios de expressão para 53 transcrições obtidas após a exposição a um choque térmico curto (30 min a 34 °C). As estacas de caixa representam a distribuição da expressão mRNA média de vermes individuais (uma média de três réplicas técnicas foram utilizadas por worm individual). Os pontos representam níveis de expressão em 28 vermes individuais. Os níveis de mRNA dos genes alvo foram normalizados em relação à média dos três genes de limpeza CDC-42, PMP-3e Ira-1. (B) O coeficiente da variação26 (CV) em função da expressão mRNA média para 53 transcrições após a exposição a um choque térmico curto foi calculado a partir de 28 animais individuais (dados brutos mostrados no painel B). O conjunto de transcrições inclui a variável nlp-29 transcrição27 e duas transcrições estáveis(ife-1 e Y45F10D.4; dados inéditos). O CV é a razão do desvio padrão para a média. Este CV foi utilizado para estimar a variabilidade inter-individual na expressão da transcrição entre vermes individuais. Como esperado, a variabilidade inter-individual escalou com diminuição dos níveis médios de expressão. Clique aqui para ver uma versão maior desta figura.
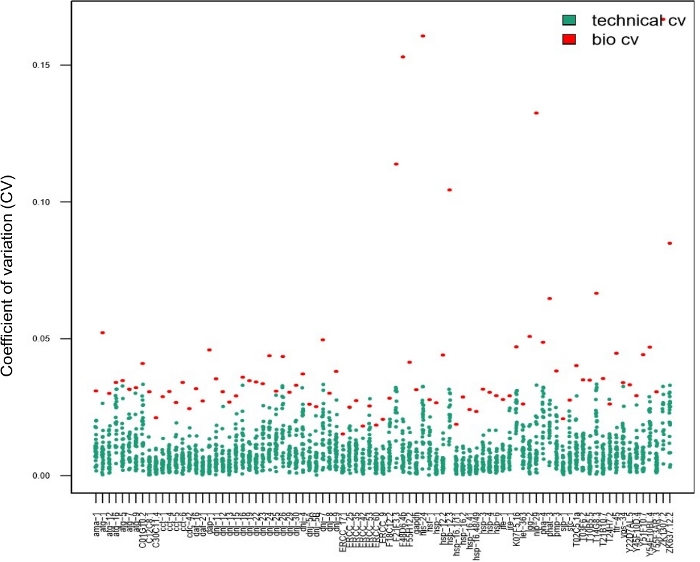
Figura 7: As réplicas técnicas não foram necessárias ao analisar a variabilidade inter-individual na expressão genética utilizando um chip nanofluido.
Os dados apresentados neste gráfico foram obtidos em 28 vermes individuais após um choque térmico curto (30 min a 34 °C). Cada ponto vermelho representa o coeficiente de variação (CV) dos níveis médios de expressão da transcrição para uma transcrição avaliada entre 28 vermes individuais (bio CV). Cada ponto azul representa o CV dos níveis de expressão entre três réplicas técnicas obtidas a partir de um único worm, por transcrição conforme avaliado (CV técnico). Este gráfico mostra que a variabilidade técnica (entre réplicas técnicas) foi muito menor do que a variabilidade biológica (entre vermes individuais), sugerindo que é desnecessário realizar réplicas técnicas em uma matriz de expressão genética nanofluida ao avaliar a expressão genética em vermes únicos, semelhante aos estudos unicelulares14,15,28. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Planeje o layout para um chip multi array. A tabela acima mostra um layout simples que pode ser utilizado ao planejar uma execução de chip multi array. À esquerda estão os espaços que devem ser preenchidos com as metas de interesse e à direita são espaços que devem ser preenchidos com as amostras de interesse. Cada conjunto de ensaios e amostras é emparelhado em termos numédes através do chip. Clique aqui para baixar esta tabela.
Tabela 2: Planeje o layout para um chip de matriz única. A tabela acima mostra um layout simples que pode ser utilizado ao planejar uma execução de chip de matriz única. À esquerda estão espaços que devem ser preenchidos com metas de interesse e à direita são espaços que devem ser preenchidos com as amostras de interesse. Clique aqui para baixar esta tabela.
Tabela 3: Lista de primers RT-qPCR utilizados neste estudo. Clique aqui para baixar esta tabela.
Tabela Suplementar 1: Primers do banco de dados de primers RT-qPCR. Clique aqui para baixar esta tabela.
Discussão
Neste artigo, o protocolo Worm-to-CT é mostrado como um método rápido e eficiente para extrair RNA de vermes únicos ou um pequeno pool de worms. O alto rendimento oferecido pelo sistema nanofluido torna-o ideal para quantificação de medidas de variabilidade inter-individual. Além disso, a alta sensibilidade deste método permite a detecção de genes expressos em níveis baixos que ficam abaixo da detecção ao usar tecnologias RNA-seq de um wormúnico 9.
Ao considerar a escolha do método para preparar cDNA a partir de worms únicos. Ly et al.29 otimizaram um protocolo que depende de proteinase K para digestão de cutículas. A cutícula é um grande obstáculo para o isolamento de moléculas de vermes e proteinase K fornece um método eficaz para quebrá-la. No entanto, proteinase K tem que ser inativado pelo calor para poder usar enzimas para transcrição reversa. Enquanto Ly et al. usaram uma exposição de 10 min a 96 °C, esta etapa foi evitada neste protocolo porque o RNA é facilmente degradável. Em vez de usar proteinase K, ciclos repetidos de congelamento foram usados para quebrar a cutícula. O congelamento é um método eficaz para quebrar a cutícula porque mais RNA pode ser isolado por verme. Ly et al. relatam que o total de RNA extraído por verme é de 35 ng usando proteinase K, enquanto este protocolo obtém 51,75 ng ± 6,74 SEM do total de RNA por worm. Evitar a exposição ao calor juntamente com as etapas de pré-amplificação aparentemente amplia o alcance dinâmico de detecção do Worm-to-CT em comparação com os protocolos padrão. Ly et al. relatório valores absolutos ct de 21,1 ± 0,15 para hsp-16.2 e 22,8 ± 0,17 para hsp-70 após choque térmico. Utilizando as mesmas condições de choque térmico (1 h a 30 °C), este protocolo obtém valores absolutos de TC de 17,93 ± 0,57 para hsp-16.2 e 21,13 ±0,33 para hsp-70. Isso indica que o método de congelamento proporciona maiores rendimentos de RNA e é mais apropriado para transcrições mal expressas.
Sistemas nanofluidos são ideais ao investigar um determinado conjunto de transcrições-alvo e o uso de um número menor (chip multi array) ou maior (chip de matriz única) permitindo a adaptação à escala do experimento. Para obter uma imagem imparcial de todas as transcrições expressas em um único worm, a escolha óbvia é usar sequenciamento de RNA. Se, no entanto, o foco do experimento é um conjunto menor, mas ainda relativamente grande de genes-alvo, é mais econômico utilizar este protocolo, desde que o pesquisador tenha acesso a uma máquina PCR nanofluida. O custo dos reagentes do sistema nanofluido e de um chip de matriz única é estimado em aproximadamente £13 por worm, enquanto os custos dos reagentes para sequenciamento de um único verme seriam de aproximadamente £60 por worm, sem incluir os custos de sequenciamento.
Ao considerar qual plataforma PCR usar, o método Worm-to-CT acoplado ao qPCR nanofluido oferece vantagens em relação ao tempo e rendimento. É possível obter 9.216 resultados de RT-qPCR em aproximadamente 2 dias de trabalho, enquanto a amplificação do mesmo número de alvos usando uma plataforma qPCR padrão levaria aproximadamente 5 semanas de trabalho usando 96 ensaios de placas de poço, executando quatro placas por dia. No entanto, se o número de alvos a serem testados for menor, então é mais econômico usar Worm-to-CT juntamente com uma máquina qPCR padrão. Os chips de matriz única não podem ser reprisados, então executar poços vazios diminui a eficiência de custo.
Uma limitação do método é a formação potencial de primer-primer dimers durante a etapa multiplexa, mas isso ocorre em menos de 1% dos casos. Embora o protocolo Worm-to-CT seja eficiente e forneça resultados confiáveis quando aplicado a worms únicos, há uma taxa de falha de cerca de 5%, o que provavelmente corresponde aos casos em que o verme permanece preso na tampa ou no topo do tubo durante a etapa de colheita.
Juntos, este método versátil e confiável oferece maior rendimento e sensibilidade em comparação com técnicas mais padrão. Este método pode ser muito útil para validação de telas de alto rendimento e é uma excelente escolha para monitorar ou validar níveis de expressão genética de um único verme. Este método pode ser aplicado a outras técnicas desafiadoras, como a quantitação da expressão genética a partir de tecidos isolados. Por exemplo, o isolamento de tecidos completos, como intestino, gôndas ou células isoladas pelos FACs, fornece material suficiente para realizar experimentos de sequenciamento de RNA. No entanto, quantidades limitadas de material muitas vezes levam a leituras duplicadas, o que impede a quantitação de transcrições raras. Neste cenário, o uso da tecnologia baseada em nanofluidos deve fornecer mais sensibilidade aos experimentos e aumentar o custo-eficiência se os pesquisadores precisarem monitorar apenas um subconjunto de todas as transcrições nesses tecidos ou células.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Sharlene Murdoch e ao Instituto Babraham Facilities pelo apoio. A JLP foi apoiada pelo Wellcome Trust (093970/Z/10/Z) e o OC é suportado pela ERC 638426 e BBSRC [BBS/E/B000C0426].
Materiais
| Name | Company | Catalog Number | Comments |
| 100µM stock primers for genes of interest. | |||
| 20X DNA Binding Dye | Fluidigm | 100-7609 | for 96.96 chip (Single-Array Chip) |
| 2X Assay Loading Reagent | Fluidigm | 100-7611 | |
| 384 well plates | |||
| 8-strip PCR tubes | |||
| 96 well ice block | |||
| 96 well plates | |||
| 96.96 Dynamic Array IFC | Fluidigm | BMK-M-96.96 | Referenced throughout the manuscript as "Single-Array Chip" |
| 96-well sealing tape | |||
| BioMark & EP1 Software | Fluidigm | 101-6793 | Contains: Biomark HD Data Collection software, Real-Time PCR Analysis software, SNP Genotyping Analysis software, Digital PCR Analysis software, Melt Curve Analysis software |
| BioMark or BioMark HD system | Fluidigm | 100-2451 K1 | Referenced throughout the manuscript as "nanofluidics thermocycler" |
| Control Line Fluid Kit for 96.96 and FlexSix IFCs | Fluidigm | 89000021 | Referenced throughout manuscript as "control line fluid" |
| DNA Suspension buffer | TEKnova | T0021 | |
| domed PCR caps | |||
| Exonuclease I | New England BioLabs | M0293L | |
| Exonuclease I reaction buffer | New England BioLabs | B0293S | |
| FLEXsix DELTAgene Sample Reagent | Fluidigm | 100-7673 | referenced throughout manuscript as "sample reagent" |
| FLEXsix Gene Expression IFC | Fluidigm | 100-6308 | referenced throughout manuscript as "Multi-Array Chip" |
| Fluidigm Real-Time PCR Analysis User Guide | Fluidigm | 68000088 | This is the protocol used as a basis for section 2 of the protocol, referenced within the manuscript. |
| IFC Controller MX | Fluidigm | 68000112 I1 | Referenced throughout the manuscript as "nanofluidics PCR priming machine" |
| IFC Controllers SOFTWEAR | Fluidigm | 100-2297 | Contains all softwear and scripts required for running the IFC controller MX |
| liquid nitrogen in dewar | |||
| Microcentrifuge | StarLab | C1301B-230V | Used to spin down PCR tube strips in the protocol. |
| Nuclease Free Water | |||
| plate spinner | Labnet | K4050725 | mini plate spinner, mps 1000. referenced through the protocol as "tabletop plate spinner" |
| Power SYBR Green Cells-to-Ct kit | invitrogen | 4402955 | This kit is that which is adapted for use in nematodes in the Worm-to-CT protocol. Contense: Store Stop Solution, DNase I and 20X RT Enzyme Mix at -20°C. Store Lysis Solution, 2X SYBR RT Buffer (referenced throughout the manuscript as RT buffer), and Power SYBR®Green PCR Master Mix (refferenced througout the manuscript as PCR Master Mix). This Kit is for 400 reactions, kits also available for 40 and 100 reactions. |
| PreAmp Master Mix | Fluidigm | 100-5580, 100-5581 | |
| Reverse Transcription Master Mix—480 reactions | Fluidigm | 100-6299 | One tube also available for 96 reactions (PN100-6298) |
| Rnase Free water | |||
| SsoFast EvaGreen Supermix with Low ROX | Bio-Rad Laboratories | 172-5211 | referenced throughout the manuscript as "fluorescent probe supermix" |
| Standard 96 and 384-well Thermal Cycler | |||
| TE Buffer (10mM Tris, pH8.0, 1.0mM EDTA | TEKnova | T0224 | Referenced throughout the manuscript as Tris-EDTA buffer |
| ThermoMixer C | Eppendorf | 5382000031 | Referenced throughout the text as "thermal mixer" |
| Trizol | Thermo-Fisher | 15596026 | Referenced through the protocol as "guanidium thiocyanate-phenol-chloroform" |
| Warm water bath |
Referências
- Raj, A., Peskin, C. S., Tranchina, D., Vargas, D. Y., Tyagi, S. Stochastic mRNA Synthesis in Mammalian Cells. PLoS Biology. 4 (10), 309(2006).
- Semrau, S., van Oudenaarden, A. Study lineage decision-making in vitro: emerging concepts and novel tools. Annual Review of Cell Developmental Biology. 31, 317-345 (2015).
- Kelsey, G., Stegle, O., Reik, W. Single-cell epigenomics: Recording the past and predicting the future. Science. 358 (6359), 69-75 (2017).
- Eling, N., Morgan, M. D., Marioni, J. C. Challenges in measuring and understanding biological noise. Nature Review Genetics. 20 (9), 536-548 (2019).
- Kaufmann, B. B., van Oudenaarden, A. Stochastic gene expression: from single molecules to the proteome. Current Opinion in Genetics & Development. 17 (2), 107-112 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , Edited by The C. elegans Research Community (2015).
- Casanueva, M. O., Burga, A., Lehner, B. Fitness trade-offs and environmentally induced mutation buffering in isogenic C. elegans. Science. 335 (6064), 82-85 (2012).
- Raj, A., Rifkin, A. A., Andersen, E., van Oudenaarden, A. Variability in gene expression underlies incomplete penetrance. Nature. 463 (7283), 913-918 (2010).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Serra, L., et al. Adapting the Smart-seq2 Protocol for Robust Single Worm RNA-seq. Bio-protocol. 8 (4), 2729(2018).
- Kaletsky, R., et al. Transcriptome analysis of adult Caenorhabditis elegans cells reveals tissue-specific gene and isoform expression. PLoS Biology. 14 (8), 1007559(2018).
- Cao, J., et al. Comprehensive single-cell transcriptional profiling of a multicellular organism. Science. 357 (6352), 661-667 (2017).
- Stegle, O., Teichmann, S. A., Marioni, J. C. Computational and analytical challenges in single-cell transcriptomics. Nature Review Genetics. 16 (3), 133-145 (2015).
- Ståhlberg, A., Kubista, M. The workflow of single-cell expression profiling using quantitative real-time PCR. Expert Review of Molecular Diagnostics. 14 (3), 323-331 (2014).
- Livak, K. J., et al. Methods for qPCR gene expression profiling applied to 1440 lymphoblastoid single cells. Methods. 59 (1), 71-79 (2013).
- Fluidigm. Real-Time PCR Analysis User Guide. , https://www.fluidigm.com/binaries/content/documents/fluidigm/resources/real-time-pcr-analysis-ug-68000088/real-time-pcr-analysis-ug-68000088/fluidigm%3Afile (2018).
- Huggett, J. F., et al. The digital MIQE guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clinical Chemistry. 59 (6), 892-902 (2013).
- U. S. National Library of Reference. Primer Blast. , Available from: https://www.ncbi.nlm.nih.gov/tools/primer-blast/ (2020).
- Bustin, S. A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. Journal of Molecular Endocrinology. 29 (1), 23-39 (2002).
- Nolan, T., Huggett, J., Sanchez, E. Good Practice guide for the application of quantitative PCR (qPCR), LGC. , (2013).
- Yuan, J. S., Reed, A., Chen, F., Stewart, C. N. Jr Statistical analysis of real-time PCR data. BMC Bioinformatics. 22 (7), 85(2006).
- He, F. Total RNA Extraction from C. elegans. Bio-protocol. Bio-101. 47, (2011).
- Hajdu-Cronin, Y. M., Chen, W. J., Sternberg, P. W. The L-Type Cyclin CYL-1 and the Heat-Shock-Factor HSF-1 Are Required for Heat-Shock-Induced Protein Expression in Caenorhabditis elegans. Genetics. 168 (8), 1937-1949 (2004).
- Douglas, P. M., et al. Heterotypic Signals from Neural HSF-1 Separate Thermotolerance from Longevity. Cell Reports. 12 (7), 1196-1204 (2015).
- Zhang, X., Zhang, Y. Dbl-1 a TGF-beta is essential for C. elegans aversive olfactory learning. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 17081-17086 (2012).
- Sørensen, J. B. The Use and Misuse of the Coefficient of Variation in Organizational Demography Research. Sociological Methods & Research. 30 (4), 475-491 (2002).
- Pujol, N. Distinct innate immune responses to infection and wounding in the C. elegans epidermis. Current Biology. 18 (7), 481-489 (2008).
- Brennecke, P., et al. Accounting for technical noise in single-cell RNA-seq experiments. Nature Methods. 10 (11), 1093-1095 (2013).
- Ly, K., Reid, S. J., Snell, R. J. Rapid RNA analysis of individual Caenorhabditis elegans. MethodsX. 7 (2), 59-63 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados