Method Article
Поперечное секционирование зрелого риса (Oryza sativa L.) Ядра для сканирующей электронной микроскопии с использованием наконечников пипеток в качестве поддержки иммобилизации
В этой статье
Резюме
Этот протокол позволяет готовить поперечные срезы семян зерновых культур (например, риса) для анализа морфологии эндосперма и гранул крахмала с помощью сканирующей электронной микроскопии.
Аннотация
Гранулы крахмала (SGs) демонстрируют различную морфологию в зависимости от вида растений, особенно в эндосперме семейства Poaceae. Фенотипирование эндосперма может быть использовано для классификации генотипов на основе морфотипа SG с использованием сканирующего электронно-микроскопического (SEM) анализа. SG можно визуализировать с помощью SEM путем нарезки ядра (околоплодниковые, алейроновые слои и эндосперм) и обнажения органеллярного содержимого. Современные методы требуют, чтобы рисовое ядро было встроено в пластиковую смолу и разрезано с использованием микротома или встроено в усеченный наконечник пипетки и разделено вручную с помощью лезвия бритвы. Первый метод требует специализированного оборудования и отнимает много времени, в то время как второй вводит новый набор проблем в зависимости от генотипа риса. Меловые сорта риса, в частности, представляют проблему для этого типа сечения из-за рыхлого характера их эндоспермальной ткани. Здесь представлена методика приготовления полупрозрачных и меловых зерен риса для микроскопии, требующая только кончиков пипетки и лезвия скальпеля. Подготовка срезов в пределах кончика пипетки предотвращает разрушение эндосперма рисового ядра (для полупрозрачных или «стекловидных» фенотипов) и крошку (для меловых фенотипов). Используя эту технику, можно наблюдать паттерн клеток эндосперма и структуру неповрежденных SG.
Введение
Гранулы крахмала (SGs) демонстрируют различную морфологию в зависимости от вида растений, особенно в эндосперме семейства Poaceae 1,2. Фенотипирование эндосперма может быть использовано для классификации генотипов на основе фенотипа SG с использованием сканирующего электронно-микроскопического анализа. SG можно визуализировать с помощью сканирующей электронной микроскопии (SEM) путем разрезания ядра и удаления клеточных стенок эндосперма2.
Целью этого метода является легкая подготовка поперечных срезов рисовых зерен исключительно для быстрого анализа SEM. Развитие этой методики было мотивировано необходимостью быстрого подхода к поперечному сечению, при котором образцы подготавливаются для SEM-микроскопии непосредственно перед визуализацией с использованием минимального оборудования.
Этот метод включает в себя введение шелушащегося рисового ядра в кончик пипетки для полной иммобилизации. Это особенно важно при поперечном сечении меловых рисовых ядер фенотипов, которые рыхлые и легко крошатся под давлением3. Мел является нежелательным качеством риса, поскольку он влияет на внешний вид ядра и заставляет ядро легко ломаться во время полировки и измельчения3. Мел представляет собой непрозрачную область в поперечном сечении ядра, которую можно наблюдать невооруженным глазом; на микроскопическом уровне мел характеризуется мелкими, слабо упакованными гранулами крахмала. Причины мела могутбыть генетическими 4,5 или экологическими6,7.
Поперечные сечения семян зерновых традиционно готовились с использованием химических методов фиксации и секционирования после встраивания образца в парафиновый воск или другую твердую матрицу4,8,9,10. В 2010 году метод Мацусима был введен как способ избежать сложной и трудоемкой пробоподготовки рисовых зерен4. Этот метод включал введение шелушащегося рисового ядра в усеченный наконечник пипетки. Наконечник удерживается неподвижно блочным триммером, а тонкие, частичные участки эндосперма собираются с помощью ручного лезвия бритвы. Еще одна быстрая методика, разработанная в 2016 году, позволила тонкое целое секционирование широкого спектра сухих семян, включая меловые сорта10. Эти методы мотивировали развитие представленной здесь быстрой техники.
Этот новый метод подходит для исследователей, которые хотят получить неповрежденные поперечные сечения рисовых зерен для фенотипирования эндосперма и анализа морфологии крахмала с использованием SEM.
Настоящий протокол представляет собой адаптацию метода4усеченного наконечника пипетки Мацусима с несколькими заметными изменениями: (1) ядра не впитываются ни в одной точке метода; (2) Для подготовки секций не требуется ни блочного триммера, ни ультрамикротома. В этом исследовании были исследованы дикий тип «полупрозрачного» сорта(Oryza sativa L. ssp. japonica cv. Nipponbare) и мутагенизированная «меловая» линия Nipponbare (ssg1, некачественное крахмальное зерно1)4. Эти два сорта были отобраны для анализа здесь, чтобы продемонстрировать технические и визуальные различия в обработке полупрозрачных и меловых рисовых секций.
протокол
1. Приготовление поперечного рисового сечения
- Удаление шелухи сухих, неповрежденных ядер, как показано на рисунке 1А.
- Разрыхлите шелуху и очистите рисовые ядра, измельчив ядра между двумя плоскими резиновыми пробками. Удалите шелушащиеся рисовые ядра из метелки, если это необходимо.
- Поместите одно ядро на плоскую резиновую пробку на рабочем столе(рисунок 1B). Убедитесь, что эта пробка остается неподвижной.
- Используйте вторую плоскую резиновую пробку(рисунок 1C)для истирания ядра, скручивая его против первой резиновой пробки, используя достаточное давление(рисунок 1D). Удалите шелуху с ядра, позаботившись о том, чтобы не разрушить эндосперм. Удалите оставшуюся шелуху с помощью мелких щипцов. Ядро с шелушением показано на рисунке 1E.
- Используя тонкие щипцы, вставьте отдельное ядро шелухи в пластиковый наконечник пипетки (размер 250 мкл, одно семя/наконечник)(рисунок 1F). Убедитесь, что эмбриональный конец ядра обращен к (коническому) концу кончика пипетки(рисунок 1G).
ПРИМЕЧАНИЕ: Вставка ядра таким образом гарантирует, что ядро будет как можно плотнее помещаться в кончик пипетки, поскольку ядро будет более узким к своему проксимальному концу. - Вставьте второй наконечник пипетки объемом 250 мкл, чтобы заставить ядро врезаться в наконечник пипетки и сохранить ядро неподвижным во время сечения, следя за тем, чтобы не повредить ядро или не согнуть второй наконечник пипетки(рисунок 1H). Правильная сборка «телескопа» показана на рисунке 1I.
- Уложите наконечник пипетки плоско на рабочий стол и удерживайте на месте вручную(рисунок 1J). С другой стороны, используйте острое лезвие скальпеля (No 20), чтобы разрезать центр ядра и отрезать конец наконечника пипетки(рисунок 1K). С помощью скальпеля вырежьте участки рисового ядра толщиной 1 мм(рисунок 1л).
ПРИМЕЧАНИЕ: Секция ядра плотно заключена в пластиковое кольцо(рис. 1M). Средняя толщина сечения для трех примерных генотипов приведена в таблице 1. Участки значительно тоньше 1 мм будут разрушаться или крошиться. Важно отметить, из какой части ядра происходит каждая секция, если этот эксперимент проводится на нескольких сортах риса для сравнения, так как морфология крахмала варьируется по всему эндосперму11.
2. Микроскопия отраженного света поперечных срезов риса
- Используйте тонкие щипцы, чтобы поместить поперечные рисовые срезы (подготовленные в разделе 1) на черный кусок черной бумаги тяжелого калибра.
- Получение световых изображений поперечных участков Ниппонбаре с помощью стереомикроскопа с установленными гусиными шеями для косого освещения, как показано на рисунке 1N-S.
- Наблюдайте морфологию эндосперма при по крайней мере 10-кратном увеличении.
ПРИМЕЧАНИЕ: Любой источник эпилайта предпочтительнее яркой полевой микроскопии, поскольку срезы, полученные с помощью этого метода, недостаточно тонкие для прохождения света.
3. Сканирующая электронная микроскопия поперечных срезов риса
- Поместите образцы на углеродный диск, прикрепленный к алюминиевой заглушке, и поместите на держатель для образцов для снижения заряда. Снимите пластиковое кольцо с крепления наконечника пипетки с помощью тонких щипцов, чтобы предотвратить попадание пластика в вакуумный аппарат SEM.
ПРИМЕЧАНИЕ: Изображения эндоспермальных клеток, SG и подгранул получены с помощью настольной машины SEM, которая не требует, чтобы образцы были покрыты напылением. - Получение изображений с помощью высокочувствительного многомодового детектора обратного рассеяния электронов (BSE) на 10 кВ.
Результаты
Дикие типы Nipponbare(рисунок 2A)и ssg1 (рисунок 2B)рассматривались под тремя увеличениями: 260x, 920x и 4200x. Этот метод позволяет получать срезы достаточного качества для наблюдения за всей эндоспермальной клеткой(рисунок 3А),составными гранулами крахмала(рисунок 3В)и отдельными подгранулами(рисунок 3С). Обработка шелухистых ядер занимает больше времени, чем полированных ядер, поскольку сухая шелуха должна быть удалена путем истирания перед секционированием. Меловые ядра также требуют больше времени для обработки, чем полированные полупрозрачные ядра, поскольку необходимо соблюдать осторожность, чтобы не разрушить ядро во время секционирования. Правильно подготовленный рисовый срез должен быть толщиной примерно 0,9 мм(таблица 1)с минимальным или нулевым разрушением эндосперма(рисунок 1N)и неповрежденными слоями околоплодника и алейронов(рисунок 1O). Неправильное размещение скальпеля на кончике пипетки при секционировании может привести к «сколу» срезов(рисунок 1P). Аналогичным образом, яркие полевые изображения оптимальных поперечных сечений ssg1 (рисунок 1Q)продемонстрировали неповрежденные слои эндосперма, околоплодника и алевронов неповрежденными и доступными для визуализации(рисунок 1R). Сломанный меловой участок ядра(рисунок 1S)все еще может быть использован для визуализации, если единственной целью является наблюдение за SGs, но паттерн эндоспермальных клеток не будет виден. Сломанный участок может быть трудно обрабатывать для анализа. Большее срезание клеточных стенок эндосперма наблюдалось у дикого типа Nipponbare, так как клетки более плотно упакованы и менее рыхлые, чем ядра ssg1. В секциях ssg1 не наблюдалось сдвига клеток эндосперма, а составные гранулы крахмала неповреждены.
Рисунок S1 демонстрирует надежность результатов с использованием метода «телескопа» для секционирования рисовых зерен. Рисовые линии, идентифицированные как полупрозрачные производители ядра – гибридная линия твердого крахмала дикого типа (RS) Xieyou 7954(Oryza sativa L. ssp. indica)12,13,14 (рисунок S1A)и кобальтовый мутант RS11113,15 (рисунок S1B)производили участки, через которые свет был виден с помощью стереомикроскопа. Соответствующие изображения SEM показали, что эти линии производят «нормальный» фенотип эндосперма риса: плотно упакованные, многогранные гранулы крахмала. Производители меловых ядер, коммерческая разновидность Yi-Tang16 (рисунок S1C)и RS413, мутантRS11115 (рисунок S1D),демонстрировали белые, непрозрачные участки ядра. Соответствующие изображения SEM отображали заметно отличающуюся морфологию по сравнению с полупрозрачной фоновой линией RS дикого типа: гранулы крахмала были круглыми и свободно упакованными. Дикий тип Xiushui 11(Oryza sativa L. ssp. japonica)(Рисунок S1E)и его мутант KMD1 (Kemingdao1), которые экспрессируют ген Cry1Ab для ингибирования хищничества насекомых17,18,19 (Рисунок S1F),демонстрируют участки и морфотипы эндосперма, похожие на полупрозрачные линии RS.
Представленная здесь методика является оптимальной для подготовки образцов рисовых ядер мелового типа для фенотипического анализа, но также обеспечивает преимущества для секционирования полупрозрачных фенотипов рисовых ядер20:нарезка образцов с использованием давления сверху снижает риск разрушения эндосперма и дислокации. Образцы могут быть легко подготовлены в течение нескольких секунд(таблица 2). Несколько генотипов были проанализированы с использованием этой методики для проверки ее эффективности(таблица 3). Как показано на рисунке S2,этот метод может быть применен к семенам других видов. Модель monocot Brachypodium distachyon производит очень твердые семена, содержащие только B-гранулы крахмала21,в которых отсутствует пуроиндолин А, белок, который придает мягкость гранулам крахмала22. Еще удалось получить неповрежденное поперечное сечение(рисунок S2A). Получение неповрежденного поперечного сечения из мягкой белой озимой пшеницы (SWWW) было сложной задачей, но может быть выполнено(рисунок S2B). Семена SWWW богаты пуроиндолином А и большие по сравнению с семенами дистахиона B. и рисовыми ядрами. Эти семена часто крошатся при секционировании с помощью телескопа.
| Генотип | Средняя ширина сечения (мкм) с использованием телескопа | Средняя ширина сечения (мкм) сечение от руки |
| Ниппонбаре (шелуха) | 971.7 ± 152.4ab | 1059.571 ± 394.2ab |
| Сею 7954 | 825.1 ± 128.3b | 1306.187 ± 179.1а |
| РС4 | 910.6 ± 165.0ab | 1126.694 ± 395.3ab |
| Средние, за которыми следуют одни и те же буквы, существенно не отличаются при P < 0,01 с использованием одностороннего дисперсионного анализа (ANOVA) и теста Туки (n = 10). Статистический анализ проводился с использованием программного обеспечения JMP 15. | ||
Таблица 1: Средняя толщина сечения ядра.
| Генотип | Среднее время (с)* |
| Ниппонбаре (шелуха) | 14.7 ± 1.36a |
| Сею 7954 | 9.81 ± 0.98b |
| РС4 | 11.9 ± 1.28c |
| *С помощью телескопа. | |
| Средние, за которыми следуют одни и те же буквы, существенно не отличаются при P < 0,01 с использованием одностороннего дисперсионного анализа (ANOVA) и теста Туки (n = 10). Статистический анализ проводился с использованием программного обеспечения JMP 15. | |
Таблица 2: Среднее время пробоподготовки.
| Генотип | Фон | Качество |
| Ниппонбаре | Дикий тип | Просвечивающий |
| Крахмальное зерно некачественное1 (ssg1) | Ниппонбаре | Меловой |
| Устойчивый крахмал (RS) Xieyou 7954 | Дикий тип | Просвечивающий |
| РС111 | Сею 7954 | Просвечивающий |
| РС4 | РС111 | Меловой |
| Yi-Tang, «Новая жизнь», бренд Lujuren | Сею 7954 | Меловой |
| Сюшуй 11 | Дикий тип | Просвечивающий |
| Кемингдао1 (KMD1) | Сюшуй 11 | Просвечивающий |
Таблица 3: Генотипы риса, рассмотренные в данном исследовании.

Рисунок 1: Подготовка поперечных рисовых срезов. (A) Ядро Nipponbare дикого типа с неповрежденной шелухой. (В).Ядро помещено на плоскую резиновую пробку диаметром четыре дюйма. (C)Шелуху удаляли путем измельчения ядра между двумя резиновыми пробками. (D) Шелуха была отделена от рисового ядра. (E)Крупный план шелухи рисового ядра. Показан конец эмбриона. (F)Введение ядра в наконечник пипетки с использованием тонких щипцов. (G)Ядро было помещено в дистальный конец кончика пипетки. (H)Вставка второго наконечника пипетки для обездвиживания ядра для сечения (сборка "телескопа"). (I)Рисовое ядро плотно прилегало к дистальному концу кончика пипетки. (J)Секционирование рисового ядра в пределах сборки. (K) Крупный план разреза секции. (L)Секция ядра, заключенная в пластиковое кольцо. (M) Крупный план поперечного сечения. (N) Поперечное сечение дикого типа Nipponbare. (O) Крупный план эндосперма в секции дикого типа Nipponbare. (P) Бедный, неоптимальный участок ядра дикого типа Nipponbare. (Q) Поперечное сечение мутанта Nipponbare ssg14. (R) Крупный план эндоферма в секции ssg1. (S) Бедный, неоптимальный раздел ssg1. Стержень (панели A, N-S)= 1 мм. Целое рисовое ядро и срезы были визуализированы с помощью стереомикроскопа с цифровой зум-камерой и лампами на гусиной шее. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
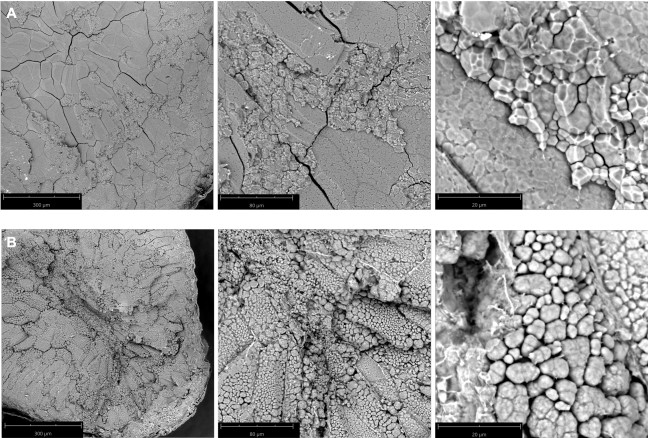
Рисунок 2: SEM-изображения поперечных секций ядра. (A) Дикий тип Nipponbare, полупрозрачный сорт. Составные гранулы крахмала плотно сцементировались друг к другу; (B) Nipponbare mutant ssg14, меловой фенотип. Составные гранулы крахмала были слабо упакованы и не имели цементирующей природы морфотипа крахмала дикого типа Nipponbare. Увеличение слева направо: 260x, 920x и 4200x. Длина стержня указывается в панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
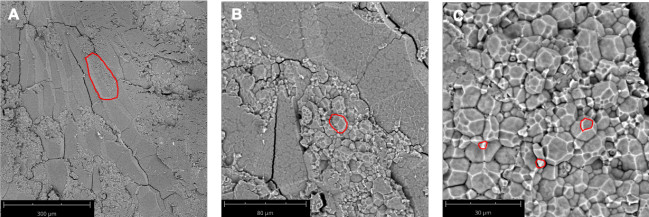
Рисунок 3: Микроскопическая анатомия SEM поперечного участка ядра Xiushui 11. (A) Одна эндоспермальная клетка выделена красным цветом. 260-кратное увеличение. (B) Составная гранула крахмала очерчена красным цветом. 920-кратное увеличение. (C) Множественные крахмальные субгранулы выделены красным цветом. 2250x увеличение. Длины стержней указаны на панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок S1: Поперечные срезы других генотипов риса, подготовленные для SEM с использованием этой методики. (A) Устойчивый крахмал (RS) Xieyou 795412. (B) RS111, прозрачный мутант с высоким RS 795413. (C) RS4, меловой мутант RS11115. (D) Yi-Tang, коммерческий сорт риса с высокимсодержанием амилозы 16. (E) Сюшуй 11. (F) KMD1 (Kemingdao1)17,18,19. 10-кратное увеличение для ярких полевых изображений. Белая полоса = увеличение 1 мм 2250x для изображений SEM. Длины стержней указаны на панелях. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Рисунок S2: Техника полезна для других семян. (A) Поперечное сечение семян ложного фиолетового брома(Brachypodium distachyon L. accession Bd21). (B) Поперечное сечение семян мягкой белой озимой пшеницы (Triticum aestivum L. cv. Augusta). Яркое поле, 20-кратное увеличение. Бар = 1 мм. Пожалуйста, нажмите здесь, чтобы загрузить этот рисунок.
Обсуждение
Метод, представленный здесь, представляет собой быстрый, простой и острый подход к подготовке поперечных сечений риса для визуализации SEM на рабочем столе. Этот метод секционирования позволяет быстро наблюдать структуру эндосперма, форму, размер и рисунок клеток эндосперма, составные гранулы и морфологию крахмала. Для целей фенотипирования эндосперма и скрининга зародышевой плазмы критически важно получить целое поперечное сечение рисового ядра4,23,24. Крайне важно вставить ядро полностью в кончик пипетки, чтобы давление лезвия скальпеля не заставило эндосперм крошиться или разрушаться. При условии правильной конструкции «телескопа» образцы могут быть подготовлены для визуализации в течение 15 секунд(таблица 2)с использованием материалов, уже имеющихся в наличии в типичных лабораторных условиях. Этот метод применим к поперечному сечению любого эллипсоидального семени диаметром около четырех миллиметров в его самой широкой точке. Семена модельной травы Brachypodium distachyon (рисунок S2A)могут быть аналогичным образом разделены, но не остаются заключенными в пределах кольцевого кольца. Более крупные семена, такие как пшеница, легко ломаются и требуют ухода при секционировании(рисунок S2B).
Тем не менее, есть несколько ограничений для техники, представленной здесь. Участки, полученные с помощью этого метода, недостаточно тонкие для прохождения света, что запрещает использование этого метода для микроскопических подходов на основе пропускаемого света, таких как яркое поле (максимальная толщина образца 500 мкм для секций рисового ядра25)и просвечивающая электронная микроскопия (TEM) (максимальная толщина образца 500 нм26 ). Использование наконечника пипетки в качестве «матрицы» секционирования также ограничивает размер семян, которые могут быть разделены с помощью этой техники. Для адаптации этого метода для видов, сильно отличающихся от риса, потребуется дальнейшее устранение неполадок, а размер «матрицы» ограничен размером наконечников пипеток, доступных для покупки.
Еще одним явным преимуществом, которое обеспечивает этот метод, является качество образцов, которые могут быть получены из рисовых зерен мелового фенотипа. Стоит отметить, что даже исследование Мацусимы признало, что было трудно получить поперечные сечения с использованием этого конкретного метода для меловых фенотипов4,воспроизведенных в этом исследовании с целью сравнения(рисунок 1S). В их случае возникла необходимость химически закрепить их меловые образцы риса и встроить их в смолу для секционирования. Новая методика, в сочетании с настольной SEM-визуализацией, позволяет исследователю легко готовить поперечные срезы рисовых зерен для микроскопии с большей консистенцией, чем без поддержки иммобилизации(таблица 3).
В новую эру феномики и метаболомики важно контролировать мутагенизированные линии и библиотеки с транспозонными метками, чтобы лучше понять функцию и важность крахмала в семенах. Кроме того, Международный генный банк риса содержит более 130 000 рисовых присоединений27. Метод быстрого фенотипирования семян, подобный представленному здесь, ускорит классификацию и отбор проб для питательного качества28. Наконец, этот метод может быть полезен в свете посягательств на последствия изменения климата. Сезонный высокотемпературный стресс во время наполнения зерна уже был идентифицирован как основная причина мела6,но недавние исследования показали, что повышение глобальных температур связано с увеличением меловости риса7,29. Такое ускоренное фенотипирование эндосперма может помочь обеспечить широкое сельскохозяйственное представление о влиянии повышения глобальных температур.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарны Systems for Research (SFR Corp.) за использование их настольного SEM-инструмента Phenom ProX, а также за техническую помощь, предоставленную Марией Пиларинос (Systems for Research (SFR) Corp.) и Хлоей ван Остенде-Триплет (Cell Biology and Image Acquisition Core Facility, медицинский факультет Университета Оттавы). Финансирование было предоставлено Фондом низкоуглеродных инноваций (LCIF) от Министерства экономического развития, создания рабочих мест и торговли правительства Онтарио и Proteins Easy Corp.
Материалы
| Name | Company | Catalog Number | Comments |
| JMP 15 | SAS | N/A | N/A |
| Leit Adhesive Carbon Tabs 12 mm (Pack of 100) | Agar Scientific | AGG3347N | N/A |
| Phenom Pro Desktop SEM | Thermo Scientific | PHENOM-PRO | N/A |
| Pipette Tips RC UNV 250 µL | Rainin | 17001116 | N/A |
| SEM Pin Stub Ø12.7 Diameter Top, Standard Pin, Aluminium | Micro to Nano | 10-002012-50 | N/A |
| Shandon Microdissecting Fine Tips Thumb Forceps, Fine Tips, 12.7 cm | Thermo Scientific | 3120019 | N/A |
| Shandon Scalpel Blade No. 20, Sterile, 4.5 cm | Thermo Scientific | 28618256 | N/A |
| Shandon Stainless-Steel Scalpel Blade Handle | Thermo Scientific | 5334 | N/A |
| Zeiss V20 Discovery Stereomicroscope | Zeiss | N/A | N/A |
Ссылки
- James, M. G., Denyer, K., Myers, A. M. Starch synthesis in the cereal endosperm. Current Opinion in Plant Biology. 6 (3), 215-222 (2003).
- Shapter, F. M., Henry, R. J., Lee, L. S. Endosperm and starch granule morphology in wild cereal relatives. Plant Genetic Resources. 6 (2), 85-97 (2008).
- Ashida, K., Iida, S., Yasui, T. Morphological, physical, and chemical properties of grain and flour from chalky rice mutants. Cereal Chemistry. 86 (2), 225-231 (2009).
- Matsushima, R., Maekawa, M., Fujita, N., Sakamoto, W. A rapid, direct observation method to isolate mutants with defects in starch grain morphology in rice. Plant and Cell Physiology. 51 (5), 728-741 (2010).
- Zhao, X., et al. Identification of stable QTLs causing chalk in rice grains in nine environments. Theoretical and Applied Genetics. 129 (1), 141-153 (2016).
- Nagato, K., Ebata, M. Effects of high temperature during ripening period on the development and the quality of rice kernels. Japanese Journal of Crop Science. 34 (1), 59-66 (1965).
- Zhao, X., Fitzgerald, M. Climate change: implications for the yield of edible rice. PLoS One. 8 (6), 66218 (2013).
- Zhao, Z. K., Mu, T. H., Zhang, M., Richel, A. Effects of high hydrostatic pressure and microbial transglutaminase treatment on structure and gelation properties of sweet potato protein. LWT - Food Science and Technology. 115, 108436 (2019).
- Feiz, L., et al. Puroindolines co-localize to the starch granule surface and increase seed bound polar lipid content. Journal of Cereal Science. 50 (1), 91-98 (2009).
- Zhao, L., Pan, T., Guo, D., Wei, C. A simple and rapid method for preparing the whole section of starchy seed to investigate the morphology and distribution of starch in different regions of seed. Plant Methods. 14 (1), 16 (2018).
- Zhao, L., Pan, T., Cai, C., Wang, J., Wei, C. Application of whole sections of mature cereal seeds to visualize the morphology of endosperm cell and starch and the distribution of storage protein. Journal of Cereal Science. 71, 19-27 (2016).
- Li, C., Dong, S., Li, G., Yuan, G., Dong, W. Breeding and application of the new combination of hybrid rice "Xieyou 7954". Journal of Zhejiang University (Agriculture and Life Sciences). 19 (3), 179-181 (2002).
- Shu, X., Jia, L., Ye, H., Li, C., Wu, D. Slow digestion properties of rice different in resistant starch. Journal of Agricultural and Food Chemistry. 57 (16), 7552-7559 (2009).
- Zhou, H., et al. Critical roles of soluble starch synthase SSIIIa and granule-bound starch synthase Waxy in synthesizing resistant starch in rice. Proceedings of the National Academy of Sciences. 113 (45), 12844-12849 (2016).
- Yang, C. Z., et al. Starch properties of mutant rice high in resistant starch. Journal of Agricultural and Food Chemistry. 54, 523-528 (2006).
- Zhou, Y., Zou, Y., Jiang, Y., Li, B. Detection methods for resistance starch content of Yi-Tang rice and optimization of pretreatment. Food Science and Biotechnology. 36, 416-419 (2017).
- Cheng, X., Sardana, R., Kaplan, H., Altosaar, I. Agrobacterium-transformed rice plants expressing synthetic cryIA(b) and cryIA(c) genes are highly toxic to striped stem borer and yellow stem borer. Proceedings of the National Academy of Sciences of the United States of America. 95 (6), 2767-2772 (1998).
- Liu, H., et al. Rapid detection of P-35S and T-nos in genetically modified organisms by recombinase polymerase amplification combined with a lateral flow strip. Food Control. 107, 106775 (2020).
- Shu, Q., et al. Transgenic rice plants with a synthetic cry1Ab gene from Bacillus thuringiensis were highly resistant to eight lepidopteran rice pest species. Molecular Breeding. 6 (4), 433-439 (2000).
- Lisle, A. J., Martin, M., Fitzgerald, M. A. Chalky and translucent rice grains differ in starch composition and structure and cooking properties. Cereal Chemistry. 77 (5), 627-632 (2000).
- Chen, G., et al. Dynamic development of starch granules and the regulation of starch biosynthesis in Brachypodium distachyon: comparison with common wheat and Aegilops peregrina. BMC Plant Biology. 14 (1), 198 (2014).
- Giroux, M. J., Morris, C. F. Wheat grain hardness results from highly conserved mutations in the friabilin components puroindoline a and b. Proceedings of the National Academy of Sciences of the United States of America. 95 (11), 6262-6266 (1998).
- Matsushima, R., Hisano, H. Imaging amyloplasts in the developing endosperm of barley and rice. Scientific Reports. 9, 3745 (2019).
- Matsushima, R., et al. Amyloplast-localized SUBSTANDARD STARCH GRAIN4 protein influences the size of starch grains in rice endosperm. Plant Physiology. 164 (2), 623-636 (2014).
- Monjardino, P., et al. Development of flange and reticulate wall ingrowths in maize (Zea mays L.) endosperm transfer cells. Protoplasma. 250 (2), 495-503 (2013).
- Tizro, P., Choi, C., Khanlou, N. Sample preparation for transmission electron microscopy. Methods in Molecular Biology. 1897, 417-424 (2019).
- Liu, Q. H., Zhou, X. B., Yang, L. Q., Li, T. Effects of chalkiness on cooking, eating and nutritional qualities of rice in two indica varieties. Rice Science. 16 (2), 161-164 (2009).
- Morita, S., Wada, H., Matsue, Y. Countermeasures for heat damage in rice grain quality under climate change. Plant Production Science. 19 (1), 1-11 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены