Method Article
L'importance de la concentration de protéines correct pour Cinétique et Détermination d'affinité en analyse structure-fonction
Dans cet article
Résumé
On applique l'étiquette sans analyse de l'interaction des protéines avec X100 Biacore structure-fonction de l'analyse de la liaison de plusieurs mutants cystatine B à travers la papaïne caractérisation cinétique. Étalonnage sans analyse de concentration (ACCP) mesure la concentration de protéine avec une activité de liaison maintenu sans la nécessité d'une courbe d'étalonnage. Nous montrons que la confirmation de concentrations en utilisant CFCA augmente la fiabilité de l'analyse cinétique et que les constantes cinétiques peut être déterminée de manière fiable même si l'activité d'une protéine recombinante est réduite.
Résumé
Dans cette étude, nous explorons l'interaction entre la cystatine B cystéine protéase inhibiteur de bovins et une forme catalytiquement inactive de la papaïne (Fig. 1), une cystéine protéase végétale, en temps réel sans étiquette en utilisant l'analyse Biacore X100. Plusieurs variantes B cystatine avec des mutations ponctuelles dans des domaines d'interaction avec la papaïne, sont produites. Pour chaque variante B cystatine nous déterminons la concentration de liaison spécifique en utilisant le calibrage sans analyse de la concentration (ACCP) et de comparer les valeurs obtenues avec une concentration totale en protéines tel que déterminé par un
Protocole

Figure 1. La structure tridimensionnelle de la cystatine B complexe (bleu) à la papaïne (jaune). Mutés résidus de cystatine B sont indiquées en rouge.
1. Principes de label sans analyse de l'interaction avec les systèmes Biacore
Dans un type sans étiquette expérience de liaison en utilisant un système Biacore, une biomolécule dite «ligand» est fixée à la surface d'une puce de capteur. Un système de canaux d'écoulement apporte son partenaire de liaison, dite «analyte», en contact avec la surface de la puce, où la détection a lieu. Lorsque l'analyte se lie au ligand, le changement résultant dans la masse d'accumulation à la surface est détectée par résonance plasmonique de surface (SPR). La réponse RSP est proportionnelle à la quantité de liaison de l'analyte.
Depuis la liaison est mesurée en temps réel, la cinétique d'association et de dissociation conconstantes pour une interaction spécifique peut être déterminée. A partir de ces constantes, il est possible de calculer l'affinité que la constante de dissociation à l'équilibre. Il est également possible de calculer à partir des données affinité état d'équilibre contraignantes. Une méthode similaire peut également être utilisée pour déterminer la concentration d'une protéine qui se lie spécifiquement à un ligand sur la surface.
2. Analyser les propriétés cinétiques d'une interaction protéine-protéine
Dans X100 Biacore, l'analyse cinétique peut être effectuée en utilisant un seul cycle cinétique. Dans une expérience unique cycle cinétique, une série de concentrations de la substance à analyser est injecté dans un cycle d'analyse unique sans régénération de la surface entre les deux injections. Par conséquent, un seul cycle cinétique permet une analyse cinétique quand il est difficile de trouver des conditions de régénération appropriées.
Une fois que les données pour une expérience cinétique a été collecté, le logiciel d'évaluation Biacore X100 génère leLes valeurs de K a, K d, K et D en ajustant les données d'un modèle d'interaction.
3. Approches pour déterminer la concentration de protéines
L'analyse des interactions entre biomolécules est important pour comprendre leur fonction. La caractérisation de la liaison des protéines à d'autres protéines, de l'acide nucléique, ou à de petites molécules est fondamentale à la recherche biochimique, et trouve son utilité dans de nombreux autres domaines, notamment la découverte de médicaments.
Pour une mesure précise de la cinétique d'interaction entre deux protéines qui interagissent, il est essentiel de connaître la concentration de protéines se liant spécifiquement dans l'échantillon expérimental qui est utilisé comme analyte. Une lecture au spectrophotomètre A 280 ou dosages colorimétriques telles que celle employant réactif de Bradford est couramment utilisée pour déterminer la concentration totale en protéines. Cependant, les impuretés protéiques peuvent affecter le résultat. PlusSurtout, les deux formes active et inactive de la protéine sont inclus dans la concentration totale en protéines. En particulier dans le cas de protéines recombinantes, qui peuvent être inactives en raison de pliage incorrect, il est important de déterminer le pourcentage de protéines se liant spécifiquement dans l'échantillon.
Dans X100 Biacore, la concentration liée à l'activité de liaison spécifique peuvent être déterminés par comparaison des niveaux de réponse de liaison à une courbe d'étalonnage provenant d'un étalon connu, ou en utilisant la méthode la plus récemment introduite Aucune calibration Analyse Concentration (ACCP). CFCA ne repose pas sur une norme. Par conséquent, ACCP est particulièrement utile dans le cas de l'étude des formes mutantes de protéines, où les normes sont généralement pas disponibles.
Dans une expérience ACCP, le taux initial de liaison est mesuré à des débits différents, dans des conditions où la diffusion de l'échantillon à la surface de la puce est limitante. La diffusion coefficient de la substance à analyser, les dimensions de la cellule d'écoulement et les débits sont pris en compte lors du calcul de la concentration de liaison spécifique de la liaison 1,2 taux initial.
Dans une expérience de cinétique, la concentration de la substance à analyser est utilisée dans le calcul de la vitesse d'association et de la constante cinétique d'affinité à partir des données expérimentales. ACCP et mesure cinétique dans les systèmes Biacore reposent toutes deux sur les mêmes propriétés d'interaction. Par conséquent, en utilisant la concentration de liaison spécifique déterminée par analyse Biacore, plutôt que la concentration totale en protéines, augmente la fiabilité des résultats.
4. En utilisant l'analyse Biacore pour caractériser l'interaction entre la cystatine B et la papaïne
B cystatine mammifère est un inhibiteur réversible, protéines concurrentiel et de liaisons fortes des protéinases de cystéine papaïne-like, surtout la cathepsine B, H, K, L et S. Ces protéines sont principalement impliquées dans nonsélective dégradation des protéines intracellulaires. Cystatines sont présumés pour protéger les cellules et les tissus de la protéolyse inappropriée par ces enzymes. Ils ont également inactiver protéinases de cystéine de parasites et de virus et peut participer à la défense contre l'invasion de ces agents infectieux. En outre, cystatines inhiber plusieurs protéases de cystéine de plantes, telles que la papaïne, qui est fréquemment utilisé comme modèle dans une enzyme études structure-fonction. La structure tridimensionnelle du complexe B cystatine avec la papaïne 3 montre que l'interaction entre les deux protéines est dominé par les contacts hydrophobes, qui, du côté inhibiteur, sont fournis par les N-et C-terminales et deux boucles en épingle à cheveux ( Figure 1). Dans cette étude, nous examinons l'importance de l'extrémité C-terminale et la seconde boucle de liaison de la cystatine B pour la liaison à la papaïne en utilisant la cystatine B bovine variants contenant des mutations ponctuelles dans des domaines d'interaction avec la papaïne. Nous déterminons d'abord le co liaison spécifiquencentration des quatre variantes B cystatine utilisés, ainsi que celle de la protéine de type sauvage. Une fois que les concentrations de liaison spécifiques de la cystatine B actif est établie, les constantes de vitesse et d'affinité de type sauvage et mutantes de variantes B cystatine liaison à la papaïne sont mesurées à l'aide X100 Biacore.
5. Instruments et réactifs
- Les variantes B cystatine Cys3Ser/His75Gly, Cys3Ser/Leu73Gly, Cys3Ser/Tyr97Ala et Cys3Ser sont produites comme décrit précédemment 4. Tous les mutants contiennent une substitution de la cystéine supplémentaire à la sérine en position 3, pour empêcher la formation de ponts disulfure dimères inactifs de cystatine B.
- L'objectif de la papaïne est également préparé comme décrit précédemment 5. Il est le S-(méthylthio) papaïne (MMTS-papaïne) ayant un groupe méthylthio fixé à Cys25 actif dans la fente, ce qui rend la protéase catalytiquement inactif.
- X100 X100 Biacore Biacore avec Plus Packl'âge est utilisé pour mesurer et analyser les concentrations de liaison spécifique et de la cinétique de liaison.
- MMTS-papaïne est immobilisé sur CM5 puce de capteur en utilisant le kit d'accouplement Biacore Amine.
- Les essais sont effectués à 25 ° C, et le tampon est le HEPES 0,01 M à pH 7,4, 0,15 M de NaCl, 0,0034 M EDTA et 0,05% de polysorbate 20.
- Entre chaque variante de la cystatine B, la surface de capteur est régénérée avec NaOH 20 mM pendant 30 secondes à un débit de 10 l / min.
6.Immobilization du ligand MMTS-papaïne
La fixation covalente de MMTS-papaïne pour CFCA analyse
CFCA repose sur la mesure du taux de liaison dans des conditions où la vitesse est limitée par la diffusion des molécules d'analyte à la surface (limitation de transport de masse). Ceci est favorisé par des niveaux élevés d'immobilisation du ligand. Immobilisation de MMTS-papaïne a été mis en place et exécuté à l'aide de l'immobilisationAssistant de configuration de logiciels Biacore X100.
- Activer la surface en 2 cellule d'écoulement par injection d'un mélange de succinimide (NHS) et carbodiimide (EDC) pendant 7 minutes à un débit de 10 l / min. 1 cellule d'écoulement n'est pas modifié de manière à être utilisé comme surface de référence.
- Injecter MMTS-papaïne à 50μg/ml dans du tampon acétate de sodium à pH 4,5 pendant 15 minutes à un débit de 5 l / min.
- L'éthanolamine est injecté pendant 7 minutes à un débit de 10 l / min pour désactiver les esters actifs restants.
La procédure de couplage entière devrait se traduire par environ 3000 RU MMTS-papaïne immobilisé dans 2 cellule d'écoulement.
La fixation covalente de MMTS-papaïne pour l'analyse cinétique
La même procédure est utilisée pour immobiliser MMTS-papaïne pour l'analyse cinétique, avec la seule différence étant que dans l'analyse cinétique, le niveau de l'immobilisation doit être faible afin d'éviter la vitesse de liaison Becomment limitée par la diffusion. 1 cellule d'écoulement n'est pas modifié lors de cette étape et en vue d'être utilisée comme surface de référence.
- Après l'activation de la surface avec le mélange de NHS et EDC comme dans 7,1, MMTS-papaïne est injecté à 1μg/ml pour 50 secondes. Après que la surface est désactivable avec une injection d'éthanolamine comme à l'étape 7.3.
Le niveau de couplage doit être d'environ 50 RU après cette procédure.
7. Détermination de la concentration B cystatine utilisant le test ACCP
- L'expérience ACCP est mis en place en fonction de l'assistant ACCP en X100 Biacore Plus Package. Environ 10 nM de protéine est injectée à des débits de 10 à 100 l / min en double exemplaire pendant 48 secondes. La surface est régénérée avec NaOH 20 mM entre chaque cycle.
- Inclure les injections vierges pour chaque débit.
- La concentration en protéine est ensuite déterminée à partir de la liaison de données (figure 3) avec efonction de courrier évaluation CFCA du X100 Biacore plus le logiciel d'évaluation package.
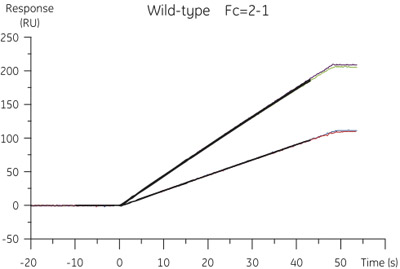
Résultats Figure 2. CFCA de l'analyse de B. cystatine type sauvage Les données spécifiques de concentration de liaison a été extraite des sensorgrammes obtenus à des débits de 10 et 100 ml / min.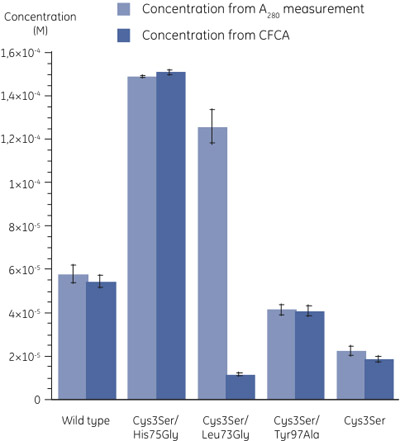
Concentrations Figure 3. Des mutants déterminés en utilisant une mesure 280 (n = 3) et CFCA (n = 2). Les erreurs-types sont indiquées par des barres d'erreur. Les coefficients d'absorption molaires ont été calculés comme décrit dans (6). Une grande différence dans les valeurs de concentration de Cys3Ser/Leu73Gly mutant déterminées par les deux méthodes peuvent être observés. - Lorsque l'on compare la concentration déterminée par une mesure 280 avec que par ACCP, il est clair que, même si dans la plupart des cas, la protéine est pleinement active, pour la Cys3Ser/Leu73Gly variante, la fraction de la protéine active est très faible (figure 3). Le tableau ci-dessous présente les activités de la cystatine B variantes liées aux concentrations totales par A 280.
Échantillon CFCA par rapport à A 280 (%) De type sauvage 94 Cys3Ser/His75Gly 101 Cys3Ser/Leu73Gly 9 Cys3Ser/Tyr97Ala 99 Cys3Ser 83
8. Mesure de la cinétique de la cystatine B de liaison à la papaïne
- Sur la base des mesures ACCP, préparer une série de concentrations double allant de 2,5 à 40 nM pour chacune des variantes B cystatine.
- L'expérience cinétique est up en utilisant l'assistant cinétique dans X100 Biacore avec l'approche du cycle unique. La surface n'est pas régénérée entre les injections, mais après la fin de chaque cycle d'analyse à l'aide de NaOH 20 mM en tant que solution de régénération.
- Mettre en place l'expérience de sorte que chaque cycle contenant l'échantillon est flanquée par un cycle de vide, où un tampon est injecté à la place de l'échantillon.
- Utilisez la fonction d'évaluation dans la cinétique X100 Biacore pour effectuer automatiquement des soustractions vierges de référence soustraite de données avant d'installer un modèle d'interaction 1:1.
- Les données expérimentales obtenues pour la liaison de variantes B cystatine à la papaïne est illustré à la figure 4. Le tableau ci-dessous résume l'association et de dissociation des constantes de vitesse et les constantes d'équilibre de dissociation obtenus dans l'analyse cinétique.
Échantillon k a (M -1 s -1) k d (s -1 ) K D (M) De type sauvage 1,8 x 10 6 0,41 x 10 -3 2,3 x 10 -10 Cys3Ser/His75Gly 1,1 x 10 6 1,7 x 10 -3 1,5 x 10 -9 Cys3Ser/Leu73Gly 1,1 x 10 6 23 x 10 -3 2,2 x 10 -8 Cys3Ser/Tyr97Ala 1,7 x 10 6 12 x 10 -3 7,1 x 10 -9 Cys3Ser 0,9 x 10 6 0,53 x 10 -3 5,8 x 10 -10 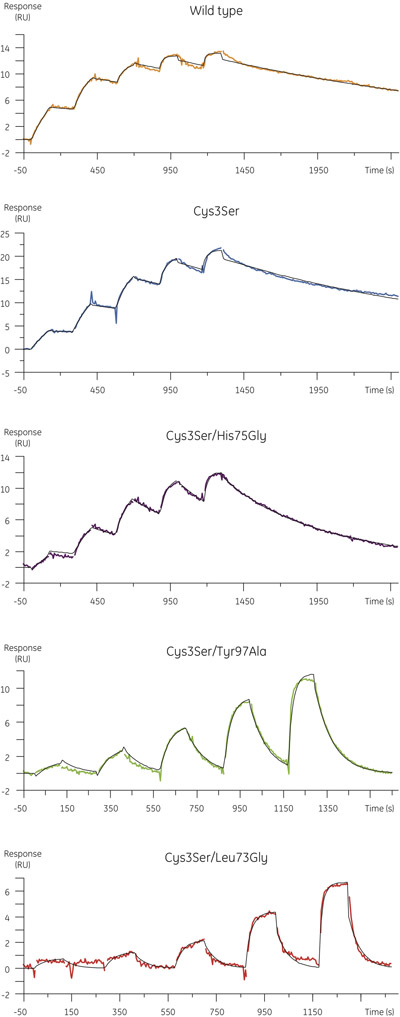
Figure 4. Profils cinétiques des variantes B cystatine binding à MMTS-papaïne déterminée en utilisant la cinétique du cycle simples. Sensorgrammes montrer à blanc et de référence soustraite des données avec un ajustement cinétique de 1h01 modèle d'interaction recouverte de noir. - Bien que les taux d'association des mutants sont comparables à celle de la protéine de type sauvage (figure 5, panneau supérieur), les constantes de vitesse de dissociation des mutants peut être supérieure de près de deux ordres de grandeur, avec une augmentation correspondante de la dissociation à l'équilibre constante (figure 5, panneau inférieur).

Figure 5. Les calculs des constantes de vitesse et d'affinité ont été fondées sur les concentrations obtenues à partir de l'ACCP. Les changements de K a, K d et K D, associée à des mutations sont représentées dans les graphiques. - Depuis concentration de l'échantillon est un paramètre dans le calcul de la vitesse constante d'association à partir des données expérimentales, il estimportante qu'elle est correcte. En utilisant la concentration basée sur la A 280 à la place de mesure de l'ACCP conduirait à la conclusion que Leu73 est important pour la vitesse d'association, où le remplacement semble se traduire par environ 10 fois plus lente que l'association les autres variantes B cystatine. Cependant, la concentration de liaison spécifique mesurée par ACCP est seulement d'environ 10% des protéines totales dans ce cas. Lorsque cela est pris en compte, il devient clair que le taux association pour Leu73 est similaire à celle des autres variantes. Par conséquent, CFCA permet une évaluation correcte de K a et K D rendant ainsi possible l'interprétation appropriée du mécanisme d'interaction.
Discussion
Dans ce travail, quatre mutants et sauvages cystatine type B ont été produites afin d'évaluer l'importance de la seconde boucle contraignant et C-terminales de l'interaction entre la cystatine B et la papaïne. Cette étude a démontré l'avantage et la facilité d'utilisation X100 Biacore pour déterminer la concentration spécifique de liaison et d'analyser la cinétique de interactions protéine-protéine pour mieux comprendre les relations structure-fonction. Nous avons montré que mesure de la concentration totale en protéines ne révèle pas les variantes de protéines qui ont réduit l'activité de liaison, qui dans ce cas introduit une erreur de mesure significative dans la détermination de l'affinité de liaison et de cinétique. Les concentrations spécifiques de liaison des variantes B cystatine ont été déterminés en utilisant ACCP avec X100 Biacore. Utilisation des mesures de concentration par ACCP comme entrée pour l'analyse cinétique conduit à vitesse fiable et constantes d'affinité, permettant ainsi à la bonne interprétation du mécanisme d'interaction.
Les affinités diminution des mutants étaient presque exclusivement due à une augmentation de k d-valeur, alors que k a été très peu touché. Ce comportement indique que tant la région seconde boucle de liaison et l'extrémité C-terminale ne sont pas importants pour le taux de liaison de l'inhibiteur à la papaïne. Au lieu de cela, ils contribuent à une affinité de liaison principalement en gardant l'inhibiteur lié à l'enzyme une fois que le complexe a été formé.
Déclarations de divulgation
matériels
| Nom du produit | Type | Entreprise | Numéro de catalogue | Commenter |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Système X100 Biacore ™ | GE Healthcare | BR-1100-1173 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html | |
| Biacore ™ X100 Plus Package | GE Healthcare | BR-1007-1098 | http://www.biacore.com/lifesciences/products/systems_overview/x100/ SYSTÈME_INFOS / index.html | |
| CM5 Capteur CCD | GE Healthcare | BR-1000-1014 | http://www.biacore.com/lifesciences/products/systems_overview/x100/system_information/index.html | |
| Amine Coupling Kit | GE Healthcare | BR-1000-1050 | ||
| Tampon acétate pH 4,5, 50 ml | GE Healthcare | BR-1003-1050 | ||
| HBS-EP + tampon 10X, 4 x 50 ml | GE Healthcare | BR-1008-1026 | ||
| Flacons en plastique Ø 11 mm | GE Healthcare | BR-1002-1087 | ||
| Capuchons en caoutchouc, type 2 | GE Healthcare | BR-1004-1011 |
Références
- Christensen, L. L. H. Theoretical analysis of protein concentration determination using biosensor technology under conditions of partial mass transport limitation. Anal. Biochem. 249, 153-164 (1997).
- Sigmundsson, K., Mâsson, G., Rice, R., Beauchemin, N., Öbrink, B. Determination of active concentrations and association and dissociation rate constants of interacting biomolecules: an analytical solution to the theory for kinetic and mass transport limitations in biosensor technology and its experimental verification. Biochemistry. 41 (26), 8263-8276 (2002).
- Stubbs, M. T., Laber, B., Bode, W., Huber, R., Jerala, R., Lenarcic, B., Turk, V. The refined 2.4 A X-ray crystal structure of recombinant human stefin B in complex with the cysteine proteinase papain: a novel type of proteinase inhibitor interaction. EMBO J. 9 (6), 1939-1947 (1990).
- Pol, E., Björk, I. Importance of the second binding loop and the C-terminal end of cystatin B (Stefin B) for inhibition of cysteine proteinases. Biochemistry. 38 (32), 10519-10526 (1999).
- Björk, I., Pol, E., Raub-Segall, E., Abrahamson, M., Rowan, A. D., Mort, J. S. Differential changes in the association and dissociation rate constants for binding of cystatins to target proteinases occurring on N-terminal truncation of the inhibitors indicate that the interaction mechanism varies with different enzymes. Biochem. J. 299, 219-225 (1994).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. ProteinScience. 4 (11), 2411-2423 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon